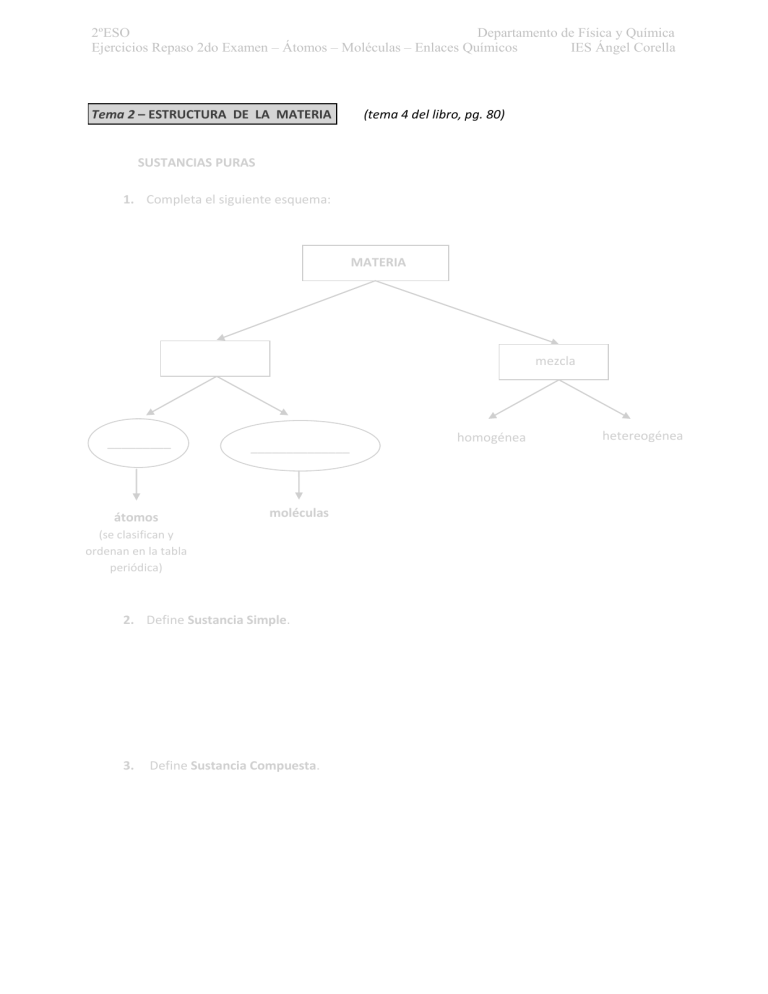
2ºESO Departamento de Física y Química Ejercicios Repaso 2do Examen – Átomos – Moléculas – Enlaces Químicos IES Ángel Corella Tema 2 – ESTRUCTURA DE LA MATERIA (tema 4 del libro, pg. 80) SUSTANCIAS PURAS 1. Completa el siguiente esquema: MATERIA mezcla _________ ______________ átomos moléculas (se clasifican y ordenan en la tabla periódica) 2. Define Sustancia Simple. 3. Define Sustancia Compuesta. homogénea hetereogénea 2ºESO Departamento de Física y Química Ejercicios Repaso 2do Examen – Átomos – Moléculas – Enlaces Químicos IES Ángel Corella 4. Ordena de mayor a menor tamaño: a) Átomo ( 10-10 m ) b) Ameba ( 700 · 10-6 m ) c) Virus de la gripe ( 130 · 10-9 m ) EL ÁTOMO 5. Define átomo. 6. Define elemento químico. 7. Completa la siguiente tabla con la ayuda de la tabla de tu cuaderno: nombre símbolo Representación de tamaños electrón e- · carga masa descubridor 9,11 · -31 kg + 1,66 · 10-19 C protón neutrón valor de la carga Rutherford 0 8. Rellena los cuadrados del siguiente dibujo con las correspondientes partes del átomo. 2ºESO Departamento de Física y Química Ejercicios Repaso 2do Examen – Átomos – Moléculas – Enlaces Químicos IES Ángel Corella MODELOS ATÓMICOS 9. Nombra a tres de los científicos que diseñaron un modelo atómico. 10. Explica qué es lo característico del modelo atómico de Niels Bohr. Ayúdate de un dibujo para completar la explicación. ESTRUCTURA DEL ÁTOMO: NÚCLEO Y CORTEZA ELECTRÓNICA 11. Dibuja un átomo con 3 protones y 4 neutrones en el núcleo. a) ¿Qué pasa si le añades 4 electrones? ¿Sería un átomo neutro? Si no es así, ¿qué exceso de carga tendría? b) ¿Qué pasa si le añades 2 electrones? ¿Sería un átomo neutro? Si no es así, ¿qué exceso de carga tendría? c) ¿Qué cantidad de electrones tendrías que añadirle para que sea neutro? 2ºESO Departamento de Física y Química Ejercicios Repaso 2do Examen – Átomos – Moléculas – Enlaces Químicos IES Ángel Corella 12. Observa este esquema de un átomo: a) ¿Qué partículas hay en el núcleo? b) ¿qué carga tienen los protones? c) ¿Qué carga tienen los neutrones? d) ¿Los protones se atraen o se repelen entre ellos? e) ¿Crees que los neutrones se atraen, se repelen, o no sienten ningún tipo de fuerza entre ellos? f) ¿Qué tipo de fuerzas crees que se pueden dar dentro del núcleo? (no tienes por qué saberlas, sólo quiero que pienses en relación a las preguntas anteriores) g) ¿Crees que podría haber solo dos protones en el núcleo? Haz un dibujo del núcleo si lo necesitas h) ¿cuál piensas que es el papel del neutrón dentro del núcleo? i) ¿Crees que un átomo puede tener menos neutrones que protones? ¿Por qué? 2ºESO Departamento de Física y Química Ejercicios Repaso 2do Examen – Átomos – Moléculas – Enlaces Químicos IES Ángel Corella Representación elementos químicos: Ejemplos: A = número másico = nº protones + nº neutrones A Z = Z + N = número atómico = nº protones N = nº neutrones * si átomo neutro: nº protones = nº electrones 13. Responde a las siguientes preguntas: a) ¿A qué llamamos número atómico? ¿Cuál es su símbolo? b) ¿A qué llamamos número másico? ¿Cuál es su símbolo? c) Completa los huecos: A = __ + __ d) ¿Cómo podemos calcular el número de neutrones? N = __ - __ 2ºESO Departamento de Física y Química Ejercicios Repaso 2do Examen – Átomos – Moléculas – Enlaces Químicos IES Ángel Corella 14. Con la ayuda de la chuleta de la página anterior rellena la siguiente tabla de átomos neutros: Elemento Símbolo Representa ción Z N H Litio A Protones Neutrones 3 Metal /Semimetal Electrones /No metal /Halógenos 1 Li Sodio 12 K Berilio 19 11 39 4 5 Mg 24 Calcio 12 20 Co Niquel 27 20 59 28 Cu 30 29 Pt 63 117 Oro 118 Boro 6 Aluminio 78 79 11 27 Ga 31 13 70 Carbono Silicio 28 Germanio 32 14 72 Nitrógeno 14 Fósforo 31 7 16 Arsénico Oxígeno 8 Azufre 16 16 34 45 Selenio Se 16 79 34 45 34 Fluor Cloro 17 Bromo 35 45 Helio Neón 4 10 2 10 Argón Kriptón 35 40 47 18 36 No metal 2ºESO Departamento de Física y Química Ejercicios Repaso 2do Examen – Átomos – Moléculas – Enlaces Químicos IES Ángel Corella 15. Indica la constitución de los núcleos de los siguientes átomos: Núcleo Protones Neutrones 16. Sabiendo que en el átomo tenemos tres partículas subatómicas: protón, electrón, neutrón. Explica qué ocurre en cada uno de los siguientes casos: a) ¿Qué ocurre si cambiamos el nº de protones? Pon un ejemplo. b) ¿Qué ocurre si cambiamos el nº de neutrones? Pon un ejemplo. c) ¿Qué ocurre si cambiamos el nº de electrones? Pon un par de ejemplos 2ºESO Departamento de Física y Química Ejercicios Repaso 2do Examen – Átomos – Moléculas – Enlaces Químicos IES Ángel Corella ISÓTOPOS 17. Indica cuáles de los siguientes átomos de elementos son isótopos entre sí. IONES 18. Jugad con el applet de la web del departamento de Física y Química para construir átomos. Observad: - ¿Qué ocurre cuando ponéis electrones de más? - ¿Qué ocurre cuando ponéis electrones de menos? 19. ¿Cuántos electrones deben ganar o perder los átomos neutros de cada elemento para convertirse en los siguientes iones? a) Li + b) F - c) Na + d) Cl - e) Be 2+ f) O 2- g) P 3- h) B 3+ i) C 4+ j) Si 4- Indica en cada caso si es un Catión o un Anión. 20. Un ión de un átomo de oxígeno ( Z= 6 A=12 ) contiene 8 electrones. a) Indica la carga del ión. b) Indica cuántos protones tiene este átomo. c) Indica cuántos neutrones tiene este átomo. 2ºESO Departamento de Física y Química Ejercicios Repaso 2do Examen – Átomos – Moléculas – Enlaces Químicos IES Ángel Corella INTRODUCCIÓN A LA TABLA PERIÓDICA 21. Rellena la siguiente tabla con la ayuda de la información de la página 92 del libro: Brillo Estado Físico (a Tª ambiente) Conductores del Calor Conductores de la Electricidad Metales No Metales ENLACE QUÍMICO 22. Define Enlace Químico. (pag. 94 libro) Nombra los tres tipos de enlace químico que hay. 23. Rellena la siguiente tabla de los tipos de enlace químico con la ayuda de la información de la página 94 del libro: Tipo de Enlace Átomos que se enlazan Estructura que se obtiene 24. Define los siguientes conceptos, y pon varios ejemplos de cada uno de ellos: a. Isótopo b. Ión 2ºESO Departamento de Física y Química Ejercicios Repaso 2do Examen – Átomos – Moléculas – Enlaces Químicos IES Ángel Corella c. Molécula d. Macromolécula. 25. Relaciona conceptos a través de flechitas: a. Cambia el número de protones 1. Isótopo b. Cambia el número de neutrones 2. Ión c. Cambia el número de electrones 3. Diferentes elementos de la tabla periódica 26. Relaciona conceptos a través de flechitas: a. Enlace Iónico. 1. Metal + Metal b. Enlace Covalente. 2. Metal + No Metal c. Enlace Metálico. 3. No Metal + No Metal CRISTALES 27. Define Cristal. (pag. 96 del libro) 2ºESO Departamento de Física y Química Ejercicios Repaso 2do Examen – Átomos – Moléculas – Enlaces Químicos IES Ángel Corella 28. Rellena la siguiente tabla con la información de la página 96 del libro. CRISTALES Iónicos Descripción Solubles en Agua Funden a Temperaturas Conductores de la Electricidad Covalentes Metálicos








