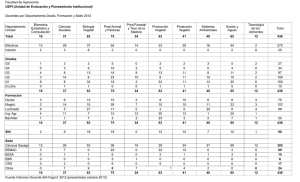
UNIVERSIDAD NACIONAL JORGE BARADRE GROHMANN – TACNA Facultad de Ciencias Escuela profesional de Biología-Microbiología Determinación del medio Murashige & Skoog (MS) para el desarrollo adecuado de hojas en Solanum tuberosum L. variedad Chiquisa, bajo condiciones in vitro Informe de prácticas pre-profesionales Presentado por: Jhon Luis Choquegonza Aguilar Lugar: Laboratorio de Biotecnología Vegetal-UNJBG Fecha de prácticas: Agosto del 2019 – Diciembre del 2019 TACNA-PERÚ 2019 Índice de Contenido I GENERALIDADES ................................................................................................................................... 2 1.1 Razón Social de la empresa. ......................................................................................................... 2 1.2 Ubicación ...................................................................................................................................... 2 1.2.1 Rama industrial: ........................................................................................................................ 2 1.3 Organización de la empresa: ......................................................................................................... 3 1.4 Objetivos ....................................................................................................................................... 4 1.4.1 Objetivos Generales ..................................................................................................................... 4 1.4.2 Objetivos Específicos ................................................................................................................... 4 II. FUNDAMENTO TEORICO .................................................................................................................... 5 2.1 Cultivo in vitro .................................................................................................................................... 5 2.2 Medios de cultivo ................................................................................................................................ 6 2.2.1 Componentes inorgánicos del medio de cultivo .......................................................................... 8 2.2.2 Componentes orgánicos del medio de cultivo. .......................................................................... 10 2.3 Medio MS.- ....................................................................................................................................... 12 2.4 Generalidades de Solanum tuberosum L. .......................................................................................... 13 2.4.1 Origen ........................................................................................................................................ 13 2.4.2 Descripción botánica.................................................................................................................. 14 a) Semilla ............................................................................................................................................ 15 b) Raíz. ................................................................................................................................................ 15 2.4.3 Clasificación taxonómica .............................................................................................................. 16 III. MATERIALES Y METODOS ............................................................................................................. 19 3.1 Material vegetal empleado ................................................................................................................ 19 3.2 Materiales de laboratorio .................................................................................................................. 19 3.2.1 Materiales de vidrio. .................................................................................................................. 19 3.2.2 Equipos. ..................................................................................................................................... 20 3.2.3 Medios de cultivo, reactivos y otros .......................................................................................... 20 3.2 Métodos: ........................................................................................................................................... 20 3.2.1 Multiplicación del material vegetal............................................................................................ 20 3.2.2 Preparación del medio de cultivo ............................................................................................... 22 IV. ACTIVIDADES DE PRACTICAS PRE-PROFESIONALES ............................................................. 26 4.1 Adiestramiento en las capacidades útiles en el desempeño de un Biólogo-Microbiólogo. .................. 26 V. RESULTADOS ...................................................................................................................................... 27 VII. CONCLUSIONES Y SUGERENCIAS .............................................................................................. 34 7.1 Conclusiones ..................................................................................................................................... 34 7.2 Sugerencias ....................................................................................................................................... 34 VIII. BIBLIOGRAFIA ............................................................................................................................... 36 IX. ANEXOS .............................................................................................................................................. 38 9.1 Tratamientos y muestras de la variedad chiquisa en medio MS para propagación de papa estándar. .................................................................................................................................................. 38 9.2 Crecimiento de los vástagos después de 27 días de evaluación................................................. 39 9.3 Cuadros de Soluciones stock de minerales mayores y menores ................................................. 43 9.4 Altura y numero de hojas final de cada segmento ............................................................................ 45 INTRODUCIÓN Durante las practicas pre-profesionales se realizó varias actividades en el cual el estudiante aprender y ganara experiencia para los distintos procedimientos en el laboratorio de biotecnología vegetal de la universidad Jorge Basadre Ghromann, que, mediante la preparación de medios de cultivo, esterilización, el uso de materiales y equipos de laboratorio adiestran al estudiante durante la duración de las practicas pre-profesionales el cual serán de utilidad cuando se ejerza la profesión en un área relacionada con Biotecnología Vegetal donde se realizó las practicas. En el laboratorio de Biotecnología Vegetal se iniciara también la consulta de bibliografía para resolver problemas que pueden presentarse en el laboratorio, como ejemplo en este caso sobre el correcto crecimiento de Solanum tuberosum L. variedad chiquisa el cual en condiciones in vitro tuvo un crecimiento limitado por tanto hubo dificultades en el proceso de aclimatación ya que había una tasa de mortalidad elevada por tanto en este informe se planteó un solución aplicando tratamientos, modificando el medio Murashige Skoog (MS) para un correcto desarrollo encontrándose resultados favorables que serán de utilidad para futuros trabajos de investigación. 1 I GENERALIDADES: 1.1 Razón Social de la empresa. En la Universidad Nacional Jorge Basadre Ghromann (UNJBG) Ubicado en la dirección: Av. Miraflores Nro. S/n Cercado (Ciudad Universitaria) Tacna, con número de RUC: 20147796634, número telefónico (052) 583000, con email coin@unjbg.edu.pe 1.2 Ubicación: El Laboratorio de Biotecnología Vegetal de la Facultad de Ciencias Agropecuarias de la Universidad Jorge Basadre Grohmann ubicado en el “Fundo Los Pichones Sur” que se encuentra ubicado en las siguientes coordenadas: Latitud Sur. - 17° 59´ 38´´ Latitud Oeste. - 70°14´22´´ Altitud. - 550 msnm 1.2.1 Rama industrial: Biotecnología vegetal 2 1.3 Organización de la empresa: UNIVERSIDAD JORGE BASADRE GROHMANN FACULTAD DE CIENCIAS AGROPECUARIAS LABORATORIO DE BIOTECNOLOGIA VEGETAL JEFE DE LABORATORIO ÁREA DE TUBEROSAS ÁREA DE FRUTALES TÉCNICO DE LABORATORIO TÉCNICO DE LABORATORIO PRACTICANTES PRACTICANTES 3 1.4 Objetivos 1.4.1 Objetivos Generales: Determinar el medio Murashige skoog (MS) adecuado para un mayor desarrollo de hojas in vitro de Solanum tuberosum L. variedad chiquisa. 1.4.2 Objetivos Específicos: Determinar la concentración adecuada de nitrógeno, sacarosa y Ácido giberelinico (AG3) en el medio Murashige & Skoog (MS). Determinar la altura en los brotes de Solanum tuberosum L. variedad chiquisa bajo condiciones in vitro. Determinar el número de hojas de los brotes de Solanum tuberosum L. variedad chiquisa en condiciones in vitro. 4 II. FUNDAMENTO TEORICO Dado el incremento en la población mundial, actualmente de 6 477 millones de habitantes y estimada en 8 mil y 9 mil 300 millones para los años 2025 y 2050 respectivamente, la producción de alimentos es un importante reto para este siglo. El vencerlo dependerá de la capacidad para mejorar el rendimiento y productividad de los cultivos agrícolas y desarrollar variedades mejoradas de plantas que proporcionen alimentos de mejor calidad y productos naturales a más bajos costos. Durante la denominada Revolución Verde, por ejemplo, usando técnicas tradicionales de autopolinización y polinización cruzada fue posible seleccionar especies vegetales de alta productividad, mejor crecimiento, valor nutricional, producción de semillas y frutos de mejor calidad que las variedades silvestres y con las cuales se revertió la deficiencia de alimentos que se presentó antes de los años sesenta del siglo pasado. No obstante, muchas de las variedades vegetales cultivadas a gran escala obtenidas por la Revolución Verde están cerca de sus límites biológicos y físicos de productividad, por lo que es difícil incrementar más su productividad por técnicas tradicionales de mejoramiento (Universidad Autonoma de Mexico, 2005). 2.1 Cultivo in vitro: El cultivo de células y tejidos vegetales se refiere al conjunto de técnicas usadas para crecer células, tejidos u órganos vegetales in vitro, bajo condiciones asépticas, controladas y libres de microorganismos. Se basa en el principio de totipotencia (De haan, Palomino, & Ramos, 5 2006) que indica que cualquier célula vegetal contiene una copia íntegra del material genético de la planta a la que pertenece sin importar su función o posición en ella, y por lo tanto tiene el potencial para regenerar una nueva planta completa. El proceso involucrado en la transformación de una célula a una planta u órgano, en ese entonces lo llamaron diferenciación celular, pero actualmente se denomina organogénesis. Se indican los principales sucesos ocurridos durante la evolución de las técnicas de cultivo de células vegetales. En un principio los investigadores sugerían que las células en las plantas se diferenciaban al retener sólo aquella parte del genoma necesario para el tipo celular del órgano al que estaban destinadas. Se pensaba que debía haber factores externos que provocaban que las células cambiaran tomando gran diversidad de formas y funciones. Al inicio no se sabía si los cambios sufridos por la diferenciación eran permanentes e irreversibles o si sólo eran características temporales para que las células se adaptasen a necesidades funcionales del organismo en general y del órgano en particular. Sin embargo, en experimentos realizados por Vochting en 1878 sobre la polaridad celular, se observó que células de tallos eran capaces de rediferenciarse y formar raíces y brotes, lo que demostró que la diferenciación no era permanente, sino que estaba dada por la posición relativa de la célula en la planta. Ahora se sabe que la diferenciación celular está regulada por la expresión genética y que no implica la pérdida de material genético (Ferl & Paul, 2000). 2.2 Medios de cultivo: Para crecer, las células requieren una variedad de nutrimientos orgánicos e inorgánicos; estos requerimientos se demuestran fácilmente en órganos y tejidos extirpados de plantas superiores eh inferiores. Los nutrimientos orgánicos al igual que los inorgánicos, se requieren en dos 6 niveles: unos macros y otros micro. Generalmente, las células en crecimientos pueden fabricar sus proteínas a partir de fuentes adecuadas de nitrógeno y carbohidratos suministrados por el medio de cultivo; sin embargo, existe además una cantidad de sustancias orgánicas adicionales que se requieren en cantidades mínimas y que son activas en el crecimiento. A menudo, la necesidad de los factores orgánicos de crecimiento se hace evidente solo cuando se considera un crecimiento largo y continuado o potencialmente indefinido. Aunque una planta verde intacta autótrofa, las células de sus regiones de crecimiento pueden ser acentuadamente heterótrofas y requerir la aplicación de un numero de estimulantes orgánicos complejos que, en el caso de la planta intacta, generalmente se derivan de las células verdes. En cuanto a los tejidos de plantas, desde 1940 se ha desarrollado una gran cantidad de trabajos sobre sus requerimientos nutricionales en medios estrictamente definidos. En términos generales, la mayor parte de tales tejidos se pueden cultivar exitosamente en un medio que contenga cualquiera de varias mezclas de sales minerales diseñadas para mantener el crecimiento de tejidos y órganos. A menudo se utiliza la sacarosa como una fuente de energía. Algunos tejidos se pueden cultivar exitosamente en un medio completamente definido, mientras muchos otros no presentan crecimiento en soluciones salinas relativamente simples, a menos que se complementen con ciertos micro elementos, vitaminas y otras sustancias promotoras de crecimiento de naturaleza completamente indefinida, tales como el agua de coco (AC), la caseína hidrolizada (CH), los extractos de levadura y de malta, el endospermo liquido de la castaña de Indias y otros semejantes. Posiblemente la formulación del medio para el cultivo de tejidos es más un arte que una disciplina por derecho propio, la experiencia es el mejor maestro en este tipo de trabajo y este 7 es el mejor consejo orientación que se le puede dar a un principiante. (Roca & Mroginski, 1993). 2.2.1 Componentes inorgánicos del medio de cultivo Los medios de cultivo están constituidos por componentes inorgánicos, los cuales son suministrados en cantidades relativamente grandes (macronutrientes) y otros añadidos en menor cantidad (micronutrientes). Dentro de los macronutrientes, se encuentran de nitrógeno (N), potasio (K), calcio (Ca), fósforo (P), magnesio (Mg) iones y azufre (S). El nitrógeno se adiciona al medio de cultivo en forma de nitrato o iones amonio, o la combinación de ambos iones, el sulfato de magnesio (Mg SO4 7H2O) satisface tanto el requerimiento de magnesio como el de azufre, el fósforo puede adicionarse en cualquiera de las formas NaH2PO4.H2O ó KH2PO4, el potasio es un catión que se agrega en forma de KCl, KNO3, ó KH2PO4, el calcio se adiciona con Ca Cl2.2H2O, Ca(NO3)2.4H2O o la forma anhidra de cualquier sal y el cloro se presenta en forma de KCl ó CaCl2. Los micronutrientes, que son añadidos a los medios de cultivo son hierro (Fe), níquel (Ni), cloro (Cl), manganeso (Mn), cinc (Zn), boro (B), cobre (Cu), y molíbdeno (Mo). Estos elementos junto con el carbono (el C), oxígeno (O) e hidrógeno (H) constituyen los 17 elementos esenciales. Estos micronutrientes, aunque son requeridos en menor cantidad son necesarios para una adecuada actividad metabólica de las células vegetales. El Fe y el Mn son esenciales para la síntesis de clorofila y la función de los cloroplastos. El Fe es requerido para la formación de precursores de la clorofila y es un componente de los citocromos, ferredoxina y legohemoglobina, esta 8 última es esencial en la fijación de nitrógeno por las plantas leguminosas. El Mn es necesario para el mantenimiento de la ultraestructura y el proceso fotosintético. Los elementos Cu y Zn son requeridos para la oxidación e hidroxilación de compuestos fenólicos. El Zn está relacionado con la síntesis de triptófano, precursor del ácido indolacético (AIA) y ejerce control sobre las ribonucleasas lo que permite mantener la síntesis proteica en caso de estrés ambiental (medio de cultivo). El Cu, además es un componente de la Plastocianina que es esencial en el funcionamiento del transporte electrónico de la fotosíntesis y es activador de otras enzimas como la oxidasa del ácido ascórbico (Vitamina C), tirosinasa, lacasa, fenolasa y citocromoxidasa, esta última forma parte de la cadena de transporte electrónico del proceso respiratorio. El Mo forma parte de las nitratorreductasas de las plantas y nitrogenasas en leguminosas y bacterias fijadoras de nitrógeno. El boro (B) es necesario para el mantenimiento de la actividad meristemática, está involucrado en la síntesis de bases nitrogenadas, en particular uracilo y adenina y por ello aumenta los niveles de citocininas y ácidos nucleicos. Lugo el Fe es añadido en forma de quelato cuyas moléculas son capaces de retener un ión de un metal con varias uniones químicas form ando un anillo complejo (un quelato) como el EDTA (ácido etilendinitrotetraacético), que utilizado en bajas concentraciones estimula el crecimiento al hacer disponible en bajas cantidades este elemento. El medio de cultivo más utilizado es la formulación de las sales Murashige y Skoog (1962) el cual fue desarrollado inicialmente para el crecimiento de callos de tabaco y en la actualidad se emplea como medio de cultivo basal para un grupo importantes de plantas de interés para la alimentación y con fines ornamentales. Sales minerales del medio de cultivo de Murashige y Skoog (1962), (Krikorian,1991). Ver cuadro N°01. 9 2.2.2 Componentes orgánicos del medio de cultivo. Dentro de los componentes orgánicos del medio de cultivo se encuentran carbohidratos, vitaminas, aminoácidos, extractos naturales y reguladores del crecimiento vegetal. a) Carbohidratos. – La nutrición que es desarrollada en las condiciones in vitro a partir en los diferentes órganos y tejidos son ampliamente heterótrofos con respecto al carbono debido a la ausencia o insuficiencia de asimilación clorofílica, por lo cual resulta indispensable añadir azúcares a los medios de cultivo como fuente de energía y reguladores osmóticos. La sacarosa es el azúcar empleado universalmente. Le siguen en importancia glucosa, maltosa, rafinosa, fructosa y galactosa entre otros. b) Vitaminas. – Son necesarias para llevar a cabo una serie de reacciones catalíticas en el metabolismo y son requeridas en pequeñas cantidades. Las vitaminas más empleadas son: Tiamina (vitamina B1): se añade como hidrocloruro de tiamina y constituye una vitamina esencial para el crecimiento de células vegetales. Es una coenzima de la descarboxilación de los cetoácidos piruvato y œ-cetoglutarato y es esencial para el crecimiento radical pues interviene en la síntesis de citocininas. Ácido Nicotínico: forma parte de las coenzimas NAD y NADP que intervienen en la transferencia de hidrógeno, además de ser precursor el triptófano y por 10 tanto tiene un efecto sinérgico con el AIA en la producción de raíces y ejerce acción inhibitoria en el desarrollo de yemas axilares. Piridoxina (Vitamina B6): Es añadida como hidrocloruro de Piridoxina (Piridoxina-HCl). Participa como coenzima en el metabolismo de los aminoácidos, entre ellos el triptófano, precursor de AIA y ácido nicotínico, además de favorecer la formación de raíces. Myo-inositol: No es propiamente una vitamina, sino un azúcar-alcohol. Tiene un efecto sobre la proliferación de tejidos y sobre la activación de la organogénesis. Ácido ascórbico y ácido cítrico: Son añadidos a los medios de cultivo en ocasiones no como vitaminas sino como antioxidantes para evitar el oscurecimiento de determinados tejidos. c) Aminoácidos y Extractos naturales. – Los aminoácidos favorecen la proliferación de callos y la organogénesis. Los efectos obtenidos mediante el aporte de aminoácidos parecen muy variables según la especie y el tipo de morfogénesis estudiada. Dentro de ellos se encuentran la glutamina, Larginina, L-cisteína entre otros. Los extractos naturales estimulantes son numerosos productos de composición variable y no bien definida. Dentro de ellos se encuentran extracto de levadura, hidrolizado de caseína, peptona y agua de coco (más utilizado) entre otros (Krikorian,1991). 11 2.3 Medio MS.Es el medio más conocido; se elaboró tomando el cultivo in vitro de tabaco como modelo y siguiendo un procedimiento cuantitativo se determinaron las concentraciones más adecuadas de todos los nutrientes. Es apto para la mayoría de las especies, por lo que es de amplia utilización, excepto para las más sensibles a la salinidad ya que se caracteriza por tener una elevada concentración salina. En esos casos puede recurrirse a otros medios o simplemente utilizarlo diluido (1/2 MS, 1/4 MS) (Sharry, Adema, & Abedini, 2015). Cuadro N°01: Composición química del medio estándar MS Fuente: Sharry, et al., 2015 Según en el artículo de investigación sobre efectos del nitrato y sacarosa nos dice que el nitrógeno es el nutriente de mayor influencia en la producción de papas, induce el crecimiento de la planta y su formación de tubérculos (Coraspe et al., 2009) observaron 12 en el invernadero que la absorción del nitrógeno (N) fue en forma de amonio, en las primeras etapas de desarrollo en plantas Solanum tuberosum L., tornándose a nítrica en la formación de tubérculos. A mayor disponibilidad de este nutriente mayor fue el rendimiento y calidad de los tubérculos. También en los cultivos in vitro se ha comprobado que el nitrógeno favorece el crecimiento de los explantes de papas. El medio básico MS (Murashige & Skoog, 1962), se caracteriza, ante otros medios de cultivo, por su alto contenido de nitratos, amonio y potasio (Huang & Murashige, 1997). Evans (1993) experimentó con distintos genotipos S. tuberosum L., S. sparsipilum y S. oplocense, a partir de segmentos nodales cultivados en un medio MS modificado, usando concentraciones entre: 1,6 – 4,8 g L1 para nitrato de amonio (NH4NO3) y 2,06,0 g L-1 para nitrato de potasio (KNO3). La tendencia de la respuesta fue un mayor alargamiento de yema a menor concentración de los nitratos, dentro del rango establecido por el investigador (Tacoronte, 2017). 2.4 Generalidades de Solanum tuberosum L. 2.4.1 Origen La papa se cultiva en los Andes desde hace más de 7.000 años. Según investigaciones confirmadas recientemente, el origen de la papa, especie Solanum tuberosum L., se centra en la parte norte del lago Titicaca, sur del Perú. Actualmente, la subespecie S. tuberosum tuberosum es el cuarto cultivo de mayor importancia en el mundo después del arroz, el trigo y el maíz. Se cultiva en más de 130 países. En el año 2005 cubrió una superficie de 18.652.381 hectáreas a nivel mundial. Las otras especies cultivadas: S. goniocalyx, S. stenotomum, S. chaucha, S. phureja, S. curtilobum, S. juzepczukii y S. 13 Ajanhuiri también son de origen andino. Representan diferentes hibridaciones con parientes silvestres o cultivados a lo largo de la evolución de la papa, en compleja relación con el hombre andino. El departamento de Huancavelica se ubica en el centro sur de los Andes peruanos. Fue un centro de temprana diversificación de la papa, aunque no existen documentos antiguos que se refieran específicamente al desarrollo del cultivo de la papa en Huancavelica. Los restos de papa encontrados en la cueva Tres Ventanas, en el valle de Chilca y en La Centinela, textos antiguos y estudios lingüísticos, evidencian la presencia muy temprana de este cultivo en la sierra central del Perú (De haan, et al., 2006). 2.4.2 Descripción botánica. La papa pertenece a la familia de las solanáceas. Las especies cultivadas son las Tetraploides (2n=48) que pertenecen a las especies Solanum tuberosum y Solanum andigenum. La Solanum tuberosum es la papa que fue llevada a Europa por los españoles y domesticada en esos países, generalmente es de días y ciclo cortos; (90 a 100 días) de forma alargada, piel lisa, ojos superficiales, el color de la pulpa es crema a amarilla y la piel rosada, roja o beige, y tiene estolones cortos. La Solanum andigenum es de días largos, ciclo tardío (de forma redonda, y ojos profundos, color de piel variable (morada, roja, blanca, negra y combinada); la pulpa es blanca o amarilla, y es cultivada por los países de Sur América. Existen variedades que son mezcla de ambas especies (Cortéz & Hurtado, 2018). 14 a) Semilla. – Generalmente se llama semilla al tubérculo seleccionado o destinado para la reproducción y producción de la papa; pero la verdadera semilla es producida en una baya de forma redonda, ovoide o cónica alargada y con un diámetro entre 1 a 3 cm, de color verde, en cuyo interior se encuentra la semilla sexual de papa, la forma y color de ésta es similar a la del tomate, pero con la mitad de su tamaño; es dicotiledónea, con un peso de 0.5 mg. En un gramo existen 1600 semillas y un promedio de 200 semillas por baya y 20 bayas por planta. (Roman Cortéz & Hurtado, 2018). Figura N° 02: Semillas ampliadas en tamaño Figura N° 01: semillas Fuente: Google imágenes Fuente: Google imágenes b) Raíz. En las plantas provenientes de semilla sexual, la raíz principal es filiforme, a partir de la cual aparecen ramificaciones laterales que forman un sistema fibroso. 15 La raíz formada a partir de semilla tubérculo es fibrosa, no existe una raíz principal y posee muchas raíces adventicias. Su mayor crecimiento lo desarrolla en los primeros 0.20 m de profundidad, extendiéndose lateralmente de 0.30 hasta 0.60 m. Las raíces laterales fibrosas pueden llegar hasta 1.20m de profundidad, en suelos francos y profundos (Roman Cortéz & Hurtado, 2018). 2.4.3 Clasificación taxonómica: REINO: Plantae DIVISIÓN: Magnoliophyta CLASE: Magnoliopsida ORDEN: Solanales FAMILIA: Solanaceae GÉNERO: Solanum L., 1753 ESPECIE: tuberosum L., 1753 VARIEDAD: Chiquisa (Conabio, 2018) 16 Figura N°03: Partes principales de Solanum tuberosum Fuente: Google imágenes 17 Figura N° 04: Principales partes de la parte radicular de Solanum tuberosum. Fuente: Google imágenes 18 III. MATERIALES Y METODOS: En las practicas pre-profesionales estuvo basada en metodologías desarrolladas por el practicante de laboratorio bajo la supervisión del encargado responsable del laboratorio de biotecnología vegetal. Las actividades durante el periodo de prácticas pre-profesionales fueron el mantenimiento de las condiciones de asepsia del laboratorio, preparaciones de soluciones stock para cultivo in vitro, proceso de introducción de ex plantes de Solanum tuberosum L. de diferentes variedades, y el proceso de aclimatación de las variedades de papa en el invernadero, así como la preparación de todos los procesos necesarios para su aclimatación. 3.1 Material vegetal empleado: Segmentos de tallo de Solanum tuberosum L. var. Chiquisa del Laboratorio de Biotecnología Vegetal. 3.2 Materiales de laboratorio: 3.2.1 Materiales de vidrio. Matraces Erlenmeyer de 250ml, 500ml Vaso precipitado de 100ml y 500ml Mechero Baguetas 45 Tubos de ensayo de 25x100 Fiola de 50ml 19 Pipeta de 1ml 3.2.2 Equipos. Autoclave Horno microondas Medidor de pH 3.2.3 Medios de cultivo, reactivos y otros: Medio MS (Modificado) HCl al 0.1 y 1 Normal NaOH al 1N Papel aluminio Rejilla para tubos de ensayo Film adherente Escobilla de lavado para tubos de ensayo Agua destilada 3.2 Métodos: 3.2.1 Multiplicación del material vegetal Para tener más material vegetal, se inició la multiplicación a partir de plántulas in vitro de Solanum tuberosum L. var. chiquisa que estaban en magentas dentro de la sala de incubación. 20 El proceso se hizo dentro de la cámara de flujo laminar, se extrajeron los brotes ya crecidos para cortarlas en tamaño de 3cm aproximadamente, empleando un bisturí y pinzas estériles para su extracción, luego se colocó los explantes en placas Petri, se hicieron cortes el cual cada segmento tenían entre 2 a 3 yemas axilares además de que tenían que ser de la misma longitud de 3cm aproximadamente. De los cortes obtenidos, solo se tomaron aquellos segmentos con yemas axilares y aquellos segmentos que tenían yemas apicales, se les corto quedando solo yemas axilares. Estos segmentos de aproximadamente 3cm se pusieron dentro de nuevas magentas siendo un total de 16 segmentos por magenta donde se los sello con film eh incubaron por un lapso de 15 días para disponer de mayor cantidad de muestras para la posterior aplicación de tratamientos. 3.2.2 Aplicación de los tratamientos Transcurrido 15 días de crecimiento de los segmentos de tallo, se tomaron 4 magentas en el cual se extrajeron los brotes ya crecidos para su corte de aproximadamente 3 cm de longitud que tenían de 2 a 3 yemas axilares, procurando que todos los segmentos tengan la misma longitud (Sagasta, 1990). Estos segmentos se colocaron uno por tubo siendo un total de 5 segmentos de tallo o repeticiones por tratamiento. 21 3.2.2 Preparación del medio de cultivo En el laboratorio de biotecnología vegetal se encuentran las soluciones concentradas de sales para le preparación de medio MS para la propagación de Solanum tuberosum, estos se encuentran en botellas de 1 litro, nombradas con soluciones A, B, C, D, E y F (ver anexos 7.2). Para la preparación de los medios se usaron variadas concentraciones de nitrógeno, sacarosa y ácido giberélico (AG3), las concentraciones fueron expresadas en mg/L, según cada tratamiento (ver tabla N°02). (Medio MS modificado). En los frascos de las soluciones ya vienen rotulados la cantidad en ml de solución para preparar el medio MS siendo un total de 50ml para preparar un litro de medio de cultivo para multiplicación, que están ordenados desde letra A hasta la F con su respectivo rotulo de las sales que contiene cada frasco. Para la preparación de los 4 primeros tratamientos se usó 50ml de la solución A, los siguientes tratamientos desde el tratamiento 5 hasta el 8 se usó 60ml de solución A, con respecto a la sacarosa, el tratamiento 1,2,5 y 6 se les agrego 20 g de sacarosa por litro de medio Morashige & Skoog, mientras que los tratamientos 3,4,7 y 8 se les agrego 10g de sacarosa por litro y finalmente con respecto al Ácido giberélico (AG3) los tratamientos que contenían 0.1 mg/L de hormona fueron los tratamientos 1,3,5,7 mientras que los tratamientos 2,4,6,8 no contenían la hormona AG3. El tratamiento 9 es el medio Murashige & Skoog que se usa normalmente el proceso de multiplicación de Solanum tuberosum in vitro del Laboratorio de Biotecnología Vegetal. Para la multiplicación de Solanum tuberosum, este medio fue usado como testigo para compararlo con los demás tratamientos. 22 Se hicieron un total de 8 medios distintos más un testigo, donde los tratamientos desde la 1 hasta el tratamiento 8 varió la concentración de nitrógeno, sacarosa y Ácido giberélico (AG3). Se preparó un total de 45 tubos y se llevaron a la autoclave para esterilizarlos a una Presión de 1 atm y en un tiempo de 25 minutos, se sacaron los segmentos de tallo ya desarrollados de las magentas, se cortaron segmentos de aproximadamente 3 cm de largo, procurando que todos los demás cortes sean del mismo tamaño, y que cada segmento tenga entre 2 a 4 yemas, solamente se consideró aquellas yemas axilares. Tabla N°01: Resumen de la variación de los tratamientos Tratamiento Sol. A (ml/L) T1 50 T2 50 T3 50 T4 50 T5 60 T6 60 T7 60 T8 60 testigo 50 sacarosa (g/L) 20 20 10 10 20 20 10 10 25 Hormona AG3(mg/L) 0.1 0 0.1 0 0.1 0 0.1 0 0.1 Fuente: Elaboración propia En el cuadro se muestra la cantidad de solución A, que aporta el nitrógeno al medio Murashige & Skoog (MS) que se empleó para preparar los 8 tratamientos y el testigo con el medio comúnmente empleado en el proceso de multiplicación in vitro de Solanum tuberosum L. Lo mismo ocurre con la cantidad de sacarosa empleada para preparar 1 litro de medio por cada tratamiento donde los tratamientos 1,2,5 y 6 son los que tienen 20 g/L de 23 sacarosa y finalmente la cantidad de hormona empleada en mg/L para la preparación de un litro de medio Murashige & Skoog (MS). 3.2.3 Tratamientos empleados: Tabla N°02: Tratamientos aplicados a Solanum tuberosum L. variedad chiquisa. Componentes Testigo NH4NO3 KNO3 MgSO4.7H2O CaCl.2H2O 1650 1900 370 170 KI H3BO3 MnSO4.4H2O ZnSO4.7H2O NaMoO4.2H2O CuSO4.5H2O CoCl2.6H2O 8.83 6.2 22.3 8.6 0.25 0.025 0.025 Na2.EDTA FeSO4.7H2O 37.3 27.8 Inositol Acido nicotínico Piridoxina Tiamina Glicina 100 0.5 0.5 0.1 2 Sacarosa Hormona AG3 Phytagel (%) pH 25 0.1 0.3 5.6 T1 MEDIO MS (mg/L) T2 T3 T4 T5 Macronutrientes 1650 1900 370 170 T6 T7 T8 1650 1650 1650 1980 1980 1980 1980 1900 1900 1900 2280 2280 2280 2280 370 370 370 370 370 370 370 170 170 170 170 170 170 170 Micronutrientes 8.83 8.83 8.83 8.83 8.83 8.83 8.83 8.83 6.2 6.2 6.2 6.2 6.2 6.2 6.2 6.2 22.3 22.3 22.3 22.3 22.3 22.3 22.3 22.3 8.6 8.6 8.6 8.6 8.6 8.6 8.6 8.6 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.25 0.025 0.025 0.025 0.025 0.025 0.025 0.025 0.025 0.025 0.025 0.025 0.025 0.025 0.025 0.025 0.025 Hierro 37.3 37.3 37.3 37.3 37.3 37.3 37.3 37.3 27.8 27.8 27.8 27.8 27.8 27.8 27.8 27.8 Vitaminas 100 100 100 100 100 100 100 100 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.1 0.1 0.1 0.1 0.1 0.1 0.1 0.1 2 2 2 2 2 2 2 2 Otros compuestos y parametros 20 20 10 10 20 20 10 10 0 0.1 0 0.1 0 0.1 0 0.1 0.3 0.3 0.3 0.3 0.3 0.3 0.3 0.3 5.6 5.6 5.6 5.6 5.6 5.6 5.6 5.6 Fuente: Elaboración propia 24 En el cuadro mostrado se han resaltado en color amarillo las variaciones que se han hecho en el medio Murashige & Skoog (MS) siendo los compuestos a variar la concentración de nitrógeno del medio, la concentración de sacarosa y la presencia o ausencia de Ácido giberélico (AG3). Esto se debe ya que bibliografía consultada demostraron que la variación de nitrógeno y sacarosa son los que influyen en el correcto desarrollo del segmento de tallo al finalizar el tratamiento, así como la cantidad de hojas que es lo que se busca en estos tratamientos empleados. 25 IV. ACTIVIDADES DE PRACTICAS PRE-PROFESIONALES 4.1 Adiestramiento en las capacidades útiles en el desempeño de un Biólogo-Microbiólogo. Las labores de mantenimiento del laboratorio bajo las condiciones de limpieza y asepsia, la preparación de soluciones stock para el cultivo in vitro de papa, así como el proceso que inicia en la toma de muestras para su cultivo in vitro hasta la multiplicación de variedades de interés para ser llevadas a campo fueron actividades de rutina que no reportaron resultados cuantificables. Es necesario informar los objetivos generales y específicos en la adquisición de experiencias durante las practicas pre-profesionales, esto fue logrado mediante el ejercicio constante de las labores, así como la supervisión constante de las mismas por parte del técnico de laboratorio. Estos resultados obtenidos se muestran en el cuadro siguiente: Cuadro N°01: Capacitación profesional obtenida en las practicas pre-profesionales 26 Tarea realizada Habilidad obtenida Mantenimiento de condiciones de limpieza y asepsia en el laboratorio área tuberosas eh higiene y esterilización de materiales de laboratorio Técnicas de limpieza útiles para cualquier trabajo de laboratorio para desarrollo de cualquier área de investigación del BiólogoMicrobiólogo Preparación y esterilización de soluciones stock y medios de cultivo Técnicas útiles para trabajar en el área de microbiología, micología, fitopatología, biotecnología microbiana y vegetal. Técnicas útiles para el BiólogoMicrobiólogo en la identificación de hongos causantes de plagas para el mejoramiento vegetal (Fitosanidad) Preparación de medios de cultivo PDA Técnicas de introducción, micro propagación, aclimatación y cultivo in vitro Técnicas útiles para el profesional con desempeño en las áreas de biotecnología vegetal, Fitopatología y mejoramiento vegetal Fuente: Propia La tabla N°01 resume las actividades realizadas durante las practicas pre-profesionales y las capacidades o habilidades logradas durante su práctica además de que se han podido consolidar conocimientos como la identificación de hongos Fito patógenos, así como obtener nuevas nociones eh ideas que aporten en la realización profesional en las diversas ramas que existen en la biología. V. RESULTADOS 27 Los resultados se midieron en cada repetición anotando los datos de cada medición en una tabla (ver tabla numero), en el cuadro se muestra la medición final de la altura de cada segmento de tallo, siento un total de 5 repeticiones y 8 tratamientos más el testigo, también está el número de hojas que se han desarrollado por repetición y tratamiento, transcurrido los 30 días de evaluación. A partir de estas mediciones se sacaron los promedios resaltados en azul, y partiendo de esto promedios se efectuó la formación de un gráfico promedio tanto de numero de hojas como de altura final por tratamiento Tabla N°06: Cuadro con promedios de altura y numero de hojas desarrolladas por tratamiento Tratamiento T1 T2 T3 T4 T5 T6 T7 T8 Testigo altura 4.98 5.36 4.34 5.04 4.1 5.2 4.3 7.2 6.02 Fuente: Propia 28 # de hojas 22 26 13 20 21 24 21 22 23 Gráfico de barras N°01: Barras de medición en cm de la altura final del segmento de tallo (barras celestes) y numero de hojas desarrolladas (barras naranjas) numero de hojas y altura final 26 24 22 21 23 22 21 13 7.2 4.98 5.36 1 2 4.34 5.04 3 4 2 4.1 5 5.2 6 4.3 7 8 6.02 9 Fuente: Propia El número de hojas desarrolladas (barras naranjas) durante el periodo de incubación fue mayor en el tratamiento 2 seguido por el tratamiento 6 caso diferente cuando se trata de la altura obtenida por los segmentos, que es mayor en el tratamiento 8 donde gano una altura promedio de 7.2 centímetros seguido en segundo lugar por el testigo obteniéndose una altura promedio de 6.02 centímetros. Dado que lo que se busca sea un mayor desarrollo en el número de hojas del segmento de tallo, se observa que el tratamiento 2 obtuvo un total promedio de 26 hojas superando al testigo, este resultado es el más importante ya que el número de hojas influirá en la capacidad del segmento desarrollado para poder resistir el proceso de aclimatación. 29 Tabla N°07: Análisis de los resultados estadísticos para determinar la relación que existe entre los tratamientos empleados y el número de hojas. Coeficientes Modelo Coeficientes no Coeficien estandarizados tes t Sig. 95.0% intervalo de confianza para B estandari zados B Desv. Beta Error 1 (Constante) 7.125 9.981 cantidad de .170 .169 .248 nitrógeno cantidad de Límite inferior superior .714 .507 -18.532 32.782 1.00 .360 -.264 .604 .034 .050 .820 .080 -80.424 6.424 6 .435 .150 .725 azúcar 2.90 5 ausencia o -37.000 16.893 -.541 presencia de 2.19 AG3 a. Límite 0 Variable dependiente: número de hojas En el cuadro estadístico arrojado por el programa IBM SPSS Stadistics 25 empleando un análisis multivariado con 3 factores que fueron 2 niveles de cantidad de nitrógeno, 3 niveles en cantidad de azucares y ausencia o presencia de la hormona AG3, la prueba de hipótesis que se planteo fue: H0: la cantidad de nitrógeno, azúcar y Hormona AG3 están relacionado con el número de hojas desarrolladas en el vástago. H1: la cantidad de nitrógeno, azúcar y Hormona AG3 no está relacionada con el número de hojas desarrollada en el vástago. 30 Según en el cuadro estadístico el valor de significancia con respecto a la cantidad de nitrógeno tiene un valor de 0.360 (resaltado en verde) que es superior al valor p=0.05, esto quiere decir que la cantidad de nitrógeno aplicado en los tratamientos no afecta significativamente al desarrollo del número de hojas en los vástagos que se desarrollaron a partir de segmentos de tallo. Con respecto a si hay relación en el número de hojas con la aplicación de la hormona AG3 este cuadro estadístico nos muestra un valor de 0.080, este valor es superior al valor p=0.05 por tanto no es significativo, así que la hormona AG3 no ha influenciado en el número de hojas de los vástagos. Finalmente, un valor estadísticamente significativo fue la relación que existe entre el factor independiente que está representada por la cantidad de azúcar y el desarrollo en la cantidad de hojas obtenidas en los segmentos de tallo, el valor de significancia es de 0.034 que es un valor p menor a 0.05 por tanto el valor independiente que es la concentración de azucares si influye en la cantidad de hojas que se han logrado desarrollar en los segmentos. 31 Tabla N°08: Análisis estadísticos de los resultados para determinar la relación que existe entre los tratamientos empleados y la altura final de los vástagos. Coeficientesa Coeficientes Modelo 1 Coeficientes no estandarizad 95.0% intervalo de estandarizados os confianza para B B Desv. Error (Constante) 5.418 4.335 NITROGENO -.003 .073 .028 -9.747 AZUCAR HORMONA Beta t Sig. Límite Límite inferior superior 1.250 .267 -5.724 16.561 -.013 -.035 .974 -.191 .186 .065 .170 .432 .684 -.139 .195 7.336 -.518 -1.329 .241 -28.605 9.111 a. Variable dependiente: ALTURA Fuente: Propia En el cuadro siguiente se observa los tres factores independientes que son la cantidad de nitrógeno, cantidad de azúcar y hormona AG3 (cuadros celestes) en donde los valores de significancia no son menores a 0.05 (resaltado en verde) por tanto la cantidad de nitrógeno, hormona AG3 ni la cantidad de azúcar afectan significativamente la altura final de los segmentos de tallo en cada tratamiento aplicado. 32 VI. DISCUSIÓN Según el trabajo de Tacoronte et al., (2018), se obtuvieron mejores resultados en el medio Murashige Skoog que contenía 20g/L de sacarosa, 2.28g/L de NH4NO3 el cual logro desarrollar un promedio de 18 hojas extendidas de color verde intenso en las tres variedades de Solanum tuberosum que fueron “Cucuba”, “Arbolona negra” y “Rosada”, en este trabajo si hubo una relación estadísticamente significativa con el factor cantidad de sacarosa en el medio Murashige & Skoog (MS) por tanto si se obtiene el mismo resultado independientemente de la variedad de Solanum tuberosum que se empleó en el trabajo de Tacoronte et al., (2018). Con respecto a la cantidad de NH4NO3 no tiene relación con la cantidad de hojas desarrolladas en el segmento de tallo, esto puede haberse dado por otros factores como son la variedad de Solanum tuberosum empleado en este trabajo ya que no todas las variedades responden de la misma manera frente a la concentración de NH4NO3 presentes en el medio Murashige & Skoog (MS) modificado porque en el trabajo de Tacoronte et al.,2018 las variedades mencionadas desarrollaron menos cantidad de hojas pero estas eran más grandes comparándolas con el tamaño de hojas de Solanum tuberosum variedad chiquisa. Esto requiere de un tratamiento más exhaustivo aumentando el número de tratamientos con respecto al factor cantidad de nitrógeno y con sacarosa en 20g/L. 33 VII. CONCLUSIONES Y SUGERENCIAS 7.1 Conclusiones El medio Murashige Skoog (MS) modificado adecuado para que desarrolle un mayor número de hojas fue el tratamiento 2 que contiene 1980 mg/L de NHNO3 y 20g/L de sacarosa. Se ha demostrado mediante pruebas estadísticas que la cantidad de nitrógeno aplicado en los tratamientos no es un factor que influye directamente en el desarrollo del número de hojas que desarrollaron los segmentos de tallo, sino el factor determinante es la cantidad de sacarosa. Los crecimientos de altura de los segmentos de tallo se obtuvieron en los medios que contenían mayores concentraciones de nitrógeno (1950mg/L de NH4NO3) y menor cantidad de sacarosa (10g/L) que fue en el tratamiento 8. Hubo un aumento mayor en el número de hojas en el tratamiento 2 desarrollando un total promedio de 26 hojas. 7.2 Sugerencias El medio adecuado para un mayor desarrollo de hojas fue aquel que contenía 20 g de sacarosa por litro de medio, a partir de este valor se pueden aplicar otras variables como por ejemplo una mayor cantidad de tratamientos variando la cantidad de nitrógeno, pero manteniendo constante la cantidad de sacarosa a 20g/L en el medio Murashige & Skoog (MS). 34 Siempre mantener la asepsia en la manipulación de los explantes y de tubos de ensayo para evitar cualquier contaminación o accidente frente a los segmentos de tallo. Se debe emplear un mayor espacio entre los tubos para que incida mejor la luz, una solución es usar rejillas para tubos de ensayo más grandes o usar dos rejillas 4 tratamientos por rejillas para tubos de ensayo. 35 VIII. BIBLIOGRAFIA: FERL, R., PAUL A. L. (2000). Genome organization and expression. En: Buchanan B., Gruissem W., Jones R. (eds.) Biochemistry and Molecular Biology of Plants. USA: American Society of Plant Physiologists, pp. 312-357. CALVA C. G., RIOS L. E. (1999). Cultivo de callos y acumulación de metabolitos secundarios. En: Rodríguez V. R., Calva C. G., Ramos R. E. G., Salazar M. A. (Eds.) Aspectos aplicados de la biotecnología. pp 267- 301. Tacoronte B., Melangel, & A., María Vielma, & Olivo, Auxiliadora, & Chacín, Nancy (2017). Efectos de nitratos y sacarosa en la propagación in vitro de tres variedades de papa nativa. Revista Colombiana de Biotecnología, XIX(2),63-73.[fecha de Consulta 2 de Enero de 2020]. ISSN: 0123-3475. Disponible en: https://www.redalyc.org/articulo.oa?id=776/77654661007. Conabio. (diciembre de 2018). Conabio. Obtenido de Conabio.org: http://www.conabio.gob.mx/conocimiento/bioseguridad/pdf/20914_sg7.pdf De haan, S., Taipe Palomino, A., & Ramos Condor, A. (Agosto de 2006). Cipotato.org. Obtenido de Cipotato: content/uploads/2014/08/003524.pdf 36 https://cipotato.org/wp- Roman Cortéz, M., & Hurtado, G. (30 de Diciembre de 2018). Centa. Obtenido de Centa.gob: http://www.centa.gob.sv/docs/guias/hortalizas/Guia%20Papa.pdf Sharry, S., Adema, M., & Abedini, W. (2015). PLantas de probeta. Manual para la propagación de plantas para cultivo de tejidos in vitro. Mexico: De la universidad de la plata. Obtenido de Sedici.unlp: http://sedici.unlp.edu.ar/bitstream/handle/10915/46738/Documento_completo_ _.pdf Unam. (2005). Cultivo de celulas y tejidos vegetales: Fuente de alimentos para el futuro. Revista digital universitaria, 3-16. Mateo Sagasta, L. (1990). Cultivo in vitro de plantas superiores. Madrid: Mundi-prensa. Krikorian A. D. (1991). Medios de cultivo: generalidades y preparación Regeneración de plantas en el cultivo de tejidos. Embriogénesis somática y organogénesis. En: Roca, WM y Mroginski LA (eds). Cultivo de Tejidos en la Agricultura: Fundamentos y Aplicaciones. CIAT, Cali pp 41-59. 37 IX. ANEXOS 9.1 Tratamientos y muestras de la variedad chiquisa en medio MS para propagación de papa estándar. Imagen 01 y 02: tubos de ensayo con los tratamientos preparados Imagen 03 y 04: plántulas de Solanum tuberosum L. variedad chiquisa 38 9.2 Crecimiento de los vástagos después de 27 días de evaluación. a) Tratamiento 01. N° de hojas Imag.05: 35 Imag.06: 24 Imag.07: 22 Imag.08: 13 Imag.09: 16 b) Tratamiento (Mateo Sagasta, 1990) 02. Imag.09: 26 Imag.10: 30 Imag.11: 21 39 Imag.12: 16 Imag.13: 40 c) Tratamiento 03. Imag.14: 10 Imag.15: 7 Imag.16: 16 Imag.17: 15 Imag.18: 18 d) Tratamiento 04. Imag.19: 25 Imag.20: 26 Imag.21: 12 40 Imag.22: 30 Imag.23: 9 e) Tratamiento 05. Imag.24: 30 f) Imag.25: 23 Imag.26: 20 Imag.27: 18 Imag.28: 15 Tratamiento 06. Imag.29: 28 Imag.30: 17 Imag.31: 30 41 Imag.32: 20 Imag.33: 26 g) Tratamiento 07. Imag.34: 40 Imag.35: 18 Imag.36: 14 Imag.37: 12 Imag.38: 20 h) Tratamiento 08. Imag.39: 24 Imag.40: 24 Imag.41: 20 42 Imag.42: 22 Imag.43: 18 i) Testigo. Imag.44: 34 Imag.45: 29 Imag.46: 8 Imag.47: 29 Imag.48: 14 9.3 Cuadros de Soluciones stock de minerales mayores y menores: a) Solución A COMPONENTE NH4NO3 KNO3 Agua destilada CANTIDAD (g) 16.5 19 500ml Fuente: Laboratorio de Biotecnología vegetal b) Solución B COMPONENTE CaCl2 Agua destilada CANTIDAD (g) 4.4 500ml Fuente: Laboratorio de Biotecnología vegetal c) Solución C COMPONENTE MgSO4.2H2O CANTIDAD (g) 3.7 43 KH2PO4 Agua destilada Fuente: Laboratorio de Biotecnología vegetal 1.7 500ml d) Solución D COMPONENTE EDTA-Na2 FeSO4.7H2O Agua destilada Fuente: Laboratorio de Biotecnología vegetal CANTIDAD (g) 0.373 1.7 500ml e) Solución E COMPONENTE H3BO3 MnSO4.7H2O ZnSO4.7H2O KI Na2MoO4.2H2O Solución Co-Cu Agua destilada Fuente: Laboratorio de Biotecnología vegetal f) CANTIDAD (g) 0.31 0.84 0.43 0.041 0.0125 1ml 500ml Solución F (vitaminas) COMPONENTE Tiamina Glicina Ácido nicotínico Piridoxina Agua destilada Fuente: Laboratorio de Biotecnología vegetal CANTIDAD (g) 0.005 0.1 0.025 0.025 500ml g) Solución de Co-Cu COMPONENTE CuSO4.5H2O CoCl2.6H2O Agua destilada Fuente: Laboratorio de Biotecnología vegetal 44 CANTIDAD (g) 0.0625 0.0625 50ml 9.4 Altura y numero de hojas final de cada segmento Tabla N°09: Medidas de altura final y numero de hojas por tratamiento y plántula TRATAMIENTO T1 Promedio T2 Promedio T3 Promedio T4 Promedio T5 Promedio ALTURA 6.1 5.8 3.6 4.9 4.5 4.98 5.9 5.1 7.9 4.4 3.5 5.36 5.1 4.8 3.4 3.2 5.2 4.34 4.3 8 4.6 4.6 3.7 5.04 4.1 4 4 4.1 4.3 4.1 # DE HOJAS TRATAMIENTO 35 24 T6 22 13 16 Promedio 22 26 30 T7 21 16 40 Promedio 26.6 10 7 T8 16 15 18 Promedio 13.2 25 26 Testigo 12 30 9 Promedio 20.4 30 23 20 18 15 21.2 Fuente: Propia 45 ALTURA 5.6 4.7 5.4 5.7 4.6 5.2 4.8 4.6 4.9 3.7 3.5 4.3 7.2 9.5 5.4 6.5 7.4 7.2 6 8 4.4 7.3 4.4 6.02 # DE HOJAS 28 17 30 20 26 24.2 40 18 14 12 20 20.8 24 24 20 22 18 21.6 34 29 8 29 15 23