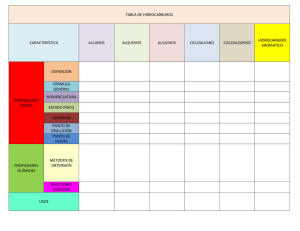
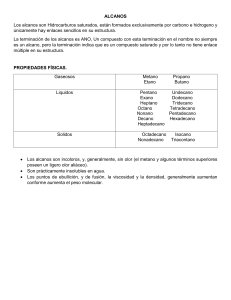
MANUAL DE LABORATORIO DE QUÍMICA ORGÁNICA CÓDIGO LQ-313 VERSION 001 PÁGINA 5 DE 7 PRÁCTICA # 5 ALCANOS Síntesis del Metano FECHA Objetivos Obtener metano en el laboratorio a partir de reactivos convenientes. Comprobar algunas reacciones con el metano obtenido Los alcanos se forman por la superposición de dos orbitales sp3 del carbono. Los alcanos se describen a menudo como hidrocarburos saturados de modo que contiene la máxima cantidad posible de hidrógeno por carbono. Los alcanos son compuestos formados por carbono e hidrógeno que sólo contienen enlaces simples carbono – carbono. Tienen formula general C n H2n + 2 donde n es un numero entero. Los alcanos también se denominan en ocasiones compuestos alifáticos, un nombre derivado del griego aleiphas que significa grasas. I. FUENTES DE ALCANOS. La principal fuente de los alcanos, es el petróleo. El petróleo, es una mezcla compleja de compuestos orgánicos; la mayoría de los cuales son alcanos e hidrocarburos aromáticos. También contiene cantidades pequeñas de compuestos que contienen oxígeno, nitrógeno y azufre. Otra fuente es el gas natural, que solo contiene los alcanos mas volátiles, es decir, los de bajo peso molecular. Otra fuente potencial de alcanos la constituye el otro combustible fósil, el carbón. Los productos del petróleo provienen de la destilación fraccionada del petróleo crudo, que produce diversas fracciones, las cuales se clasifican de acuerdo a la magnitud de sus puntos de ebullición. Las fracciones que se separan del proceso de refinamiento son: Gas natural C1 - C4 Éter de petróleo C5 - C6 Ligroína C6 - C7 Gasolina C7 - C12 Keroseno C12 - C18 Gas oil C18 - C20 Aceite lubricante C16 - C30 Parafinas C20 - C30 Asfalto C30 - C40 El principal uso de todas las fracciones volátiles es utilizarlo como combustibles. La fracción gaseosa, igual que el gas natural, se emplea sobre todo en calefacción. La gasolina se utiliza en máquinas de combustión interna que requieren un combustible bastante volátil; el queroseno se usa en motores de tractor y reactores, y el gasóleo, en motores Diesel, estos dos últimos también se emplean para calefacción, recibiendo el nombre de fuel-oil. MANUAL DE LABORATORIO DE QUÍMICA ORGÁNICA CÓDIGO LQ-313 VERSION 001 PÁGINA 5 DE 7 PRÁCTICA # 5 ALCANOS Síntesis del Metano FECHA La fracción de aceite lubricante, a menudo contiene grandes cantidades de alcanos de cadena larga (C20-C34), con puntos de fusión bastante altos. Si permanecieran en el aceite podrían cristalizar en forma de sólidos al bajar las temperaturas, en los oleoductos; para prevenirlo, se enfría el aceite y se separa la cera por filtración, que se vende como cera parafínica (p.f. 50-55ºC) una vez purificada, o bien se emplea como gelatina de petrolato (vaselina). El asfalto se emplea para impermeabilizar techumbres y en la pavimentación de carreteras. El éter del petróleo y la ligroína son disolventes útiles para muchos materiales orgánicos de baja polaridad. II. PROPIEDADES FÍSICAS. El estado físico de los 4 primeros alcanos: metano, etano, propano y butano es gaseoso. Del pentano al hexadecano (16 átomos de carbono) son líquidos y a partir de heptadecano (17 átomos de carbono) son sólidos. • Temperatura de Ebullición. Muestran un incremento regular al aumentar su peso molecular en los alcanos no ramificados, sin embargo, la ramificación de la cadena del alcano disminuye la temperatura de ebullición. • Temperatura de Fusión. Los alcanos no ramificados no muestran el mismo incremento uniforme en temperatura de fusión al aumentar el peso molecular que muestran en su temperatura de ebullición. Hay una alternativa a medida que se avanza de un alcano no ramificado con un número par de átomos de carbono al siguiente con un número impar de átomos de carbono. El efecto de la ramificación de la cadena sobre la temperatura de fusión de los alcanos es más difícil de predecir. En general, la ramificación que produce estructuras muy simétricas da como resultado temperaturas de fusión anormalmente altas. • Densidad. Como clase, los alcanos y ciclo alcanos son los menos densos de todos los grupos de compuestos orgánicos. Todos los alcanos y ciclo alcanos, tienen densidades considerablemente inferiores a 1.00 g/ml, como resultado de ello el petróleo flota sobre el agua. • Solubilidad. Los alcanos y ciclo alcanos son casi totalmente insolubles en agua debido a su muy baja polaridad y a su incapacidad para formar enlaces de hidrógeno. Los alcanos y ciclo alcanos líquidos son solubles entre sí, y en general se disuelven en disolventes de baja polaridad. Entre los buenos disolventes para ellos están: -Benceno -Tetracloruro de carbono -Cloroformo y otros. MANUAL DE LABORATORIO DE QUÍMICA ORGÁNICA CÓDIGO LQ-313 VERSION 001 PÁGINA 5 DE 7 PRÁCTICA # 5 ALCANOS Síntesis del Metano III. FECHA Metano (CH4 ) Tiene un átomo de carbono, cuyas 4 valencias se saturan con 4 átomos dehidrogeno Propiedades físicas del metano: Las moléculas de metano, en sí, son no polares, ya que las polaridades de los enlaces carbonohidrogeno individuales se anulan. La atracción entre moléculas es limitada a las fuerzas de Van-der Waals, en consecuencia el metano es un gas a temperaturas ordinarias. El punto de fusión del metano es de -183 y su punto de Ebullición de -161,5. El metano es incoloro y, en estado sólido, menos denso que el agua (densidadrelativa 0,4); es apenas soluble en agua, pero muy soluble en líquidos orgánicos, como la gasolina, éter y alcohol. Propiedades químicas del metano Son bastantes inertes debido a la elevada estabilidad de los enlaces C-C yC-H y a su baja polaridad. No se ven afectados por ácidos o bases fuertes ni por oxidantes como el permanganato. Sin embargo la combustión es muy exotérmica aunque tiene una elevada energía de activación. Las reacciones más características de los alcanos son las de sustitución: Combustión del metano La llama del metano es de color azul, debido a que la combustión con exceso de oxigeno es en general completa. El metano se oxida a CO2 y H2O pero si la combustión es incompleta se forma en poca cantidad CO, H2O y un residuo carbonoso, llamado negro de humo.CH4 + 2O 2 CO2 + 2 H2O + calor (213 Kcal/mol) IV. FUENTES DE METANO. El metano fue uno de los principales componentes de la atmosfera primitiva terrestre. Sobre la tierra el metano es el principal componente del gas natural, junto con el etano y otros alcanos de bajo peso molecular. Como los componentes del gas natural son importantes en la industria, se han hecho grandes esfuerzos para encontrar procesos de gasificación de la hulla y obtener así fuentes alternas. Algunos organismos vivos, producen metano a partir de dióxido de carbono e hidrógeno. Estas criaturas muy primitivas, llamadas metanogenos solamente pueden sobrevivir en ambiente anaerobio; se han encontrado en las grietas oceánicas, en el lodo, drenajes y en el estómago de la vaca.