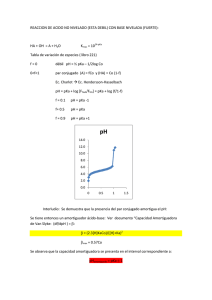
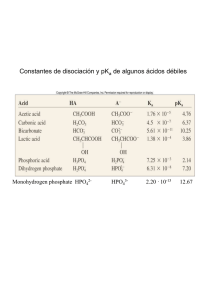
4. Ácidos y Bases Ácidos y Bases (teoría de Bronsted-Lowry) Ácido: especie química que tiende a ceder protones Base: especie química que tiende a aceptar protones A - + H+ AH B + H+ BH+ Ácido Ác. Clorhídrico Ác. Fórmico Ác. Acético Ác. Carbónico: Disociación 1 Disociación 2 Ác. Fosfórico: Disociación 1 Disociación 2 Disociación 3 Amoníaco Metilamina Base conjugada HCl H-COOH CH3-COOH ClH-COOCH3-COO- H2CO3 HCO3- HCO3CO32- H3PO4 H2PO4HPO42NH4+ CH3NH3+ H2PO4HPO42PO43NH3 CH3NH2 Ácidos y Bases (teoría de Lewis) Bases: grupos moleculares con pares electrónicos libres (nucleófilos) Ácidos: grupos moleculares con afinidad hacia pares electrónicos libres (electrófilos) Ecuación de HendersonHasselbach A- + H+ AH [A-][H+] Ka = [AH] logKa = log [H+] -] [A + log [AH] -log [H+] = -logKa + log [A-] [AH] [base] pH = pKa + log [ácido] Producto iónico del agua H2O H+ + OH[H+][OH-] Kd = [H2O] Kd[H2O] = [H+][OH-] = 10-14 Concepto de pH - Logaritmo cambiado de signo de la concentración de hidrogeniones - Dado el producto iónico del agua, [H+][OH-] = 10-14 la neutralidad ácido-base tiene lugar cuando [H+] = [OH-] = 10-7 ; pH = 7 - Medio ácido: pH < 7 Medio básico: pH > 7 Concepto de pKa - Logaritmo cambiado de signo de la constante de equilibrio de disociación de un ácido de Bronsted - Es propio de un grupo, no de una molécula - Cuando pH = pKa, [ácido] = [base] - La capacidad tampón es máxima en las proximidades del pKa - Un ácido es tanto más fuerte cuanto más bajo es su pKa; una base es tanto más fuerte cuanto más alto es su pKa. pKa de algunos sistemas ácido-base Ác. Fórmico Ác. Acético Ác. Fosfórico: Disociación 1 Disociación 2 Disociación 3 Amoníaco Metilamina 3.75 4.76 2.14 7.20 12.40 9.25 10.60 Titulaciуn de бcido acйtico CH3 COOH CH3 COO- + H+ 9 8 CH3 COO- 7 pH 6 5 pKa 4 3 CH3 COOH 2 1 0 1 Base aсadida Titulaciуn de un aminoбcido 16 R CH COO- 14 NH2 12 pH 10 pKN 8 R CH COO- 6 NH3+ 4 2 pKC R CH COOH 0 NH3+ 0 1 Base aсadida 2 Comportamiento tampón Titulaciуn de бcido acйtico 9 8 7 pH 6 5 4 3 2 1 0 1 Base aсadida Sistema carbónico-bicarbonato CO2 + H2O H2CO3 HCO3- + H+ - pKa relativamente alejado del pH fisiológico - Ácido: [CO2] Base: [HCO3-] - [CO2]: regulado por la respiración - [HCO3-]: regulado por excreción renal Sistema de los fosfatos H3PO4 H2PO4- HPO4-- PO4--- - La segunda disociación tiene un pKa adecuado al tamponamiento fisiológico, pero su concentración es relativamente baja. Sistema de las proteínas - Las proteínas tienen una gran cantidad de grupos disociables que contribuyen a su capacidad tampón. - Es un sistema de gran capacidad - Son particularmente eficientes como tampones las proteínas ricas en el aminoácido histidina H O H O N C CH N C CH CH2 CH2 NH HN N HN + H+