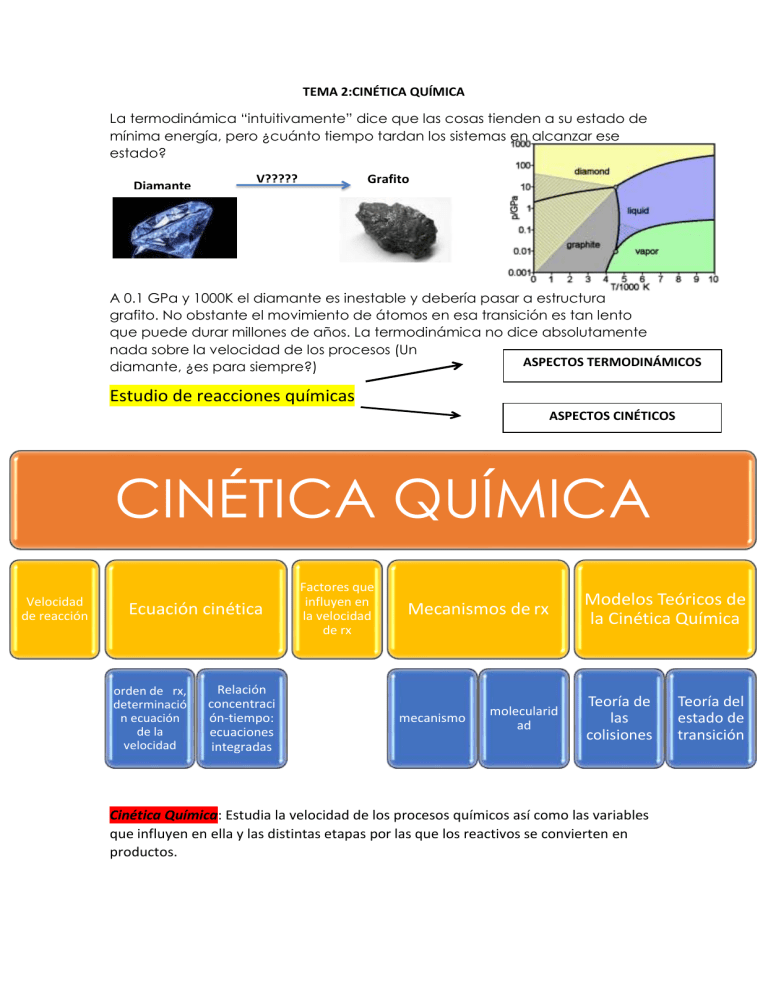
TEMA 2:CINÉTICA QUÍMICA La termodinámica “intuitivamente” dice que las cosas tienden a su estado de mínima energía, pero ¿cuánto tiempo tardan los sistemas en alcanzar ese estado? Diamante V????? Grafito A 0.1 GPa y 1000K el diamante es inestable y debería pasar a estructura grafito. No obstante el movimiento de átomos en esa transición es tan lento que puede durar millones de años. La termodinámica no dice absolutamente nada sobre la velocidad de los procesos (Un ASPECTOS TERMODINÁMICOS diamante, ¿es para siempre?) Estudio de reacciones químicas ASPECTOS CINÉTICOS CINÉTICA QUÍMICA Velocidad de reacción Ecuación cinética orden de rx, determinació n ecuación de la velocidad Relación concentraci ón-tiempo: ecuaciones integradas Factores que influyen en la velocidad de rx Mecanismos de rx mecanismo molecularid ad Modelos Teóricos de la Cinética Química Teoría de las colisiones Cinética Química: Estudia la velocidad de los procesos químicos así como las variables que influyen en ella y las distintas etapas por las que los reactivos se convierten en productos. Teoría del estado de transición 1.Velocidad de reacción Magnitud que permite determinar la variación que experimenta la concentración de cualquiera de las especies que intervienen en una reacción química en función del tiempo. A [A] Velocidad de reacción P Pendiente de la recta tangente a la curva en un punto [P] t (s) Signo -: reactivo desaparece Signo +: producto aparece Instantánea:t 0 Definición de velocidad de rx: Variación instantánea y con signo positivo de la concentración molar de reactivo o producto dividida por su coeficiente estequiométrico 2. Ecuación cinética: ecuación que relaciona la v de rx con las concentraciones molares de reactivos que participan en la rx a A + b B + …→g G + h H + … Orden de reacción v=k … [A]m [B]n Ley diferencial de velocidad o ecuación cinética de velocidad m, n,: orden parcial de reacción respecto de A, B, ... Números enteros positivos pequeños: 0, 1, 2, … NO están relacionados con los coeficientes estequiométricos de la reacción global. Coinciden SÓLO en reacciones que transcurren en un solo paso (reacciones elementales) m + n + ... : orden de reacción total, orden global de reacción (idea del nº de moléculas que tienen que chocar para que se de la reacción) Constante de velocidad o constante cinética: k Depende de la reacción, de los catalizadores (cuando se usan), y de la temperatura, y su valor indica si la reacción es rápida o lenta Tiene unidades que dependen de n y m, y deben ser tales de manera que las unidades de la velocidad sean molar/s (M/s) 1-(m+n+...) M /t Determinación de la ecuación de velocidad: MÉTODO DE LAS VELOCIDADES INICIALES Paso 1: Determinar los órdenes de reacción en el instante inicial, eligiendo convenientemente las concentraciones de reactivos experiment o 1 CA0/ M CB0/ M v0/ Ms-1 CA1 CB1 v1 2 CA2 CB2 =CB1 v2 3 CA3 =CA1 CB3 v3 Paso 2: Determinar la constante de velocidad a partir de los datos de concentración y velocidad inicial de cualquiera de los experimentos anteriores. EJEMPLO: velocidad – concentración [H2O2] (M Medida directa: concentración - tiempo (mirar ejercicio presen) Integración Ecuaciones cinéticas Ecuación matemática que relaciona las concentraciones molares de los reactivos con el tiempo 3.Factrores que intervienen en la Velocidad de reacción Concentración de los reactivos: “A mayor concentración, mayor número de choques entre las moléculas y, por tanto, mayor velocidad de reacción”. FACTORES ENGLOBADOS EN LA CONSTANTE CINÉTICA Catalizadores Los catalizadores son sustancias que, sin consumirse en la reacción, varían la velocidad de la misma, aumentándola si son catalizadores positivos (disminuye la Ea) y la disminuyen si son catalizadores negativos o inhibidores (aumenta la Ea). Estado físico de los reactivos: La Interacción directa favorece las reacciones directas Reacciones homogéneas: más rápidas Reacciones heterogéneas: más lentas Influencia de la temperatura: La velocidad de una reacción aumenta con la Temperatura ECUACIÓN DE ARRHENIUS (1889): La constante de velocidad de la mayoría de las reacciones aumenta con la T según: Ea: Energía de activación: energía mínima de las moléculas para que haya reacción A: Factor de frecuencia K: Constante de la ecuación de velocidad -1 -1 R: Constante de los gases ideales (usando 8.3145 J·mol ·K ) T: temperatura ejer 4.Mecanismos de reacción Descripción detallada de una reacción química presentada como una serie de cambios denominados procesos elementales, que dan lugar a una reacción global y se corresponden con al avance de la reacción Consistente con la estequiometría de la reacción global Consistente con la ecuación de velocidad experimental Etapas elementales: Transformación molecular que modifica de forma importante la energía o geometría de una molécula, o produce una o más nuevas moléculas en una sola etapa intermedia. Estas etapas se caracterizan por: Los órdenes parciales coinciden con los coeficientes estequiométricos Si una etapa elemental transcurre mucho más lenta que las demás etapas elementales del mecanismo, será la etapa limitante de la velocidad, determinando la velocidad de la reacción global Los procesos elementales son reversibles y algunos pueden alcanzar una condición de equilibrio en la que las velocidades de los procesos directo e inverso se igualan. Molecularidad Número total de especies que intervienen como reactivos en una etapa elemental: unimolecular, bimolecular, trimolecular, … Especies químicas intermedias Especies que se producen en un proceso elemental y se consumen en otro (NO aparecen en la ecuación de velocidad global) 5. Modelos teóricos de la Cinética Química TEORÍA DE LAS COLISIONES Para que ocurra una reacción química es necesario que existan choques entre las moléculas de reactivos que den origen a productos. Estas colisiones deben cumplir las siguientes condiciones: Las moléculas de reactivos deben poseer la energía suficiente para que pueda ocurrir la ruptura de enlaces, un reordenamiento de los átomos y, finalmente, la formación de los productos. Si no se dispone de la energía suficiente, no se forman los productos. Los choques entre las moléculas deben efectuarse con la debida orientación en los reactivos (colisiones efectivas o choques eficaces). Cabe destacar que no todas las colisiones (gases, la frecuencia 30 6 de colisiones 10 colisiones/s → vteórica = 10 M/s) entrereactivos son -4 efectivas, por lo tanto no todas originan productos (gases, vreal ≈ 10 M/s). Sin embargo, a mayor número de colisiones mayor es la probabilidad de que sean efectivas. TEORÍA DEL ESTADO DE TRANSICIÓN La aproximación de los reactivos da lugar a la formación de un estado intermedio de alta energía, alta inestabilidad y corta duración: COMPLEJO ACTIVADO (estructura intermedia entre los reactivos y los productos). El complejo activado está en un estado transitorio llamado estado de transición (ET), que se descompone por su elevada energía, dando lugar o bien a los reactivos o bien a los productos. Para representar estos procesos se utilizan diagramas de energía (perfil energético de la reacción), donde se representa la cantidad de energía en función del avance de la reacción: La energía que necesitan los reactivos para alcanzar este complejo se llama energía de activación: Ea. A mayor Ea menor velocidad de reacción en general ENDOTÉRMICA (sistema absorbe E) EXOTÉRMICA (sistema libera E) EJERCICIOS DEL TEMA










