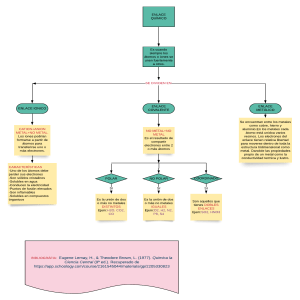
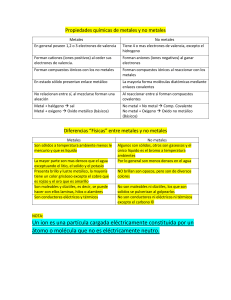
Análisis de metales Practica de laboratorio Elementos químicos Elementos químicos Propiedades físicas Tienen brillo (lustre), como la plata y el oro. Conducen bien el calor y la electricidad como el cobre. Son maleables: es decir, pueden formar láminas al golpearlos con un martillo como el aluminio o el estaño. Son dúctiles: pueden estirarse para formar alambres como el cobre. Propiedades físicas La mayoría son sólidos a temperatura ambiente, a excepción del mercurio, galio y cesio, que son líquidos. Tienen densidades y puntos de fusión muy altos ya que la mayoría son sólidos. Casi todos son duros como el hierro y el cromo, aunque algunos son suaves como el sodio y el plomo. Propiedades físicas Propiedades químicas Actúan como agentes reductores Cuando reacciona un metal con un no metal, generalmente el metal actúa como agente reductor, mientras el no metal es el agente oxidante. Por ejemplo: el sulfuro de sodio Na2S contiene cationes de Na+ y aniones de sulfuro S-2. Propiedades químicas Formación de cationes La capacidad de ceder electrones de valencia y formar cationes es una de las propiedades de los metales. Por ejemplo, los metales alcalinos, como el sodio y el potasio, ceden fácilmente un electrón. Los metales alcalino térreos, como magnesio y calcio, ceden los dos electrones de su última capa de valencia Actividad del día. (Realizar en el cuaderno y subirlo al aula virtual en la sección asignada) ELEMENTO 1 2 3 4 5 ESTADO NATURAL (gaseoso, liquido, solido) CARACTERISTICAS USOS