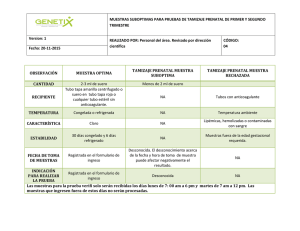
CONDICIONES DEL PACIENTE PARA UNA TOMA DE MUESTRA PARA EXÁMENES DE LABORATORIO AUTORES: Dr. Álvaro Justiniano Grosz Dra. Lizandra Morales Jurado Dr. Julio Urizar Rojas ÍNDICE I. INTRODUCCIÓN II. INDICACIONES GENERALES PARA TOMA DE MUESTRAS EN EXÁMENES DE SANGRE. III. MUESTRAS SANGUÍNEAS. IV. CONDICIONES DETERMINACIÓN DEL PACIENTE DE ACUERDO AL TIPO DE V. TOMA DE MUESTRAS BACTERIOLÓGICAS. INSTRUCTIVO VI. CONDICONES DE TOMA MICROBIOLÓGICOS Y DE ORINA DE MUESTRA PARA ESTUDIOS I. Introducción. El objeto de cualquier trabajo analítico es proporcionar resultados de análisis con un alto nivel de exactitud, reproducible y con un alto nivel de precisión, de tal manera que se puedan sacar conclusiones y tomar decisiones con base en una información que tenga niveles aceptables de error y ambigüedad. La preparación cuidadosa del paciente, la toma y el manejo adecuados de las muestras son los primeros pasos que garantizan resultados válidos, aunque, frecuentemente se descuidan. Existen muchas variables pre analíticas al preparar al paciente o al manejar la muestra que influirán el resultado de la medición y afectarán la calidad del servicio que ofrece. La implementación de un sistema de control de calidad en un laboratorio clínico, con procedimientos específicos y bien definidos de todas las actividades, posibilita superar las no conformidades y las necesidades de acciones correctivas y preventivas, impidiendo el aparecimiento de efectos adversos en la organización. La actividad laboratorial, en gran parte depende de la capacidad humana que está sujeta a aparecimiento de errores, consecuencia de una falta de estandarización o de cumplimiento de procedimientos de calidad, lo que puede determinar la emisión de resultados no compatibles con la situación actual del paciente. Según la bibliografía las principales fuentes de error, cerca del 70%, acontecen en el laboratorio clínico en la fase pre-analítica, que pueden estar en las actividades siguientes: • Los requisitos de los exámenes • La preparación del paciente • La identificación del paciente • La identificación de la muestra • La recolección de la muestra • El transporte de la muestra, la llegada a su destino, almacenamiento e inicio de su procesamiento. El cumplimiento de las especificaciones contenidas en los procedimientos de calidad, pueden disminuir grandemente el aparecimiento de errores, debidos a la actividad humana. Los errores cometidos por el equipo profesional del laboratorio clínico deben ser utilizados para identificar las no conformidades, posibilitando la implementación de acciones correctivas, con la finalidad de que las mismas no vuelvan a acontecer. Debe ser considerado que además de los errores humanos, existen factores fisiológicos que influencian los resultados de los exámenes, tales como: edad, actividad física, reposo, alimentación, consumo de alcohol, ciclo menstrual, obesidad, postura, gravidez, sexo, consumo de cigarro, hora de colecta de la muestra y ritmo circadiano. Los laboratorios tienen la necesidad básica de implementar un sistema de gestión de la calidad, que asegure un control de las fases pre analítica, analítica y post analítica lo que evitará el aparecimiento de no conformidades, alcanzando cada vez más precisión y exactitud en los resultados. La ausencia de un Sistema de Control de Calidad en un Laboratorio Clínico, puede traer consecuencias desagradables, como: • Diagnósticos equivocados por la aceptación de un resultado errado • Ansiedad en el paciente y el médico • Incidencia de mayor número de exámenes repetidos • Procedimientos terapéuticos innecesarios • Riesgo para el paciente • Problemas legales Al ser la fase preanalítica (que dentro de las actividades del laboratorio comprende desde los requisitos de los exámenes hasta la disponibilidad de la muestra para la fase analítica o de obtención de un resultado) una fase crucial antes de la emisión de un resultado, en este manual se exponen todos los requisitos necesarios para la obtención de un espécimen adecuado, a partir del cual se obtendrá un resultado que coadyuvará con el diagnóstico de las patologías. II. INDICACIONES GENERALES PARA TOMA DE MUESTRAS EN EXÁMENES DE SANGRE. 2.1. Preparación del paciente: • El paciente debe ser instruido para conocer los procedimientos necesarios para la recolección de las muestras para los exámenes. • El personal que atiende la sala de colecta debe tener el conocimiento de todas las instrucciones para que pueda transmitir a los pacientes en un lenguaje claro, objetivo y de fácil entendimiento, para no dejar dudas sobre las referidas instrucciones de preparación anticipada de los pacientes. 2.2. Instrucciones para el paciente: • Debe existir en el laboratorio instrucciones destinadas a los pacientes, elaboradas para que los funcionarios de la sala de recepción y colecta puedan disponer a los pacientes para que los mismos puedan saber y prepararse para la colecta. • Estas instrucciones deben ser escritas, en lenguaje claro, objetivas y de fácil entendimiento. • Debe ser considerada la posibilidad de que el paciente no pueda leer las instrucciones, razón por la que las instrucciones deben ser también transmitidas oralmente, confirmando el entendimiento del paciente. • El laboratorio debe verificar si el paciente recibió las instrucciones destinadas a su preparación para la realización de los exámenes solicitados. • Si el paciente no recibió las instrucciones necesarias para la realización de los exámenes, estas deben ser dadas, inclusive por escrito, si fuera necesario. • Hay consideraciones que el médico las debe saber y que deben ser informadas al paciente, pues pueden alterar algunos exámenes de laboratorio: o El paciente no debe realizar ejercicios físicos intensos durante las últimas 24 hrs. o La colecta debe ser realizada en ambiente que no produzca estrés físico o mental en el paciente. o El paciente debe evitar ingerir alimentos grasosos y fumar antes de la colecta. o Las colectas de sangre deben ser realizadas entre las 7:00 y 9:00 hrs. de la mañana, después de haber permanecido sentado en posición relajada durante 20 a 30 minutos antes de la colecta. 2.3. Identificación del paciente. El personal de la sala de recolección y de recepción, al recibir un paciente debe inmediatamente identificarlo de forma única e inequívoca, registrando su código y su número de identidad. Esta identificación debe ser repetida por el funcionario, evitando de esta forma la posibilidad de recolectar muestra de persona diferente a la codificada. Es recomendable aplicar los procedimientos siguientes para reducir los errores de identificación de pacientes en el laboratorio: • Monitorear los errores de identificación de identificación, para localizar sus causas. • Asegurar que los pacientes sean correctamente identificados. • Utilizar por lo menos 2 identificaciones por paciente (nombre, sobrenombre, fecha de nacimiento, sexo, historia clínica) • Verificar los requisitos de exámenes en el sistema de informática, antes de liberar los resultados de un paciente. • El uso de etiquetas impresas con código de barras reduce la tasa de errores. • El personal debe estar capacitado. El registro del paciente debe incluir, la información siguiente: • Número de registro de identificación del paciente generado por el laboratorio. • Nombre del paciente • Edad y sexo • Procedencia del paciente (sala, consulta externa, seguro, cuarto, cama, etc.) • Teléfono y dirección del paciente (cuando aplique) • En caso de pacientes menores y/o incapacitados: nombre y dirección del responsable. • Fecha y hora de atención • Horario de colecta (cuando aplique) • Exámenes solicitados y tipo de muestra • Cuando sea necesario: información adicional de acuerdo al examen (medicamentos en uso, ciclo menstrual, etc.) • Fecha prevista para entrega de los resultados. III. MUESTRAS SANGUÍNEAS. La sangre es el fluido más utilizado. Las venipunciones se deben estandarizar en términos de la hora de recolección. Se debe definir muy bien el protocolo de preparación de muestras, el tiempo de aplicación del torniquete, la postura durante la toma de sangre, la temperatura, de transporte y el almacenamiento. Los datos obtenidos de sangre venosa no pueden compararse con los obtenidos de sangre de capilares. Los valores hematológicos también dependen de la edad, sexo hábito de fumar, hora de día, posición erecta o supina del paciente durante la toma, duración de la éxtasis venosas producida por el torniquete y la administración de líquidos y drogas. Los 3 métodos más importantes para obtenerlo son: 1) Punción venosa; 2) Punción capilar 3) Punción arterial. La sangre oxigenada por el pulmón, es bombeada por el corazón hacia todos los órganos y tejidos para cubrir las necesidades metabólicas. Esta sangre arterial tiene prácticamente una composición uniforme en todo el cuerpo. La venosa varía según la actividad metabólica del órgano o tejido por lo que el punto donde se extrae la muestra puede influir en la composición de la sangre venosa. Esta tiene menos Oxigeno que la arterial también se diferencia por el pH, por su concentración en Dióxido de Carbono y su hematocrito. La sangre obtenida por punción de la piel, que a veces se denomina sangre capilar incorrectamente, es una mezcla de sangre procedente de arteriolas, vénulas y capilares por lo tanto es en parte arterial, y en parte venosa. El aumento de presión en las arteriolas hace que la muestra sea más rica en sangre arterial, pero contiene también líquido intersticial e intracelular. PREPARACIÓN DEL PACIENTE. Ayuno del paciente: Si exceptuamos la glucosa, los triglicéridos y el fósforo inorgánico, los demás elementos sanguíneos no se alteran significativamente después de un desayuno “normal” por lo que el paciente no precisa guardar ayuno absoluto antes de la toma de sangre. Sin embargo la lipemia provocada por un aumento transitorio de los triglicéridos (como Quilo micrones) después de una comida que contengan grasa, puede provocar interferencias con un gran numero de determinaciones químicas, debida a la turbidez. La hiperlipemia postprandial transitoria suele desaparecer de 4 a 6 horas después de la comida. Entonces: “El paciente concurrirá con 8 hs de Ayuno para efectuarse cualquier tipo de extracción sanguínea, siendo la excepción la determinación de triglicéridos y perfil lipídico para las cuales el ayuno deberá ser de 12 hs” Momento para la obtención de los especimenes sanguíneos Algunas sustancias exhiben variaciones diurnas de importancia. Ej: cortisol, hierro, glucosa, triglicéridos y estriol. Estas sustancias pueden variar de 30 a 50 % durante el día. A menos que se especifiquen lo contrario, es mejor obtener los especimenes sanguíneos de 7 a 9 hs de la mañana. Las alteraciones están asociadas a los ritmos circadianos o ritmos biológicos, que provocan cambios relacionados con el día. Por Ej. La secreción de Catecolaminas es mayor durante el día que durante la noche, excepto en los veladores. Los ritmos biológicos se encuentran adaptados al entorno por medio de los diferentes factores externos que le son propios los ciclos luz/oscuridad y sueño/actividad, la alimentación, la influencia social, las estaciones, la temperatura, la humedad y los campos magnéticos. Los sincronizadores influyen sobre el “reloj interno” hasta conseguir que este oscile en función de los factores ambientales. Por eso: “La toma de los especimenes sanguíneos debe ser realizada entre las 7,00 a 9,00 de la mañana, con lo cual se respetan los ciclos circadianos o ritmo biológicos de todos los especimenes” Ejercicio antes de la toma La actividad muscular tiene efectos, tanto transitorios como de larga duración, sobre diversos parámetros químicos. Los efectos duraderos del ejercicio consisten en incrementos de las actividades de las enzimas musculares medidas en suero, ejemplo: creatinincinasa, aldolasa, aspartato-aminotransferasa y lactato-deshidrogenasa. El ejercicio físico prolongado modifica los niveles de cierto número de las hormonas sexuales. El volumen del plasma, esta disminuido significativamente después del ejercicio, después de tres semanas de reposo en cama y después de exponerse al frío. Po tanto: “El paciente no habrá realizado ejercicios previo a la extracción de la muestra sanguínea” Posición del paciente Debe tranquilizarse al paciente, el estrés provocado por la flebotomia puede afectar los resultados del laboratorio como cambios en la concentración de catecolaminas y gases en sangre. Las modificaciones posiciónales afecta: Albúmina, proteínas, diversas enzimas, calcio, bilirrubina, colesterol, triglicéridos, angiotensina, aldosterona y renina. Acostado: Existe un acomodo o distribución hemodinámica y de otros líquidos corporales Sentado: Empieza la salida de líquido intravascular al espacio intersticial y, por lo tanto, se produce hemoconcentración. Entonces: “La toma de la muestra se realizara si fuera posible con el paciente acostado, de no poder hacerlo la misma se hará con el paciente sentado y después de que haya descansado algunos minutos” Torniquete Este puede producir éxtasis venoso localizado, la muestra se hace hemoconcentrada, induciendo valores erróneamente altos para todos los especimenes proteicos y todas las especies ligadas a proteínas. El mismo no debe prolongarse por mas de 1 minuto. Se pide al paciente que cierre el puño, lo cual distiende las venas, el ejercicio excesivo del puño debe evitarse, dado que el mismo puede producir elevación en la concentración de potasio, como en la de la LDH. Las muestras para determinar Lactato deben ser tomadas sin torniquete. “El uso del torniquete no debe exceder de 1 minuto y su presión no debe ser excesiva, para determinar Lactato no debe usarse el mismo” Transporte de las muestras: Los tubos deben ser transportados en el menor tiempo posible al laboratorio. Los tubos deben mantenerse en posición vertical para promover la formación del coagulo y minimizar la agitación del liquido, lo cual reduce la posibilidad de hemólisis. El tubo tapado elimina la posibilidad de contaminación exógena de la muestra, evaporación, posibilidad de derrame y la producción de aerosoles al momento de la centrifugación. Las muestraspara la determinación de estado ácido-base deben transportarse en hielo a 4ºc. El manejo suave evita la hemólisis y no se verán afectadas: LDH, AST, potasio, hierro, ALT, fósforo, proteínas totales, albúmina, magnesio, calcio, fosfatasa ácida y disminución de la T4. Debe evitarse la exposición a la luz especialmente porque se afectarían las vitaminas A y B6, beta-carotenos, porfirinas y bilirrubina. “Las muestras deben ser enviadas lo mas rápido posible al laboratorio para evitar la degradación de muchos analitos, y las muestras de gases en sangre se deben transportar en hielo a 4ºC Xenobióticos: Alcoholismo: La Ingestión de etanol incluye incrementos de la concentración plasmática de lactato, ácido úrico y metabolismo del etanol. Los alcohólicos crónicos presentan HDL-Colesterol, Gama-GT y Ácido úrico elevados, como así un volumen corpuscular medio superior al normal (absorción de fólico). Prueba de Laboratorio Prueba de laboratorio Modificación Glucosa ↓ Bicarbonato ↓ Lactato ↑ Gasometría Acidosis Metabólica Urato ↑ Tabaquismo: Aumento de la concentración de la Carboxihemoglobina, catecolamina, cortisol sérico, un aumento del hematocrito y la hemoglobina. Actividad Tabaquismo agudo Tabaquismo crónico Variabilidad iatrogénica: Prueba Hemoglobina Catecolamina Cortisol Eosinófilos Neutrófilos Monocitos Ácidos grasos no esterificados Hemoglobina VCM Leucocitos Modificación ↑ ↑ ↑ ↓ ↑ ↑ ↑ ↑ ↑ ↑ Están causadas por medicamentos o actos terapéuticos o diagnósticos. Las alteraciones causadas por fármacos en las pruebas de laboratorio pueden agruparse en dos categorías: a) Efectos debidos a las propiedades farmacológicas o tóxicas de las drogas. b) Efectos debidos a la interferencia con la prueba de laboratorio “Deberá realizarse un pequeño interrogatorio al paciente para saber si el mismo toma algún medicamento o esta en tratamiento, pues estos pueden interferir en algunas determinaciones” Alteraciones gestacionales: En el embarazo se producen cambios profundos en diversos procesos metabólicos y bioquímicos: orina, hipófisis, tiroides, corteza suprarrenal, lípidos séricos, proteínas séricas, función hepática y glucosuria. Disminución de la concentración de la hemoglobina y el hematocrito. “A las mujeres en edad fértil deberá preguntárseles si pudieran estar embarazadas, dado que, este estado altera muchas determinaciones y debe tenerse en cuenta” Manejo de las fracciones sanguíneas: Coagulación de las muestras: Los tubos deben mantenerse en posición vertical para promover la formación del coagulo, la sangre coagula normalmente en pocos minutos, mas rápido si se agrega un activador, la formación del coagulo debe ser completa para poder centrifugar. El tubo tapado elimina la posibilidad de contaminación exógena de la muestra, evaporación, posibilidad de derrame y la producción de aerosoles que incrementan el riesgo de infección en el personal al momento de la centrifugación, y reducir la agitación del liquido, lo cual reduce la posibilidad de hemólisis también el manejo suave evita la hemólisis y no se verán afectadas: LDH, AST, potasio, hierro, ALT, fósforo, proteínas totales, albúmina, magnesio, calcio, fosfatasa ácida y disminución de la T4. Debe evitarse también prolongada exposición a la luz especialmente porque se afectarían las vitaminas A y B6, beta-carotenos, porfirinas y bilirrubina. Suero: No es aconsejable desprender el coagulo del tubo con un aplicador, porque es una fuente potencial de hemólisis. Si el tiempo de coagulación no es el adecuado, la formación latente de fibrina puede causar un problema en las determinaciones que se efectúan en equipos automáticos, se puede acelerar la coagulación utilizando un activador como trombina, o partículas de vidrio o sílice. Plasma: Se utiliza un tubo que contiene un anticoagulante, el cual puede ser centrifugado inmediatamente. Los anticoagulantes usados son Citrato; EDTA; heparina sódica y heparina de litio. Los dos primeros previenen la coagulación por extracción del Calcio de la sangre mediante precipitación o unión en forma no ionizada. No pueden usarse para las determinaciones de Calcio, Magnesio y Fosfatasa alcalina. La heparina actúa formando un complejo con la antitrombina III que inhibe la coagulación. Para las determinaciones de un coagulograma no puede usarse heparina, ni EDTA, el Citrato se usa para las determinaciones de eritrosedimentación y pruebas de coagulación. La heparina no puede usarse, inhibe etapas de la activación de los factores. No es satisfactorio usar heparina para recuento de leucocitos agrega células, y disminuye el numero de plaquetas, también debe usarse poca cantidad de heparina si se dosa monograma. ¿Qué ventajas tiene el plasma sobre el suero? 1) Economía de tiempo, se elimina la espera de la coagulación de la sangre. 2) Rendimiento mas alto, en sangre total, puede obtenerse de un 15 a 20 % mas de muestra 3) Puede ocurrir coagulación en suero, post centrifugación 4) El resultado del plasma es más representativo del estado biológico 5) Riesgo bajo de hemólisis y trombocito lisis, las plaquetas permanecen intactas, no hay seudohiperkalemia. ¿Cuáles son las desventajas del plasma sobre el suero? 1) En electroforesis de proteínas se altera. El fibrinógeno aparece como una banda en la región de las gammaglobulinas. 2) Interferencia método-dependiente, los anticoagulantes pueden llevar a la interferencia del método. 3) Interferencia del catión, cuando se usan heparina de litio o amonio. Tubos con gel Estos producen una buena separación del paquete globular y son útiles para la conservación de las muestras, pero debe respetarse el tiempo previo de coagulación. Estos dispositivos no se deben utilizar para las muestras que se utilizaran para estudiar calcio ionizado, progesterona, HIV, hepatitis, LDH, metales o fármacos antidepresivos. Interferencias analíticas Hemólisis: Denota la lisis anormal de los eritrocitos, la lisis provoca una descarga de la enzima adenilato cinasa. Aumenta la concentración sérica del potasio, magnesio, LDH, fosfatasa ácida y aldolasa. Larga permanencia de la sangre total en un recipiente. Contaminación de la sangre con detergentes, agua, choque térmico. Las muestras deben obtenerse por succión suave. La muestra debe trasvasarse lentamente por las paredes del tubo después de ser eliminada la aguja. Lipemia: Provocada por una concentración alta de triglicéridos en el suero provocara resultados aparentemente altos para todas las sustancias cuyas determinaciones se basan en la absorbancia a las mismas longitudes de onda en que las partículas de lípido también absorben luz. Ictericia: Puede interferir en las determinaciones de Albúmina, en los ensayos de colesterol que utilizan como reactivo el cloruro férrico, en las determinaciones de glucosa basadas en el método de la o-toluidina y en las proteínas totales por biuret, o las reacciones que usen filtro a 405 o a 520. IV. CONDICIONES DETERMINACIÓN. DEL PACIENTE DE ACUERDO AL TIPO DE HEMOGRAMA CONDICIONES DE LA MUESTRA Sangre total con anticoagulante EDTA (tubo tapa morada. La muestra se transporta a temperatura ambiente. La muestra es estable a temperatura ambiente entre 18 y 25°C por 6 horas, refrigerada a 4°C por 24 horas. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO El hemograma es un análisis de sangre en el que se mide en forma global y en porcentaje los tres tipos básicos de células que contiene la sangre, las denominadas tres series celulares sanguíneas: serie eritrocitaria o serie roja, serie leucocitaria o serie blanca y la serie plaquetaria. Además de la valoración del hematocrito, hemoglobina, recuento de eritrocitos, recuento de leucocitos, recuento de plaquetas, extendido de sangre periférica, incluye índices eritrocitarios que comprenden: El volumen corpuscular medio (VCM): es una medida del volumen o tamaño medio de los eritrocitos, y por lo tanto se usa para definir los conceptos de normocitosis microcitosis y macrocítosis. El VCM puede encontrarse aumentado en enfermedad hepática, alcoholismo, anemia perniciosa, deficiencia de ácido fólico. El VCM puede encontrarse disminuido en anemia ferropénica y talasemia. La hemoglobina corpuscular media (HCM): representa la concentración en peso picogramos (pg) de hemoglobina en cada eritrocito. La HCM se encuentra aumentada en anemia macrocítica y la HCM se encuentra disminuida en anemia microcitica y anemia hipocrómica. La concentración de la Hemoglobina corpuscular media (CHCM): representa la concentración de hemoglobina expresada en g/dl de células rojas empacadas. La CHCM se encuentra aumentada en esferocitosis y disminuida en la anemia microcitica y anemia hipocromica. METODOLOGÍA Se puede usar el método manual y actualmente se tienen los métodos electrónicos. Para el análisis celular el equipo coulter utiliza los siguientes principios de medición:Impedancia eléctrica. -Conductividad: es la medida del contenido interno celular basado en la citometría de flujo por rayo láser con enfoque electrodinámico. -Volumen: mide la membrana celular. -Scatter: Sheat o enfoque hidrodinámico. Este método da al recuento celular exactitud y reproducibilidad debido a que las células pasan a través del centro de la celda de flujo "fila india" y de a una para evitar la generación de pulsos anormales. INTERFERENCIAS Y LIMITACIONES -La leucocitosis importante (más de 400.000/ml) produce falso aumento de la hemoglobina por turbidez y del VCM y hematocrito porque los leucocitos son contados falsamente como eritrocitos. -La hiperglicemia por encima de 400 mg/dl se asocia con falso aumento de VCM y el hematocrito con disminución de la CHCM. -La hiperlipemia, debido a la turbidez que causa, puede asociarse con falso aumento de la hemoglobina, de la HCM y de la CHCM. CALCIO IONIZADO CONDICIONES DE LA MUESTRA La dosificación se verifica en plasma con gel separador y heparina de litio (tubo tapa verde con negro) o en suero tomado en tubo de tapa amarilla con gel o en tapa roja con gel. Es necesario conservar la muestra entre 2º y 8ºC si el proceso se va a demorar más de 4 horas. La muestra se conserva congelada a una temperatura de -18ºC o menos. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO Es la forma libre y fisiológicamente activa y representa el 50-55% del calcio total. La forma no libre está unida un 70% a albúmina y por esto cuando hay concentración anormal de la albúmina circulante la medición del calcio ionizado da una evaluación más precisa de calcio biológicamente importante. Una ventaja a la medición de calcio ionizado es que esta fracción no resulta afectada por las variaciones de los niveles séricos de albúmina. Es útil durante procedimientos quirúrgicos mayores como transplante hepático, puentes coronarios y otro que requieran transfusión rápida de grandes volúmenes de sangre y componentes, pues la infusión del citrato que contiene las unidades de sangre disminuye los niveles de calcio ionizado y en muy poca proporción los del calcio total. Niveles por debajo del 50% de su valor normal reducen significativamente el gasto cardiaco y deprimen la función ventricular. Se encuentra hipercalcemia en hiperparatiroidismo primario, tumores ectópicos secretores de hormona paratiroidea, intoxicación por vitamina D y entidades malignas. Hay hipocalcemia en hipoparatiroidimo, enfermedad renal severa y en pacientes críticamente enfermos. METODOLOGÍA Ión selectivo indirecto INTERFERENCIAS Y LIMITACIONES Entre los fármacos que pueden aumentar los niveles se incluye sales de calcio, vitamina D, litio, hidralacina, diuréticos tiacídicos, hormona paratiroidea, y hormona tiroidea. Los fármacos que pueden reducir los niveles incluyen anticonvulsivantes, aspirina, corticoesteroides, laxantes, anticonceptivos orales acetazolamida, calcitonina, sales de magnesio y CALCIO URINARIO CONDICIONES DE LA MUESTRA La dosificación se verifica en orina de 24 horas, guardada en refrigeración. Para la recoleccion de la muestra el paciente debe descartar la primera orina y apartir de este momento comenzar a recoger la orina que se excrete hasta alcanzar las 24 horas de recoleccion requeridas para la prueba. A medida que se este recogiendo la muestra, el recipíente debe mantenerse dentro de la nevera las 24 horas del procedimiento y llevar al laboratorio inmediatamente se termine este. Recordar al paciente que orine antes de defecar para que la orina no este contaminada por heces. CONDICIONES DE PACIENTE El paciente debe recoger la muestra siguiendo la dieta alimenticia habitual FUNDAMENTO El calcio que se absorbe normalmente en la zona superior del intestino y que se excreta por las heces y la orina, permite conservar el pH tisular y de líquidos, el balance electrolítico en líquidos celular y extracelular, y la permeabilidad de las membranas celulares. El calcio estimula procesos enzimáticos, facilita la coagulación de la sangre y disminuye la irritabilidad neuromuscular. Por lo tanto es importante valorar de manera cuantitativa la cantidad de calcio excretada en la orina. Valores aumentados en la eliminación de calcio, traducen indirectamentamente trastornos en la resorción ósea, fenómeno normal que aumenta en la osteoporosis evolutiva. Niveles aumentados de calcio tambien los podemos encontrar en hiperparatiroidismo primario, hipercalciuria idiopática y sarcoidiosis. Niveles disminuidos se encuentran en hipoparatiroidismo, deficiencia de vitamina D y osteodistrofía renal. Se debe tener en cuenta que en la menopausia baja el nivel de los estrógenos y se aumenta la eliminación del calcio, por lo que normalmente en dicho estado se debe aumentar la ingestión de calcio y vitamina D. Para valorar si la cantidad de calcio ingerido y el factor de absorción de la vitamina D está funcionando correctamente, la dosificación del calcio en la orina informa si la dosis establecida es la adecuada. La dieta alimenticia es indispensable tenerla en cuenta en su dosificcion. METODOLOGÍA Fotometría INTERFERENCIAS Y LIMITACIONES Los fármacos que pueden aumentar los niveles de calcio urinario incluyen diuréticos, anticonvulsivates y fosfatos. Los fármacos que pueden disminuir los niveles de calcio urinario incluyen adrenocorticoesteroides y anticonceptivos orales. El hecho de no reunir toda la orina durante el periodo especificado interfiere en la cuantificacion precisa de los resultados. La hormona paratiroidea disminuye la excreción de calcio por la orina. COLESTEROL TOTAL CONDICIONES DE LA MUESTRA La dosificación se verifica en suero tomado (si se usa vacutainer) en tubo de tapa amarillla con gel o en tapa roja con gel. CONDICIONES DE PACIENTE El paciente tres días precedentes a la prueba debe seguir el régimen alimenticio habitual. FUNDAMENTO El colesterol es un componente estructural de la membrana celular y las lipoproteínas plasmáticas y es indispensable en la producción de esteroides, síntesis de hormonas femeninas (estrógenos), además es el principal componente de la bilis e interviene activamente en la síntesis de los andrógenos. La mayor parte del colesterol ingerido procede de alimentos de origen animal. El hígado metaboliza el colesterol hasta su forma libre. El colesterol es transportado en el torrente sanguíneo por lipoproteínas. Casi el 75% del colesterol está unido a lipoproteínas de baja densidad (LDL) y el 25% a lipoproteínas de alta densidad HDL. Por lo tanto la dosificación de los niveles de colesterol tiene como finalidad evaluar el riesgo de arteriopatía coronaria, el metabolismo de la grasa, facilitar el diagnóstico de síndrome nefrótico, pancreatitis, hipotiroidismo e hipertiroidismo. Valores por encima de los 220 mg/dl se deben controlar. De esta cifra en adelante se inicia el riesgo coronario, que está influenciado por factores genéticos, alimentación, sistema de vida, concentración de HDL, ingestión de grasas animales, vida sedentaria, entre muchos otros. Niveles aumentados de colesterol (hipercolesterolemia) se pueden encontrar en hiperlipidemias, hipotiroidismo, diabetes mellitus descontrolada, síndrome nefrótico, embarazo, dieta rica en colesterol, xantomatosis, hipertensión, infarto de miocardio, aterosclerosis, cirrosis biliar, estrés y nefrosis. Niveles disminuidos de colesterol (hipocolesterolemia) se pueden encontrar en trastornos de mal absorción, desnutrición, hipertiroidismo, anemia perniciosa, enfermedad hepática, sepsis y estrés. METODOLOGÍA Colorimetría INTERFERENCIAS Y LIMITACIONES Durante el embarazo suelen observarse niveles elevados de colesterol. Entre los fármacos que pueden elevar los niveles de colesterol se incluye corticoesteroides, adrenalina, anticonceptivos orales, sulfamidas y diuréticos. Entre los fármacos que pueden reducir los niveles de colesterol se incluye andrógenos, captopril, eritromicina y nitratos. TRIGLICÉRIDOS CONDICIONES DE LA MUESTRA La dosificación se verifica en plasma con gel separador y heparina de litio (tubo tapa verde con negro) o en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel. Debido a la fragilidad de la sustancia a medir, la muestra debe ser procesada el mismo día en que se toma o refrigerada a 4°C por una semana. El suero no debe permanecer entre 15 y 30°C por más de ocho horas. Sino se completan los ensayos en ocho horas, se debe guardar el suero entre 2 y 8°C. Si en 48 horas no se completan los ensayos, o si la muestra debe almacenarse por más de 48 horas, debe congelarse entre menos 15 y menos 20°C. Las muestras deben descongelarse solamente una vez. CONDICIONES DE PACIENTE La muestra debe ser tomada después de un ayuno de 12 a 14 horas con el fin de no dosificar triglicéridos exógenos y abstinencia de alcohol de más de tres días. El paciente no debe modificar la dieta ni sus hábitos entre dos y tres semanas antes de realizar la prueba. La prueba para la determinación de triglicéridos no se recomienda realizar en pacientes hospitalizados. FUNDAMENTO Los triglicéridos son una familia de complejos lipídicos resultantes de la esterificación del glicerol con tres ácidos grasos (saturados o insaturados) de la misma o diferentes longitudes. Los triglicéridos no son solubles en la sangre, en donde son transportados como quilomicrones (triglicéridos de origen exógeno) o como lipoproteínas de muy baja densidad o VLDL (triglicéridos de origen endógeno). Los triglicéridos constituyen el 95% del depósito de grasas del organismo. Los triglicéridos están integrados en su mayor parte por las VLDL y su exceso se manifiesta por depositarse como tejido graso. Mientras más elevado esté su nivel, más materia prima se tiene para fabricar LDL. Los triglicéridos se elevan con la obesidad y en las hepatopatías y nefropatías crónicas. Está plenamente demostrada la relación que existe entre la diabetes mellitus e hipertrigliceridemia. Los valores más altos están íntimamente relacionados con la posibilidad de desarrollar una pancreatitis. Otras enfermedades en las cuales hay hipertrigliceridemia son enfermedad de depósito de colágeno, hiperlipoproteinemias tipo I, IIb, III, IV, y V, hipotiroidismo, síndrome nefrótico, infarto de miocardio y embarazo. También la hay en pacientes alcohólicos, situación que se normaliza con la abstinencia. Niveles disminuídos se pueden encontrar en síndrome de mala absorción y desnutrición. La determinación de los triglicéridos puede ser utilizada para “calcular” indirectamente las lipoproteínas LDL mediante la formula de Friedewald. LDL = colesterol total – HDL – (triglicéridos/5) METODOLOGÍA Colorimetría INTERFERENCIAS Y LIMITACIONES Los valores por encima de 400 mg/dl, no permiten calcular las LDL aplicando la fórmula de Friedewald. La prueba es muy sensible a la falta de preparación del paciente, sobre todo a la falta de ayuno. La ingestión de alcohol puede incrementar los niveles. Los niveles pueden estar aumentados durante el embarazo. ALBÚMINA SÉRICA CONDICIONES DE LA MUESTRA La dosificación se verifica en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel(si se usa vacutainer). La albúmina es estable siete días a temperatura ambiente, un mes en refrigeración y hasta 6 meses en congelación. CONDICIONES DE PACIENTE No requiere ninguna condición especial FUNDAMENTO La albúmina y la globulina constituyen la mayor parte de proteínas dentro del cuerpo humano. La albúmina es una fracción proteica que se forma en el hígado y cuyas funciones primordiales son el transporte de diferentes elementos y sostén de la presión oncótica. Hay niveles aumentados de albúmina en la deshidratación, desnutrición, mala absorción, alcoholismo, quemaduras y complicaciones renales, hepáticas y cardiacas. Pero sí la hipoalbuminemia, que es manifiesta de toda desproteinemia. Hay tres factores que pueden disminuir su concentración: por pérdidas cuantiosas o frecuentes (hemorragia, albuminuria persistente, paracentesis, catabolismo excesivo), por síntesis defectuosa, como ocurre en la mayor parte de las hepatopatías; y por carencia de materia prima, como en la hipo alimentación. METODOLOGÍA Colorimetría INTERFERENCIAS Y LIMITACIONES Los fármacos capaces de aumentar los niveles de proteínas incluyen esteroides, anabólicos, andrógenos, insulina, progesterona, corticosteroides, dextrano, hormona del crecimiento y fenazopiridina. Entre los fármacos que pueden disminuir los niveles de proteína se incluyen iones amonio, fármacos hepatotóxicos, estrógenos y anticonceptivos orales AMILASAS CONDICIONES DE LA MUESTRA La dosificación se verifica en plasma con gel separador y heparina de litio (tubo tapa verde con negro) o en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel (si se usa vacutainer). La alfa-amilasa en suero es estable una semana a temperatura ambiente o dos meses a 4ºC CONDICIONES DE PACIENTE No requiere ninguna condición especial FUNDAMENTO La amilasa es una enzima hidrolizada que se produce principalmente en el páncreas y en pequeñas cantidades en las glándulas salivales y trompas de Falopio. Las células acinares pancreáticas las segregan, van al conducto pancreático y luego al duodeno. En el intestino participa en la digestión de los carbohidratos para descomponerlos en azúcares simples. La destrucción de dichas células (pancreatitis) o la obstrucción del conducto pancreático (carcinoma) da lugar a que esta enzima pase al torrente circulatorio. El riñón elimina la amilasa rápidamente. Es de gran importancia su dosificación en todo abdomen agudo difuso o epigástrico, para diferenciar la pancreatitis de una perforación de úlcera péptica, o de un proceso agudo de diferente etiología. Niveles elevados se pueden encontrar en pancreatitis aguda, ulcera péptica perforada, perforación intestinal, parotiditis (paperas), infarto pulmonar, pancreatitis recidivante crónica, úlcera péptica penetrante, necrosis intestinal, colecistitis aguda, embarazo ectópico, cetoacidosis diabética. METODOLOGÍA Amiloclástico INTERFERENCIAS Y LIMITACIONES Las soluciones de dextrosa intravenosa pueden ocasionar un resultado negativo. Entre los fármacos que pueden incrementar los niveles séricos de amilasa se incluyen aspirina, dexametasona, glucocorticoides, medios de contraste con yodo, diuréticos del asa, metildopa, analgésicos narcóticos corticoesteroides, alcohol etílico y anticonceptivos orales. Entre los fármacos que pueden reducir los niveles se incluyen citratos, glucosa y oxalatos. ASPARTATO AMINOTRANFERASA CONDICIONES DE LA MUESTRA La dosificación se verifica en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel.Las muestras se pueden refrigerar para mantenerlas por 7 días, si es necesario conservarlas por más tiempo pueden congelarse hasta por tres meses. CONDICIONES DEL PACIENTE No se requiere ninguna condición especial. FUNDAMENTO Es una enzima que se encuentra tanto en el citoplasma del hepatocito como en las mitocondrias por lo que es bilocular. Está presente en la epidermis de la piel, miocardio, músculo estriado, páncreas y riñones. Aunque no es específica de lesión miocárdica, cuando la cifra de AST se combina con las de creatinina fosfocinasa y deshidrogenasa láctica es útil en el diagnóstico, el análisis cuantitativo y la cronología de un infarto de miocardio. El nivel de GOT se eleva de 6 – 10 horas después de un infarto de miocardio, alcanzando el máximo a las 12 – 48 horas y normalizándose a los 3 o 4 días, siempre que no se produzca otra lesión. Es de mucha utilidad para medir la actividad hepática y cronicidad de hepatitis viral. Se encuentran niveles aumentados en infarto de miocardio, operaciones cardíacas, cateterismo y angioplastia del corazón, hepatitis, cirrosis hepática, necrosis hepática, mononucleosis, pancreatitis aguda, anemia hemolítica, convulsiones recientes y enfermedad renal aguda. Niveles disminuidos se pueden encontrar en Beri – Beri, cetoacidosis diabética, embarazo. METODOLOGÍA Enzimático-colorimétrico. Cinético INTERFERENCIAS Y LIMITACIONES Los niveles de AST pueden disminuir durante el embarazo. El ejercicio puede incrementarlos. Los fármacos capaces de aumentar los niveles de GOT incluyen hipotensores, agentes colinérgicos, anticoagulante de tipo cumarínico, preparados de digital, eritromicina, isoniacida, anticonceptivos orales, opiáceos y salicilatos. BILIRRUBINA TOTAL Y DIRECTA CONDICIONES DE LA MUESTRA La dosificación se verifica en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel.Se debe evitar la exposición a la luz de las muestras pues la bilirrubina es muy fotosensible. La muestra se conserva a temperatura ambiente por cuatro horas, también puede refrigerarse hasta por 7 días o se congela por seis meses CONDICIONES DE PACIENTE No requiere ninguna condición especial. En pacientes sometidos a fototerapia pueden alterarse los resultados. FUNDAMENTO La bilirrubina resulta de la ruptura de la hemoglobina en heme y globina, el heme es catabolizado después de formar la biliverdina que se transforma en bilirrubina que se denomina indirecta. En el hígado, la bilirrubina indirecta es conjugada con glucorónido para producir bilirrubina conjugada o directa y esta se excreta después por las células hepáticas hacia los canalículos intrahepáticos, que acaban conduciéndola a los conductos hepáticos, el conducto biliar común y el intestino. El nivel de la bilirrubina sérica total es la suma de la fracción directa e indirecta. La bilirrubina indirecta se correlaciona con hemólisis o daño hepático y es la responsable del tinte amarillento que toma la piel cuando sus niveles se elevan, la bilirrubina directa se eleva cuando hay obstrucción del árbol biliar e ictericia de tipo obstructivo. Se encuentran niveles aumentados en el síndrome de Dubin-Johnson, eritoblastosis fetal, cirrosis, hepatitis, reacciones a fármacos, ictericia hemolítica, transfusión de un gran volumen de sangre, resolución de hematomas grandes, infiltración tumoral extensa del hígado, obstrucción del conducto biliar por tumor, inflamación, cálculo biliar, cicatrización o traumatismo quirúrgico, anemia perniciosa, anemia drepanocítica, reacción transfusional, síndrome de Crigler-Najjar, anemia hemolítica. METODOLOGÍA Colorimétrico INTERFERENCIAS Y LIMITACIONES La hemólisis de la sangre y la lipemia pueden producir resultados erróneos. Entre los fármacos que pueden causar niveles aumentados de bilirrubina total se incluyen esteroides, anabólicos, antibióticos, antipalúdicos, ácido ascórbico, azatioprina, clorpropamida, colinérgicos, codeína, dextrano, diuréticos, adrenalina, meperidina, metotrexano, metildopa, inhibidores de la monoaminooxidasa, morfina, ácido nicotínico, anticonceptivos orales, fenotiacinas, quinidina, rifampina, salicilatos, esteroides, sulfamidas, teofilina y vitamina A. Los fármacos que pueden reducir los niveles de bilirrubina total incluyen barbitúricos, cafeína, penicilina y salicilatos (dosis elevadas). CALCITONINA CONDICIONES DE LA MUESTRA Suero libre de hemólisis. Estabilidad de la muestra: congelada –20 °C: 1 mes CONDICIONES DE PACIENTE Estricto ayuno. FUNDAMENTO Detección y confirmación de carcinoma medular de tiroides, especialmente en pacientes con hiperparatiroidismo, feocromocitoma, sindrome de Cushing, neuromas mucosos y pacientes con neoplasia endrocrina múltiple, marcador de carcinoma de pulmón. CREATININA CONDICIONES DE LA MUESTRA La dosificación se verifica en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel.La muestra es estable a temperatura de refrigeración de 4°C por siete días. CONDICIONES DE PACIENTE La muestra puede tomarse en cualquier momento y no es necesario el ayuno. FUNDAMENTO Esta prueba mide la cantidad de creatinina presente en la sangre. La creatinina es el producto catabólico de la creatina utilizada en la contracción del músculo esquelético. La producción diaria de creatina, y por lo tanto de creatinina, depende de la masa muscular. La creatinina se excreta principalmente por los riñones de forma que su eliminación es directamente proporcional a la función excretora renal y una pequeña parte por las heces. La determinación de creatinina es un fiel reflejo de insuficiencia renal y del estado evolutivo de proceso urémico. Niveles aumentados de creatinina se encuentran en glomerulonefritis, pielonefritis, necrosis tubular aguda, diabetes, nefritis, acromegalia y gigantismo. Niveles disminuidos de creatinina se encuentran en estados de debilidad y disminución de la masa muscular. La creatinina se eleva considerablemente en obstrucciones urinarias, regresando a la normalidad al cesar ésta. En adenoma prostático y cálculo uretral, las cifras pueden pasar de 6 mg/dl sin que tenga el pronóstico de la insuficiencia renal. En procesos de deshidratación, también puede elevarse con carácter regresivo. En insuficiencia renal con uremia cifras superiores a 5 mg/dl, dan pronóstico fatal a corto plazo. METODOLOGÍA Colorimétrico INTERFERENCIAS Y LIMITACIONES La contaminación bacteriana causada por almacenamiento de muestras por largos períodos de tiempo puede causar valores falsamente bajos de creatinina. Sustancias como glucosa, ácido ascórbico, piruvato, acetona, ácido acético, levulosa, ácido úrico, proteínas, bilirrubina y cefalosporinas causan reducción en la medición de la concentración de creatinina. Los individuos con masa muscular grande como los atletas pueden tener niveles de creatinina mayores al promedio, incluso en presencia de función renal normal. CUERPOS CETÓNICOS CONDICIONES DE LA MUESTRA Sangre capilar(puncionar pulpejo dedo). Muestra de orina ocasional CONDICIONES DE PACIENTE No requiere ninguna condición especial FUNDAMENTO Son el resultado del producto incompleto de las grasas y su presencia es indicativa de acidosis. El 78% de los cuerpos cetónicos encontrados en el individuo corresponde al beta-hidroxibutirato, el 20% al acetoacetato y un mínimo porcentaje, 2% a la acetona. El acetoacetato se forma a partir de acetil-CoA, producto intermediario de la degradación de ácidos grasos, el beta-hidroxibutirato es convertido a ácido beta-hidroxibutírico por acción de la beta-hidroxibutirato deshidrogenasa; la acetona se forma también a partir del acetoacetato por mecanismos de descarbozilación espontánea. En condiciones normales no existen cetonas en la orina. La presencia de cuerpos cetónicos son de gran importancia para evaluar los trastornos del metabolismo de los carbohidratos y cuando se encuentra en cantidades elevadas en diabéticos indican acidosis y la posibilidad de coma. Se puede presentar cetonuria en estados febriles agudos, intoxicaciones, embarazo, caquexia, ayuno prolongado, dietas reductoras de peso y en estado postanestésico. METODOLOGÍA Técnica cualitativa colorimétrica de apreciación visual . INTERFERENCIAS Y LIMITACIONES Ciertas dietas especiales carentes de carbohidratos y ricas en proteínas pueden causar cetonuria. Hay interferencia en la orina con resultados falsos positivos por bromosulftaleína, fenilcetonas y metabolitos de la L-dopa. CURVA DE GLICEMIA PRE Y POST CARGA CONDICIONES DE LA MUESTRA La dosificación se verifica en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel. CONDICIONES DE PACIENTE El paciente debe presentarse en ayunas al laboratorio. Obtener muestra basal y posterior a esto el paciente debe ingerir una carga de glucosa por lo general entre 75 a 100 gr de glucosa. En los niños 1.75 gr de glucosa por kilo de peso hasta un máximo de 75 gr. FUNDAMENTO Dosificaciones periódicas de glicemia después de estimular el páncreas con una dosis de glucosa. El organismo absorbe rapidamente la dosis y hace que aumenten los niveles de glucosa plasmática y alcance su máximo en terminos de treinta minutos a una hora. El páncreas reacciona por secreción de mayor cantidad de insulina, y hace que los niveles de glucosa se normalicen después de dos a tres horas. Esta prueba permite analizar en forma práctica y global el metabolismo de los glúcidos, diagnosticar hipoglicemias funcionantes, diabetes latentes no diagnosticadas o comportamiento de las ya establecidas. Esta prueba esta contraindicada en caso de sospechar insulinoma, porque el ayuno prolongado en estos pacientes puede ocasionar lipotimia y coma. Los pacientes con una respuesta de insulina apropiada pueden tolerar la dosis de glucosa con bastante facilidad y sólo presenta un mínimo aumento transitorio de la glucemia en la hora siguiente a la ingestión. Los pacientes diabéticos, que tienen una deficiencia de insulina activa, son incapaces de tolerar esta sobrecarga. En consecuencia, los niveles séricos de glucosa aumentan mucho entre una y cinco horas después. La curva típicamente diabética consiste en ayunas superior a 100 mg/ml. A la hora, superior a 300 mg/ml. Dos horas, superior a 340 mg/ml. A las tres horas, las cifras pueden ser más altas o más bajas, según la intensidad de la diabetes. La típicamente curva hipoglicemica la podemos encontrar con ayunas, inferior a 70 mg/ml. A la hora, no pasa de 90 mg/ml. A las dos horas, 70 mg/ml o menos con bajas, más o menos acentuada hasta la quinta hora que puede llegar hasta 35 mg/ml. Se debe tener en cuenta que por encima de los cincuenta años, la tolerancia a la glucosa disminuye en razón de 10 a 15 mg/ml por cada decenio. Niveles aumentados se encuentran en diabetes mellitus, adenoma de páncreas y acromegalia. Niveles disminuidos se encuentran en hipoglucemia, insulinoma, hipotiroidismo y enfermedad de Adisson. METODOLOGÍA Método de trinder. Colorimétrico- Enzimático INTERFERENCIAS Y LIMITACIONES El consumo de cigarrillo durante la prueba, el ejercicio, el estrés, la cafeína y ciertos fármacos como antidepresivos, corticoesteroides, estrógenos, glucagón y salicilatos.puede elevar falsamente los valores. Todos deben suspenderse tres dias antes. Las infecciones recientes, fiebre, embarazo o enfermedad aguda como el infarto del miocardio, pueden hacer que aumenten los niveles de glucosa. DEPURACIÓN DE CREATININA CONDICIONES DE LA MUESTRA Para la depuración se requiere muestra de orina recolectada durante 24 horas, estando el paciente bien hidratado, en frasco sin preservativos; simultáneamente se debe tomar muestra de sangre en plasma con gel separador y heparina de litio (tubo tapa verde con negro) o en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel al final de la recolección. También se requiere conocer el peso y talla del paciente. La orina se puede preservar congelada a una temperatura de -18ºC o inferior. CONDICIONES DE PACIENTE No requiere ninguna condición especial. La orina de 24 horas se recoge de la siguiente manera: -Iniciar la recogida de 24 horas después de orinar el paciente y descartar este espécimen. -Recoger la orina emitida por el paciente las 24 horas siguientes. -El paciente debe orinar antes de defecar para que la orina no este contaminada por heces. Recoger el último espécimen lo más cerca posible del período de 24 horas. Mantener el recipiente dentro de la nevera; las 24 horas del procedimiento y llevar al laboratorio inmediatamente se termine este FUNDAMENTO La creatinina es importante en el metabolismo del músculo porque sirve de almacenamiento de fosfatos de alta energía a través de la síntesis de fosfocreatina. La creatina es un anhídrido de creatinina y se forma, de una manera constante, por una reacción espontánea e irreversible de la creatinina perdiéndose una molécula de agua. La creatinina libre no es reutilizada por el organismo y funciona solamente como un producto de desecho de la creatina. Por lo tanto la creatinina endógena proviene del metabolismo muscular y es la forma de eliminación de la creatinina de la que se deriva por deshidratación. Se elimina únicamente por la orina después de filtrarse en el glomérulo. La depuración de creatinina es un indicador de la tasa de filtración glomerular, es decir del número de mililitros filtrados que fabrica el riñón en un minuto. Se evalúan los niveles de creatinina en orina y suero y se calcula la depuración. La cantidad de filtrado que fabrica los riñones depende de la cantidad de sangre y de la capacidad de los glomérulos para actuar como filtros. Se encuentran niveles aumentados en ejercicio y embarazo y niveles disminuidos se encuentran en trastornos de la función renal, glomérulonefritis y necrosis tubular. METODOLOGÍA Colorimétrico INTERFERENCIAS Y LIMITACIONES El ejercicio puede incrementar los valores de creatinina. Si no se recoge toda la orina se pueden dar valores falsamente bajos. Hay aumento en el suero por interferencia analítica con algunos métodos por algunas drogas y constituyentes como los aminoglucósidos, acetaminofén, bilirrubina, citrato, heparina, lactato, L-dopa, EDTA, warfarina etc. . FOSFATASA ÁCIDA TOTAL Y PROSTÁTICA CONDICIONES DE LA MUESTRA Suero no hemolizado, ni lipémico Estabilidad de la muestra: refrigerada 2-8 °C: 48 horas. Congelada -20°C: 1 mes. CONDICIONES DE PACIENTE No requiere ayuno, la muestra debe tomarse antes de cualquier manipulación de la próstata: tacto rectal, masaje prostático, prostatectomía o biopsia. FUNDAMENTO Sospecha de carcinoma de próstata, además de otros parámetros; juega un papel pequeño en el diagnóstico de carcinoma primario de próstata; ayuda en el diagnóstico de metástasis de adenocarcinoma de próstata y/o extensión más allá de la cápsula prostática; monitoreo, seguimiento y respuesta al tratamiento de los pacientes. FOSFATASA ALCALINA CONDICIONES DE LA MUESTRA La dosificación se verifica en plasma con gel separador y heparina de litio (tubo tapa verde con negro) o en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel. La hemólisis parcial es aceptada, pero muestras con hemólisis franca no se aceptan. La muestra es estable a temperatura ambiente por cuatro horas. CONDICIONES DE PACIENTE No requiere condiciones especiales. FUNDAMENTO Las fosfatasas alcalinas se originan principalmente en los huesos y en el hígado, aunque para algunos es segregada solamente por los osteoclastos y el hígado es solamente órgano de excreción. Se localiza en muchos tejidos y las concentraciones más elevadas fuera del hígado, también se encuentran en el epitelio del tracto biliar, huesos, mucosa intestinal y placenta. Las fosfatasas alcalinas son una familia de enzimas que transfiere fosfato. Las fosfatasas exhiben actividad óptima a un pH alcalino. Para una óptima actividad requiere de iones de Mg++ y Zn++ y un pH aproximadamente de 10.0. el Ca++ y fosfato inorgánico inhibe la actividad de la enzima. La determinación de la fosfatasa alcalina es de gran utilidad en las ictericias donde sirve para diferenciar la obstructiva de la parenquimatosa. En la primera, las cifras están elevadas. En el diagnóstico de feto muerto, donde sus niveles descienden en contraposición del embarazo donde sus niveles están aumentados. Además la determinación de esta enzima es también importante en pacientes con enfermedades óseas. Existe una clara relación entre los osteoclastos y la formación ósea. El ritmo rápido del crecimiento óseo infantil, corre paralelo a las cifras de la fosfatasa alcalina que se encuentra en los niños. Si el crecimiento se bloquea, las cifras son similares a las del adulto. Los niveles de fosfatasa alcalina aumentan en casos de obstrucción biliar, tanto extrahépatica como intrahépatica, también se observa aumentada en carcinoma metastásico, tumores primarios (hepatoma), cirrosis, embarazo normal, hiperparatiroidismo, neoformación ósea patológica en las metástasis osteoblásticas (metástasis de cáncer de mama o de próstata), enfermedad de Paget, fracturas en consolidación, artritis reumatoide y en el crecimiento normal de los huesos. Los niveles de fosfatasa alcalina disminuyen en casos de hipotiroidismo, desnutrición, anemia perniciosa, hipofosfatemia, escorbuto, ingestión excesiva de vitamina B y enfermedad celíaca. METODOLOGÍA Calorimétrico- enzimático. Cinético INTERFERENCIAS Y LIMITACIONES Los fármacos que pueden elevar los niveles de fosfatasa alcalina incluyen albúmina obtenida de tejido placentario, allopurinol, antibióticos, azatioprina, colchicina, fluoruros, indometacina, isoniacida, metotrexato, metildopa, ácido nicotínico, anticonceptivos orales, fenotiacina, probenecid y tetraciclina. Los fármacos que pueden disminuir los niveles de fosfatasa alcalina incluyen arsenicales, cianuros, fluoruros, nitrofurantoína, oxalatos y sales de zinc. La temperatura por encima de los 37°C interfiere en los resultados debido a que a estas temperaturas las enzimas se degradan. FOSFORO CONDICIONES DE LA MUESTRA La dosificación se verifica en plasma con gel separador y heparina de litio (tubo tapa verde con negro) o en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel. CONDICIONES DE PACIENTE No requiere de condiciones especiales. FUNDAMENTO La mayor parte del fósforo que se encuentra en el organismo está combinado con calcio del esqueleto en forma de fosfato de calcio. Un 15% se encuentra en la sangre en forma de fósforo inorgánico (fosfato). Dichos compuestos permiten almacenar y utilizar la energía celular y regulan los niveles de calcio, el metabolismo de carbohidratos, lípidos y el equilibrio acidobásico. La leche y derivados, carne, pescado y trigo son las principales fuentes del fósforo y se absorbe en forma muy eficáz en la primera porción del intestino delgado. La excreción renal de fósforo debe ser igual a la ingesta dietética para mantener un nivel normal de fosfato en suero. Los niveles de fósforo dependen del metabolismo del calcio, de la paratohormona y en menor grado, de la absorción intestinal. Dado que existe una relación inversa entre el calcio y fósforo, la disminución de uno de ellos hace que se eleve el otro. Así pues, los niveles séricos de fósforo dependen del metabolismo del calcio y viceversa. La regulación del fosfato por la paratohormona se hace de tal forma que la hormona tiende a disminuir la reabsorción del fosfato en el riñón. Sin embargo, la paratohormona y la vitamina D tienden a estimular la absorción de fosfato en el intestino. La determinación de fósforo sérico tiene como finalidad valorar la insuficiencia renal crónica donde generalmente hay hiperfosfatemia, en la acromegalia donde su aumento está en relación con la actividad del adenoma, en el hipoparatiroidismo, fracturas evolutivas, hipervitaminosis D y en las crisis de enfermedad de Addison. Niveles aumentados (hiperfosfatemia) se encuentran en hipoparatiroidismo, insuficiencia renal, acromegalia, sarcoidiosis, fracturas en fase de cicatrización, acidosis diabética y enfermedad hepática. Niveles disminuídos (hipofosfatemia) se encuentran en ingestión crónica de alcalinos, hiperparatiroidismo, alcoholismo crónico, acidosis diabética, desnutrición, osteomalacia, infecciones por flora cocoide Gram negativa en su forma septicémica, en la hipovitaminosis D y raquitismo. En niños, la hipofosfatemia puede anular el crecimiento normal. METODOLOGÍA Fotometría. INTERFERENCIAS Y LIMITACIONES El manejo inadecuado de la muestra que ocasiona hemólisis, puede incrementar falsamente los niveles de fosfato en suero. La disminución de los niveles de fosfato puede ser consecuencia de excreción excesiva del mineral por vómitos y diarrea duradera, deficiencia de vitamina D o por fármacos como son los alcalinos y el manitol. La ingestión excesiva de vitamina D, la administración de esteroides, andrógenos anabólicos, meticilina y laxantes que contienen fosfato sódico pueden hacer que aumenten los niveles de fósforo en suero. GLICEMIA CONDICIONES DE LA MUESTRA Suero (tapa amarilla con gel o tapa roja) CONDICIONES DE PACIENTE Se requiere ayuno de 8 horas. Si es mayor de 12 horas consultar. FUNDAMENTO La cantidad de glucosa en la sangre, normalmente es un factor constante con pequeños cambios en aumento o disminución, de acuerdo a los alimentos, pero regresando a la normalidad en poco tiempo. Los niveles séricos deben interpretarse según la hora en que se determine. Normalmente, después de la ingestión de alimentos, se origina una carga de insulina para regresar la glicemia a la normalidad en el transcurso de dos horas, que es lo que se conoce como glicemia post-prandial. La determinación de la glucosa sérica es útil para el diagnóstico de numerosas enfermedades metabólicas. Cifras en ayunas superiores a 110 mg/dl impone un estudio exhaustivo para descartar una diabetes, teniendo en cuenta la edad del paciente. En jóvenes menores de 12 años, la diabetes tipo I insulino dependiente, es la más predominante y después de los 50 años la tipo II es la más común. También se pueden encontrar niveles aumentados como respuesta al estrés agudo, adenoma de páncreas, tratamiento diurético y acromegalia. Cifras por debajo de 60 mg/dl justifican una curva de tolerancia para descartar o afirmar una hipoglicemia. También se pueden encontrar niveles disminuidos en insulinoma, hipotiroidismo y enfermedad de Adisson. INTERFERENCIAS Y LIMITACIONES La cafeína puede elevar falsamente los valores. Entre los fármacos que pueden aumentar los niveles incluyen antidepresivos, corticoesteroides, estrógenos, glucagón y salicilatos. GLICEMIA EN AYUNAS Y POST PRANDIAL CONDICIONES DE LA MUESTRA La dosificación se verifica en plasma con gel separador y heparina de litio (tubo tapa verde con negro) o en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel. En ayunas se toma la primera muestra, se administra la carga de glucosa correspondiente y dos horas más tarde se toma nuevamente otra muestra. CONDICIONES DE PACIENTE El procedimiento requiere ayuno de 8 horas. Durante el procedimiento no se puede consumir alimentos, ni fumar, ni hacer ningún ejercicio. En caso de vomitar la carga, la prueba se invalida. FUNDAMENTO La glicemia post-prandial consiste en dosificar la glicemia en ayunas y posteriormente a las dos horas después de ingerir la carga, tomar una nueva muestra. Normalmente las cifras deben ser sensiblemente iguales. Esta prueba sirve para valorar selectivamente la diabetes mellitus. Niveles aumentados se encuentran en diabetes mellitus, síndrome de Cushing, acromegalia y desnutrición. Niveles disminuídos se pueden ver en enfermedad de Addison, esteatorrea e insuficiencia de la hipófisis anterior. METODOLOGÍA Colorimetría. INTERFERENCIAS Y LIMITACIONES Fumar durante el período de la prueba puede aumentar la cifra de glucosa sanguínea. El estrés puede elevar los niveles de glucosa. HEMOGLOBINA GLICOSILADA CONDICIONES DE LA MUESTRA La dosificación se verifica en sangre total con anticoagulante EDTA (tubo tapa morada). La muestra es estable refrigerada entre 2 y 6°C por cinco días. CONDICIONES DE PACIENTE Esta prueba no requiere ninguna condición especial. FUNDAMENTO La hemoglobina glicosilada está integrada por una serie de compuestos estables que se forman entre la hemoglobina y los glúcidos. Su concentración se eleva en los glóbulos rojos de pacientes diabéticos. La Hb-A1c es una fracción de la hemoglobina del adulto, que se adhiere a los glóbulos rojos en relación directa a la concentración de glucosa sanguínea. Cuando circulan los glóbulos rojos, parte de su hemoglobina se combina con algo de la glucosa presente en el torrente sanguíneo para formar glicohemoglobina. Esta glicosilación es irreversible. La cantidad de hemoglobina glicosilada depende de la cantidad de glucosa disponible en el torrente sanguíneo durante los ciento veinte días de vida de los glóbulos rojos. Dado que los glóbulos rojos antiguos están siendo destruidos constantemente, la determinación de hemoglobina glicosilada refleja el nivel de glucemia medio durante los 100-120 días anteriores a la prueba. La hemoglobina glicosilada tiene interés para evaluar el tratamiento antidiabético, comparar y comprobar el éxito de formas pasadas y nuevas de tratamiento antidiabético, determinar la duración de la hiperglicemia en pacientes diabéticos recientemente diagnosticados, proporcionar una estimación sensible del desequilibrio de la glucosa en pacientes con diabetes mellitus, individualizar los regímenes de control diabético, además de permitir conocer la glicemia en un período corto de tiempo. Si el paciente está dentro del rango normal, la dosis o el tratamiento empleado es correcto. Si se aparta de la normalidad, su glicemia dentro de los 100-120 días anteriores, ha tenido control deficiente. Se pueden encontrar resultados anormales en diabetes diagnosticada recientemente, diabetes mal controlada, anemia hemolítica en individuos no diabéticos, insuficiencia renal crónica y embarazo. METODOLOGÍA Colorimetría INTERFERENCIAS Y LIMITACIONES Pueden encontrarse niveles bajos en casos de anemia drepanocítica, insuficiencia renal crónica y embarazo. Se encuentran niveles falsamente elevados cuando se prolonga la duración de la vida de los eritrocitos como es el caso de la talasemia. HIERRO SÉRICO CONDICIONES DE LA MUESTRA La dosificación se verifica en plasma con gel separador y heparina de litio (tubo tapa verde con negro) o en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel. La muestra se conserva por cuatro horas a temperatura ambiente y para mantenerla por siete días se debe refrigerar. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO El hierro es un mineral esencial para la mayoría de los organismos vivientes porque participa en una variedad de procesos vitales que van desde mecanismos oxidativos celulares hasta transporte de oxígeno a los tejidos. La mayor parte del hierro corporal se encuentra en la hemoglobina de los hematíes. El hierro aportado por la dieta es absorbido en el intestino delgado y transportado hasta el plasma. Una vez en el plasma, el hierro se une a una proteína globulínica denominada transferrina y es transportado hasta la médula ósea para su incorporación a la hemoglobina. El resto del hierro está en flavoproteínas, ferrosulfuros, ferritina y en varias enzimas como citocromo oxidasa, xantina oxidasa, peroxidasa y catalasa. La determinación del hierro sérico mide la cantidad de hierro unido a transferrina. La transferrina se mide indirectamente por la cantidad de hierro que puede enlazar y es lo que conocemos como capacidad de combinación o enlace de hierro. Otra medida que también es útil es el porcentaje de saturación que es un mejor indicador de los depósitos de hierro. Los niveles de hierro sérico elevados se pueden encontrar en anemias hemolíticas, envenenamiento por plomo, anemia perniciosa, hemocromatosis, siderosis por transfusión, hepatitis o administración oral o parenteral del hierro. Los niveles bajos de hierro pueden ser debidos a perdidas crónicas del hierro como resultado del sangrado activo o pueden ser debidos a inflamación, infección, tumor o infarto de miocardio, absorción inadecuada de hierro, embarazo, anemia ferropénica, neoplasia, hematuría crónica y menstruación intensa crónica. METODOLOGÍA Colorimetría. INTERFERENCIAS Y LIMITACIONES Las transfusiones recientes de sangre pueden afectar los resultados de la prueba. La ingestión reciente de alimentos ricos en hierro puede afectar a los resultados de la prueba. Las enfermedades hemolíticas se asocian a veces con un contenido de hierro artificialmente alto. Entre los fármacos capaces de aumentar los niveles de hierro se incluyen cloramfenicol, dextrano, estrógenos, etanol, preparados de hierro, metildopa y anticonceptivos orales. Los fármacos que pueden disminuir los niveles de hierro son la hormona adrenocorticotrópica, colestiramida, cloramfenicol, colchicina, deferoxamina, meticilina y testosterona. IONOGRAMA CONDICIONES DE LA MUESTRA La dosificación se verifica en plasma con gel separador y heparina de litio (tubo tapa verde con negro) o en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel. Anticoagulante que contiene calcio, quelantes de calcio o precipitantes de calcio como son EDTA, oxalato y fluoride no se pueden usar. Las concentraciones de potasio en plasma pueden ser de 0.1-0.2 mmol/l más bajas que las observadas en el suero. Las muestras pueden ser conservadas a temperatura ambiente por 8 horas, refrigeradas a 4°C por un día o congeladas a –20°C por un año. CONDICIONES DE PACIENTE No requiere ninguna condición especial. No tomar muestras de brazos que estén recibiendo infusión intravenosa. FUNDAMENTO El potasio es el principal catión intracelular que predomina en las células del músculo estriado. La concentración intracelular de potasio oscila alrededor de 150 mEq/l, mientras que la concentración sérica normal es de alrededor unos 4 mEq/l. El sodio es el principal catión del espacio extracelular. Su concentración depende del grado de hidratación celular y cuando aumenta en general la hidratación de todo el organismo, sus niveles bajan y cuando al contrario viene la deshidratación, la concentración sanguínea aumenta y es por esto que indica indirectamente el grado de hidratación. El calcio es un catión predominantemente extracelular que regula y permite la actividad neuromuscular y enzimática, el desarrollo del esqueleto y la coagulación de la sangre. El cloro es un electrolito que existe predominantemente en los espacios extracelulares. Mantiene la integridad celular a través de la influencia de la presión osmótica, el equilibrio ácido básico y el balance hídrico. Responde directamente a las influencias de concentración de otros electrolitos. Los cloruros totales del suero se componen de cloruro de sodio, potasio, calcio y magnesio, siendo los más importantes los de Na y K. La determinación del ionograma es util debido a que estos iones desempeñan un gran papel en el equilibrio ácido básico y en el sostenimiento del equilibrio normal del agua. Generalmente se encuentran elevados en los procesos de acidosis y disminuidos en la alcalosis. Además permiten evaluar la función renal, el metabolismo de la glucosa, los trastornos neuromusculares y endocrinos. METODOLOGÍA Potenciometría: Na, K y Cl Fotometría: calcio. Método del ión electrón INTERFERENCIAS Y LIMITACIONES Elevan los niveles del ionograma los antibióticos, antineoplásicos, adrenalina, heparina, histamina, litio, traumatismo reciente, la cirugía o el shock. Disminuye los valores del ionograma las infusiones de glucosa, fenotiacinas, aspirina e insulina. Muestras hemolizadas pueden tener falsamente elevados los niveles del ionograma en suero. Muestras lipémicas o con proteínas interfieren en la cuantificación del ionograma. Los laxantes o las transfusiones excesivas de sangre citratada pueden suprimir los niveles del ionograma. No se recomienda la sangre de pacientes que recibieron hypaque como medio de contraste radiográfico ya que puede interferir con la prueba. ANTI DNA-NATIVO CONDICIONES DE LA MUESTRA La dosificación se verifica en plasma con gel separador y heparina de litio (tubo tapa verde con negro) o en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel. La muestra se puede conservar refrigerada hasta por 7 días. Si va a mantenerse por más tiempo, se debe congelar a -20ºC. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO Son anticuerpos dirigidos contra el DNA nativo (de doble cadena) o de cadena simple (desnaturalizado). Su título se utiliza para evaluar la respuesta al tratamiento y actividad de la enfermedad (LES). Positivo en el 80-90% de pacientes con Lupus Eritematoso Sistémico (LES), el aumento del título se correlaciona con la exacerbación de la enfermedad). Sólo el DNA doble cadena es específico de esta enfermedad (buena correlación con nefritis lúpica). Los anticuerpos anti-DNA se detectan en el 80-90 % de los pacientes con LES. También puede detectarse en otras enfermedades reumáticas, hepatitis crónica activa, mononucleosis infecciosa, síndrome lupoide por medicamentos, cirrosis biliar primaria. Se pueden detectar por Radioinmunoanalisis (RIA) o por IFI sobre Crithidia luciliae. Los niveles de anti-DNA descienden coincidiendo con las fases de remisión de la enfermedad, y son un buen parámetro para medir la respuesta terapéutica. Este test nunca debe usarse de rutina para screening de enfermedad en un paciente con artralgias. Existen diversos tipos de autoanticuerpos frente al DNA: AntiDNA NATIVO o de doble cadena (Anti-DNAds) Anti-DNA de cadena simple "desnaturalizado" (Anti-DNAss) Anti-DNA "total" que reacciona con ambos DNA Los anticuerpos anti-DNAds se consideran los más específicos de LES. Los anti-DNAss son menos específicos. La prueba utilizada para su detección es le inmunofluorescencia indirecta que usa como sustrato la critidia lucillae. Los anticuerpos anti-DNA son de alta especificidad, y nos va a confirmar el diagnóstico. Sin embargo no hay que esperarlos en el 100% de los sujetos. Títulos menores: dermatomiositis, esclerosis sistémica progresiva, S. Sjogren. Aumentado: la procainamida e hidralacina producen síntesis de DNA. También por penicilamina. Disminuido: Captotril. Falsos positivos: Clorpromacina METODOLOGÍA Inmunofluorescencia indirecta (sustrato Critidia lucillae) INTERFERENCIAS Y LIMITACIONES Muestras hemolizadas, lipémicas o turbias no son adecuadas para esta prueba. ANTICUERPOS ANTI NUCLEARES CONDICIONES DE LA MUESTRA Suero tomado en tubo de tapa amarillla con gel. La muestra se puede conservar refrigerada hasta por 7 días. Si va a mantenerse por más tiempo, se debe congelar a 20ºC. CONDICIONES DE PACIENTE No requiere ninguna condición especial FUNDAMENTO Los anticuerpos antinucleares son resultado de una reacción de autoinmunidad que aparece en sujetos predispuestos, son inmunoglobulinas (predominantemente IgG) dirigidos contra moléculas nucleares bien sea de DNA, RNA o proteínas nucleares y/o citoplasmicas. Sólo algunas son específicas de una enfermedad y su papel patológico no es bien conocido. Los anticuerpos antinucleares se originan durante la evolución de diferentes enfermedades del tejido conjuntivo tipo inmunológico. Traducen un defecto de regulación del sistema inmunitario y se han descrito más de cuarenta especies. Son de utilidad en el diagnóstico de muchas enfermedades, entre las que se cuenta el lupus eritematoso. No toda prueba positiva indica afección y su interpretación debe considerarse como un signo semiológico más en la enfermedad que se sospecha. Se encuentra en varios transtornos reumáticos, lupus eritematoso sistémico, artritis rematoidea, síndrome de Sjogren, polimiositis, enfermedades hepáticas, pulmonares, linfoma, leucemia crónica, colitis ulcerativa crónica, mononucleosis infecciosa, anemia hemolítica y reacciones a múltiples drogas. METODOLOGÍA Inmunofluorescencia indirecta (sustrato células Hep-2 "Células humanas epiteliales") INTERFERENCIAS Y LIMITACIONES Muestras hemolizadas, lipémicas o turbias no son adecuadas para esta prueba. Se han encontrado resultados falsamente positivos en pacientes en tratatamiento con captopril, carbamazepina, clorpromazina, difenilhidantoína, fenitoína, hidralazina, isoniazida, metildopa y nitrofurantoína entre otras. ANTICUERPOS CONTRA ANTÍGENOS NUCLEARES SINÓNIMOS ANAS CONDICIONES DE LA MUESTRA Plasma con gel separador y heparina de litio (tubo tapa verde con negro) o en suero tomado en tubo de tapa amarillla con gel o en tapa roja con gel. Se recomienda guardar las muestras a temperatura ambiente no mas de ocho horas. Si el ensayo no se va a realizar en ocho horas, refrigerar la muestra a 2-8ºC y si no se va a realizar en 48 horas la muestra se debe congelar a –20ºC. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO Constituyen una familia de anticuerpos que reaccionan contra proteínas nucleolares no histona (patrón moteado fino con IFI). Estos antígenos extractables son expresión de varios sistemas Ag-Ac, unos caracterizados y otros desconocidos. Son más frecuentes en LES, RPN (40%), Sm (20%), Ro (25-40%), La (10-15%). Se detectan por ELISA. Anti-RPN: se asocia con fenómeno de Raynaud; títulos altos > de 80 unidades son sugestivos de EMTC (pacientes con LES, esclerosis sistémica y poliomiositis) también se encuentra en LES, escleroderma, síndrome de Sjogren y artritis reumatoide. Anti-Ro: es de origen citoplasmático y nuclear. Se encuentra en pacientes con síndrome de Sjrogren primario; identifica un subgrupo de pacientes con manifestaciones extraglandulares como vasculitis, o compromiso del SNC. También es positivo en LES y con menor frecuencia en AR. Anti-la: es de origen solamente nuclear. Se encuentra en 45-60% de los pacientes de Sjogren y en un 10-15% de los pacientes con LES. AntiSm: es específico de LES, pero solamente se encuentra en 10 a 30% de los casos y tiene gran significado diagnóstico principalmente cuando el anti-ADN es negativo. En nuestro medio lo hemos encontrado en el 18% de los casos. METODOLOGÍA Microscopio de fluorescencia INTERFERENCIAS Y LIMITACIONES Muestras hemolizadas, lipémicas o turbias no son adecuadas para esta prueba. FACTOR REUMATOIDEO CONDICIONES DE LA MUESTRA Suero tomado en tubo de tapa amarillla con gel.No se recomienda refrigerar la muestra para este tipo de examen. CONDICIONES DE PACIENTE No requiere ninguna condición especial FUNDAMENTO Los factores rematoideos son autoanticuerpos IgG, IgA e IgM que reaccionan con la fracción cristalizable (fracción Fc) de la IgG; los factores rematoideos se designan como factores rematoideos IgM, IgG e IgA. El que más comúnmente se titula es la IgM. La prueba tiene su mayor aplicación en el diagnóstico de artritis rematoidea, cuya positividad está relacionada con la intensidad de la lesión. La prueba también puede ser positiva en otras enfermedades, como lupus eritematoso sistémico. Niveles aumentados se encuentran en artritis reumatoide, infecciones virales crónicas, endocarditis bacteriana y tuberculosis. INTERFERENCIAS Y LIMITACIONES Los ancianos suelen presentar resultados falsos positivos. Sueros lipémicos no son adecuados para esta prueba. INMUNOGLOBULINA E CONDICIONES DE LA MUESTRA Suero tomado en tubo de tapa amarillla con gel. CONDICIONES DE PACIENTE No requiere ninguna condición especial FUNDAMENTO Su concentración en el suero es de 0.06mg/dl. Los receptores específicos de alta afinidad para la IgE se encuentran en las membranas de superficie de los mastocitos y basófilos y es por esto que juegan un papel clave en la generación de reacciones inmediatas de hipersensibilidad. Cuando el antígeno se pone en contacto con ella, se produce una desintegración de las células con liberación de histamina. Está integrada por dos cadenas pesadas y dos livianas. Su producción es regulada por los linfocitos T en tal forma, que si la subpoblación supresora de dichos linfocitos disminuye en forma cualitativa o cuantitativa, la producción de IgE se aumenta considerablemente, como ocurre en las enfermedades alérgicas. En asocio con el poder lítico de los eosinófilos, es uno de los mecanismos de defensa con que cuenta el organismo contra los helmintos. La determinación del nivel de IgE se utiliza en la evaluación de enfermedades tales como rinitis alérgica, asma extrínseca, urticaria y en eczema atópico; También se encuentra elevada en aspergilosis pulmonar, infestaciones parasitarias, algunas inmunodeficiencias, nefropatías, afecciones neoplásicas incluyendo entre otras el síndrome de Wiskott-aldrich, enfermedad de Hodgkin, pénfigo, psoriasis y pitiriasis rubra pilosa y en el síndrome de Job donde se presentan infecciones recurrentes y está asociado con eczema, abscesos recurrentes e infecciones pulmonares. METODOLOGÍA Elisa INTERFERENCIAS Y LIMITACIONES No se recomienda utilizar anticoagulantes líquidos. No se deben usar muestras hemolizadas ni muestras inactivadas (sueros) con calor, porque pueden interferir con los resultados de anticuerpos heterófilos y la presencia de eritrocitos. INMUNOGLOBULINA G CONDICIONES DE LA MUESTRA Suero tomado en tubo de tapa amarillla con gel.Para mantener la muestra durante 72 horas es necesario refrigerarla. Si debe conservarse por más tiempo, debe congelarse a 15ºC o menos. Descongelar sólo una vez. CONDICIONES DE PACIENTE No requiere ninguna condición especial FUNDAMENTO Es la más abundante de las sintetizadas en el organismo y representa el 80% de los anticuerpos circulantes contra bacterias, virus y toxinas. Es la inmunoglobulina que tiene la vida biológica mas larga (25 días), el feto no es capaz de sintetizarla y la que tiene el recién nacido es de la madre, que pasa a través de la placenta, no por filtración sino por transporte activo a través del trofoblasto y es la única inmunoglobulina que es capaz de traspasarla. Entre sus propiedades se encuentra la extraordinaria potencia que tiene biológicamente, lo que ha permitido su uso en la profilaxis de la eritroblastosis fetal. Existen cuatro variedades de la misma: IgG-1, IgG-2, IgG-3 y IgG-4, con comportamientos diferentes ante la activación del complemento. Hay algunos anticuerpos específicos que están integrados por una de estas fracciones, como por ejemplo los anticuerpos antinucleares, conformados por IgG-3. La IgG puede estar aumentada en mieloma IgG, sarcoidosis, enfermedad crónica hepática, enfermedades autoinmunes, enfermedades parasitarias e infecciones crónicas. Se encuentra disminuida en inmunodeficiencias adquiridas, deficiencias hereditarias y embarazo. METODOLOGÍA Elisa INTERFERENCIAS Y LIMITACIONES Muestra lipémicas o contaminadas no son adecuadas para esta prueba INMUNOGLOBULINA M CONDICIONES DE LA MUESTRA Suero tomado en tubo de tapa amarillla con gel.Para mantener la muestra durante 72 horas es necesario refrigerarla. Si debe conservarse por más tiempo, debe congelarse a 15ºC o menos. Descongelar sólo una vez. CONDICIONES DE PACIENTE No requiere ninguna condición especial FUNDAMENTO Se sintetiza primordialmente en el bazo, no traspasa la barrera placentaria, su vida media es de 5 días, se localiza primordialmente en el espacio intravascular y tiene una gran importancia en la defensa contra las bacteremias y septicemias. Su producción se inicia antes que de la IgG y por tanto es la que condiciona la respuesta inmunológica primaria, lo que se explica inmunológicamente por su constitución bioquímica. En efecto, tiene en su estructura espacial 10 valencias o terminaciones y en cambio la IgG sólo tiene 2, lo que explica la mayor capacidad de fijación antigénica. Tiene 2 suclases: IgM-1 y IgM-2. La deficiencia de IgM puede ser debida a pérdida de proteínas, defectos hereditarios primarios o a toxinas retenidas en falla renal o secundaria a entidades malignas linfoides. Hay aumento policlonal en el suero como respuesta a las infecciones especialmente virales primarias y en sistémicas como la malaria, también hay aumento en cirrosis biliar primaria y en infecciones intrauterinas. La producción fetal de IgM aumenta produciéndose aumento de la IgM en sangre del cordón. Hay aumento monoclonal en la macroglobulinemia de Waldeströn y en crioglobulinemia monoclonal. El aumento en la síntesis de IgM en la barrera hematoencefálica es característico en pacientes con meningoencefalitis infecciosa de origen viral o bacteriana y en las infecciones por Borrelia burgdorferi así como en el tratamiento de la neurosífilis. METODOLOGÍA Elisa INTERFERENCIAS Y LIMITACIONES Muestras lipémicas o contaminadas no son adecuadas para esta prueba. PROMESA DE SERVICIO Para exámenes electivos el mismo día y para exámenes urgentes 90 minutos desde la llegada de la muestra al laboratorio. PROTEÍNA C REACTIVA CONDICIONES DE LA MUESTRA Suero tomado en tubo de tapa amarillla con gel CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO La proteína C reactiva es un tipo especial de proteína producida por el hígado que sólo está presente durante episodios de inflamación aguda. El aspecto más importante de la PCR es su interacción con el sistema del complemento, el cual es uno de los mecanismos de defensa inmunológica del cuerpo. A pesar de que este no es un examen específico, sí da un indicio general de la presencia de una inflamación aguda. El médico podría utilizar este examen para evaluar una exacerbación de artritis reumatoidea o de fiebre reumática. El examen también podría servir para controlar la respuesta a la terapia. Sin embargo, incluso en casos de inflamación en las enfermedades reumáticas como la artritis reumatoidea y el lupus eritematoso sistémico, los niveles de PCR pueden no siempre estar elevados. La razón para esto no se conoce en este momento. De esta manera, un nivel de PCR bajo no siempre significa que no haya inflamación presente. Recientemente, nuevos estudios han sugerido que la PCR también puede estar elevada en ataques cardíacos. El papel de la PCR en la enfermedad de la arteria coronaria aún no es claro. No se sabe si simplemente es un marcador de la enfermedad o si realmente juega un papel en la causa de la enfermedad ateroesclerótica. Muchos consideran que la PCR elevada es un factor positivo para la enfermedad de la arteria coronaria. Es una proteína que se sintetiza en el hígado y tiene una vida media de 20 a 30 horas; reconoce potencialmente sustancias autógenas tóxicas que liberan los tejidos lesionados, se unen a estas sustancias, las detoxifica y depura de la circulación. La proteína C reactiva se eleva dentro de las dos horas después de una lesión aguda, hace un pico y empieza a disminuir a las 48 horas si no hay un nuevo evento. La proteína C reactiva aumenta después de infarto agudo del miocardio, trauma, infecciones, procesos inflamatorios, cirugía y proliferación neoplásica. METODOLOGÍA Látex INTERFERENCIAS Y LIMITACIONES Las muestras hemolizadas o lipémicas interfieren en el análisis. ANTITROMBINA III CONDICIONES DE LA MUESTRA Plasma citratado, es necesario refrigerar la muestra para su envío. No congelar. Estabilidad de la muestra: refrigerada 2-8°C: 48 horas. Congelada -20°C: 1 mes. CONDICIONES DE PACIENTE Tomar la muestra en ayunas. FUNDAMENTO Es una proteína que ayuda a prevenir y regular la coagulación sanguínea. Ayuda a diferenciar entre deficiencia de ATIII tipo I y tipo II. FACTOR IX DE LA COAGULACIÓN CONDICIONES DE LA MUESTRA Tubo tapa azul. Plasma pobre en plaquetas. Centrifugar 10 minutos a 3800 rpm, para obtener plasma pobre en plaquetas. Todas las muestras deben ser recolectadas en tubos que no contengan superficies activadoras como vidrio. Cuando se obtengan muestras provenientes de catéter, este debe ser purgado con 5 ml de solución salina y los primeros 5 ml de volumen deben ser descartados. AJUSTE DE CONCENTRACIÓN DE CITRATO: La concentración de citrato en la sangre debe ser ajustada en pacientes quienes tienen un hematocrito por encima de 55 % y por debajo de 20%. ESTABILIDAD DE LA MUESTRA Temperatura Tiempo 22-24oC 2 horas 2-4oC 4 horas Menos 20oC 2 semanas Menos 70oC 6 meses CONDICIONES DE PACIENTE El paciente no requiere ninguna preparaci special para este examen. FUNDAMENTO Este es un examen que se realiza en sangre para medir la actividad del factor IX de la coagulaci Usualmente se realiza este an sis para diagnosticar o controlar el tratamiento para la hemofilia B, enfermedad cong鮩ta ligada al cromosoma X. Este examen se puede usar para detectar una causa espec ca del sangrado excesivo en el paciente. Los pacientes que reciben terapias anticoagulantes, en deficiencias de ingesti absorci e vitamina K, hepatopatias y coagulaci ntravascular diseminada, pueden tener niveles bajos del factor. Los inhibidores del factor IX tambi鮠disminuyen los niveles del factor. Los niveles elevados del factor IX, se relacionan con el embarazo y con trombosis. METODOLOGÍA Prueba modificada del tiempo de tromboplastina parcial activada INTERFERENCIAS Y LIMITACIONES El exceso de ictericia o lipemia pueden producir interferencias en las lecturas durante la medici el factor. FIBRINOGENO CONDICIONES DE LA MUESTRA Plasma citratado (tubo tapa azul). La muestra es estable a -20?C por una semana. CONDICIONES DE PACIENTE No requiere ayuno FUNDAMENTO Las afecciones que pueden estar asociadas con la deficiencia de factor I (fibrin o) son: enfermedad hep ca, CID, fibrinol s, deficiencia cong鮩ta del factor I. La hipofibrinogenemia se observa en forma general en todas las infecciones agudas, exceptuando fiebre tifoidea. Su intensidad mayor se aprecia en procesos neum os, absceso hep co amibiano, infarto agudo del miocardio, despu鳠 de irradiaci on rayos X y en la fase de regeneraci em ca post hemorr ca. METODOLOGÍA Nefelometría INTERFERENCIAS Y LIMITACIONES En pacientes con disfibrinogenemia, determinaci in鴩 ca de fibrin o puede dar valores exageradamente bajos. En pacientes con elevados niveles en plasma de productos de degradaci e la fibrina (CID y fibrinolisis) la determinaci e fibrin o puede ser baja. La presencia de grandes cantidades de heparina (> de 5 U/ml) puede causar err mente bajos niveles de fibrin o o hacer imposible la medici el fibrin o por la t飮ica nefelometrica. TIEMPO DE PROTROMBINA SINÓNIMOS TP CONDICIONES DE LA MUESTRA Sangre total recolectada con anticoagulante citrato de sodio al 3.2% (tubo de tapa azul) en proporción de 9 partes de sangre por 1 de anticoagulante. Centrifugar 10 a 15 minutos a 3500 rpm para obtener plasma pobre en plaquetas, separar el plasma de lo eritrocitos. CONDICIONES DE PACIENTE El paciente no requiere ninguna preparación especial para este examen. CRITERIOS DE RECHAZO DE LA MUESTRA Las muestras para TP centrifugadas en los tubos SIN abrir pueden permanecer de 2 a 4°C ó de 18 a 24°C sí la muestra va a ser analizada dentro de las 4 horas siguientes a la recolección de la muestra. Si no cumple estas condiciones no puede ser aceptada. FUNDAMENTO Es un examen de sangre que mide el tiempo que le toma a la porción líquida (plasma) de la sangre en coagularse. INDICACIONES: El examen de Tiempo de Protrombina puede ser realizado para: -Monitorear la intensidad de la terapia con anticoagulantes orales, expresado en el reporte de INR. -Screening para detectar deficiencias de uno ó más factores (factores I,II,V,VII,X) de la coagulación debido a deficiencias congénitas, deficiencias de vitamina D, enfermedades del hígado, inhibidores específicos contra un factor de la coagulación , deficiencias adquiridas de los factores II, V, VII, X. Screening para detectar inhibidores de la coagulación (anticoagulantes circulantes) asociado a inhibidores de la coagulación, anticuerpos antifosfolípidos, inhibidores no específicos al tiempo de protrombina. METODOLOGÍA Nefelometría (Coagulometría). INTERFERENCIAS Y LIMITACIONES La sensibilidad de TP para las deficiencias de los factores I y II es limitada. El TP sólo puede prolongarse si el factor II es inferior al 10% de lo normal y el fibrinógeno inferior a 100mg/dl. El exceso de anticoagulante en la toma de la muestra da resultados falsamente prolongados. El retraso en el proceso de la muestra puede prolongarse ya que el factor V es muy lábil y se destruye rápidamente por envejecimiento así como la ingesta de alcohol puede incrementar los niveles de TP. Una dieta rica en grasas puede acortarlo. Entre los fármacos que pueden aumentar el tiempo se incluyen alopurinol, ácido salicílico, barbitúricos, anticonceptivos orales, estrógenos, vitamina K. - Se pueden procesar las muestras que tengan una concentración de los siguientes analitos por debajo de los valores que a continuación se detalla: Triglicerídos: 1200 mg/dl Bilirrubina: 20 mg/dl Hemoglobina: 150 mg/dl Valores de hematocrito muy elevados ó disminuidos pueden alterar el tiempo. - Sustancias como el alcohol pueden afectar el análisis. -Los antibióticos, la aspirina y la cimetidina pueden aumentarlo. - Los barbitúricos, los anticonceptivos orales y el tratamiento hormonal sustitutivo y los suplementos de vitamina K pueden disminuirlo. - Alimentos que contienen grandes cantidades de vitamina K pueden alterar también los valores. No se debe abandonar ningún medicamento sin previa autorización del médico tratante. VALORES DE REFERENCIA Tiempo de protrombina 10.0 – 14.0 segundos Cada laboratorio debe ajustar periódicamente sus propios valores de referencia INR 0.9 a 1.2 El INR es usado únicamente para estabilizar la terapia de anticoagulación oral. TIEMPO DE SANGRÍA CONDICIONES DE LA MUESTRA Mantener todo el tiempo el tensiometro a 40 mmHg en el tercio superior del brazo; en una zona no muy vascularizada realizar la punción con un dispositivo estandarizado (simplate) cada 30 segundos limpiar el sitio de la punción, hasta que se detenga la hemorragia teniendo presente no tocar la herida. CONDICIONES DE PACIENTE l no se les debeµPacientes con recuento de plaquetas inferior a 50.000 practicar la prueba. Pacientes que estén recibiendo tratamiento a base de ácido acetil salicílico deben esperar mínimo de 7 a 9 días de ser suspendido el medicamento para poderle realizarle la prueba. FUNDAMENTO El tiempo de sangría evalúa la función hemostática global (capacidad de las plaquetas para reaccionar a una lesión, y capacidad funcional de vasoconstricción). El tiempo de sangría es útil para el diagnóstico de trastornos congénitos y adquiridos, en la función plaquetaria ya que esta íntimamente relacionado con el recuento y la integridad funcional de las plaquetas. El tiempo de sangría es proporcional al recuento de plaquetas cuando l. Una de las causas más frecuentes del tiempo deµestán por debajo de 100.000 sangría alargado es la disfunción de las plaquetas de origen hereditario como el síndrome de Wiskott-Aldrich, el síndrome de Bernard-Soulier y la trombastenia de Glanzmann o adquiridos como las trombocitopatías que se encuentran asociadas con drogas como la aspirina y los antiinflamatorios no esteroides, también puede estar alargado en las alteraciones de la formación de fibrina como el síndrome de EhlersDanlos y enfermedad Willebrand entre otras. METODOLOGÍA Método estandarizado de IVY, Duke. INTERFERENCIAS Y LIMITACIONES Las sulfonamidas, tiacidas, antineoplásicos, anticoagulantes, antiinflamatorios no esteroides, aspirina y compuestos de ella derivados y algunos analgésicos no narcóticos a veces prolongan el tiempo de sangría. Punción a vasos tarda más en dejar de sangrar. TIEMPO PARCIAL DE TROMBOPLASTINA SINÓNIMOS TPT CONDICIONES DE LA MUESTRA Sangre total recolectada con anticoagulante citrato de sodio al 3.2% (tubo de tapa azul) en proporción de 9 partes de sangre por 1 de anticoagulante.Centrifugar la sangre total recolectada con anticoagulante citrato de sodio al 3.2%(tubo de tapa azul), 10/15 minutos a 3500 rpm para obtener plasma pobre en plaquetas, separar el plasma de lo eritrocitos y enviar 0.5 uL del plasma congelado en vial de plástico. CONDICIONES DE PACIENTE No requiere ninguna condición especial. Conocer si esta recibiendo heparina. CRITERIOS DE RECHAZO DE LA MUESTRA No se procesaran muestras transportadas en refrigeración ó a temperatura ambiente. Las muestras para TPT centrifugadas en los tubos SIN Abrir pueden permanecer de 2 a 4°C ó de 18 a 24°C sí la muestra va a ser analizada dentro de las 4 horas siguientes a la toma de la muestra. Sí el TPT es control para Heparina no fraccionada, la muestra debe ser centrifugada antes de la hora y procesada antes de 4 horas. FUNDAMENTO Es un examen de sangre que examina el tiempo que le toma a la sangre coagularse y puede ayudar a establecer si una persona tiene problemas de sangrado o coagulación. Monitoreo de la terapia con Heparina -Screening para determinar la deficiencia de factores de la coagulación (factor VIII, IX, XI, X, XII, V, I) debido a deficiencias congénitas, enfermedades del hígado. - Detección de algunos inhibidores de la coagulación tales como el anticoagulante lúpico (anticuerpos antifosfolípidos), inhibidor especifico a un factor e inhibidores no-específicos. METODOLOGÍA Nefelometría (Coagulometría) INTERFERENCIAS Y LIMITACIONES La calidad de la muestra es crrítica ya que puede estar contaminada con sustancias procoagulantes. No usar el anticoagulante adecuado en el tubo, la hemólisis por el manejo demasiado vigoroso de la muestra o los intentos repetitivos de punción puede alterar los resultados de la prueba. Entre los factores que pueden prolongar el TPT se incluyen antihistamínicos, ácido ascórbico, clorpromacina, heparina y salicilatos.- Se pueden procesar las muestras que tengan una concentración de los siguientes analitos por debajo de los valores que a continuación se detalla: Trigliceridos: 1200 mg/dl Bilirrubina: 20 mg/dl Hemoglobina: 150 mg/dl Valores de Hematocrito muy elevados ó disminuidos pueden tener un Tiempo Parcial de Tromboplastina alterado - La medición del Tiempo Parcial de Tromboplastina en plasma debe realizarse en muestras libres de contaminación con heparina, a excepción de que se trate de un monitoreo de la misma. La deficiencia discreta ó media de un factor de la coagulación puede no reflejarse directamente en la prolongación del Tiempo Parcial de Tromboplastina. - No todos los ensayos de Tiempo Parcial de Tromboplastina detectan todos los anticoagulantes lúpicos ó inhibidores de la coagulación. - Las muestras que exhiben fuertes lipemias interfieren con los mecanismos de detección de los instrumentos, por lo tanto su análisis debe ser realizado en muestra en ayunas preferiblemente. - Los fármacos como los antihistamínicos, acido ascórbico, clorpromacina, salicilatos pueden prolongar el Tiempo Parcial de Tromboplastina. No se debe abandonar ningún medicamento sin previa autorización del médico tratante. VALORES DE REFERENCIA Tiempo parcial de tromboplastina, TPT, en segundos Relación Paciente/Control Tiempo Parcial de Tromboplastina 22.4 a 34.23 segundos Cada laboratorio debe ajustar periódicamente sus propios valores de referencia. -Tiempo Parcial de Tromboplastina y monitoreo de Heparina Los diferentes reactivos de Tiempo Parcial de Tromboplastina pueden variar en su sensibilidad a la Heparina, por lo tanto cada laboratorio debe establecer la relación entre la respuesta del Tiempo Parcial de Tromboplastina y la concentración plasmática de Heparina. V. TOMA DE MUESTRAS BACTERIOLÓGICAS. INSTRUCTIVO El diagnóstico de las enfermedades infecciosas se basa en el estudio de los síntomas y signos clínicos, así como en la demostración de la presencia del agente, de productos o de la huella que éste ha dejado en su contacto con el sistema inmune del individuo. El diagnóstico clínico es, en muchos casos, orientador luego de evaluar los datos que ofrecen la historia clínica y la exploración pero, la confirmación de un diagnóstico clínico requiere en enfermedades infecciosas el diagnóstico etiológico que confiere el Laboratorio de Microbiología Clínica. Toda la información diagnóstica que el laboratorio de microbiología puede proporcionar, depende de la calidad de la muestra recibida. Por ello, una toma mal realizada, pobremente recogida o mal transportada determinará un posible fallo en la recuperación de los agentes patógenos, que puede inducir a errores diagnósticos, e incluso a un tratamiento inadecuado del enfermo. Este hecho es bien conocido por los microbiólogos, no obstante la mayoría de las muestras son obtenidas por otros profesionales de la salud en diversos servicios clínicos, por lo que es necesaria la educación continua de dicho personal sanitario, al que hay que advertir del gasto inútil y el error de los datos obtenidos a partir de un estudio realizado de forma inadecuada. El OBJETIVO de este manual es realizar una puesta al día de la toma, transporte y conservación de las muestras microbiológicas reseñando el material necesario, la técnica de obtención, volumen, número y transporte de cada una de ellas, según las distintas localizaciones y características especiales de aquellas o de los microorganismos a investigar. Normas básicas generales: · Las muestras deben venir acompañadas de su respectiva hoja de pedido donde deben llenarse todos los datos solicitados por el laboratorio. En todos los casos es imprescindible: 1) nombre completo, 2) Nº de Cédula de Identidad o Nº de registro, 3) edad, 4) sexo, 5) servicio, policlínica o internación ( piso, sala, cama) 5) tipo de muestra: urocultivo, exudado de herida quirúrgica de tórax, pus de colección intrabdominal, etc. 6) consignar si el paciente recibió antibióticos en los últimos 7 días, si es así anotar nombre del ATB, dosis y vías de administración. · Los viales, tubos o frascos donde se colocan las muestras deben ser estériles con tapón hermético. Las muestras se deben obtener antes de iniciar el tratamiento antibiótico o antiviral. Cuando esto no es posible, se obtendrán justo antes de la administración de la dosis del antimicrobiano, o tras 48 horas de finalizado el tratamiento. · Hay situaciones en que es conveniente la toma junto a la cama del enfermo, como en hemocultivos y líquido cefalorraquídeo (LCR), pero en otras es imprescindible realizarla en el propio laboratorio como en exudados genitales que requieren una observación en fresco al microscopio y/o siembra inmediata. · En líneas generales en todas las localizaciones es necesario que la toma se efectúe en el sitio exacto de la lesión con las máximas condiciones de asepsia que eviten la contaminación con microbios exógenos, que la muestra nunca se ponga en contacto con antisépticos desinfectantes, que la toma sea lo más precoz posible y ”siempre se prefieran los productos purulentos recogidos por aspiración directa con jeringa o tejidos sospechosos, a las muestras tomadas con hisopos o torundas con algodón.” · Todas las situaciones no previstas en este manual deben ser consultadas con los especialistas en Microbiología antes de tomar las muestras. · En caso de no disponer de alguno de los sistemas de transporte recomendados consultar con la Sección Microbiología que será la que deberá instrumentar las soluciones alternativas. · Criterios de Rechazo de Solicitudes y/o Muestras: Si las solicitudes y/o las muestras no cumplen los requisitos mínimos indispensables para su correcto procesamiento el laboratorio deberá aclarar las discrepancias con el servicio que las envío, previo a su realización y en algunos casos será imposible su procesamiento hasta tanto se envíe la muestra correcta. Los siguientes son algunos ejemplos de ello: • Discrepancia entre la identificación del paciente que figura en la solicitud del examen y la que figura en el contenedor de la muestra. Acción: Hablar con el servicio que envío la muestra y no procesarla hasta que se solucione la discrepancia. Para muestras únicas (LCR , materiales quirúrgicos) se procesará pero no se enviará el informe. • No se indica en la solicitud de examen el tipo de muestra a analizar y/o procedencia anatómica del mismo. Acción: Llamar al servicio que lo envío. No se procesará hasta tanto se conozcan esos datos, imprescindibles para la realización del estudio. • Muestra enviada en frasco no estéril o con conservantes (formol). Acción: Informar al servicio que lo envío y solicitar nueva muestra. • Muestra enviada en envase o tubo con pérdida o derrame Acción: No procesar. Esterilizar la muestra y solicitar una nueva. • Muestra inadecuada para realizar el estudio solicitado. Acción: No procesar. Informar al servicio que la muestra es inadecuada y cual muestra deberá enviar. • • • • Cultivo anaerobio solicitado en exudado faríngeo, expectoración, orina, secreciones vaginales, úlceras o fístulas entre otras. Acción: Comunicarse con el servicio y explicar las razones. Muestra en cantidad insuficiente para realizar los exámenes solicitados: Acción: Solicitar muestra adicional, si no es posible establecer prioridades de procesamiento en acuerdo con el médico tratante. Muestras repetidas por más de una vez en el mismo día, excepto hemocultivos. Acción: procesar una sola muestra por día y comunicarse al servicio para que justifique el procesamiento de las muestras restantes. Muestra evidentemente contaminada. Acción: Descartar la muestra y solicitar otra. VI. CONDICONES DE TOMA MICROBIOLÓGICOS Y DE ORINA DE MUESTRA PARA ESTUDIOS CITOQUÍMICO DE ORINA CONDICIONES DE LA MUESTRA Muestra de orina de micción simple descartando la primera orina de la mañana. La muestra refrigerada desde la toma de la muestra se conserva por 24 horas. Para mantenerla hasta un mes, debe congelarse a -20ºC o menos. CONDICIONES DE PACIENTE -Hombres: Se retira el prepucio hacia atrás con el fin de lavar bien el glande, se limpia cuidadosamente con una toalla impregnada de solución jabonosa, se hace un movimiento suave de adelante hacia atrás; luego se utiliza otra toalla bastante húmeda o agua directa del grifo o canilla para eliminar lo que quedo de jabón y se descarta la primera parte de la micción; la siguiente parte se recoge en el recipiente procurando taparlo hermética e inmediatamente. Es necesario verificar si la información escrita en la etiqueta del frasco está correcta. -Mujeres: Se separan los labios mayores para limpiarlos suavemente con una toalla húmeda y desechable, o se lavan con agua y jabón, realizando un movimiento de adelante hacia atrás; seguidamente se limpia con otra toalla, frotando de adelante hacia atrás y tratando de limpiar el orificio uretral y perianal, se puede hacer el lavado directamente del grifo; luego se descarta la primera parte de la orina y se recoge la parte restante en el recipiente, el cual se tapa inmediatamente. Es necesario verificar si la información escrita en la etiqueta del frasco está correcta. -Lactantes y recién nacidos: Para recoger la muestra se requiere la inmovilización del niño, procurando fijar las piernas y dar limpieza a los alrededores del orificio uretral, luego se coloca una bolsita plástica estéril, la cual tiene un anillo de cinta adhesiva que se adhiere a la piel para evitar la pérdida de la muestra. FUNDAMENTO El examen de orina proporciona información de utilidad clínica para el reconocimiento de afecciones renales y trastornos del metabolismo, el control terapéutico y el seguimiento de problemas metabólicos como la diabetes y sus complicaciones. Parte de esta información la aporta el análisis químico mediante el manejo adecuado de las tirillas reactivas; estás ofrecen datos simultáneos de varios procedimientos químicos y sirven como base para el empleo de otras pruebas bioquímicas complementarias, utilizadas como alternativas confirmadoras. En la actualidad, el uso de las tiras reactivas facilita el análisis fisicoquímico de la orina; éste se complementa con el estudio del sedimento, el cuál permite hacer la correcta interpretación de los resultados y posibilita la realización de otros análisis complementarios. El análisis físico de la orina comprende el volumen, color, aspecto, olor. El análisis químico comprende gravedad o peso especifico, pH, leucocitos, nitritos, proteínas, glucosa, cetonas, urobilinógeno, bilirrubina y sangre. METODOLOGÍA Físico, químico y microscópico. INTERFERENCIAS Y LIMITACIONES Evitar el uso de preservativos en la orina. BACILOSCOPIA CONDICIONES DE LA MUESTRA Tipo de muestra: esputo,LBA. Tomar la muestra en un frasco de boca ancha, tapa rosca e idealmente estéril. Se debe enviar la muestra al laboratorio en las 2 primeras horas de tomada, de lo contrario es necesario refrigerarla. CONDICIONES DE PACIENTE No debe enjuagarse con ningún antiséptica, ni tomar antibióticos antes de que sea tomada la muestra. Si lo esta tomando, es necesario que los suspenda entre 24 y 48 horas previas a la toma de la muestra. FUNDAMENTO La turberculosis es una enfermedad infecto-contagiosa aguda o crónica producida en el hombre, principalmente por dos especies de micobacterias, Mycobacterium tuberculosis y Mycobacterium bovis. Usualmente compromete el pulmón, pero puede virtualmente producir enfermedad en cualquier órgano o sistema. El diagnóstico definitivo de tuberculosis se realiza mediante la identificación de la micobacteria por el laboratorio. Su búsqueda en el esputo siguiendo el método más útil, a pesar de su sensibilidad del 60%. Se deben solicitar 3 muestras recolectadas idealmente a primera hora de la mañana. METODOLOGÍA Microscópico. INTERFERENCIAS Y LIMITACIONES Las células epiteliales interfieren con la calidad de la muestra. COLORACIÓN DE GRAM CONDICIONES DE LA MUESTRA Una buena calidad de la muestra. Pueden ser orina, sangre, líquidos estériles, secreciones, etc. La muestra debe recolectarse de tal manera que se minimice la contaminación superficial. Se deben de seguir todas las recomendaciones para la obtención de los diferentes especimenes como son esputos, lesiones de mucosas y piel, catéteres, heridas traumáticas y quirúrgicas, orina, hemocultivos, etc. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO Fue ideada por Hans Christian Gram a fines del siglo XIX y se usa para determinar en extendidos de material biológico, presencia o ausencia de bacterias, parásitos, levaduras, células sanguíneas y células epiteliales. Diferencia las bacterias en gram positivas, las que retienen la tinción con cristal violeta, pues resisten la decoloración (se observan azul moradas), y gram negativas, aquellas que si pierden el color violeta, por lo que necesitan ser reteñidas con safranina para adquirir su aspecto rojo claro característico. Ha sido y sigue siendo, el mejor método rápido para el diagnóstico inicial de la mayoría de las infecciones bacterianas. De acuerdo con la morfología observada, permite la identificación presuntiva del microorganismo, evalúa la calidad de la muestra (presencia o no de las células epiteliales, sugestivas de exposición prolongada a las mucosas, y por lo tanto de contaminación con su flora normal), e informa semicuantitativamente la intensidad de la reacción leucocitaria. Permite evaluar la calidad de un espécimen para cultivo especialmente en el caso de esputos, secreciones vaginales y orina y determinar presuntivamente el tipo de microorganismos para la selección adecuada de los medios de cultivo. METODOLOGÍA Coloración de Gram. INTERFERENCIAS Y LIMITACIONES Una mala calidad de la muestra. Algunas bacterias no se tiñen con el Gram debido a sus características estructurales o a que son predominantemente intracelulares: legionelas, clamidias, micoplasmas, micobacterias, rickettsias, etc. CONCENTRACIÓN INHIBITORIA MÍNIMA SINÓNIMOS MIC CONDICIONES DE LA MUESTRA Cepa aislada Estabilidad de la muestra: refrigerada 2-8°C: 3 días. CONDICIONES DE PACIENTE Ninguna. FUNDAMENTO La concentración inhibitoria mínima es importante en el diagnóstico de laboratorio para confirmar la resistencia de microorganismos para un agente antimicrobiano y además para monitorizar la actividad de los nuevos agentes antimicrobianos. COPROCULTIVO CONDICIONES DE LA MUESTRA Muestra de materia fecal en un recipiente de plástico, con boca ancha, tapa rosca y limpio. Utilizar idealmente el medio de Cary Blair. Si no se utiliza medio de transporte, la muestra debe entregarse al laboratorio durante las dos horas posteriores a su recolección. En caso contrario debe refrigerarse. CONDICIONES DE PACIENTE No debe de iniciar antibióticos antes de la recolección de la muestra. FUNDAMENTO Los medios se hacen altamente selectivos mediante el agregado de una variedad de inhibidores a sus formulas, generalmente en concentraciones más altas que en agar MacConkey o EMB. Estos medios son usados primariamente para inhibir el crecimiento de E. coli y otros coliformes, pero permiten el crecimiento de especies de Salmonella y Shigella a partir de muestras de materia fecal. Luego se utilizan medios selectivos como el agar Salmonella-Shigella (SS), el agar xilosa-lisina-desoxicolato (XLD) y el agar Hektoen entérico (HE). En general estos medios se emplean en el laboratorio clínico para la recuperación de especies de Salmonella y Shigella de muestras de materia fecal diarreica. METODOLOGÍA Cultivo de bacterias. INTERFERENCIAS Y LIMITACIONES No utilizar laxantes, antiparasitarios, antidiarreicos con bismuto Los pacientes a quienes se les ha practicado estudio radiológico con bario deben esperara entre cinco y diez días para realizarles el examen. COPROLÓGICO POR CONCENTRACIÓN CONDICIONES DE LA MUESTRA Muestra de materia fecal en un recipiente de plástico, con boca ancha, tapa rosca y limpio. Las muestras líquidas se deben procesar en los 30 minutos posteriores a su recolección (no de llegar al laboratorio) Las muestras semilíquidas se deben procesar en la primera hora. Las muestras sólidas se pueden refrigerar, hasta por 24 horas. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO El objetivo de los métodos de concentración es separar los parásitos de los restos fecales, de tal manera que su número aumente en proporción al volumen de materia fecal que se examine. Se basan en las leyes físicas de la gravedad: sedimentación y flotación. Si las formas de los parásitos (huevos, larvas y quistes) tiene una menor densidad que la solución en la cual se suspenden, flotaran, al contrario si la densidad de las formas es mayor que la solución utilizada irán al fondo sedimentándose. El empleo de estos métodos ofrece las siguientes ventajas: Permite analizar una mayor cantidad de heces fecales. Detectar parásitos que existen en números reducidos. Es importante tener en cuenta que antes de preparar una concentración de materia fecal se debe realizar invariablemente un examen microscópico directo ya que en las preparaciones de concentración no se encuentran las formas móviles de los protozoos. METODOLOGÍA Físico y microscópico en materia fecal concentrada (formol-éter). INTERFERENCIAS Y LIMITACIONES No utilizar laxantes, antiparasitarios, antidiarreicos con bismuto Los pacientes a quienes se les ha practicado estudio radiológico con bario deben esperara entre cinco y diez días para realizarles el examen. CULTIVO EN THAYER MARTÍN CONDICIONES DE LA MUESTRA Muestra de secreción endocervical, uretral, conjuntival, rectal y faríngea. Si la muestra no se puede enviar inmediatamente al laboratorio se incuba a 37ºC por 24 horas. Si el cultivo se va a enviar previo a la incubación, se debe transportar en un tubo con CO2. Cuando se va a enviar el aplicador en el medio de transporte, éste debe de estar a temperatura ambiente y garantizar que llegue al laboratorio en las 12 horas posteriores a la recolección de la muestra. CONDICIONES DE PACIENTE No deben de estar tomando antibióticos. Las mujeres, no deben de hacerse duchas vaginales, ni aplicarse óvulos o cremas vaginales para la toma de muestras endocervicales. Para muestras uretrales en hombres y mujeres, es necesario que el paciente no haya orinado en las dos últimas horas. No hacerse enjuagues bucales para muestras faringeas. FUNDAMENTO La infección gonococica es una de las enfermedades de transmisiones sexual o perinatal más prevalentes en todo el mundo y compromete principalmente las mucosas del área genital como uretra y endocérvix y menos frecuentemente el recto, la orofaringe y las conjuntivas. La N. gonorrhoeae. es un coco gram negativo, no móvil, no formador de esporas, el cual crece característicamente en pares (diplococo), con sus bordes adyacentes aplanados. METODOLOGÍA Cultivo para N. gonorrhoeae. INTERFERENCIAS Y LIMITACIONES Interfieren los enjuagues bucales, los antibióticos, duchas vaginales etc. CULTIVO PARA AEROBIOS CONDICIONES DE LA MUESTRA Una buena calidad de la muestra. Pueden ser orina, sangre, líquidos estériles, secreciones, etc. La muestra debe recolectarse de tal manera que se minimice la contaminacion superficial. Se deben seguir todas las recomendaciones para la obtención de los diferentes especimenes como son esputos, lesiones de mucosas y piel, catéteres, heridas traumáticas y quirúrgicas, orina, hemocultivos, etc. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO Los cultivos aerobios logran el aislamiento de los germenes causantes o asociados a una infección. Su cultivo no sólo lo identifica, si no que permite realizarles pruebas de tipificación Tiene como utilidad el aislamiento e identificación de los diferentes tipos de bacterias patógenas que están comprometidas en infecciones humanas. METODOLOGÍA Cultivo para bacterias aerobias. INTERFERENCIAS Y LIMITACIONES Mala calidad de la muestra. CULTIVO PARA ANAEROBIOS CONDICIONES DE LA MUESTRA Una buena calidad de la muestra. Pueden ser orina, sangre, líquidos estériles, secreciones, etc. La muestra debe recolectarse de tal manera que se minimice las contaminaciones superficial. Se deben de seguir todas las recomendaciones para la obtención de los diferentes especimenes como son esputos, lesiones de mucosas y piel, catéteres, heridas traumáticas y quirúrgicas, orina, hemocultivos, etc. Se debe transportar en un medio de anaerobiosis. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO Las bacterias anaerobias son causa de infecciones variadas y comunes en el organismo humano, generalmente son infecciones severas y en muchas ocasiones se encuentran asociadas a microorganismos aerobios. La temperatura óptima para mantener el aislamiento primario de bacterias anaerobias a partir de muestras clínicas es de 35 a 37ºC. Las placas, sembradas en la mesada y colocadas en jarras para anaerobiosis, deben incubarsen por lo menos durante 48 horas y reincubarse otros 2 ó 4 días para permitir que los microorganismos de crecimiento lento formen colonias. Los cultivos se hacen en medios frescos con potenciales de óxido-reducción bajos y suplementados con vitamina K y hemina. Tiene como utilidad el aislamiento e identificación de los diferentes tipos de bacterias patógenas que están comprometidas en infecciones humanas. METODOLOGÍA Cultivo para bacterias anaerobias. INTERFERENCIAS Y LIMITACIONES Mala calidad de la muestra. DIRECTO PARA HONGOS CONDICIONES DE LA MUESTRA Los frotis se preparan ya sean directamente del material clínico o a partir de una suspensión de microorganismos provenientes de colonias desarrolladas en un medio de cultivo primario. La muestra debe recolectarse de tal manera que se minimice las contaminaciones. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO El examen directo con KOH constituye la técnica más empleada en micología médica; el KOH digiere el material proteico, lisa las células del material purulento, aclara pigmentos y disuelve el “cemento” que mantiene pegadas a las células queratinizadas, lo cual permite observar los elementos fúngicos que estén presentes en el tejido queratinizado y en los esclerotes de eumicetoma y entre los tejidos. METODOLOGÍA Directo de KOH. Extendido directo. INTERFERENCIAS Y LIMITACIONES Una mala calidad de la muestra. DIRECTO Y GRAM DE FLUJO VAGINAL CONDICIONES DE LA MUESTRA Flujo vaginal. Con un aplicador de algodón o dacrón, tomar la muestra de la mucosa alta de la vagina y el endocérvix, utilizando aplicadores diferentes para cada sitio. El aplicador con muestra vaginal se introduce en un tubo con 0.5ml de solución salina. Con el de endocérvix se hace una placa para Gram. Para la toma de la muestra se debe utilizar un espéculo sin lubricante. CONDICIONES DE PACIENTE No requiere ninguna condición especial. Se recomienda que el día del examen no se realicen duchas vaginales y no se tenga contacto semen. FUNDAMENTO Las infecciones vaginales causantes de vaginitis, cervicitis, etc y, como expresión de ésta, de flujo vaginal, son uno de los problemas más frecuentes tanto en la práctica médica como en la ginecología y en la consulta sobre enfermedades de transmisión sexual. Desde el punto de vista de estas últimas enfermedades interesan los siguientes entidades la Tricomoniasis, candidiasis, y también la gonorrea y la clamidiasis entre otras. METODOLOGÍA Microscópico cualitativo, directo y gram, pH. INTERFERENCIAS Y LIMITACIONES Contaminación de la muestra. HEMOCULTIVO DE AEROBIOS CONDICIONES DE LA MUESTRA La determinación se realiza en sangre. Las muestras se recolectan directamente del paciente mediante el sistema al vacío en los viales correspondientes. Los tipos de viales utilizados son: Viales pediátricos: ped plus código 94 (vial tapa rosado). Utilizados en niños menores de cinco años. Viales para adultos: estándar 10 aerobic/f código 60 sin resina (vial tapa azul). Para la recolección de la muestra se debe tener encuenta algunas recomendaciones como son: Elegir la mejor vena palpándola antes de desinfectar el área. Realizar la correcta asepsia que consta de limpiar el punto a puncionar con alcohol al 70% de adentro hacia fuera, posteriormente aplicar solución yodada al 2% y dejarla actuar por dos minutos. Seguidamente se procede a retirar la tapa de los viales y a limpiar con alcohol la punta del vial. Los guantes y las gasas empleadas para la toma de la muestra deben ser estériles. Realizar la venopunción con el sistema al vacío. Obtener un set de dos o tres viales según las recomendaciones del médico y las muestras se deben tomar de diferente vena, si no es posible se toman con un intervalo de treinta minutos cada una de las muestras. Los viales deben ir marcados con la nota de cargo, el nombre completo del paciente y la numeración en la cual fueron tomados. Se debe indicar el origen de donde se tomaron los hemocultivos. Los hemocultivos para aerobios tienen un período de incubación de cuatro días. CONDICIONES DE PACIENTE No iniciar terapia antimicrobiana antes de tomar los hemocultivos. En caso de haber iniciado terapia antimicrobiana, los hemocultivos deben tomarse en viales que contengan resinas que permiten la captura de antibióticos. FUNDAMENTO La bacteriemia es la presencia de bacterias en la sangre que se pone de manifiesto por el aislamiento de éstas en los hemocultivos. Es una complicación grave de las infecciones bacterianas que se presenta en general en pacientes hospitalizados. La bacteriemia se producen cuando la multiplicación y llegada de microorganismos a la sangre supera la capacidad del sistema reticuloendotelial para eliminarlos. La invasión del torrente sanguíneo se produce desde un foco de infección extravascular, a través de los capilares o de las vías linfáticas, o desde un foco intravascular como en la endocarditis. El hemocultivo es importante no sólo porque establece con certeza el diagnóstico etiológico, sino también porque la identificación del microorganismo causal y el estudio de su sensibilidad a los antimicrobianos permite elegir el tratamiento más eficaz. Los hemocutivos se ordenan por situaciones como fiebre (sin causa clara), estado de shock no explicado por causas hemodinámicas, infecciones localizadas que pueden complicarse con bacteriemia como neumonía, pielonefritis, meningitis, infecciones intraabdominales, infecciones graves de la piel o tejido celular subcutáneo y presencia de leucopenia, leucocitosis o trombopenia no relacionada con procesos hematológicos. En caso de que un hemocultivo muestre resultados positivos se procede a retirar del equipo los viales y a realizar la identificación del microorganismo presente, inicialmente realizando un extendido y colorearlo con Gram y posteriormente realizando los cultivos correspondientes. METODOLOGÍA Monitoreo continuo e ininterrumpido, con agitación constante, y notificanción inmediata de resultados positivos. Este sistema se basa en la detección del CO2 que se produce en el crecimiento bacteriano a través de un método fluorimétrico. INTERFERENCIAS Y LIMITACIONES Se presentan falsos positivos cuando se encuentra un índice de crecimiento elevado y no se consigue aislar ningún microorganismo. Lo anterior se atribuye a la actividad de las células hemáticas y se presenta en pacientes con leucemias agudas. Contaminación de la muestra de sangre, en especial por bacterias cutáneas. Entre los fármacos que pueden alterar los resultados de la prueba se encuentran los antibióticos. HEMOCULTIVO HONGOS CONDICIONES DE LA MUESTRA La determinación se realiza en sangre. Las muestras se recolectan directamente del paciente mediante el sistema vacutainer en los viales correspondientes. Los tipos de viales utilizados son: Viales pediátricos y de adulto: myco/f. lytic código 88 (vial tapa roja). Para la recoleccion de la muestra se debe tener encuenta algunas recomendaciones como son: Elegir la mejor vena palpándola antes de desinfectar el área. Realizar la correcta asepsia que consta de limpiar el punto a puncionar con solucion yodada, de adentro hacia fuera, posteriormente retirar la solución con alcohol al 70% y nuevamente aplicar solución yodada al 2% y dejarla. Los guantes y las gasas empleadas para la toma de la muestra deben ser esteriles. Limpiar la tapa del vial para hemocultivo con alcohol. Realizar la venopunción con el sistema vacutainer. Obtener un set de dos o tres viales según las recomendaciones del medico y las muestras se deben tomar de diferente vena, si no es posible se toman con un intervalo de treinta minutos cada una de las muestras. Los viales deben ir marcados con la nota de cargo, el nombre completo del paciente y la numeración en la cual fueron tomados. Se debe indicar el origen de donde se tomaron los hemocultivos. Los hemocultivos para hongos tienen un período de incubación de catorce días. CONDICIONES DE PACIENTE No iniciar terapia antimicrobiana antes de tomar los hemocultivos. En caso de haber iniciado terapia antimicrobiana, los hemocultivos deben tomarse en viales que contengan resinas que permiten la captura de antibióticos. FUNDAMENTO El término fungemia se utiliza para designar la presencia de hongos en la sangre. La mayoría de las fungemias son causadas por levaduras como Candida y Criptococcus. La fungemia se produce cuando la multiplicación y llegada de microorganismos a la sangre supera la capacidad del sistema reticuloendotelial para eliminarlos. La invasión del torrente sanguíneo se produce desde un foco de infección extravascular, a través de los capilares o de las vías linfáticas, o desde un foco intravascular como en la endocarditis. El hemocultivo es importante no sólo porque establece con certeza el diagnóstico etiológico, sino también porque la identificación del microorganismo causal y el estudio de su sensibilidad a los antimicrobianos permite elegir el tratamiento más eficaz. Los hemocutivos se ordenan por situaciones como fiebre (sin causa clara), estado de shock no explicado por causas hemodinámicas, infecciones localizadas que pueden complicarse con bacteriemia como neumonía, pielonefritis, meningitis, infecciones intraabdominales, infecciones graves de la piel o tejido celular subcutáneo y presencia de leucopenia, leucocitosis o trombopenia no relacionada con procesos hematológicos. En caso de que un hemocultivo muestre resultados positivos se procede a retirar del equipo los viales y a realizar la identificación del microorganismo presente, inicialmente realizando un extendendido y colorearlo con Gram y posteriormente realizando los cultivos correspondientes. METODOLOGÍA Monitoreo continuo e ininterrumpido, con agitación constante, y notificanción inmediata de resultados positivos. Este sistema se basa en la detección del CO2 que se produce en el crecimiento bacteriano a través de un método fluorimétrico. INTERFERENCIAS Y LIMITACIONES Se presentan falsos positivos cuando se encuentra un índice de crecimiento elevado y no se consigue aislar ningún microorganismo. Lo anterior se atribuye a la actividad de las células hemáticas y se presenta en pacientes con leucemias agudas. Contaminación de la muestra de sangre, en especial por bacterias cutáneas. Entre los fármacos que pueden alterar los resultados de la prueba se encuentran los antibióticos. . HEMOCULTIVO MICOBACTERIAS CONDICIONES DE LA MUESTRA La determinación se realiza en sangre. Las muestras se recolectan directamente del paciente mediante el sistema al vacío en los viales correspondientes. Los tipos de viales utilizados son: Viales pediátricos y de adulto: myco/f. lytic código 88 (vial tapa roja). Para la recolección de la muestra se debe tener encuenta algunas recomendaciones como son: Elegir la mejor vena palpándola antes de desinfectar el área. Realizar la correcta asepsia que consta de limpiar el punto a puncionar con solución yodada, de adentro hacia fuera, posteriormente retirar la solución con alcohol al 70% y nuevamente aplicar solución yodada al 2% y dejarla. Los guantes y las gasas empleadas para la toma de la muestra deben ser esteriles. Limpiar la tapa del vial para hemocultivo con alcohol. Realizar la venopunción con el sistema vacutainer. Obtener un set de dos o tres viales según las recomendaciones del médico y las muestras se deben tomar de diferente vena, si no es posible se toman con un intervalo de treinta minutos cada una de las muestras. Los viales deben ir marcados con la nota de cargo, el nombre completo del paciente y la numeración en la cual fueron tomados. Se debe indicar el origen de donde se tomaron los hemocultivos. Los hemocultivos para micobacterias tienen un período de incubación de cuarenta y dos días. El tiempo de detección también depende de la concentración de Mycobacterium en la sangre y de la especie de Mycobacterium que produce la infección. CONDICIONES DE PACIENTE No iniciar terapia antimicrobiana antes de tomar los hemocultivos. En caso de haber iniciado terapia antimicrobiana, los hemocultivos deben tomarse en viales que contengan resinas que permiten la captura de antibióticos. FUNDAMENTO En general Mycobacterium tuberculosis cursa con cortos períodos de bacilemia aún en pacientes con SIDA por lo que su recuperación a partir de una muestra de sangre es menos frecuente que M. avium- intracelullare y otras micobacterias no tuberculosas. El hemocultivo es importante no sólo porque establece con certeza el diagnóstico etiológico, sino también porque la identificación del microorganismo causal y el estudio de su sensibilidad a los antimicrobianos permite elegir el tratamiento más eficaz. Los hemocutivos se ordenan por situaciones como fiebre (sin causa clara), estado de shock no explicado por causas hemodinámicas, infecciones localizadas que pueden complicarse con bacteriemia como neumonía, pielonefritis, meningitis, infecciones intraabdominales, infecciones graves de la piel o tejido celular subcutáneo y presencia de leucopenia, leucocitosis o trombopenia no relacionada con procesos hematológicos. En caso de que un hemocultivo muestre resultados positivos se procede a retirar de el equipo los viales y a realizar la identificación de el microorganismo presente, inicialmente realizando un extendido y colorearlo con Gram y posteriormente realizando los cultivos correspondientes. METODOLOGÍA Monitoreo continuo e ininterrumpido, con agitación constante, y notificanción inmediata de resultados positivos. En el sistema BACTECMYCO/F Lytic ha mostrado resultados comparables con los de lisis-centrifugación. El método de lisiscentrifugación ha sido el método más ampliamente utilizado, ya que las micobacterias son microorganismos intracelulares y la lisis celular permite la liberación de las micobacterias lo que favorece su desarrollo. INTERFERENCIAS Y LIMITACIONES Se presentan falsos positivos cuando se encuentra un índice de crecimiento elevado y no se consigue aislar ningún microorganismo. Lo anterior se atribuye a la actividad de las células hemáticas y se presenta en pacientes con leucemias agudas. Contaminación de la muestra de sangre, en especial por bacterias cutáneas. Entre los fármacos que pueden alterar los resultados de la prueba se encuentran los antibióticos. PRUEBA DE GRAHAM CONDICIONES DE LA MUESTRA Residuos o restos de material en la región perianal, vulvar o perineal. La muestra debe tomarse preferiblemente en la mañana. CONDICIONES DE PACIENTE La muestra debe tomarse siempre antes de bañarse la región perianal, preferiblemente en las horas de la mañana y durante varios días. FUNDAMENTO El Enterobius vermicularis (oxiuros) es el agente causal de una de las helmintiasis más frecuente en niños que en adultos, y es la más común en homosexuales por su forma de transmisión. Es de amplia distribución en el mundo. La enfermedad que produce da prurito en la región perianal, insomnio y cambios de conducta. El hábitat del parásito es la región del ciego y el hombre es el único huésped definitivo. Se adquiere por vía oral al ingerir huevos larvados generalmente a partir de las manos, polvo de habitación, ropas etc. Frecuentemente ocurre auto infección a partir de manos y uñas contaminadas al rascarse la región perianal. El examen coprológico no es recomendado para hacer el diagnóstico de esta parasitosis; ya que la hembra no deposita los huevos en las materias fecales, sino fuera, del tubo intestinal. METODOLOGÍA Método de la cinta engomada de Graham. INTERFERENCIAS Y LIMITACIONES No debe de estar ingiriendo antiparasitarios que tengan actividad contra Enterobius vermicularis. PRUEBA DIRECTA PARA STREPTOCOCCUS CONDICIONES DE LA MUESTRA Colecte el espécimen usando un escobillón de dacrón o rayón frotando cuidadosamente la faringe posterior y las amígdalas. Los escobillones deben enviarse al laboratorio tan pronto como se hay tomado la muestra. Se procesa la muestra inmediatamente que llegue al laboratorio. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO La causa más común de faringitis bacteriana es el Streptococcus pyogenes (Streptococcus grupo A). Los Streptococcus son cocos gram positivos en forma de cadenas o agrupados en pares, catalasa negativos que tienen forma esférica ovoide o lanceolada. El Streptococcus pyogenes del grupo A puede ser tipificado por sus antígenos protéicos M y T; el M representa factores de virulencia esenciales que dan inmunidad específica y el T no produce virulencia ni estimula formación de anticuerpos. Elabora más de 20 diferentes exotoxinas, entre las que están la O y la S que son hemolíticas, la eritrogénica que produce el salpullido de la escarlatina, la estreptoquinasa que es fibrinolítica, la hialuronidasa y la difosropiridin nucleotidasa que es cardiotóxica. Para el diagnóstico de la faringitis estreptocóccica hay necesidad de seleccionar métodos de óptima sensibilidad ya que un número bajo de la bacteremia puede representar infección y no colonización. En niños la detección rápida del Streptococcus del grupo A es de vital importancia, por la alta posibilidad de desarrollar fiebre reumática aguda o síndrome de choque tóxico, como complicación de la faringitis. METODOLOGÍA Test cualitativo rápido de detección de Streptococcus del grupo A. INTERFERENCIAS Y LIMITACIONES La faringitis puede ser causada por otros organismos diferentes al Streptococcus del grupo A. S. PYGENES, CULTIVO DE FARINGE CONDICIONES DE LA MUESTRA Si el aplicador se puede enviar antes de tres horas haberse tomado la muestra, puede llevarse en un tubo seco, si se va a transportar después de tres horas, es necesario introducir el aplicador en un tubo con cílica. CONDICIONES DE PACIENTE No ingerir antibióticos antes de la toma de la muestra. Es preferible que los niños estén en ayunas, por la posibilidad de que presente vómito al tomar la muestra. FUNDAMENTO La faringitis es un síndrome causado por diferentes grupos de microorganismos y puede presentarse a cualquier edad. Los resultados de los estudios epidemiológicos son influidos por la edad, la severidad del cuadro clínico y los métodos de diagnóstico empleados. Aproximadamente 15% de la faringitis son por S. pyogenes, estos son más frecuentes entre los 3 y los 15 años de edad. La importancia de su diagnóstico etiológico radica en la posibilidad de complicaciones no supurativas (fiebre reumática) y supurativas (otitis media, mastoiditis, sinusitis, absceso periamigdaliano y adenitis supurada), los cuales pueden presentarse si no se da tratamiento específico. METODOLOGÍA Cultivo para S. pyogenes. INTERFERENCIAS Y LIMITACIONES Interfieren los antibióticos y una mala calidad de la muestra. SANGRE OCULTA EN MATERIA FECAL CONDICIONES DE LA MUESTRA Muestra de materia fecal en un recipiente de plástico, con boca ancha, tapa rosca y limpio. Se recomienda recoger muestras de tres movimientos intestinales, lo que incrementa la posibilidad de detectar pólipos sangrantes de forma intermitente o distribución no homogénea de sangre en la materia fecal. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO Su utilidad esta dada por la detección de sangre cuando no es posible observarla macroscópicamente. Algunas causas pueden ser de origen bacteriano como la salmonelosis que invade mucosas y produce ulceración otras como algunas parasitosis, colitis ulcerativas idiopáticas, tumores, hemorroides y fisuras, etc. El estudio de la sangre oculta es importante como método de tamizaje para detectar cáncer colorectal o hemorragia gastrointestinal de otro origen; las drogas como aspirina, indometacina, fenilbutazona, reserpina, hierro, corticosteroides, antiinflamatorios no esteroides y el alcohol pueden producir hemorragia y dar reacción positiva. Para la determinación de sangre oculta se utiliza un método que emplea una única combinación de anticuerpo monoclonal y otro policlonal en fase sólida contenidos en un dispositivo sólido para la identificación selectiva de hemoglobina humana con una alta especificidad y sensibilidad. METODOLOGÍA Test rápido de inmunocromatografía cualitativa. INTERFERENCIAS Y LIMITACIONES La vitamina C puede dar lugar a falsos negativos y las dietas basadas en productos cárnicos o peroxidasas de plantas como las de rábano, manzanas, naranjas y banano dan lugar a falsos positivos. SEROLOGÍA DE HONGOS CONDICIONES DE LA MUESTRA Suero, mínimo 2 ml Estabilidad de la muestra: temperatura ambiente 18-25 °C: 1 semanas. Refrigerado 2-8 °C: 2 semanas. Congelado –20 °C: 2 meses. CONDICIONES DE PACIENTE Ninguna. FUNDAMENTO Diagnóstico de enfermedades causadas por hongos oportunistas TINTA CHINA CONDICIONES DE LA MUESTRA Los frotis se preparan ya sean directamente del material clínico (LCR) o a partir de una suspensión de microorganismos provenientes de colonias desarrolladas en un medio de cultivo primario. La muestra debe recolectarse de tal manera que se minimice las contaminaciones. CONDICIONES DE PACIENTE No requiere ninguna condición especial. FUNDAMENTO La tinta china es un método de contraste, no de coloración, que permite destacar la cápsula de levaduras al no poder penetrarla, produciéndose asi un campo oscuro que permite la observación de la cápsula, un halo transparente dentro del cuál se observa la levadura. Se emplea especialmente en el diagnóstico de la criptococosis. La criptococosis es una enfermedad sistémica de curso generalmente subagudo o crónico; la forma primaria es casi siempre pulmonar pero no necesariamente sintomática que es causa por el C. neoformans que es una levadura oval o esférica que raramente produce seudomicelios, de tamaño variable y que se reproduce por gemación. METODOLOGÍA Método de contraste. INTERFERENCIAS Y LIMITACIONES Mala calidad de la muestra. UROCULTIVO CONDICIONES DE LA MUESTRA Muestra de orina de micción simple descartando la primera orina de la mañana. La muestra refrigerada desde la toma de la muestra se conserva tres días. Para mantenerla hasta un mes, debe congelarse a -20ºC o menos CONDICIONES DE PACIENTE Hombres: Se retira el prepucio hacia atrás con el fin de lavar bien el glande, se limpia cuidadosamente con una toalla impregnada de solución jabonosa, se hace un movimiento suave de adelante hacia atrás; luego se utiliza otra toalla bastante húmeda o agua directa del grifo o canilla para eliminar lo que quedo de jabón y se descarta la primera parte de la micción; la siguiente parte se recoge en el recipiente procurando taparlo hermética e inmediatamente. Es necesario verificar si la información escrita en la etiqueta del frasco está correcta. -Mujeres: Se separan los labios mayores para limpiarlos suavemente con una toalla húmeda y desechable, o se lavan con agua y jabón, realizando un movimiento de adelante hacia atrás; seguidamente se limpia con otra toalla, frotando de adelante hacia atrás y tratando de limpiar el orificio uretral y perianal, se puede hacer el lavado directamente del grifo; luego se descarta la primera parte de la orina y se recoge la parte restante en el recipiente, el cual se tapa inmediatamente. Es necesario verificar si la información escrita en la etiqueta del frasco está correcta. -Lactantes y recién nacidos: Para recoger la muestra se requiere la inmovilización del niño, procurando fijar las piernas y dar limpieza a los alrededores del orificio uretral, luego se coloca una bolsita plástica estéril, la cual tiene un anillo de cinta adhesiva que se adhiere a la piel para evitar la pérdida de la muestra. FUNDAMENTO La infección urinaria es una de las infecciones más frecuentes en la práctica médica, se ha dividido en baja uretritis, cistitis, prostatitis y alta pielonefritis y abscesos perinefríticos. Microbiológicamente existe infección cuando los microorganismos son detectados en la orina, uretra, vejiga, riñón o próstata. METODOLOGÍA Lectura semicuantitativa de unidades formadoras de colonias (ufc) por ml de orina sembrada. INTERFERENCIAS Y LIMITACIONES La orina recogida en malas condiciones de asepsia. CITOQUÍMICO DE LÍQUIDO CEFALORRAQUÍDEO SINÓNIMOS LCR citoquímico CONDICIONES DE LA MUESTRA Muestra tomada por el médico, enviada al laboratorio en la primera hora despues de haber sido tomada. CONDICIONES DE PACIENTE No necesita ayuno. Se sugiere sangrar al paciente al mismo tiempo para glicemia. CRITERIOS DE RECHAZO DE LA MUESTRA Muestras sin marcar. FUNDAMENTO El líquido cefalorraquídeo (LCR) es estéril, se forma a partir del plasma por ultrafiltración originada en los plexos coroideos de los ventrículos, en cantidad de 500 ml diarios y el volumen total es de 150 ml por existir un rápido recambio constante. Hallazgos en el LCR: Poliomielitis: pleocitosis neutrófila en sus comienzos y linfocitaria después. Meningitis: hipoglucorraquia Guillain-Barré: aumento progresivo de proteínas (pleocitosis) Hemorragia cerebral: aspecto sanguinolento, hipertensión, proteínas aumentadas. Meningitis infecciosas (bacterias, hongos): presencia del microorganismo. El aumento de las proteínas en el LCR puede ser causado por: Punción traumática (contaminación plasmática) En meningitis bacteriana y viral, procesos endocrinos, metabólicos y tóxicos: debido a que se aumenta la permeabilidad de la barrera hematoencefalica En una compresión medular debida a un tumor. EXAMEN MICROSCOPICO: El citodiagnóstico cuantitativo consiste en determinar los tipos celulares hallados en el sedimento del LCR. Linfocitosis: típica en procesos subagudos o crónicos como meningitis tuberculosa, meningitis viral o aséptica. Polinucleosis neutrófila: se hallan en procesos sépticos agudos como meningitis purulenta. Polinucleosis eosinófila: se debe a parásitos y tiene gran valor en el diagnóstico de cisticercosis cerebral. Glucorraquía: La disminución de la glucosa en el LCR se asocia con meningitis aguda o crónica, bacteriana, tuberculosa, micótica o parasitaria. Un nivel de glucosa en el LCR inferior al 60% de la glicemia, es compatible con meningitis bacteriana o neoplasi. METODOLOGÍA Examen macroscópico Examen microscópico Examen químico INTERFERENCIAS Y LIMITACIONES Condiciones médicas que contraindiquen realizar la punción. La muestra debe ser procesada inmediatamente. CITOQUÍMICO DE LÍQUIDO PLEURAL CONDICIONES DE LA MUESTRA Debe ser una muestra tomada por el médico. (Toracocentesis). Al laboratorio la muestra es enviada en dos tubos: uno heparinizado para realizar el citoquímico y un segundo tubo seco estéril para cultivo microbiológico. CRITERIOS DE RECHAZO DE LA MUESTRA En muestras coaguladas no es posible realizar conteo celular. FUNDAMENTO La principal función del líquido pleural es la lubricación con el fin de llevar al mínimo la fricción durante la respiración y se estudia para identificar la causa del derrame pleural; pudiendo ser esta insuficiencia cardiaca congestiva, cirrosis hepática, neoplasias, tuberculosis e infarto pulmonar. El derrame pleural es la acumulación de líquido en el espacio pleural. Esta cavidad pleural se extiende entre el pulmón y la pared del tórax. Este líquido puede ser un trasudado, el cual es la acumulación de líquido debido a causas extrínsecas a la cavidad, tales como presión hidrostática aumentada (insuficiencia cardiaca congestiva, pericarditis) o exudado, el cual es el líquido acumulado por enfermedad de los órganos situados dentro de la misma cavidad o cerca de su superficie, tales como infecciones, neoplasias, embolia pulmonar e infarto, proceso intraabdominales (pancreatitis), enfermedades del tejido conectivo y por hipersensibilidad (artritis reumatoidea, lupus eritematoso, reacción a fármacos) METODOLOGÍA Análisis macroscópico, microscópico y químico. CITOQUÍMICO LÍQUIDO ASCÍTICO SINÓNIMOS Líquido abdominal CONDICIONES DE LA MUESTRA Por punción realizada por el médico (Paracentesis) CRITERIOS DE RECHAZO DE LA MUESTRA En muestras coaguladas no es posible realizar conteo celular. FUNDAMENTO La acumulación de líquido peritoneal se conoce como ascitis , el estudio del líquido obtenido por punción es para determinar la etiología. Es importante determinar si se trata de un exudado o trasudado, que aclara la etiología del proceso. El transudado se debe a una acumulación excesiva de líquidos sin inflamación, es generalmente estéril, con obstrucción de los linfáticos. Los exudados son producidos por mecanismos infecciosos, originados por procesos infecciosos. Cuando el transudado corresponde a neoplasia abdominal, el examen citológico tiene una sensibilidad superior al 95%. La LDH (deshidrogenasa láctica) es alta en los procesos neoplásicos. Las causas de ascitis: Insuficiencia cardiaca congestiva Cirrosis hepática Neoplasias Peritonitis tuberculosa, piógena IRC Pancreatitis Traumatismo Seudoquistes pancreáticos. EXAMEN MICROSCOPICO: recuento de glóbulos rojos es +/- 100.000/mm3 corresponde a un líquido hemorrágico, si coagula espontáneamente puede ser una punción traumática. Si al realizar el análisis químico el líquido es pobre en proteínas (menor de 2.5 gr/dl) se puede estar frente a una cirrosis, hipoproteinemia o insuficiencia cardiaca congestiva. En contraste si el líquido es rico en proteínas (mayor de 2.5 gr/dl) se puede estar frente a una neoplasia o infección. Cuando se determina el gradiente albúmina suero-albúmina líquido y el resultado es mayor de 1.1 corresponde a una insuficiencia cardiaca congestiva o cirrosis. Si es menor de 1.1 corresponde a infecciones, neoplasias, vasculitis, síndrome nefrótico o ruptura de vasos sanguíneos. Si el diagnóstico del paciente lo requiere determinar: pH: puede variar entre 7.25 (infección) a 7.45 (cirrosis). Glucosa: menor de 60% mg/dl en el 50% de los pacientes con peritonitis tuberculosa o en caso de carcinomatosis peritoneal. LDH (deshidrogenasa láctica): elevada en trasudados. METODOLOGÍA Análisis microscopico, químico y conteo celuar. CITOQUIMICO DE LÍQUIDO ARTICULAR SINÓNIMOS Líquido sinovial CONDICIONES DE LA MUESTRA Muestra tomada por el médico.Tubo tapa rosca con heparina. Enviar tubos (3) tapa rosca para realizar otras pruebas diferentes al citoquímico. CONDICIONES DE PACIENTE Se sugiere tomar muestra de sangre concomitante, para medir glucosa en suero. CRITERIOS DE RECHAZO DE LA MUESTRA Si la muestra está coagulada no puede realizarse recuento diferencial. FUNDAMENTO En las articulaciones existe el líquido sinovial que es un trasudado del plasma, cuya función principal es servir de lubricante a la articulación. Es más abundante en articulaciones grandes como rodillas, hombro, caderas, codos, muñecas y tobillos, donde es factible extraerlo por punción o inyectar medicamentos antiinflamatorios por lo general corticosteroides. El líquido sinovial contiene proteoglucanos elaborados por la membrana celular con un pH de 7.3 a 7.4. Densidad 1.010, concentración protéica del 1% y no contiene fibrinógeno. El líquido sinovial es una extensión del líquido intersticial y no un producto de secreción. El estudio de líquido sinovial constituye uno de los exámenes más útiles para el diagnóstico y pronóstico de enfermedades reumatoides. Se debe estudiar en todo paciente con artropatía no diagnosticada y derrame articular asintomático. El líquido puede encontrarse de un color rojizo brillante debido a la presencia de sangre fresca por una punción traumática; rojizo parduzco por presencia de sangre allí almacenada, en hemofílicos o por tumores sinoviales; xantocrómico (intensamente amarillo) en procesos inflamatorios, artritis traumáticas ya superadas y artrosis. El líquido sinovial puede encontrarse turbio por presencia de leucocitos, en artritis séptica y en procesos inflamatorios por cristales (gota); sanguinolento con coágulo por punción traumática; sanguinolenta sin coágulo, en los hemofílicos y en los tumores; lechoso por abundantes cristales en artritis gotosa. En artritis reumatoidea, gota, espondilitis, fiebre reumática y escleroderma, aumenta la cantidad y los leucocitos pueden llegar hasta 100.000 por mm3 con más del 50% de polimorfonucleares. La glucosa 25 a 50 mg/dl inferior a la sanguínea y proteínas aumentadas. En lupus eritematoso y artritis reumatoidea, la dosificación de anticuerpos antinucleares y complemento o el factor reumatoide, puede esclarecer el diagnóstico. Los procesos sépticos articulares pueden dar color verde amarillento, leucocitos superiores a 10.000 por mm3 y glucosa inferior a 25 mg/dl con 75% de polimorfonucleares. METODOLOGÍA Citoquímico (fotomtería) INTERFERENCIAS Y LIMITACIONES No se debe puncionar la articulación si existen infecciones cutáneas o heridas en el área de la punción, por el riesgo de sepsis.