Técnicas Microscópicas: Práctica de Laboratorio de Biología
Anuncio

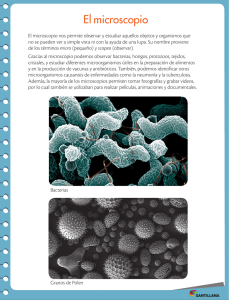
Práctica 1 Introducción a las técnicas microscópicas Según recoge la guía docente de la asignatura Laboratorio Integrado de Biología, el objetivo general de esta parte de la asignatura es saber identificar estructuras celulares y tejidos al microscopio. Los objetivos específicos son: a) saber utilizar el microscopio como herramienta principal en la observación de muestras biológicas; b) identificar y evaluar muestras biológicas de células y tejidos animales; c) procesar en el laboratorio muestras biológicas de células y tejidos animales para su posterior observación y estudio. Los organismos pluricelulares están formados por células que son muy diversas en forma y función. Las células se asocian formando tejidos. Un tejido es un conjunto de células, matriz extracelular, y fluido corporal que cooperan para llevar a cabo una o varias funciones en un organismo. Distintos tejidos se asocian entre sí para formar los órganos. La histología es una disciplina eminentemente descriptiva que se dedica a la observación de los diferentes tejidos mediante microscopios. La mayoría de las técnicas histológicas van encaminadas a preparar el tejido para su observación con el microscopio. Ello es debido a que la composición de los tejidos, salvo contadas ocasiones, no tienen contraste ni colores permitan diferenciar sus estructuras de una manera clara mediante la observación directa con los microscopios. Por ello hay que procesar las muestras, primero para que no se deterioren y después para resaltar sus estructuras y poder estudiarlas en detalle. De manera general, para alcanzar este objetivo es necesario realizar los siguientes pasos: ‐ Toma de la muestra ‐ Fijación ‐ Inclusión ‐ Microtomía ‐ Coloración o tinción ‐ Montaje Obtención de muestras.‐ Se realiza mediante biopsias de un ser vivo, o mediante disección de uno muerto. En este último caso hay que proceder de forma lo más inmediata posible la muerte y siguiendo los usos aceptados y permitidos. Una vez extraídos de un ser vivo, los órganos cesan en sus funciones vitales y se trata de impedir las modificaciones post morten que pueda sufrir las células (procesos autolíticos), manteniendo la estructura morfológica de células y tejidos sin que ocurran cambios notables en ellos. Se trata también de evitar la putrefacción por acción bacteriana. Estos procesos se consiguen mediante las técnicas de fijación. Fijación.‐ Fijar un tejido es preservar sus características morfológicas y moleculares lo más parecidas posibles a las que poseía en su estado vivo. Esto se consigue inmovilizando (por coagulación o precipitación) las moléculas proteínicas e inhibiendo principalmente las enzimáticas haciéndolas insolubles. Esta acción garantiza la integridad de las células y tejidos. Aunque detiene todos los procesos vitales, este proceso conserva la estructura de células y tejidos. Se efectúa mediante agentes químicos denominados fijadores o mediante agentes físicos. Para ello se sumerge la muestra en el fijador o este se inyecta en el torrente sanguíneo para su rápida difusión a todas las partes (perfusión). Los fijadores físicos se basan bien en una congelación muy rápida del tejido o bien en la aplicación de calor elevado. La congelación en realidad más que un método de fijación es un método de conservación, y en la mayoría de los casos, para conseguir las preparaciones microscópicas, se requiere en algún momento una fijación química. Tiene la ventaja de que no altera en absoluto las conformaciones moleculares, que sí se ven afectadas por los procesos químicos. El calor elevado coagula las proteínas, pero conserva la estructura morfológica. El ejemplo más claro de fijación por calor es un huevo cocido: aunque la clara y la yema se coagulan, el huevo sigue conservando su aspecto. Los fijadores se pueden clasificar en tres grandes grupos según su acción sobre el tejido: los coagulantes, los que establecen enlaces cruzados y los oxidantes coagulantes: provoca la desnaturalización de las proteínas sin modificarlas químicamente. Entre ellos se encuentran sustancias como los alcoholes, el ácido acético, el cloruro de mercurio, etc entrecruzantes: establecen enlaces cruzados entre distintas moléculas generando con ellas una red tridimensional. Entre ellos se encuentran los aldehídos. El formaldehido es un fijador ampliamente usado que se une a grupos funcionales de las proteínas. Esta unión hace que muchos enzimas queden inactivas. Los grupos a los que se une son amino, sulfidrilos, guanidilos, grupos hidroxilos alifáticos, etcétera. La unión a uno de estos grupos produce un grupo hidroximetileno. Es el hidroximetileno el que reacciona con grupos de otra, o de la misma, proteína para la formación de puentes. oxidantes: La acción oxidante de estos fijadores le confieren a las células ciertas condiciones que posibilitan una mejor aplicación de las sustancias colorantes. Entre ellos se encuentran el dicromato potásico y el tetróxido de osmio. Éste último forma puentes entre los enlaces insaturados de las cadenas de ácidos grasos de los lípidos de las membranas celulares. Las hace insolubles, oscuras y opaca a los electrones, por lo que es usado en microscopía electrónica. Inclusión y corte.‐ Para poder observar los tejidos en un microscopio es preciso que la muestra posea la dureza y la consistencia suficientes para obtener secciones delgadas y transparentes lo suficientemente finos (8‐10 µm) como para que los atraviese la luz. Incluir significa infiltrar el tejido con un medio líquido que posteriormente se solidificará y endurecerá sin afectar las características estructurales de la muestra. El medio de inclusión más usado para obtener secciones finas es la parafina; una mezcla de hidrocarburos de cadena larga que en estado sólido tiene la consistencia de la cera. Las más usadas tienen un punto de fusión de 55‐60ºC y la infiltración ha de realizarse con la parafina en estado líquido. Como la parafina no es miscible con el agua se ha de sustituir el agua de la muestra por un líquido compatible. Se utiliza alcohol etílico de gradación creciente (70‐100%) haciendo varios cambios en un tiempo que puede durar 1‐6 horas, según el tamaño de la muestra. La parafina tampoco es miscible con el alcohol, por lo que se introducen baños cortos en un solvente orgánico miscible tanto en alcohol como en parafina, normalmente el xileno. Tras 2‐3 baños de 1 hora en parafina líquida, tras lo cual la muestra estará infiltrada de parafina y al transferirse a un molde y dejar enfriar tendremos un bloque de parafina con la muestra que podemos cortar con un micrótomo. La figura muestra un esquema del proceso: Una vez incluidos los tejidos y la parafina integran un solo bloque que, posee la dureza y la consistencia suficientes para obtener secciones delgadas y transparentes. Las secciones delgadas o “cortes” se obtienen utilizando instrumentos mecánicos diseñados para que en forma más o menos automática, seccionen el bloque de parafina en cortes delgados y de grosor uniforme. Los instrumentos se denominan “microtomos”. Los micrótomos más usados son los de rotación, como el de la figura Están dotados de una cuchilla y un portamuestras que sujeta el bloque de parafina y que se desplaza arriba y abajo accionado por una manivela; en cada desplazamiento la manivela acciona un tornillo que determina el avance del bloque según el grosor seleccionado. se obtienen tiras de cortes que se colocan sobre un portaobjetos cubierto con agua calentada a unos 40 °C. El portaobjetos ha sido tratado previamente son soluciones adhesivas. El calor y la hidrofobicidad de la parafina hacen que las secciones se estiren sobre la superficie del agua y una vez evaporada queden adheridas al portaobjetos. Tinción.‐ Para poder ver los cortes en el microscopio todavía hay que solucionar el problema de la visibilidad: nosotros “vemos” las cosas por la luz que emiten (color) o por la diferencia en el índice de refracción entre el objeto y el medio: un porta no tiene color, pero vemos sus bordes por la diferencia del índice de refracción entre el vidrio y el aire; si el porta lo introdujésemos en agua sería más difícil de ver porque la diferencia en el índice de refracción es menor. En las muestras biológicas al menos el 75% es agua y color solo tienen los pigmentos, que son pocos y se encuentran en células restringidas (hemoglobina en los eritrocitos, melanina en los melanocitos…..). Para solucionar esta circunstancia se recurre al uso de colorantes, sustancias coloreadas que son capaces de unirse de manera más o menos específica a estructuras del tejido aportándoles color. Los colorantes son normalmente hidrosolubles, por lo que antes de proceder a la tinción tenemos que llevar a cabo unos tratamientos previos sobre las secciones como es el desaparafinado y la hidratación con baños sucesivos de etanol en concentración decreciente. Por otra parte, una vez teñidos los cortes interesa conservarlo para poder observarlos cuantas veces queramos. Para ello se recurre a las técnicas de montaje, que consisten en conservarlas con una gota de resina transparente y un cubreobjetos. Como las resinas de montaje no suelen ser hidrosolubles es necesaria la deshidratación con baños de etanol de concentración creciente y el paso por xileno. Una de las tinciones más comúnmente usada en histología es la hematoxilina‐eosina sobre cortes de parafina. Se usa un colorante básico, la hematoxilina (morada), que tiene apetencia por sustancias ácidas del tejido como el ADN o ciertos componentes de la matriz extracelular como los glicosaminoglicanos, y otro ácido, la eosina (rosa), que tiene apetencia por sustancias básicas, sobre todo estructuras proteicas localizadas en el citoplasma celular y también por el colágeno de la matriz extracelular. Un ejemplo del resultado de esta tinción se muestra en la figura: de color morado los núcleos y de color rosa los citoplasmas y fibras colágenas. Se usan también métodos tricrómicos para poder distinguir núcleos, citoplasmas y fibras colágenas. La imagen corresponde a una tinción tricrómica de Gomori, cuyos resultados son: colágeno, verde oscuro‐ celeste; músculo, rojo; citoplasma, rosado; núcleo morado‐negro. El esquema resume todos estos procesos El texto en color son enlaces a videos sobre la realización de los procesos que se han descrito: Proceso de inclusión en parafina Corte con un microtomo de rotación Colocación y estiramiento de cortes de parafina Tinción general de hematoxilina y eosina en cortes de parafina Técnicas histoquímicas.‐ Además del carácter ácido o básico de los componentes de los tejidos, también es posible conocer con algún detalle su naturaleza química. El objetivo de la histoquímica es poner de manifiesto una molécula o familia de moléculas. Estas moléculas son difícilmente discernibles con técnicas generales y por tanto es necesario realizar pasos previos para poner de manifiesto la molécula que queremos detectar. Las reacciones químicas consisten en la modificación química de moléculas del tejido para posteriormente poder colorearlas. Existen técnicas histoquímicas para detectar glúcidos, proteínas y nucleótidos. La técnica histoquímica más empleada es la reacción de PAS (Periodic Acid Schiff). Se utiliza para la detección de hidratos de carbono, libres o conjugados, cuando están en cantidades relativamente grandes en los tejidos. La modificación química del tejido consiste en la oxidación mediante el ácido periódico de los enlaces entre los carbonos próximos que contienen grupos hidroxilos. Esto provoca la formación de grupos aldehídos que serán reconocidos por el reactivo de Schiff, el cual se combinará con ellos para dar un color rojizo brillante. La histoenzimología se basa en la capacidad que tienen algunos enzimas del tejido de mantener funcional su centro activo tras el proceso de fijación. Estos enzimas y las células que los poseen se ponen de manifiesto mediante una reacción enzimática que convierte a unos sustratos solubles e incoloros en productos insolubles y coloreados. Los sustratos son específicos para el enzima y los productos se depositan en el lugar preciso donde se produjo la reacción, es decir, donde se localiza el enzima. Las enzimas que se pueden detectar son variadas como las peroxidasas, fosfatasas, deshidrogenasas, diaforasas, acetilcolinesterasa, etcétera. La inmunocitoquímica es una técnica para la localización de moléculas en los tejidos mediante el empleo de anticuerpos. Se basa en la gran especificidad y alta afinidad que tienen los anticuerpos para reconocer a moléculas y unirse a ellas. Además, la conjugación o combinación de los anticuerpos con enzimas o con sustancias fluorescentes permite detectar cantidades ínfimas de moléculas presentes en el tejido. Microscopio óptico El microscopio óptico es un elemento esencial para los estudios generales de histología puesto que es el que nos permite observar las diferentes características morfológicas de las células y los tejidos. Se basa en el uso de lentes para aumentar los rayos de luz que atraviesan la muestra de tejido. Un microscopio óptico compuesto está formado por las siguientes partes (ver el esquema): ‐ ‐ Oculares, son las lentes que forman la imagen que observaremos con nuestros ojos. Todos los microscopios actuales poseen dos oculares, uno para cada ojo. Al menos uno de los oculares puede regularse para alejar o acercar la lente al objetivo, permitiendo ajustar el enfoque a las condiciones de visión, dioptrías, de cada observador. Objetivos, son las lentes que reciben la luz directamente tras atravesar la sección histológica y poseen un tambor o revólver donde se encuentran varios objetivos. Cada uno de ellos posee ‐ ‐ ‐ ‐ ‐ lentes que permiten diferentes aumentos (4x, 10x, 20x, 40x y 100x). Rotando el revólver se puede seleccionar el objetivo y por tanto el aumento al que queremos observar la preparación. Platina, es la plataforma donde se coloca el portaobjetos con nuestro tejido. Posee un dispositivo para sujetar el portaobjetos, el cual se puede desplazar en el plano de la platina, movimiento controlado manualmente. Condensador, es un dispositivo con una lente que concentra y focaliza la luz proveniente de la fuente sobre la sección de tejido. Diafragma, se sitúa entre la fuente luminosa y el condensador. Permite aumentar el contraste de la muestra y la profundidad de campo, es decir, el espesor de la muestra que está enfocado. Fuente luminosa, es la que proporciona la luz que atraviesa la sección de tejido. Se usa una lámpara cuyo haz de luz atraviesa el diafragma, el condensador, la muestra, y tras ello penetra por el objetivo y atraviesa los oculares hasta nuestros ojos. La intensidad de la fuente luminosa se puede regular mediante un reostato. Macrométrico y micrométrico: el enfoque de la muestra se consigue variando la distancia de la muestra a la lente del objetivo. La distancia se controla mediante dos ruedas denominadas macrométrico y micrométrico, respectivamente. La primera permite movimientos ascendentes y descendentes amplios de la platina y la segunda ajustes finos. El enlace es a un video que explica las distintas partes y la forma de usar el microscópio. https://youtu.be/N96x3Xtp95w Microscopio electrónica Los microscopios ópticos tienen un límite máximo de resolución de 0,2 µm. El poder de resolución es la distancia mínima a la que se pueden discriminar dos puntos. Este límite viene determinado por la longitud de onda de la fuente de iluminación, en este caso la luz visible. Usando microscopios ópticos avanzados se consiguen unos 1000‐1500 aumentos (objetivo de 100x junto con oculares de 10x o 15x). Sin embargo, no debemos confundir los aumentos con el poder de resolución. Por más que consigamos aumentar una imagen tomada de un microscopio, incluso con metodología digital, no se puede aumentar la resolución de la imagen. Cuando se quieren observar estructuras celulares que están por debajo del límite de resolución del microscopio óptico se recurre al microscopio electrónico. Este tipo de microscopio tiene un límite de resolución más pequeño que 1 nanómetro gracias a que no usa la radiación electromagnética de la luz visible sino la alta frecuencia de un haz de electrones que incide sobre la muestra, y permite aumentos de varios millones de veces. El microscopio electrónico no usa lentes sino imanes que concentran los haces de electrones emitidos por un filamento. Normalmente son aparatos grandes puesto que el viaje de los electrones tiene que ocurrir en vacío, si no los electrones chocarían con las partículas de aire. En el microscopio electrónico de transmisión se produce un haz de electrones en un filamento de tungsteno que se condensan mediante electroimanes y se focalizan sobre una sección de tejido. Las secciones de tejido deben ser muy finas, se denominan ultrafinas (de unas decenas de nanómetros), para permitir que sean atravesadas por los electrones. Previamente las secciones deben ser tratadas con metales pesados como el osmio y el uranilo. La función de estos metales es similar a las tinciones usadas en el microscopio óptico pero en este caso para introducir elementos densos a los electrones. El osmio se une a los dobles enlaces de los lípidos y el uranilo a los complejos proteicos. De esta forma se consigue densidad electrónica en las membranas y los complejos macromoleculares. Los electrones que chocan con estos metales rebotarán y no cruzarán el tejido. Aquellos que consigan atravesar el tejido chocarán contra una pantalla fluorescente que emitirá un destello luminoso tras cada choque. Esa imagen emitida por la pantalla fluorescente es la que podemos observar nosotros. Por ello las imágenes observadas con el microscopio electrónico son siempre en blanco y negro. Este enlace es de un video en el que describe todo el proceso para preparar muestras para visualizar a microscopía electrónica de transmisión. También podéis ver distintas estructuras celulares en un microscopio electrónico de transmisión en este enlace. ACTIVIDADES A REALIZAR 1.‐ Los alumnos realizarán dos tinciones histológicas con preparaciones que se darán previamente desparafinadas e hidratadas. TINCIÓN 1. HEMATOXILINA‐EOSINA 1. Una vez hidratados los cortes se tiñen con hematoxilina durante 10 minutos. 2. Lavar con agua. 3. Azulear los núcleos (unos 2 minutos) en agua amoniacal (amoníaco al 2%). 4. Lavar con agua. 5. Teñir con eosina durante 30 segundos. 6. Enjuagado rápido en agua. 7. Deshidratar con etanol de 96º y luego, etanol de 100º (dos cambios de 2 minutos). 8. Aclarar en xileno (dos cambios de 2 minutos cada uno). Montar los cortes con DPX, procurando que no se sequen y evitando la formación de burbujas. TINCIÓN 2. AZUL ALCIÁN‐HEMALUMBRE‐PICROCARMIN DE ÍNDIGO 1. Una vez hidratados los cortes se tiñen con azul alcián durante15 minutos. 2. Lavar con agua. 3. Teñir con hemalumbre durante 10 minutos. 4. Lavar con agua. 5. Teñir con picrocarmín de índigo, de 30 segundos a 1 minuto. 6. Lavar con agua. 7. Deshidratar los cortes pasándolos directamente por alcohol de 100º (dos cambios de 2 minutos cada uno). 8. Aclarar en xileno (dos cambios de 2 minutos cada uno). Montar los cortes, procurando que no se sequen y evitando la formación de burbujas. 2.‐ Utilización del microscopio óptico manejando correctamente todos sus elementos: iluminación, enfoque, aumentos, etc. 3.‐ Distinguir las células y sus elementos con distintos métodos de tinción. Apreciar las formas de las células, su tamaño, la morfología de los núcleos, las relaciones entre las células, las fibras, etc. REFERENCIAS Las diferentes figuras y videos incluidos en el guion proceden del Departamento de Biología Funcional y Ciencias de la Salud. Facultad de Biología. Universidad de Vigo (https://mmegias.webs.uvigo.es/)