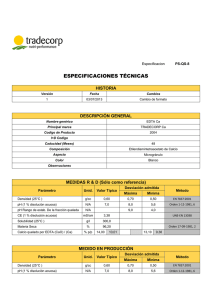
Casa abierta al tiempo PRÁCTICA 6 Determinación de calcio y magnesio en una misma muestra Objetivos: 1. Comprender el fundamento y el desarrollo del análisis de una sustancia basándose en las reacciones para la formación de complejos, conociendo el método del enmascaramiento y el uso de indicadores complejométricos. 2. Determinación del contenido de Ca y Mg en una muestra problema aplicando la técnica volumétrica complejométrica. Eventos que ocurren en esta práctica En esta práctica primero se determina la concentración total de iones de Ca2+ y Mg2+ que reaccionan con el EDTA. En una segunda etapa se determina Ca2+ por separado al precipitar el ion magnesio como Mg(OH)2 con NaOH concentrado. 82 En la primera titulación el Mg2+ y Ca2+se titulan con EDTA a un pH de 10, empleando eriocromo Negro T como indicador. El EDTA forma con el Ca2+ un complejo más estable que con el magnesio, pero produce un color muy tenue con el Eriocromo Negro T, que el correspondiente al Mg-Eriocromo Negro T; por consiguiente, cuando una disolución problema contiene magnesio y calcio, la adición de EDTA conduce a los siguientes eventos: Primero, el Ca2+ libre forma el complejo CaY2" con el EDTA, después hace lo mismo el Mg2+ libre y finalmente las minúsculas cantidades de magnesio y calcio que estaba combinada con el Eriocromo Negro T, reaccionan con el EDTA, llegando al punto final de la titu-lación. La cantidad de titulante consumido, corresponde a la suma del Ca2+ y Mg2+ presentes en la disolución. Puesto que la reacción entre el complejo de Mg2+ - Eriocromo Negro T (Mgln) y el EDTA es un poco lenta a temperatura ambiente, la disolución se calienta ligeramente, acelerando la obtención del punto final. En la segunda parte, el calcio puede titularse con EDTA a un punto final muy bien definido, usando el indicador metalocrómico, azul de hidroxinaftol. Este indicador se utiliza debido a que permanece azul a valores de pH mayores que el eriocromo negro T. Esto quiere decir, que el calcio puede titularse con EDTA en un medio fuertemente alcalino. En estas condiciones el magnesio precipita como hidróxido y no interfiere en la titulación del calcio, la [OH] necesaria para precipitar al Mg2+ es > 1.2109x 10'4 y La teoría y la práctica en el laboratorio de Química Analítica I DERECHOS RESERVADOS © 2004, Universidad Autónoma Metropolitana (México). Prohibida la reproducción de esta obra así como la distribución y venta fuera del ámbito de la UAM®. E-libro Bibliomedia Bibliomedia@mail.com Casa abierta al tiempo para el Ca2+ es > de 1.1125 x 10"2 (calculadas a partir de los Kps de los hidróxidos correspondientes) lo que quiere decir que precipitará primero el magnesio, dejando al calcio libre en la disolución para titularse con el EDTA, esto ocurre solo si la cantidad de magnesio presente no es muy alta. Material y equipo 2 matraces Erlenmeyer de 250 mi 1 bureta 1 pinzas para bureta 1 soporte universal 2 pipetas volumétricas de 10 mi 2 pipetas graduadas de 5 mi 1 propipeta 1 parrilla 1 termómetro de -10 a 250°C 1 balanza analítica 1 mufla 1 campana de extracción 2 crisoles de porcelana 1 mortero con pistilo Reactivos y disoluciones Disolución de EDTA 0.0500 M Disolución reguladora amoniacal de pH 10 Disolución de hidróxido de sodio al 50.0 % p/p Eriocromo negro T Murexida. Azul de hidroxinaftol (aproximadamente 0.1 g para cada titulación) HCI al 20 % p/p HCI concentrado Zn metálico Muestra problema (cascara de huevo o una disolución con carbonato de calcio y carbonato de magnesio). 83 Lo que debe hacerse antes del experimento Obtención de la muestra problema, cuando se emplea cascara de huevo. Se rompen los huevos, se eliminan la clara y la yema y se lava el cascarón con agua destilada. Se seca al aire durante unos días y se reduce a polvo en un mortero. Se pesan 2 muestras de 1.0000 g cada una en crisoles de porcelana y se calcinan en una mufla a 700 °C durante 16 horas como mínimo. Posteriormente se enfrían los crisoles y se añade la muestra a un matraz aforado de 100 mi. Se adiciona 2.0 mi de agua destilada y 9.5 mi de HCI concentrado. EL polvo que no se transfirió se disuelve con 1.0 mi de agua y 0.5 mi HCI concentrado y se vacía al matraz volumétrico y se afora con agua destilada. Disolución de Zn 2+ . Ver preparación en el apéndice A. DERECHOS RESERVADOS © 2004, Universidad Autónoma Metropolitana (México). Prohibida la reproducción de esta obra así como la distribución y venta fuera del ámbito de la UAM®. E-libro Bibliomedia Bibliomedia@mail.com Casa abierta al tiempo Lo que se hace el dia del experimento I) Valoración de la disolución de EDTA con Zn Metálico En un matraz Erlenmeyer de 250 mi, coloque una alícuota de 20.0 mi de la disolución de Zn 2+ y 5.0 mi de disolución reguladora de pH 10.0. Diluye con aproximadamente 50 mi de agua destilada y añade la cantidad de ENT (ENT:Na2SO4) necesario para obtener un rojo intenso y procede a la titulación con la disolución de EDTA que se desea valorar. El punto final de la titulación es cuando el color rojo de la disolución vire a azul claro (Fotografía 6.1). Repite la titulación dos veces más. Como esta reacción, no ocurre con rapidez, es necesario titular con lentitud en la proximidad del viraje, para evitar agregar un exceso de EDTA. II) Determinación de Calcio y Magnesio en una misma muestra En un matraz Erlenmeyer de 250 mi, coloque una alícuota de 20.0 mi de la disolución problema y 5.0 mi de la disolución reguladora amoniacal. Diluye la disolución con 20 mi de agua destilada, caliente entre 60-80 °C y añade la cantidad de Eriocromo Negro T necesario para obtener un rojo intenso (en algunos casos la coloración es violeta). Titule con la disolución valorada de EDTA, hasta que la disolución cambie a color azul (Fotografía 6.2). Repite dos veces más la titulación. 84 Coloque una segunda alícuota de 20.0 mi de la disolución problema en un vaso de precipitado de 250 mi, añade 30 gotas de NaOH al 50% (p/p), y agite por 2 minutos para precipitar el Mg(OH)2 (el cual puede ser imperceptible). Se añade 0.10 g de azul de hidroxinaftol (este indicador se utiliza debido a que permanece azul a pH mayores que el ericormo negro T). Titule rápidamente la disolución hasta tener un color azul. Después de alcanzar el color azul de punto final, deje reposar la disolución durante 5 minutos, con agitación ocasional, de manera que se redisuelva el Ca(OH)2 que hubiera podido precipitarse. En caso de que el color azul desaparezca continué con la titulación hasta obtener nuevamente el color azul (Fotografía 6.3). Si el color azul cambia a rojo durante el reposo, se repite este procedimiento. Titule un blanco con 20.0 mi de agua destilada. Haga lo mismo pero use una pizca de murexida y titule hasta el vire a violeta (fotografía 6.4). Reporte de la práctica I. Valoración de la disolución de EDTA Anote los siguientes datos, obtenidos durante la práctica. Cantidad pesada de zinc: Volumen final de la disolución de Zn 2+ masa (en mg) de Zn presentes en la alícuota Consumo de EDTA La teoría y la práctica en el laboratorio de Química Analítica I DERECHOS RESERVADOS © 2004, Universidad Autónoma Metropolitana (México). Prohibida la reproducción de esta obra así como la distribución y venta fuera del ámbito de la UAM®. E-libro Bibliomedia Bibliomedia@mail.com Con base en esta información calcule: Molaridad del EDTA II. Determinación de Calcio y Magnesio en la muestra Masa de la cascara de huevo antes de la calcinación Masa de la cascara de huevo después de la calcinación Volumen de la disolución que contiene la muestra problema Volumen de la alícuota de la muestra problema que utilizó Molaridad de la disolución de EDTA, obtenida en la parte anterior Mililitros de EDTA gastados en la primera titulación, donde usó ENT como indicador Mililitros de EDTA gastados en la segunda titulación, donde usó azul de hidrxinaftol como indicador Mililitros de EDTA gastados en la tercera titulación, donde uso murexida como indicador Con base en esta información calcule: a) masa de Ca2+ en la alícuota b) masa de Mg2+ en la alícuota c) exprese el contenido de Ca+2 y Mg+2 en: i) % en peso en la cascara de huevo calcinado ii) % en peso en la muestra sin calcinar DERECHOS RESERVADOS © 2004, Universidad Autónoma Metropolitana (México). Prohibida la reproducción de esta obra así como la distribución y venta fuera del ámbito de la UAM®. E-libro Bibliomedia Bibliomedia@mail.com