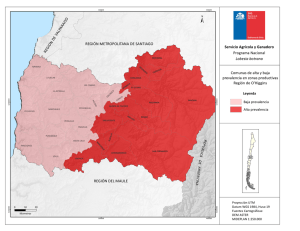
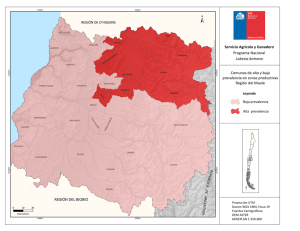
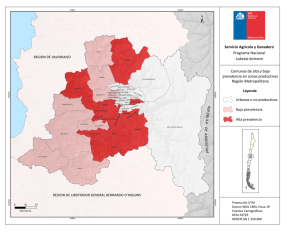
See discussions, stats, and author profiles for this publication at: https://www.researchgate.net/publication/281287528 Sintomas Gastrointestinales en Mexico. Estudio SIGAME. Un Estudio de la Epidemiologia de los Trastornos Funcionales en Mexico Book · August 2015 CITATIONS READS 0 1,717 1 author: Jose M Remes-Troche Universidad Veracruzana 387 PUBLICATIONS 1,953 CITATIONS SEE PROFILE Some of the authors of this publication are also working on these related projects: Celiac Disease and Non Gluten Celiac Sensitivty, Smart Pill and Microbiota View project All content following this page was uploaded by Jose M Remes-Troche on 28 August 2015. The user has requested enhancement of the downloaded file. SÍNTOMAS GASTROINTESTINALES EN MÉXICO Un estudio epidemiológico SIGAME José María Remes Troche Editor Síntomas gastrointestinales en México Un estudio epidemiológico SIGAME Primera edición, 2015 D.R.© ASECOM México, D.F. Impreso y hecho en México Printed and made in Mexico ISBN XXX-XXX-XXX-X Editor: Dr. José María Remes Troche Coordinador editorial: Dr. Mario Alfredo Rodriguez León Revisora: Dra. Magda Luz Atrían Salazar Diseño de portada: D.C.G. Mario Alfredo Rodríguez Velasco Diseño de interiores: Mtra. Victoria Castellanos Xolocotzi Ninguna parte de esta publicación podrá reproducirse o transmitirse por medio alguno o en forma alguna, bien sea electrónica o mecánicamente, tales como el fotocopiado y la grabación o a través de cualquier sistema de almacenamiento y recuperación de información sin el previo consentimiento escrito de ASECOM Asesores en Comunicación Médica Editorial, S.A. de C.V. Aunque se ha tenido el máximo cuidado en la recopilación y verificación de la información contenida en esta publicación con el objeto de asegurar su veracidad, el Editor no se responsabilizará de la actualización de la información o de cualquier omisión, inexactitud o error expresado en instituciones que pudieran ser consecuencia de la utilización de la información, métodos, productos, instrucciones e ideas que se expresan en esta publicación. Dado el rápido progreso con el que avanzan las ciencias médicas, el Editor recomienda que se realicen las comprobaciones oportunas al margen de los diagnósticos y dosificaciones que se indican en el material aquí publicado. ÍNDICE Acerca de los autores v Prefacio Miguel Ángel Valdovinos Díaz ix Introducción Francisco Bosques Padilla 1 Capítulo 1 La importancia de la epidemiología en los trastornos funcionales digestivos José María Remes Troche 3 Capítulo 2 Estudio SIGAME: generalidades y diseño del estudio José María Remes Troche y Mercedes Amieva Balmori 15 Capítulo 3 Epidemiología de la enfermedad por reflujo gastroesofágico Francisco M. Huerta Iga 27 Capítulo 4 Otros trastornos esofágicos y gastroduodenales Ana Teresa Abreu y Abreu 49 Capítulo 5 Epidemiología de los síntomas dispépticos Ramón Isaías Carmona Sánchez 63 Capítulo 6 Epidemiología del síndrome de intestino irritable en México Mercedes Amieva Balmori y José María Remes Troche 83 i ÍNDICE Capítulo 7 Epidemiología del dolor abdominal funcional José Luis Tamayo de la Cuesta 99 Capítulo 8 Epidemiología del estreñimiento Ma. Eugenia Icaza Chávez, Beatriz Eugenia Palomo Torres, José Alberto Paredes Uc y Arturo Segura Moreno 113 Capítulo 9 Epidemiología de los trastornos anorrectales Enrique Coss Adame 141 Capítulo 10 Sobreposición de trastornos funcionales digestivos Octavio Gómez Escudero 159 Capítulo 11 Epidemiología de los síntomas gastrointestinales en diabetes Oscar Teramoto Matsubara 179 iii ACERCA DE LOS AUTORES Editor Dr. José María Remes Troche Medicina interna y gastroenterología, egresado del Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. Maestro en Ciencias, Universidad Nacional Autónoma de México. Investigador titular, Instituto de investigaciones médico biológicas, Universidad Veracruzana. Veracruz, México. Sistema Nacional de Investigadores, Nivel II. jose.remes.troche@gmail.com Co-editores y colaboradores Dr. Miguel Ángel Valdovinos Díaz Gastroenterólogo y endoscopista. Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. Distrito Federal, México. Dr. Francisco Bosques Padilla Médico internista y gastroenterólogo. Endoscopista. Presidente de la Asociación Mexicana de Gastroenterología. Profesor titular. Facultad de Medicina, Universidad Autónoma de Nuevo León. México. Jefe de la División de Medicina Interna. Instituto Tecnológico de Estudios Superiores de Monterrey. Monterrey, Nuevo León, México. Dr. Francisco M. Huerta Iga Gastroenterólogo. Neurogastroenterología y endoscopia digestiva. Hospital Ángeles Torreón. Coahuila, México. v ACERCA DE LOS AUTORES Dra. Ana Teresa Abreu y Abreu Unidad de medicina de atención ambulatoria Villa Coapa. Servicio de gastroendoscopia, Instituto Mexicano del Seguro Social. Hospital Ángeles del Pedregal. Distrito Federal, México. Dr. Ramón Isaías Carmona Sánchez Médico internista, gastroenterólogo y endoscopista. Instituto Nacional de Ciencias Médicas Salvador Zubirán, Distrito Federal, México. Gastroenterólogo y endoscopista, San Luis Potosí, México. Dra. Mercedes Amieva Balmori Laboratorio de fisiología digestiva y motilidad gastrointestinal. Instituto de investigaciones médico biológicas, Universidad Veracruzana. Ver, México. Dr. José Luis Tamayo de la Cuesta Centro de investigación y docencia en ciencias de la salud. Hospital Civil de Culiacán, Universidad Autónoma de Sinaloa, México. Dra. Ma. Eugenia Icaza Chávez Hospital Star Médica de Mérida. Yucatán, México. Dra. Beatriz Eugenia Palomo Torres Dr. José Alberto Paredes Uc Dr. Arturo Segura Moreno Dr. Enrique Coss Adame Departamento de gastroenterología y laboratorio de neurogastroenterología y motilidad gastrointestinal. Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. Distrito Federal, México. vi ACERCA DE LOS AUTORES Dr. Octavio Gómez Escudero Especialista en Gastroenterología, Endoscopia Digestiva y Motilidad Gastrointestinal. Hospital Ángeles Puebla. Puebla, México. Dr. Oscar Teramoto Matsubara Médico gastroenterólogo. Centro Médico ABC y Hospital Ángeles de las Lomas. Miembro activo de la Asociación Mexicana de Gastroenterología. vii PREFACIO “Mide lo medible y haz medible lo que no lo sea” Galileo Galilei Me siento muy honrado por la invitación a escribir el prefacio del libro Síntomas gastrointestinales en México, un estudio epidemiológico, una obra que aporta información relevante y trascendente para el ejercicio de la gastroenterología en nuestro país. El Dr. José María Remes Troche y sus colaboradores se dieron a la tarea de medir en la población, a lo largo y ancho de la República Mexicana, la prevalencia de los principales trastornos funcionales digestivos (TFD), la intensidad de los síntomas gastrointestinales y el impacto en la calidad de vida de quienes los padecen. Debido a la heterogeneidad de la población mexicana y la compleja condición geográfica de nuestro país, se anticipaba una tarea difícil de realizar. No obstante, el Dr. Remes utilizó un diseño factible y pragmático, que le permitió cumplir los objetivos planteados. Se capacitó a 78 encuestadores(as) responsables de la obtención de la información epidemiológica; se utilizaron tres herramientas reconocidas y validadas para este tipo de estudios que incluyen el cuestionario modular de Roma III, el cuestionario PAGI-SYM y el cuestionario PAGI-QoL, además de un cuestionario que hizo posible recabar los datos sociodemográficos de las comunidades estudiadas. Acertadamente se calculó el tamaño de la muestra según la zona geográfica y económica del país, hecho necesario para obtener poder estadístico. Como corolario a este trabajo, en cada capítulo se presentan los resultados con base en el análisis descriptivo de las variables sociodemográficas. Se estima la prevalencia según las diferentes regiones del país y se realizó análisis univariado y multivariado para determinar la contribución de uno o varios factores en los diferentes TFD. Además, el uso del acrónimo SIGAME (Síntomas Gastrointestinales en México) ix PREFACIO para denominar al estudio, da cuenta una vez más sobre el pragmatismo de quienes intervinieron en el proyecto. Los dos primeros capítulos de este libro presentan las generalidades de la epidemiología, la importancia de conocer la prevalencia de los TFD en la población mexicana y los detalles para el diseño del estudio SIGAME; en los subsecuentes se destaca el empleo de metodología uniforme para la presentación de los resultados. Primero se hace la introducción al TFD en cuestión, después se describe la información epidemiológica mundial, la informada en estudios previos en México y, por último, los datos epidemiológicos derivados del estudio SIGAME. Cada uno de quienes intervinieron en la obra nos informa sobre los resultados de la investigación en la enfermedad por reflujo gastroesofágico, los trastornos funcionales del esófago, los síntomas dispépticos, el síndrome de intestino irritable, el estreñimiento crónico funcional, los trastornos anorrectales y la sobreposición en los TFD. Un último capítulo analiza la epidemiología de los síntomas gastrointestinales en pacientes con diabetes mellitus, una condición altamente prevalente en México. En cuanto a los resultados, llama poderosamente la atención sobre la distribución de las diferentes prevalencias de los TFD obtenidos en SIGAME. El estreñimiento funcional resultó como el trastorno más frecuente (22.3%), seguido de la dispepsia no investigada (12%) y el síndrome de intestino irritable (7.6%). La prevalencia de la ERGE fue de 12.1%. Las prevalencias encontradas en SIGAME difieren de las informadas en otros estudios mexicanos y en otras comunidades, lo cual puede explicarse debido a la metodología utilizada en SIGAME; sin embargo, es un hallazgo que debe tomarse en consideración para coadyuvar en el diseño y operación de políticas de salud. Invito al lector a que evalúe los resultados obtenidos en las variables sociodemográficas, la intensidad de síntomas y el impacto en la calidad de vida de las personas que padecen los TFD incluidos en este trabajo. No dudo que en adelante ésta será una obra de consulta obligada en la práctica clínica de la gastroenterología en nuestro país. Expreso mi más profundo reconocimiento al Dr. Remes como autor del método SIGAME y editor de la obra, así como al excelente equipo editorial por la misión cumplida y la valiosa información epidemiológica x PREFACIO que aportan para el mejor conocimiento de los trastornos funcionales digestivos y para el establecimiento de mejores prácticas en nuestro país. Finalmente, y en paráfrasis a Galileo, puedo afirmar que “han medido lo que parecía no medible”; por ello, mis más sinceras felicitaciones a este equipo de trabajo. Dr. Miguel Angel Valdovinos Díaz xi INTRODUCCIÓN Para establecer el adecuado enfoque y la orientación para la salud individual y colectiva de un país, es necesario conocer el perfil epidemiológico de las enfermedades que les afectan. Este es el caso de los trastornos digestivos, en los que es necesario investigar y conocer su prevalencia, incidencia, factores de riesgo y tendencias a través del tiempo. Con un enorme placer acepté la invitación para redactar la introducción del libro “Síntomas gastrointestinales en México (SIGAME), un estudio epidemiológico” cuyo autor es el Dr. José María Remes Troche, quien conjuntó la participación de 11 colegas expertos de diferentes regiones y centros médicos de nuestro país. Propusieron un proyecto epidemiológico para conocer la frecuencia y características de presentación de los padecimientos funcionales digestivos más frecuentes. La obra abarca desórdenes tanto esofágicos, como gástricos y del colon, así como un capítulo que se centra en el impacto que estos padecimientos producen en la población con diabetes mellitus, entidad que en nuestro país alcanza proporciones muy elevadas. En todos los sentidos, esta obra es una aportación original a nuestro conocimiento del tema en México; fue propuesto por el Instituto de Investigaciones Médico Biológicas de la Universidad Veracruzana en conjunto con la Fundación SALUZ Investigación de la ciudad de Veracruz y contó con el apoyo del laboratorio Asofarma de México. El proceso se inició en marzo de 2013. Con base en un método riguroso, se realizó un estudio poblacional utilizando una herramienta electrónica web que les permitió evaluar de forma dinámica, precisa y en tiempo real a individuos de población abierta provenientes de los diversos estados que conforman la República Mexicana. Este recurso estuvo disponible en un servidor dedicado para la realización del estudio; a través de esta página se aplicó una encuesta para evaluar las características demográficas y la prevalencia de los 1 INTRODUCCIÓN diversos trastornos funcionales y síntomas gastrointestinales en México. El lector podrá constatar como de manera rigurosa se llevó a cabo el tamizado de cerca de 4,000 pacientes adultos, lo que permitió precisar la frecuencia y características de estos trastornos. A lo largo de sus 11 capítulos los autores describen en detalle los resultados de este importante trabajo y permitirá a los gastroenterólogos, por primera vez en México, contar con un conocimiento sólido sobre estos padecimientos; estoy seguro que será el inicio de una productiva línea de trabajo que generará estrategias para el diagnóstico y tratamiento eficientes de los mismos. Felicito al Dr. José María Remes Troche y al grupo de investigadores por esta iniciativa, en mi conocimiento, la primera en nuestro país. Nos permite constatar como sí es posible llevar a cabo este tipo de estudios y marca el camino para que en el futuro podamos realizar investigaciones semejantes en otras áreas de nuestra especialidad. Invito a los colegas a dedicar tiempo para el estudio y reflexión de su contenido; estoy seguro redundará en una mejor atención para nuestros pacientes. Francisco Bosques Padilla 2 Capítulo 1 La importancia de la epidemiología en los trastornos funcionales digestivos JOSÉ MARÍA REMES TROCHE 1. INTRODUCCIÓN De acuerdo con la Organización Mundial de la Salud (OMS), la epidemiología “es el estudio de la distribución y los determinantes de estados o eventos (en particular de enfermedades) relacionados con la salud y la aplicación de esos estudios al control de enfermedades y otros problemas de salud.”1 Existen diferentes métodos para llevar a cabo investigaciones epidemiológicas: la vigilancia y los estudios descriptivos (observacionales) se pueden utilizar para analizar la distribución de las enfermedades, y los estudios analíticos (experimentales) permiten analizar sus factores determinantes.2 La epidemiología estudia los problemas de salud recurriendo a diseños de investigación preestablecidos, los que permiten circunscribir este análisis dependiendo de las siguientes circunstancias:3 x (OQLYHOGHFRQRFLPLHQWRTXHGHOSUREOHPDVHWHQJD x /DGLVSRQLELOLGDGGHSRVLEOHVKLSÖWHVLVTXHH[SOLFDQODRFXUUHQFLD de la enfermedad. x (O RUGHQ R VHFXHQFLD WHPSRUDO FRQ OD TXH SXHGDQ DFWXDU ODV variables asociadas a la enfermedad en estudio. x /D SRVLELOLGDG GH LQWHUYHQLU PRGLILFDQGR OD SUREDELOLGDG GH ocurrencia de una enfermedad. En los últimos años la mayor parte de la investigación en medicina se ha enfocado en el desarrollo de nuevas y mejores herramientas diagnósticas, novedosos procedimientos terapéuticos e innovadores fármacos y se ha dejado a un lado el conocimiento del comportamiento epidemiológico de las enfermedades. Una observación meticulosa de la forma en que ocurre una enfermedad, las características de los afectados y la participación de factores y circunstancias relacionadas, permiten elaborar hipótesis sobre los posibles mecanismos etiológicos y nivel de participación de eventuales factores de riesgo o de protección. 5 JOSÉ MARÍA REMES TROCHE 2. EPIDEMIOLOGÍA OBSERVACIONAL Se denomina epidemiología observacional al enfoque que basa su quehacer en la observación de eventos sin mayor participación en cuanto a la forma, cantidad y oportunidad en que las personas se relacionan o exponen a estos factores.4 El investigador que utiliza este enfoque toma cuidadosa nota de lo que ocurre, sin intervenir de modo alguno en la decisión de los sujetos respecto de su exposición a factores determinados. Este marco difiere del enfoque experimental, en el cual el ambiente de observación es, en cierta medida, controlado por el investigador, quien administra intervenciones o exposiciones a diferentes grupos de sujetos en estudio, siendo muchas veces el azar quien adjudica esta intervención. Muchos textos utilizan el concepto de “actitud pasiva” del investigador para representar el carácter observacional de un estudio, contrastándola con la “actitud activa”, representativa de un estudio experimental. Esto puede originar la errónea percepción de que los estudios observacionales están librados a su suerte en cuanto al control de variables de confusión, errores de medición y eventuales sesgos.5 Sin embargo, es de suma importancia enfatizar que a partir de los estudios observacionales se generan las hipótesis, se caracteriza la población y muchas veces ilustra el comportamiento real de las enfermedades en su entorno natural y tal como se ven los pacientes en el consultorio. Ejemplos de estudios observacionales son los descriptivos (o generadores de hipótesis) en todas sus variedades y los analíticos (por definición, son los que evalúan hipótesis de trabajo). 3. ESTUDIOS DE PREVALENCIA Los estudios de prevalencia son transversales, ya que el atributo seleccionado de la población o muestra poblacional se mide en un punto determinado del tiempo, equivalente a tratar de obtener una “fotografía” del problema.6 Se busca conocer todos los casos de personas con una cierta condición en un momento dado, sin importar por cuánto tiempo mantendrán esta característica ni tampoco cuándo la adquirieron. Estos estudios responden a preguntas tales como: 6 CAPÍTULO 1 x LA IMPORTANCIA DE LA EPIDEMIOLOGÍA EN LOS TRASTORNOS FUNCIONALES DIGESTIVOS x ¢4XÌWDQIUHFXHQWHHVODKLSHUWHQVLÖQHQSREODFLÖQDGXOWD" x ¢4XÌSRUFHQWDMHGHSDFLHQWHVPDQLILHVWDGLVFRQIRUPLGDGFRQOD DWHQFLÖQUHFLELGD" x ¢&XÄOHVODIUHFXHQFLDGHEHEHGRUHVSUREOHPDVHJÝQVXVH[R\ FXÄOVXUHODFLÖQFRQHOQLYHOVRFLRHFRQÖPLFR" Los estudios transversales habitualmente no se hacen en un solo día, incluso pueden llevar meses o años para su realización y durante la investigación se estudian varios sujetos, pero todos ellos en un momento determinado de su vida. No se los sigue en el tiempo. Es importante señalar que el corte transversal representa un momento en la vida de la persona que está siendo estudiada o entrevistada, no hay un seguimiento de esa persona. Debido a que los estudios transversales enfocan un punto en el tiempo, se llaman también de prevalencia,5,6 y permiten calcular la prevalencia de una enfermedad, no así su incidencia. La información puede usarse tanto en forma descriptiva, para mostrar cuánto hay de cada característica en la población o para apoyar la generación de hipótesis al analizar asociaciones existentes entre algunas características de los sujetos. Si la variable estudiada es de tipo cualitativo (por ejemplo: una enfermedad o sus síntomas), los resultados del estudio de prevalencia generalmente se entregan como porcentajes (tasas de prevalencia). Las variables cuantitativas pueden expresarse a través de medidas de resumen, como promedio y desviación estándar, dependiendo del tipo de variable o pueden categorizarse con base en los criterios clasificatorios previamente establecidos. Un estudio de prevalencia puede ser también analítico cuando se examinan las variables de interés en subgrupos de sujetos, entonces pueden estudiarse hipótesis causales o de asociación. Sin embargo, este tipo de modelo de investigación solo permite probar hipótesis simples, a saber, si el promedio de una característica difiere de un valor estándar conocido o del de otra población. También permite la comparación entre grupos o de un mismo grupo en diferentes momentos, por ejemplo en años o periodos diferentes.6,7 Los estudios transversales tienen escaso valor para el análisis de enfermedades agudas, ya que ellas se caracterizan por su corta evolución y su naturaleza rápidamente cambiante; en cambio, son 7 JOSÉ MARÍA REMES TROCHE de gran utilidad para determinar la prevalencia de enfermedades crónicas, de larga evolución, y esta información es de gran valor para la planificación sanitaria. En ocasiones, este tipo de estudios se utiliza para investigar la frecuencia de una enfermedad en presencia o en ausencia de un determinado factor de exposición; sin embargo, existe dificultad para establecer la relación temporal entre la supuesta causa (factor de exposición) y la enfermedad. Debido a que son más económicos y sencillos de realizar se les utiliza a menudo como primera aproximación para el estudio de una relación causal, y a partir de ellos se elaboran hipótesis que posteriormente pueden ser probadas con los estudios analíticos. En el cuadro 1 se muestran algunas ventajas y desventajas de los estudios transversales. Cuadro 1. Algunas ventajas y desventajas de estudios de prevalencia Ventajas x 'HUHODWLYDVHQFLOOH]\EDMRFRVWR x 3HUPLWHQHOHVWXGLRGH enfermedades crónicas, de prolongados periodos de incubación x $SWRVSDUDHOHVWXGLRGH parámetros fisiológicos x 3HUPLWHQSODQWHDUODH[LVWHQFLD de asociaciones x 3XHGHQXWLOL]DULQIRUPDFLÖQ recolectada previamente x /DLQIRUPDFLÖQHQJHQHUDOHVGH más fácil obtención x ,QIRUPDFLÖQGHEXHQDFDOLGDGGH covariables x 'HWHUPLQDQODSUHYDOHQFLDGHXQ daño o de un factor de riesgo x &RQWULEX\HQDXQDDGHFXDGD caracterización de la población afectada x 3HUPLWHQODHODERUDFLÖQGH estimadores de riesgo 8 Desventajas x 1RVXVWHQWDQLQIHUHQFLDGH causalidad x 6RORSHUPLWHQHVWDEOHFHU asociaciones generales x 1RSHUPLWHHVWDEOHFHUULHVJRV relativos directos x &RQGLFLRQDGRVDXQEXHQGLVHÔR de instrumentos de recolección y trabajo de terreno (fieldwork) x 6XMHWRVDVHVJRVSRUHYHQWXDOHV cambios en la población, en periodos previos al estudio x /LPLWDGRVDVXMHWRVYLYRV SRVLEOH fuente de sesgo de selección) CAPÍTULO 1 x LA IMPORTANCIA DE LA EPIDEMIOLOGÍA EN LOS TRASTORNOS FUNCIONALES DIGESTIVOS 4. IINVESTIGACIÓN EPIDEMIOLÓGICA EN GASTROENTEROLOGÍA Desde sus inicios, la epidemiología ha sido una rama de la medicina que se ha enfocado en establecer asociaciones causales y factores de riesgo asociados al cáncer. Y así pues, gracias a estos estudios el día de hoy sabemos que la exposición al tabaco o el consumo de alcohol son factores de riesgo reconocidos para el cáncer de páncreas, el cáncer de colon, el cáncer de estómago y el cáncer gástrico, entre otros.8 Afortunadamente, con el conocimiento de los factores de riesgo y los avances tecnológicos que permiten detección y tratamiento oportuno del cáncer, la expectativa de vida de la población general se ha incrementado. No obstante, en las últimas décadas la incidencia y la prevalencia de otros padecimientos crónicos, como la diabetes mellitus y la hipertensión, se ha ido incrementando. Además, los cambios en el estilo de vida y la dieta han llevado a que la población sufra trastornos metabólicos que impactan gravemente el estado de salud y la calidad de vida, como el caso de la obesidad. En este entorno, la gastroenterología es un campo que no se debe dejar de utilizar las herramientas epidemiológicas necesarias para el apropiado entendimiento de las enfermedades digestivas. Sin embargo, en los últimos 100 años el enfoque de esta especialidad ha sido muy “fisiopatológico” o “sintomático” o incluso “visual” (por el advenimiento de la endoscopia), asumiendo que lo que hemos visto y diagnosticado está muy claro desde el punto de vista epidemiológico e incluso lo hemos globalizado. Así pues, generalizamos o adaptamos las guías de manejo y diagnóstico realizadas en otros países o, aún más, ante la escasez de información epidemiológica en nuestro país establecemos programas de vigilancia o escrutinio, que seguramente no son aplicables a nuestra población. Si uno piensa cuál ha sido uno de los avances epidemiológicos más importantes en la gastroenterología, posiblemente mucha gente coincida en el hecho de haber establecido la asociación entre infección por Helicobacter pylori, enfermedad ácido péptica y cáncer gástrico. Este descubrimiento, merecedor a un premio Nobel de Medicina, fue realizado por investigadores que no eran epidemiólogos (Barry Marshall y Robin Warren) pero que usaron técnicas y abordajes 9 JOSÉ MARÍA REMES TROCHE epidemiológicos para establecer la importancia del Helicobacter pylori en el contexto de la enfermedad ácido péptica.9 Otros ejemplos destacables de la utilidad de el abordaje epidemiológico son el descubrimiento de el virus de la hepatitis C, a partir de los reportes de la existencia de una entidad inicialmente denominada “hepatitis No A no B”; o los estudios que han establecido que los pólipos adenomatosos colónicos son factor de riesgo para cáncer de colon.10 5. LA IMPORTANCIA DE LOS TRASTORNOS FUNCIONALES DIGESTIVOS Es necesario que un “experto” en cualquiera de las ramas o subespecialidades de la gastroenterología conozca la prevalencia, incidencia, impacto, costos y pronóstico de las condiciones que estudia. Esto se vuelve más relevante cuando se trata de padecimientos crónicos frecuentes, y que si bien la mortalidad es nula o baja, los costos pueden ser extremadamente altos, como es el caso de los trastornos funcionales digestivos. Con base en estudios epidemiológicos en otros países, sabemos que los trastornos funcionales digestivos y de la motilidad gastrointestinal afectan a millones de personas independientemente del sexo, edad, grupo poblacional y condición socioeconómica. Estos trastornos representan una de las primeras causas de consulta al médico general, y la principal causa de consulta al gastroenterólogo. Por ejemplo, el síndrome de intestino irritable (SII) y la dispepsia funcional (DF), los principales trastornos funcionales digestivos, afectan a 10% a 20% de la población adulta a nivel mundial.11,12 Por otra parte, en Estados Unidos de América (EUA) se estima que 40% de los adultos tiene síntomas típicos de enfermedad por reflujo gastroesofágico –ERGE– (pirosis o regurgitación) al menos una vez al mes, 20% al menos una vez a la semana y 7% diariamente.13,14 Debido a la alta prevalencia de estos padecimientos, la cronicidad de sus síntomas y el impacto en la calidad de vida, sus costos son enormes.15,16 Por ejemplo, múltiples estudios han mostrado que los pacientes con SII utilizan más los servicios de salud (más consultas, más exámenes de laboratorio, más medicamentos, e incluso más 10 CAPÍTULO 1 x LA IMPORTANCIA DE LA EPIDEMIOLOGÍA EN LOS TRASTORNOS FUNCIONALES DIGESTIVOS cirugías), que los pacientes con enfermedades orgánicas sin SII.17,18 Otro hecho relevante es que la mayoría de los sujetos que padece estos trastornos se encuentra entre la tercera y quinta década de la vida, por lo que su productividad se afecta considerablemente.11,19 Aún más, una vez que se diagnostica este problema, 75% de los sujetos permanece sintomático al menos por un promedio de 5 años.20 Todos estos factores contribuyen a que el diagnóstico y tratamiento de estos pacientes sea oneroso; por ejemplo, los costos directos e indirectos en los EUA por el manejo del SII es cercano a los 30 billones de dólares por año.21 Respecto de la ERGE, se sabe que la mayoría de los pacientes consume medicamentos que inhiben la secreción gástrica de ácido, por lo que su impacto socioeconómico también es elevado.22 Sandler et al23 calculan que los costos directos relacionados con la ERGE es de aproximadamente 11 billones de dólares al año. Al igual que el SII, la ERGE deteriora considerablemente la calidad vida; por ejemplo, la mayoría de los pacientes tiene que modificar drásticamente sus hábitos alimenticios, 60% tiene problemas relacionados con el sueño, y hasta 40% refiere tener dificultad para concentrarse en el trabajo debido a los síntomas.24 (Q FRQFOXVLÖQ ¢SRU TXÌ HV LPSRUWDQWH OD HSLGHPLRORJÐD HQ ORV WUDVWRUQRV IXQFLRQDOHV" 6L ELHQ QR VRQ SDWRORJÐDV OHWDOHV LPSDFWDQ significativamente la calidad de vida y son condiciones con un impacto económico muy alto (lamentablemente poco medible en nuestro medio). Además, en nuestro país la información es escasa y probablemente estemos realizando una práctica clínica que no es adecuada a nuestro entorno, ya que desconocemos el comportamiento epidemiológico. Es factible que el conocimiento obtenido a partir de los estudios epidemiológicos en México pueda cambiar la forma de entender y abordar a nuestros pacientes que sufren trastornos funcionales digestivos. REFERENCIAS 1. Organización Mundial de la Salud. Epidemiología. Disponible en: http://www.who.int/topics/epidemiology/es/ 11 JOSÉ MARÍA REMES TROCHE 2. Porta M, Ed. A dictionary of epidemiology. 6th Ed. New York: Oxford University Press; 2014. 3. Bhopal R. Concepts of Epidemiology. Integrating the ideas, theories, principles and methods of epidemiology. 2nd Ed. New York: Oxford University Press; 2008. 4. Hernández M, Garrido M, López M. Diseños de estudios epidemiológicos. Salud Publica Mex 2000;42:144-54. 5. MacMahon B, Trichopoulos D. Epidemiology: Principles and Methods. 2nd Ed. Boston: Lippincott Williams & Wilkins; 1996. 6. Sackett DL, Haynes RB, Guyatt GH, Tugwell P. Epidemiología clínica. Ciencia básica para la medicina clínica. 2ª Ed. Madrid: Editorial Médica Panamericana; 1994. 7. Fletcher RH, Fletcher SW, Wagner EH. Epidemiología clínica. 2ª Ed. Barcelona: Masson-Williams & Wilkins; 1998. 8. Locke III GRL, Talley NJ. The importance of epidemiology. In: GI Epidemiology. Massachussets, USA: BlackWell Publishing; 2007. 9. Talley NJ, Richter J. Nobel Prize in Medicine awarded to a gastroenterologist in 2005. Am J Gastroenterol 2006;101:211. 10. Purcell RH. The discovery of the hepatitis viruses. Gastroenterology 1993;104:995. 11. Drossman DA, Li Z, Andruzzi E, et al. U.S. householder survey of functional gastrointestinal disorders: prevalence, sociodemography, and health impact. Dig Dis Sci 1993;38:1569–80. 12. Talley NJ, Zinsmeister AR, Van Dyke C, et al. Epidemiology of colonic symptoms and the irritable bowel syndrome. Gastroenterology 1991;101:927–34. 13. Locke GR III, Talley NJ, Fett SL, et al. Prevalence and clinical spectrum of gastroesophageal reflux: a population-based study in Olmstead County, Minnesota. Gastroenterology 1997;112:1448–56. 14. A Gallup Organization National Survey. Heartburn across America. Princeton, NJ: Gallup; 1988. 15. Gralnek IM, Hays RD, Kilbourne A, et al. The impact of irritable bowel syndrome on health-related quality of life. Gastroenterology 2000;119:654–60. 16. Creed F, Ratcliffe J, Fernandez L, et al. Health-related qualify of life and health care costs in severe, refractory irritable bowel syndrome. Ann Intern Med 2001;134:860–8. 17. Drossman DA, Camilleri M, Mayer EA, et al. AGA technical review on irritable bowel syndrome. Gastroenterology 2002;123:2108–31. 12 CAPÍTULO 1 x LA IMPORTANCIA DE LA EPIDEMIOLOGÍA EN LOS TRASTORNOS FUNCIONALES DIGESTIVOS 18. Brandt LJ, Bjorkman D, Fennerty MB, et al. Systematic review on the management of irritable bowel syndrome in North America. Am J Gastroenterol 2002;97:7–219. 19. Mitchell CM, Drossman DA. Survey of the AGA membership relating to patients with functional gastrointestinal disorders. Gastroenterology 1987;92:1282–4. 20. Harvey RF, Mauad EC, Brown AM. Prognosis in the irritable bowel syndrome: a five-year prospective study. Lancet 1987;1:963–5. 21. Talley NJ, Gabriel SE, Harmsen WS, et al. Medical costs in community subjects with irritable bowel syndrome. Gastroenterology 1995;109:1736–41. 22. Graham DY, Smith JL, Patterson DJ. Why do apparently healthy people XVHDQWLDFLGVWDEOHWV"$P-*DVWURHQWHURO 23. Sandler RS, Everhart JE, Donowitz M, et al. The burden of selected digestive diseases in the United States. Gastroenterology 2002;122:1500-11. 24. National Heartburn Alliance. Survey 2000 results: a community perspective. 2000. [2015 Enero 14]. Disponible en: http://www.heartburnalliance. org/ survey2000.pdf 13 Capítulo 2 Generalidades y diseño del estudio SIGAME JOSÉ MARÍA REMES TROCHE 1. INTRODUCCIÓN En la última década ha habido importantes avances diagnósticos y terapéuticos que han permitido un mayor conocimiento de la fisiopatología de los trastornos funcionales digestivos (TFD) y determinar que son entidades clínicas heterogéneas con abordajes diagnósticos y opciones terapéuticas diversas. A pesar de la alta prevalencia a escala mundial, la información epidemiológica en nuestro país es limitada, y se ha enfocado primordialmente en el síndrome del intestino irritable (SII) y en la enfermedad por reflujo gastroesofágico (ERGE). Por ejemplo, en una revisión sistemática acerca del SII en México, solo se pudieron identificar 18 trabajos publicados (la mayoría en forma de resúmenes); se concluye que la prevalencia, características sociodemográficas, diagnóstico y utilización de recursos pueden ser similares a lo reportado en otros países.1 Respecto de la ERGE, una revisión sistemática cualitativa de 48 estudios demostró que esta enfermedad tiene una presentación clínica (típica y atípica) muy similar a lo reportado en la literatura mundial.2 Sin embargo, la mayoría de estos trabajos tiene una metodología no óptima (evidencia Tipo III); se concluye que la ausencia de estudios enfocados en aspectos epidemiológicos y pronósticos en la ERGE en nuestro país representa terreno fértil para la investigación clínica y epidemiológica. Con base en esta necesidad de contar con información epidemiológica, en marzo de 2013 se planteó el diseño de un estudio poblacional en nuestro país para tratar de determinar la prevalencia de los principales TFD. 2. POR QUÉ UN ESTUDIO POBLACIONAL SOBRE TFD EN MÉXICO Un factor determinante en la variabilidad de la prevalencia, características demográficas y presentación de los TFD es la localización del estudio.3 En otras palabras, en dónde fue realizado, cuál es el entorno y la situación de la población evaluada. Por ejemplo: la evaluación y los 17 JOSÉ MARÍA REMES TROCHE resultados obtenidos con pacientes que padecen TFD en hospitales, clínicas u hospitales de tercer nivel es completamente diferente a la obtenida en los sujetos que acuden a consulta con los médicos y servicios de primer contacto.4 De igual forma, la evaluación de sujetos que se encuentran en entornos limitados (por ejemplo: escuelas, universidades, empresas, etc.), no es la misma que la obtenida en lo que se considera la población general. El término “poblacional” (en inglés, population-based) se utiliza tradicionalmente para describir un estudio que implica una población general definida, a diferencia de los estudios en poblaciones cerradas (hospitales, escuelas, entre otras). Los estudios epidemiológicos tienen una necesidad tácita de basarse en las poblaciones, por lo que la mayoría de los estudios epidemiológicos pueden considerarse, en términos generales, como estudios “poblacionales”. El uso común de la palabra “poblacional” implica que el muestreo proviene de individuos de la población general de un país, con base en su conformación geopolítica. 3. DISEÑO DEL ESTUDIO SIGAME 3.1. Generalidades: el acrónimo SIGAME se obtuvo de: “SÍntomas GAstrointestinales en MÉxico”; éste se propuso por un grupo de investigadores del Instituto de Investigaciones Médico Biológicas de la Universidad Veracruzana y la Fundación SALUZ Investigación de la ciudad de Veracruz. Para ello se contó además con el apoyo del Laboratorio Asofarma de México en marzo de 2013. El planteamiento de realizar un estudio poblacional llevó al desarrollo de una herramienta electrónica vía una página web (Figura 1), que permitiera evaluar de forma dinámica, precisa y en tiempo real a individuos de población abierta provenientes de los diversos estados que conforman la República Mexicana. Dicha herramienta estuvo disponible en un servidor exclusivo para la realización del estudio y a través de esta página se aplicó una encuesta para evaluar las características demográficas y la prevalencia de los diversos TFD y síntomas gastrointestinales en México. La encuesta estuvo conformada por un cuestionario sociodemográfico que evaluó el sexo, la edad, la escolaridad, la zona geográfica y económica de donde provenía el individuo, y también 18 CAPÍTULO 2 x GENERALIDADES Y DISEÑO DEL ESTUDIO. SIGAME incluía el cuestionario modular Roma III (versión validada y autorizada para la realización del estudio con fecha 16 de abril de 2013)5 y los cuestionarios PAGI-SYM (Patient Assessment of Gastrointestinal Disorders Symptom Severity Index) y PAGI-QoL (Assessment of Upper Gastrointestinal Disorders-Quality of Life) (versión validada y autorizada el 18 de agosto de 2013).6,7 Una vez realizadas las pruebas pertinentes, la herramienta estuvo lista para usarse en septiembre de 2013. 3.2. Objetivos: el objetivo primario del estudio fue determinar la prevalencia de los trastornos y síntomas gastroesofágicos, duodenales y anorrectales en población abierta en México. Los objetivos secundarios incluyeron el determinar las características sociodemográficas, factores asociados y afección de la calidad de vida de los pacientes que sufren TFD en nuestro país. Aplicación de la encuesta: se capacitó a 78 encuestadores, los cuales eran trabajadores de la empresa ASOFARMA de México, quienes participaron de forma voluntaria y aplicaron la encuesta fuera de su horario laboral. Se mantuvo la privacidad de los encuestadores y se siguieron las normas regulatorias y éticas de la empresa. Todos los encuestadores recibieron una entrenamiento vía web, además de que en el servidor se diseñó un programa tutorial de ayuda. Los 78 encuestadores residen en diferentes áreas de la República Mexicana, con lo que se representó a todos los estados para la estructuración de las ocho zonas geográficas del país (Figura 2). La encuesta se aplicó del 1 de septiembre de 2013 al 31 de marzo de 2014. 3.3. Tipo de estudio y tamaño de la muestra: este estudio poblacional y transversal se realizó con base en el siguiente cálculo del tamaño de la muestra. En el año 2010, de acuerdo con el censo poblacional realizado por el Instituto Nacional de Estadística e Informática (INEGI), la República Mexicana tuvo 112,336,538 habitantes distribuidos en 31 estados y un distrito federal.8 Estas entidades se pueden dividir en ocho zonas geográficas (Figura 2). Anticipando una prevalencia de 10% a 20% de SII (el TFD más estudiado desde el punto de vista epidemiológico) con base en los estudios previos utilizando los criterios de Roma III en otras poblaciones,4,9-11 y considerando una precisión de 5% con un intervalo de confianza de 95% (IC 95%) se estimó que la muestra mínima necesaria era de 246 sujetos por área geográfica, lo que sugirió 19 JOSÉ MARÍA REMES TROCHE un tamaño total de la muestra de al menos 1,968 sujetos. Así pues, se decidió que ese fuera el tamaño de muestra mínimo, pero se incluyeron todos los sujetos que pudieran ser evaluados en el período que duró el estudio. La estrategia para la aplicación de la encuesta fue que de acuerdo con la conveniencia del encuestador se evaluaran sujetos en la población general, ya fuera en su casa, zonas aledañas a su residencia o en centros comerciales o plazas públicas. Se excluyó del estudio a mujeres embarazadas, menores de 18 años de edad, pacientes con patologías mayores, como cáncer, historia de cirugía abdominal mayor (excepto apendicectomía), o que no supieran leer ni escribir. 3.4. Análisis estadístico: la frecuencia de los TFD y los síntomas de forma individual se expresan en frecuencias relativas (%) con intervalos de confianza de 95%. Se realizó estadística descriptiva para las variables sociodemográficas como sexo, edad, estado civil, nivel de escolaridad y profesión. Se hizo un análisis comparativo considerando las ocho zonas geográficas y cuatro zonas económicas (Alta, Media-Alta, Media-Baja y Baja), según la clasificación propuesta por Kunz I et al (Figura 3).12 La comparación entre variables categóricas se realizó mediante prueba de ji-cuadrado y la prueba exacta de Fisher, y para las variables continuas se utilizó la prueba t de Student. Para la comparación entre más de tres grupos se utilizó la prueba de ANOVA con corrección de Bonferroni. De acuerdo con el análisis univariado y cuando se consideró apropiado se realizó un análisis mutlivariado de regresión logística multinomial. Se estableció significancia cuando el valor de p fue < .05 . El estudio fue aprobado por el Comité de Ética de la Fundación SALUZ Investigación. 4. RESULTADOS GENERALES DEL ESTUDIO Se evaluó un total de 3,925 sujetos, 2,227 mujeres (56.7%) y 1,698 hombres (43.3%). La edad promedio fue de 39.8 ± 13 años. La distribución de la muestra por zonas geográficas se muestra en la figura 4. Las zonas Oeste, Centro Sur y Noroeste fueron las que aportaron más sujetos al estudio, mientras que las zonas Suroeste, Sureste y Noreste fueron las que aportaron menos. Sin embargo, en todas las zonas se cumplió con el requerimiento prestablecido cuando se calculó el tamaño de la muestra (Cuadro 1). En la figura 5 se presenta 20 CAPÍTULO 2 x GENERALIDADES Y DISEÑO DEL ESTUDIO. SIGAME la distribución por zonas económicas. Dos terceras partes se ubicaron en las zonas económicas alta y media alta del país (66.9%). El cuadro 1 describe las características demográficas, socioeconómicas, ocupación y escolaridad de los sujetos evaluados. 5. CONSIDERACIONES DE LOS RESULTADOS GLOBALES PARA LOS SIGUIENTES CAPÍTULOS Es importante mencionar que a partir de estos resultados generales, en los siguientes capítulos se mostrarán las prevalencias de los síntomas y TFD de aquellos pacientes que cumplieron los criterios establecidos para los cuestionarios utilizados. En la mayoría de los capítulos (salvo en el de dispepsia), la base del análisis es 3,925 personas y el grupo control al que se hará referencia se obtiene de aquellos sujetos que NO cumplieron criterio para ningún TFD; es decir, pueden considerarse como sujetos “sanos” en la población general. También es importante remarcar el hecho de que aunque en este capítulo se encontraron diferencias significativas, esperables, entre algunas características demográficas, por ejemplo: más mujeres amas de casa, más hombres profesionistas, entre otras, en los futuros capítulos cuando se detecta significancia en el análisis multivariado, tales resultados fueron sometidos al análisis de regresión logística para descartar dependencia y covariabilidad. Así pues, si existe una duda respecto del tamaño y características de la muestra general en los siguientes capítulos, éste será la referencia del total de la población estudiada. 21 JOSÉ MARÍA REMES TROCHE Cuadro 1. Características sociodemográficas de la población estudiada SIGAME 2014 Total (n = 3,925) (%) Mujeres (n = 2,227) (%) Hombres (n = 1,698) (%) Zona geográfica 1. Noroeste 2. Noreste 3. Centro Norte 4. Oeste 5. Centro Sur 6. Suroeste 7. Este 8. Sureste 15.6 7.2 7.8 23.8 18.9 7.9 10.5 8.3 14.9 8.8 6.6 23.3 19.5 7.9 11.4 7.5 16.5 5.1 9.3 24.5 18.1 7.8 9.4 9.3 Zona económica con ingreso 1. Alto 2. Medio Alto 3. Medio 4. Bajo 38.1 28.8 19.1 14 30.4 36.7 18.3 14.6 26.7 40 20.1 13.1 Ocupación 1. Labores del hogar 2. Desempleado 3. Estudiante 4. Jubilado 5. Otro 6. Profesionista 21 2.4 11.4 5.8 19.7 35.5 36.1* 1.7 11.5 2.9 15.5 32 1.2 3.4 11.4 9.6* 25.3* 49.1* Escolaridad 1. Primaria 2. Secundaria 3. Preparatoria 4. Universidad 5. Otro 6.5 11.2 23.5 53.8 5 6.8 12.6 25 48.8 6.8* 6 9.3 21.6 60.4* 2.8 * p < .05 22 CAPÍTULO 2 x GENERALIDADES Y DISEÑO DEL ESTUDIO. SIGAME Figura 1. Herramienta electrónica utilizada en el estudio SIGAME 2014 La pantalla A) ilustra la página web desarrollada para el proyecto, la B) muestra las instrucciones y el objetivo planteado, las C) y D), algunos fragmentos de los cuestionarios utilizados para la realización de este estudio. Figura 2. Las ocho zonas geográficas de la República Mexicana SIGAME 2014 Noroeste Centro Norte Noreste Sureste Este Oeste Centro Sur Suroeste 23 JOSÉ MARÍA REMES TROCHE Figura 3. División de la República Mexicana en cuatro zonas económicas SIGAME 2014 o Alto Medio-Alto Medio-Bajo Bajo Fuente: Kunz et al, 1986.12 Figura 4. Distribución de la muestra global en las ocho zonas geográficas SIGAME 2014 Noroeste n=612 15.6% Noreste n=284 7.2% Centro Norte n=306 7.8% Sureste n=325 8.3% Este Oeste n=413 n=934 10.5% 23.8% Centro Sur n=742 18.9% 24 Suroeste n=309 7.9% CAPÍTULO 2 x GENERALIDADES Y DISEÑO DEL ESTUDIO. SIGAME Figura 5. Distribución de la muestra global en las cuatro zonas económicas SIGAME 2014 n=1497 n=1132 28.8% 38.1% o Alto Medio-Alto Medio-Bajo Bajo n=748 19.1% n=548 14% Con base en Kunz et al, 1986.12 REFERENCIAS 1. Huerta I, Valdovinos MA, Schmulson M. Irritable bowel syndrome in Mexico. Dig Dis 2001;19:251-7. 2. Remes-Troche JM, Rodríguez-González B, Valdovinos-Díaz MA. La enfermedad por reflujo gastroesofágico en México. Revisión Sistemática. Rev Gastroenterol Mex 2006;71:151-9. 3. Quigley EMM, Abdel-Hamid H, Barbara G, et al. A global perspective on irritable bowel syndrome: a consensus statement of the World Gastroenterology Organisation Summit Task Force on irritable bowel syndrome. J Clin Gastroenterol 2012;46:356–66. 4. Fang-Yuan Ch, Po-Hon Ch, Tzee-Chung W, et al. Prevalence of functional gastrointestinal disorders in Taiwan: questionnaire-based survey for adults based on the Rome III criteria. Asia Pac J Clin Nutr 2012;21:594-600. 5. Schmulson M, Remes-Troche JM, Vargas JA, et al. Low concordance between physycians clinical classification of IBS subtypes using IBS-Rome III criteria, Rome III derived from patients diaries and Rome II based on a structured questionnaire in subjects with active IBS. Gut 2009; 58 (Suppl II): A183. 25 JOSÉ MARÍA REMES TROCHE 6. Rentz AM, Kahrilas P, Stanghellini V, et al. Development and psychometric evaluation of the patient assessment of upper gastrointestinal symptom severity index (PAGI-SYM) in patients with upper gastrointestinal disorders. Qual Life Res 2004;13:1737-49. 7. de la Loge C, Trudeau E, Marquis P, et al. Cross-cultural development and validation of a patient self-administered questionnaire to assess quality of life in upper gastrointestinal disorders: the PAGI-QOL. Qual Life Res 2004;13:1751-62. 8. Instituto Nacional de Estadística y Geografía. México en Cifras. [2013 agosto 31] Disponible en: http://www3.inegi.org.mx/sistemas/mexicocifras/ 9. Saito YA, Schoenfeld P, Locke GR. The epidemiology of irritable bowel syndrome in North America: a systematic review. Am J Gastroenterol 2002;97:1910–5. 10. Canavan C, West J, Card T. The epidemiology of irritable bowel syndrome. Clin Epidemiol 2014;6:71-80. 11. Cremonini F, Talley NJ.Irritable bowel syndrome: epidemiology, natural history, health care seeking and emerging risk factors.Gastroenterol Clin North Am 2005;34:189-204. 12. Kunz I, Cortina M, Gonzalez Block MA. Socioeconomic, demographic and health regionalization of the Mexican Republic: an instrument for planning and research in primary health care. Salud Publica Mex 1986;28:681–98. 26 Capítulo 3 Epidemiología de la enfermedad por reflujo gastroesofágico FRANCISCO M. HUERTA IGA 1. INTRODUCCIÓN En las últimas décadas, la enfermedad por reflujo gastroesofágico (ERGE) ha evolucionado en forma rápida e importante. A nivel mundial se ha observado el aumento gradual y sostenido de su incidencia y de su prevalencia; se presenta como una entidad emergente en países en donde prácticamente era anecdótico encontrar estos casos. Pero no solo se ha registrado un aumento en el número de casos nuevos, sino también un cambio en las manifestaciones clínicas, consideradas anteriormente como típicas o clásicas de la enfermedad, al pasar de la pirosis y las regurgitaciones al dolor torácico y manifestaciones extraesofágicas, sobre todo en vías respiratorias y laringe. Lo que inicialmente parecía ser un simple problema anatómico ante la presencia de una hernia hiatal, o bien una alteración en la motilidad esofágica por la presión disminuida del esfínter esofágico inferior (EEI) se ha convertido en un problema complejo y heterogéneo en donde, además de lo anteriormente comentado, participan las uniones estrechas de las células del epitelio esofágico y la resistencia tisular particular de cada individuo, las relajaciones transitorias del EEI, la presencia del fenómeno de “bolsa ácida” en la unión esofagogástrica (UEG), las alteraciones de mecano y quimiorreceptores en el esófago, la hipersensibilidad esofágica y las posibles alteraciones de integración y procesamiento de toda esta información en el sistema nervioso central. Los recientes avances tecnológicos han permitido analizar la fisiopatología de la ERGE con más detalle, entenderla mejor y clasificar sus diferentes presentaciones clínicas. La endoscopia nos ayuda a establecer en forma rápida y sencilla la presencia de enfermedad erosiva y esófago de Barrett, así como de la variante no erosiva (ERNE). El uso de técnicas de magnificación, de filtros ópticos y digitales permite identificar cambios mínimos y tempranos en capilares y uniones celulares que antes se reportaban como normales con el 29 FRANCISCO M. HUERTA IGA uso de luz blanca. En la presentación no erosiva, el monitoreo del pH esofágico con cualquiera de sus técnicas permite establecer la presencia de una exposición esofágica anormal al ácido, así como la relación que guardan los síntomas del paciente con la presencia o ausencia de esta acidificación. El uso de técnicas para medir la resistencia eléctrica (impedancia) que ofrecen las membranas de las células del epitelio esofágico a los diversos estímulos intraluminales ha permitido establecer la presencia de reflujos no solamente ácidos, sino también débilmente ácidos o no ácidos, ya sean líquidos o gaseosos, así como su relación con los síntomas del paciente. Finalmente, la técnica de la manometría de alta resolución y los topogramas de presión que se construyen a partir de ella han dirigido nuestra atención de nueva cuenta a la hernia hiatal, las cruras diafragmáticas, la “bolsa ácida” en la unión esofagogástrica (UEG) y las alteraciones de las diferentes fases de la contracción esofágica normal en la fisiopatología de la ERGE: Con todo este vertiginoso cambio en conocimientos fisiopatológicos, la ERGE ha tenido algunos cambios a través del tiempo en la manera de definirla, desde los trabajos del taller de Genval,1 pasando por las guías y revisiones técnicas de las asociaciones Americana,2 Europea,3 Latinoamericana4 y Mexicana,5 hasta llegar al consenso de Montreal6 y los consensos mexicanos más recientes.7,8 Sin embargo, a pesar de ser numerosas y variadas, todas estas definiciones de la ERGE coinciden en tres aspectos fundamentales: 1) el regreso anormal del contenido del estómago y duodeno al esófago y faringe, 2) la generación de síntomas o complicaciones, y 3) la afectación importante en la calidad de vida de quien la padece. 2. EPIDEMIOLOGÍA GLOBAL La prevalencia de la ERGE está en una franca tendencia a la alza en todo el mundo, y aunque se pudiera argumentar sobre un posible sesgo en la interpretación de las publicaciones del tema, sobre todo en términos metodológicos al incluir en los estudios a pacientes que reportan un solo evento de pirosis o regurgitación a la semana, pacientes con dos o más eventos a la semana e incluso con presentación diaria, para los objetivos de esta revisión y con el objeto de estandarizar el análisis, 30 CAPÍTULO 3 x EPIDEMIOLOGÍA DE LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO solo se tomarán en cuenta los trabajos que consideran la presencia de síntomas una vez a la semana. En 2007, El-Serag9 demostró que la aparente tendencia al aumento en la incidencia de la ERGE en el mundo es una realidad. Utilizó el modelo de regresión de Poisson para analizar estudios poblacionales de pacientes con pirosis una vez a la semana, analizó también estudios que contemplaron a una misma población en diferentes periodos a lo largo del tiempo y, finalmente, estudios que tomaron en cuenta tanto los síntomas como la presencia de esofagitis en el primer y segundo niveles de atención. El modelo de Poisson aplicado a estudios realizados de 1982 a 2005 demostró una tendencia significativa a través del tiempo para el aumento de síntomas de reflujo en la población general (p < .0001). En forma particular, esta tendencia fue significativa en América del Norte (p = .0005) y Europa (p < .0001), pero no en Asia (p = .49). Por otra parte, en los estudios realizados a un mismo grupo de pacientes a lo largo del tiempo se observó la misma tendencia a la alza en Estados Unidos de América (EUA), Singapur y China, pero no en Suecia.9 Finalmente, se observó aumento en la prevalencia de ERGE y esofagitis en la mayoría de los estudios longitudinales revisados. Al analizar estas tendencias en un contexto geográfico, se evidenció que en el condado de Olmsted en Minnesota, EUA, en un trabajo publicado en 199210 se señaló pirosis semanal en 13.2% y regurgitaciones semanales en 6.5% de las personas encuestadas. En el mismo condado, pero en 2003, se envió un cuestionario sobre patología de tubo digestivo a adultos de entre 20 a 95 años de edad. De 54.2% de las personas que lo contestó, 18.1% reportó tener pirosis o regurgitaciones al menos una vez a la semana.11 En otras palabras, en un lapso de 9 años se observó el incremento de pirosis en la población abierta de este condado en casi 5%. En Europa la tendencia a la alza se confirma al comparar los datos publicados por Dent et al12 en 2005, cuando informaron una prevalencia de ERGE de entre 9.8% a 18%; con la actualización de este mismo estudio en 2014. El-Serag13 señaló un incremento por 8.8% a 25.9%, con un promedio ponderado de 15.2% y con mayor tendencia a la alza en los países de Europa del norte, comparados con los del sur. En Australia se cuenta con un estudio reciente que destaca la prevalencia de pirosis al menos una vez a la semana de 11.6%. 31 FRANCISCO M. HUERTA IGA En cuanto a los países del Lejano Oriente, la ERGE se comporta de manera distinta al occidente, ya que las cifras de prevalencia son bastante menores a las de EUA y Europa. En China, un estudio epidemiológico de 2007 en población rural y urbana de entre 18 a 80 años de edad14 se reportó pirosis al menos una vez a la semana en 1.8%, regurgitación al menos una vez a la semana de 4.2% y cualquiera de los dos síntomas en 5.2%. En otro estudio más reciente,15 las cifras se incrementaron a 2.2% para pirosis, 7% para regurgitación y 7.8% para cualquiera de los dos. En Corea del Sur se informan cifras muy similares: pirosis al menos una vez a la semana de 2%, regurgitación 2%, y cualquiera de las dos en 3.5%.16 Aun cuando históricamente las cifras epidemiológicas de la ERGE en el Lejano Oriente son bajas, se observa un comportamiento a la alza como en el resto del mundo, aunque de manera más discreta. En América Latina, el estudio con mejor calidad metodológica fue publicado en Argentina en 2005;17 en él se reporta pirosis al menos una vez a la semana en 16.9% de las personas encuestadas, regurgitación al menos una vez a la semana en 16.5% y cualquiera de los dos síntomas en 23%. 2.1. El incremento de la ERGE y su impacto: aun con la evidencia epidemiológica revisada hasta el momento, existe otra manera de ratificar el incremento real de los casos de ERGE en el mundo: el aumento en el número de casos de complicaciones de la misma, sobre todo del adenocarcinoma del esófago. La aparición y uso generalizado de los inhibidores de la bomba de protones (IBP), medicamentos de primera elección en el tratamiento de todas las variedades de la ERGE, ha permitido la anticipación de algunas de las complicaciones; sin embargo otras, como el esófago de Barrett y el adenocarcinoma del esófago, la complicación más temida de la ERGE, han aumentado. En cuanto a la estenosis esofágica, en el Sistema de Salud de los Veteranos de EUA,18 de 1998 a 2003 se ha señalado disminución en 12% de las estenosis pépticas del esófago y también la de la recurrencia de la estenosis a 1 año, de 36%. De igual manera, en el sistema Medicare,19 el decremento observado de 1992 a 2000 se señala en 11% para casos nuevos y 30% en la recurrencia a 1 año. Por el contrario, y a pesar del uso de IBP y el aumento inicial en el número de cirugías laparoscópicas 32 CAPÍTULO 3 x EPIDEMIOLOGÍA DE LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO para ERGE, el número de casos nuevos de Barrett se incrementó de 11 en 1996 a 23 por cada 100,000 pacientes en 2003,20 datos que se apoyan en otro estudio que informó un incremento de 15 casos en 1998 a 24 por 100,000 pacientes-año en 2006.21 De igual forma, de los estudios iniciales de Blot et al22 que en 1991 informaron sobre el aumento de adenocarcinoma del esófago al doble de la incidencia observada en el periodo de 1976 a 1987, para 2010 documentaron el incremento de hasta siete veces la cifra basal. Actualmente el adenocarcinoma del esófago se presenta en 2.6 casos por cada 100,000 pacientes-año en EUA.23 La razón por la que la ERGE y sus complicaciones han presentado este cambio en su epidemiología con franca tendencia a la alza en casi todo el mundo no es clara; sin embargo, algunos autores proponen que esto se relaciona con dos factores principales: la disminución en la prevalencia de infección por Helicobacter pylori (Hp) y el aumento en la prevalencia de sobrepeso y obesidad.24 El resultado de esta sinergia es un número cada vez mayor de personas que viven con reflujo crónico expuestas a la afectación permanente en su calidad de vida y a las complicaciones de la enfermedad. Por sí misma, la obesidad representa un factor de riesgo independiente para muchas patologías, pero en el caso de la ERGE un meta-análisis reciente relaciona a la adiposidad central con un riesgo de esofagitis erosiva de 1.87 (IC 95%, 1.51 a 2.31), esófago de Barrett 1.98 (IC 95%, 1.52 a 2.57) y adenocarcinoma del esófago 2.51 (IC 95%, 1.54 a 4.06).25 En cuanto a la participación del Hp en la ERGE, los informes iniciales fueron contradictorios. Sin embargo, algunos meta-análisis recientes han demostrado que las cepas cag-A de la bacteria tienden a ser protectoras en el desarrollo de esófago de Barrett26 y que el riesgo relativo para el adenocarcinoma de esófago es de .56 (IC 95%, .46 a .68) tomando en cuenta a todas las variantes bacterianas, y es aún más bajo para las cepas cag-A en .41 (IC 95%, .28 a .62).26 Además del implícito problema de salud que se genera por el incremento en la prevalencia de la ERGE y sus complicaciones, un aspecto frecuentemente ignorado por los médicos es la importante afectación a los sistemas de salud y su economía. En estadísticas estadounidenses de finales de la década de 1990, la ERGE representó un 33 FRANCISCO M. HUERTA IGA costo directo de 9.3 billones de dólares, de los que 63% correspondió a medicamentos, 27% a hospitalizaciones, 7% a consultas, 2% a visitas a domicilio y 1% a la atención en urgencias.27 En 2004, las ventas de IBP en los EUA llegaron a 10 billones de dólares; dos de ellos fueron de los cinco medicamentos más vendidos a nivel nacional y representaron 50.7% de las prescripciones para enfermedades del aparato digestivo, equivalente a 77.3% de los costos totales.28 A esto se suman los costos indirectos de la enfermedad: días de ausencia por consultas médicas, citas para realización de estudios y disminución en la productividad durante la jornada laboral. En términos generales, se calcula 41% de merma en la productividad, con un costo promedio de $237.00 dólares en un periodo de 3 meses e impacto económico de $3,441.00 dólares de costo total para la enfermedad, cuando se comparan sujetos con ERGE vs. personas sanas.29 3. EPIDEMIOLOGÍA EN MÉXICO La información sobre la epidemiología de la ERGE en México se basa principalmente en tres estudios. El primero, realizado por el grupo de López-Colombo30 en población abierta en el estado de Tlaxcala; utilizaron el cuestionario de Roma II para entrevistar a 500 personas. El 19.6% (IC 95%, 16.2% a 23.4%) de ellas manifestó pirosis. Schmulson31 informó sobre 40 pacientes que acudieron a la consulta particular en la ciudad de México. Utilizó el mismo cuestionario pero agregó endoscopia del tracto superior a 36 de ellos y monitoreo del pH esofágico durante 48 horas con cápsula Bravo a los cuatro restantes. La edad promedio fue de 44.5 ± 2.5 años, 62.5% mujeres y el IMC promedio fue de 25.5 ± .8 kg/m2. La pirosis fue reportada en 16 pacientes (40%) y en 10 (62.5%) de éstos se confirmó la ERGE por endoscopia, mientras que en quienes no informaron pirosis en el cuestionario, la endoscopia confirmó ERGE en cinco y la pH-metría en dos personas (29.2%). Finalmente, el estudio de Peralta-Pedrero32 aplicó el cuestionario de Carlsson-Dent a 400 personas mayores de 60 años de edad que acudieron al primer nivel de atención en la medicina institucional, demostró que 25% de los entrevistados presentaba ERGE (IC 95%, 21% a 29%). Con base en estos estudios se establece que la 34 CAPÍTULO 3 x EPIDEMIOLOGÍA DE LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO prevalencia de pirosis en México oscila entre 19.6% a 40%; las cifras más altas se registran en la población estudiada con un aparente mayor nivel socioeconómico. En resumen, al tomar en cuenta la presencia de al menos un evento de pirosis o regurgitación a la semana, la prevalencia de estos síntomas se señala de 18.1% a 27.8% en EUA, 8.8% a 25.9% en Europa, 2.2% a 7.8% en el Lejano Oriente, 11.6% en Australia, 23% en Argentina y de 19.6% a 40% en México. 4. RESULTADOS DEL ESTUDIO SIGAME Por lo anteriormente comentado, y ante la necesidad de contar con cifras epidemiológicas actualizadas para nuestro país, que aproximen con certeza a la realidad del problema y permitan diseñar programas de educación a población general y a los médicos, establecer estrategias para su diagnóstico y tratamiento tempranos y la prevención de complicaciones, se ha realizado esta encuesta nacional sobre síntomas funcionales digestivos con base en la metodología descrita en el Capítulo 2. A continuación se presentan algunos resultados relevantes en esta sección. 4.1 Prevalencia de síntomas en las últimas 2 semanas: de los 3,925 sujetos encuestados, 2,435 (62%) señalaron tener agruras durante el día en las últimas dos semanas, y 2,150 reportaron tener agruras durante la noche (54.8%). La intensidad de las diurnas se reportaron como muy leves o leves en 1,778 personas (45.3%), moderadas en 458 (11.7%) y severas o muy severas en 199 (5.07%). Las nocturnas fueron referidas por 2,150 personas (54.7%) y la intensidad fue muy leve o leve en 1,528 (38.9%), moderada en 431 (11%) y severa o muy severa en 191 (4.86%). La totalidad de los datos en forma desglosada se muestra en los cuadros 1 y 2. Con respecto al síntoma de amargura o sabor ácido o amargo en la boca, 2,078 personas (52.9%) tuvieron este síntoma en las últimas 2 semanas; de ellas, 1,571 (40%) las reportaron como muy leves o leves, 349 (8.9%) como moderadas y como severas o muy severas 158 (4%). Los datos completos se muestran en el cuadro 3. 35 FRANCISCO M. HUERTA IGA Cuadro 1. Agruras diurnas SIGAME 2014 Intensidad del síntoma n % 1,037 26.4 Leve 741 18.9 Moderado 458 11.7 Severo 174 4.4 Muy severo 25 .6 Sin síntomas 1,490 38.0 Muy leve Cuadro 2. Agruras nocturnas SIGAME 2014 Intensidad del síntoma 36 n % Muy leve 874 22.3 Leve 654 16.7 Moderado 431 11.0 Severo 161 4.1 Muy severo 30 .8 Sin síntomas 1,775 45.2 CAPÍTULO 3 x EPIDEMIOLOGÍA DE LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO Cuadro 3. Sabor amargo SIGAME 2014 Intensidad del síntoma n % Muy leve 969 24.7 Leve 602 15.3 Moderado 349 8.9 Severo 123 3.1 Muy severo 35 .9 Sin síntomas 1,847 47.1 Respecto a las regurgitaciones, 2,054 (52.3%) personas las reportaron durante el día al menos durante las últimas 2 semanas. Su intensidad fue estimada como muy leve o leve por 1,512 (73.6%), moderada en 378 (18.4%) y severa o muy severa en 164 (8%). Un total de 1,898 personas (48.4%) señalaron las regurgitaciones durante la noche al menos durante las últimas 2 semanas. La intensidad fue valorada como muy leve o leve por 1,401 (73.8%), moderada en 314 (16.5%) y severa o muy severa en 183 (9.6%). La totalidad de estos datos se presenta en los cuadros 4 y 5. 4.2. Características epidemiológicas de los pacientes con síntomas de ERGE: respecto al sexo de las personas encuestadas, los hombres refirieron mayor frecuencia de síntomas (63.7%) que las mujeres (60.8%); se observó significancia estadística para todos los síntomas estudiados, excepto para las agruras durante el día. La distribución de síntomas específicos por sexo se presenta en el cuadro 6. 37 FRANCISCO M. HUERTA IGA Cuadro 4. Regurgitaciones diurnas SIGAME 2014 Intensidad del síntoma n % Muy leve 979 24.9 Leve 533 13.6 Moderado 378 9.6 Severo 132 3.4 Muy severo 32 .8 Sin síntomas 1,871 47.7 Cuadro 5. Regurgitaciones nocturnas SIGAME 2014 Intensidad del síntoma 38 n % Muy leve 979 24.9 Leve 847 21.6 Moderado 314 8.0 Severo 144 3.7 Muy severo 39 1.0 Sin síntomas 2,027 51.6 CAPÍTULO 3 x EPIDEMIOLOGÍA DE LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO Cuadro 6. Síntomas reportados de acuerdo al sexo del encuestado SIGAME 2014 Sexo Agruras diurnas (%) Agruras nocturnas (%) Regurgitaciones diurnas (%) Regurgitaciones nocturnas (%) Sabor amargo (%) Hombre 63.7 58.7* 57.5* 53.7* 58.7* Mujer 60.8 51.8 48.4 44.3 48.6 *p < .05 (análisis univariado) La distribución geográfica del muestreo y los síntomas reportados en cada región se presentan en el cuadro 7. El análisis resulta muy complicado ya que en una misma región hubo estados con diferentes niveles de desarrollo socioeconómico, lo que hace la muestra muy heterogénea. Sin embargo, no hubo diferencia estadísticamente significativa entre la prevalencia en las diferentes zonas geográficas. Al analizar en forma particular el aspecto económico de las diferentes zonas en donde se levantaron las encuestas se observa la presencia de síntomas en favor de las zonas consideradas económicamente alta y media-alta; ello con asociación estadísticamente significativa, como se muestra en el cuadro 8. Cuando se toma en cuenta la ocupación de la persona encuestada, se observó significancia estadística para presentar síntomas solamente en los profesionistas, mientras que en las amas de casa, estudiantes, desempleados y jubilados la frecuencia fue baja (Cuadro 9). En cuanto a la escolaridad de las personas encuestadas, se observó aumento gradual en la frecuencia con el avance en la escolaridad. En quienes accedieron a la universidad, se alcanzó la mayor cifra (y con significancia estadística) (Cuadro 10). 39 FRANCISCO M. HUERTA IGA Cuadro 7. Síntomas reportados por región geográfica del encuestado SIGAME 2014 Zona geográfica Agruras diurnas (%) Agruras nocturnas (%) Regurgitaciones diurnas (%) Regurgitaciones nocturnas (%) Sabor amargo (%) Noroeste 16.1 16.4 15.2 16.1 17.7 Noreste 6.4 6.3 6.8 7.3 6.4 Centro Norte 7.0 6.1 5.5 5.6 6.0 Oeste 23.5 23.7 22.4 22.8 22.4 Centro Sur 22.3 22.6 22.7 21.9 22.0 Suroeste 7.2 6.8 8.9 7.4 7.8 Este 8.9 9.2 9.0 8.3 10.0 Sureste 8.6 8.9 9.6 10.5 9.6 Cuadro 8. Síntomas reportados según la situación económica del encuestado SIGAME 2014 Zona económica con base en ingreso Agruras diurnas (%) Agruras nocturnas (%) Regurgitaciones diurnas (%) Regurgitaciones nocturnas (%) Sabor amargo (%) Alto 34.0* 34.6* 34.6* 35.5* 32.4* MedioAlto 34.6* 34.2* 32.7* 32.8* 35.4* Medio 18.2 18.0 17.6 18.3 17.9 Bajo 13.2 13.2 15.1 13.4 14.3 *p < .001 (análisis multivariado) 40 CAPÍTULO 3 x EPIDEMIOLOGÍA DE LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO Cuadro 9. Síntomas reportados según la ocupación del encuestado SIGAME 2014 Agruras diurnas (%) Agruras nocturnas (%) Regurgitaciones diurnas (%) Regurgitaciones nocturnas (%) Sabor amargo (%) Ama de casa 22.8 22.3 22.3 22.9 21.2 Desempleado 3.3 3.3 3.5 3.6 3.7 Estudiante 7.6 9.1 6.7 6.2 7.7 Jubilado 6.4 6.8 7.2 7.4 8.2 Profesionista 41.1* 39.6* 42.1* 41.2* 40.6* Otro 18.9 18.8 18.3 18.7 18.6 Ocupación *p < .001 (análisis multivariado) Cuadro 10. Síntomas reportados según la escolaridad del encuestado SIGAME 2014 Agruras diurnas (%) Agruras nocturnas (%) Regurgitaciones diurnas (%) Regurgitaciones nocturnas (%) Sabor amargo (%) 8.1 9.0 9.0 9.6 9.5 Secundaria 12.4 12.6 11.9 12.6 12.9 Preparatoria 22.2 23.3 23.4 24.2 23.5 Universidad 52.0* 50.7* 51.2* 49.4* 49.3* 5.3 4.5 4.5 4.2 4.8 Escolaridad Primaria Otro *p < .001 (análisis multivariado) 41 FRANCISCO M. HUERTA IGA En resumen, con base en los datos analizados hasta el momento se confirma que los sujetos con síntomas de ERGE tuvieron significativamente mayor edad que los sujetos sin ERGE (edad promedio 42.6 años vs. 37.8 años, p = .0001). Al realizar análisis multivariado se demostró que los factores asociados a padecer síntomas de ERGE en México (p < .001), son: x 6H[RPDVFXOLQR x 9LYLUHQ]RQDHFRQÖPLFDDOWDRPHGLDDOWD x 3URIHVLRQLVWD x 3UHSDUDFLÖQXQLYHUVLWDULD 4.3. Prevalencia de síntomas de ERGE de acuerdo con los criterios de Roma III: dado que en esta revisión se han considerado solo a los pacientes que señalan pirosis o regurgitaciones al menos una vez la semana, la frecuencia para estos síntomas es de 12.1% (IC 95%, 11.09 a 1.3) en la población abierta encuestada en el país. Por otra parte, la frecuencia de síntomas en presentación diaria es de 1.2% (IC 95%, .09 a 1.3) y en presentación de al menos una vez al mes de 49.1% (IC 95%, de 47.5 a 50.6). Si se comparan estas cifras con los datos tradicionalmente reportados en los EUA para estos mismos periodos, tal parece que en nuestro país los síntomas de ERGE son más frecuentes (Figura 1). Figura 1. Frecuencia por días de los síntomas de ERGE en personas encuestadas SIGAME 2014 1,200 28.3% 1,000 22.6% 20.1% 800 18.2% 600 12.1% Al menos 1 vez por semana 400 6.1% 5.5% 200 0 42 1,109 886 637 788 238 218 Nunca Menos de una vez al mes Una vez al mes Dos o tres días al mes Más de un día a la semana Un día a la semana 1.2% 49 Todos los días CAPÍTULO 3 x EPIDEMIOLOGÍA DE LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO Es bien conocido que la pirosis puede coexistir con otros síntomas funcionales digestivos. Durante este estudio también se investigó la frecuencia de otros síntomas asociados a ERGE, como regurgitaciones, dolor torácico, náusea y vómito. Tomando en cuenta la presentación en al menos 1 día a la semana, la náusea fue el síntoma más frecuente con 16.9% (IC 95%, 15.7 a 18.1), seguida del dolor torácico con 15.3% (IC 95%, 14.1 a 16.4), las regurgitaciones con 11.02% (IC 95%, de 10.7 a 12.2) y el vómito con 4.05% (IC 95%, 3.4 a 4.69). Los datos completos se muestran en la figura 2. Figura 2. Porcentaje de síntomas en personas encuestadas SIGAME 2014 25 20 Dolor toracico 20 Nauseas 18 18 Regurgitaciones Vomito 15 12 13 12.5 11 10 10 7 6 5 4 3 2 2 .5 0 Menos de un día al mes Un día al mex 3 3 2.3 Un día a la semana 1.5 .5 Mas de un día a la semana .3 2 ó 3 días a la semana .9 .05 .02 Todos los días 4.4. Impacto en la calidad de vida: uno de los aspectos más importantes en los trastornos funcionales del aparato digestivo es el impacto que provocan en la calidad de vida del paciente. En esta investigación se comparó la afectación en la calidad de vida de las personas que informaron síntomas de ERGE, con personas consideradas como sanas. En los parámetros de actividad diaria, dificultad al vestirse, dieta, relaciones personales y manifestaciones psicológicas se demostró disminución en en este rubro de las personas que reportaron pirosis al 43 FRANCISCO M. HUERTA IGA menos una vez a la semana, comparado con las personas consideradas como sanas, todas con significancia estadística (Cuadro 11). Respecto al sexo de las personas encuestadas, los hombres reportaron mayor frecuencia de síntomas (63.7%) que las mujeres (60.8%); se observó significancia estadística para todos los síntomas estudiados, excepto para las agruras durante el día. Cuadro 11. Calidad de vida de los pacientes con ERGE vs. sanos, de acuerdo al PAGI-QoL SIGAME 2014 Parámetro evaluado sanos (n = 925) ERGE al menos una vez por semana (n = 505) Valor de p Puntaje Global 93.8 ± 17 75.3 ± 16 .001 Actividades diarias 95.2 ± 17 80.1 ± 17 .001 Vestido 91.2 ± 24 67.4 ± 23 .001 Dieta 93.16 ± 22 70.3 ± 21 .001 Relaciones 96.3 ± 18 83.9 ± 17 .001 Psicológicas 91.1 ± 17 68.28 ± 20 .001 Resultados expresados en promedio ± desviación estándar PAGI-QoL: Patient Assessment of Upper Gastrointestinal Disorders-Quality of Life 5. CONCLUSIÓN De acuerdo con los resultados obtenidos en la encuesta nacional SIGAME podemos confirmar que la ERGE es una enfermedad con una alta prevalencia en nuestro país, que se presenta con regurgitaciones como principal síntoma, seguido de la pirosis y de la presencia de sabor amargo en la boca. Los varones con estudios universitarios y profesionistas que viven en una zona económica media-alta y alta son los más afectados. La calidad de vida se afecta de forma considerable en los pacientes mexicanos que sufren de ERGE. 44 CAPÍTULO 3 x EPIDEMIOLOGÍA DE LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO REFERENCIAS 1. Dent J, Brun J, Fendrick Am, et al. An evidence-based appraisal of reflux disease management – the Genval Workshop Report. Gut 1999;44(Suppl 2):S1-S16. 2. Kahrilas PJ, Shaheen NJ, Vaezi M. American gastroenterological Association: Medical Position Statement on the Management of Gastroesophageal Reflux Disease. Gastroenterology 2008;135:1383-91. 3. Fuchs KH, Babic B, Breithaupt W, et al. EAES recommendations of the management of gastroesophageal reflux disease. Surg Endosc 2014;28:175373. 4. Cohen H, Tomasso G, Luisa Cafferata M, et al. Latin American Consensus in Gastroesophageal Reflux Disease: An Update on Therapy. Gastroenterol Hepatol 2010;33:135-47. 5. Uscanga L, Nogueira-de-Rojas JR, Gallardo E, et al. Gastroesophageal reflux disease. Gastroenterology Mexican Association Consensus. Mexican group for the GERD study. Rev Gastroenterol Mex 2002;67:216-23. 6. Vakil N, Van Zanten SV, Kahrilas P, et al. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterol 2006;101:1900-20. 7. Huerta-Iga F, Tamayo-de la Cuesta JL, Noble-Lugo A, et al. Consenso mexicano de enfermedad por reflujo gastroesofágico. Parte I. Rev Gastroenterol Mex 2012;77:193-213. 8. Huerta-Iga F, Tamayo-de la Cuesta JL, Noble-Lugo A, et al. Consenso mexicano de enfermedad por reflujo gastroesofágico. Parte II. Rev Gastroenterol Mex 2013;78:231-9. 9. El-Serag HB. Time trends of gastroesophageal reflux disease: A systematic review. Clin Gastroenterol Hepatol 2007;5:17-26. 10. Talley NJ, Zinsmeister Ar, Schleck CD, et al. Dyspepsia and dyspepsia subgroups: a population based study. Gastroenterology 1992;102:125968. 11. Jung HK, Halder S, McNally M, et al. Overlap of gastro-oesophageal reflux disease and irritable bowel syndrome: prevalence and risk factors in the general population. Aliment Pharmacol Ther 2007;26:453-61. 12. Dent J, El-Serag HB, Wallander Ma, et al. Epidemiology of gastrooesophageal reflux disease: a systematic review. Gut 2005;54:710-17. 13. El-Serag HB, Sweet S, Winchester CC, et al. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review. Gut 2014;63:87180. 14. Chen M, Xiong L, Chen H, et al. Prevalence, risk factors and impact of gastroesophageal reflux disease symptoms: a population-based study in South China. Scand J Gastroenterol 2005;40:759-67. 45 FRANCISCO M. HUERTA IGA 15. He J, Ma X, Zhao Y, et al. A population-based survey of the epidemiology of symptom-defined gastroesophageal reflux disease: the Systematic Investigation of Gastrointestinal Diseases in China. BMC Gastroenterol 2010;10:94. 16. Cho YS, Choi MG, Jeong JJ, et al. Prevalence and clinical spectrum of gastroesophageal reflux: a population-based study in Asan-si, Korea. Am J Gastroenterol 2005;100:747-53. 17. Chiocca JC, Olmos Ja, Salis GB, et al. Prevalence, clinical spectrum and atypical symptoms of gastro-esophageal reflux in Argentina: a nationwide population-based study. Aliment Pharmacol Ther 2005;22:331-42. 18. El-Serag HB. Temporal trends in new and recurrent esophageal strictures in Department of Veterans Affairs. Am J Gastroenterol 2006;101:1727-33. 19. El-Serag HB, Lau M. Temporal trends in new and recurrent esophageal strictures in a Medicare population. Aliment Pharmacol Ther 2007;25:12239. 20. Van Soest EM, Dieleman JP, Siersema PD, et al. Increasing incidence of Barrett’s oesophagus in the general population. Gut 2005;54:1062-6. 21. Corley DA, Kubo A, Levin TR, et al. Race, ethnicity, sex and temporal differences in Barrett’s oesophagus diagnosis: a large community-based study, 1994-2006. Gut 2009;58:182-8. 22. Blot WJ, Devesa SS, Kneller RW, et al. Rising incidence of adenocarcinoma of the esophagus and gastric cardia. JAMA 1991;265:1287-9. 23. Pohl H, Sirovich B, Welch Hg. Esophageal adenocarcinoma incidence: Are ZHUHDFKLQJWKHSHDN"&DQFHU(SLGHPLRO%LRPDUNHUV3UHY 70. 24. Fischbach LA, Nordenstedt H, Kramer JT, et al. The association between Barret’s esophagus and Helicobacter pylori infection: a meta-analysis. Helicobacter 2012;17:165-75. 25. Singh S, Sharma AN, Murad MH et al. Central adiposity is associated with increased risk of esophageal inflammation, metaplasia and adenocarcinoma: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2013;11:1399-412. 26. Islami F, Kamangar F. Helicobacter pylori and esophageal cancer risk: a meta-analysis. Cancer Prev Res 2008;1:329-38. 27. Rubenstein JH, Chen JW. Epidemiology of gastroesophageal reflux disease. Gastroenterol Clin North Am 2014;43:1-14. 28. Shaheen NJ, Hansen RA, Morgan DR, et al. The burden of gastrointestinal and liver diseases. Am J Gastroenterol 2006;101:2128-38. 29. Eslick GD, Talley NJ. Gastroesophageal reflux disease (GERD): risk factors and impact on quality of life – a population based study. J Clin Gastroenterol 2009;43:111-17. 46 CAPÍTULO 3 x EPIDEMIOLOGÍA DE LA ENFERMEDAD POR REFLUJO GASTROESOFÁGICO 30. López-Colombo A, Morgan D, Bravo-González D, et al. The epidemiology of functional gastrointestinal disorders in Mexico: a population-based study. Gastroenterol Res Pract 2012;2012:606174. 31. Schmulson M. Presencia de pirosis según Roma II en Español-México; obliga a descartar reflujo gastroesofágico. Rev Gastroenterol Mex 2009;74:74-6. 32. Peralta-Pedrero ML, Lagunes-Espinoza AL, Cruz-Avelar A, et al. Frecuencia de síntomas de ERGE en adultos mayores que acuden a una unidad de medicina familiar. Rev Med Inst Mex Seguro Soc 2007;45:447-52. 47 Capítulo 4 Otros trastornos esofágicos y gastroduodenales ANA TERESA ABREU Y ABREU 1. INTRODUCCIÓN Existen diversos síntomas esofágicos y gastroduodenales que pueden tener características similares a verdaderas entidades orgánicas sin que cumplan con criterios que demuestren como tal alguna enfermedad; es así que en un intento de racionalizar y ordenar algunos trastornos funcionales con manifestaciones gastrointestinales, basados en los síntomas y la posible localización anatómica, surgen los criterios del grupo de Roma.1 Publicados en el 2006, los criterios de Roma III son los criterios vigentes que caracterizan estas entidades funcionales,2 y en este capítulo se abordarán dentro de los trastornos esofágicos al dolor torácico de presunto origen esofágico, el globus y la disfagia funcional, así como dentro de los gastroduodenales a la rumiación, por ser entidades motivo frecuente de consulta. De igual manera se hará mención de la prevalencia de estas entidades en nuestro país, donde al igual que en otros reportes de la literatura se observa sobreposición de algunos síntomas cardinales en diversos trastornos funcionales.3 1.1. Dolor torácico de presunto origen esofágico. Se caracteriza por la presencia “inexplicable” en la línea media del pecho (retroesternal) de características viscerales y que se puede originar en el esófago. Es posible que se manifieste como sensación de opresión que se irradia hacia la mandíbula y brazo izquierdo, muy similar al dolor de origen cardíaco; en estos casos la historia clínica y la exploración física están obligadas inicialmente a descartar un origen cardíaco (angina), músculoesquelético, pulmonar o neurológico. De establecerse un origen no esofágico se termina con la evaluación del caso y se canaliza al manejo de la especialidad correspondiente.4,5 Antes de iniciar el abordaje del dolor torácico de posible origen esofágico, es vital considerar el riesgo de condiciones cardíacas debido a las implicaciones inherentes. La evaluación cardiológica puede incluir electrocardiograma, pruebas de esfuerzo con ejercicio, 51 ANA TERESA ABREU Y ABREU monitoreo Holter e incluso angiografía coronaria, dependiendo de las características de los síntomas y los factores de riesgo del paciente.6 Ante la sospecha de dolor torácico relacionado con reflujo está indicada una prueba con algún inhibidor de bomba de protones (IBP) dos veces al día por 2 semanas, o bien, cuando los hallazgos endoscópicos que justifiquen una condición esofágica dolorosa se terminaría el abordaje del dolor torácico funcional de probable origen esofágico, al corroborarse una entidad orgánica, como la esofagitis erosiva, esofagitis por cáusticos, esofagitis eosinofílica, infecciosa, o incluso la inducida por medicamentos.5-7 El monitoreo de pH, o pH-impedancia, debe llevarse a cabo tras suspender los IBP 1 semana antes, con el fin de obtener una adecuada evaluación de la exposición del contenido gástrico al esófago y valorar la correlación con la asociación de síntomas. La importancia de este estudio radica en que si se detecta exposición esofágica anormal al material ácido y su correlación positiva con los síntomas se establece el diagnóstico de enfermedad por reflujo gastroesofágico, aun en ausencia de lesiones endoscópicas visibles (ERGE no erosiva).4-7 Aún más, con la intención de establecer un diagnóstico certero de la causa de dolor torácico es necesaria la realización de un estudio de manometría esofágica (idealmente de alta resolución) para descartar la presencia de trastornos motores, como la acalasia clásica, espástica o con compresión, espasmo esofágico distal o esófago hipercontráctil.8 De acuerdo con los criterios diagnósticos de Roma III, un paciente sufre de dolor torácico funcional de origen presuntamente esofágico si cumple con todos los criterios siguientes: a) dolor torácico en la línea media sin manifestación de ardor, b) ausencia de pruebas que demuestren la presencia de reflujo ácido gastroesofágico como causa del síntoma, y c) ausencia de trastornos de la motilidad esofágica que tengan una base histopatológica. Los criterios anteriores deben estar presentes en los últimos 3 meses, con síntomas manifiestos al menos 6 meses antes del diagnóstico.2,5 Respecto del tratamiento, se han evaluado diversos agentes farmacológicos, como los antidepresivos tricíclicos a dosis bajas, inhibidores de la recaptura de serotonina y noradrenalina, inhibidores 52 CAPÍTULO 4 x OTROS TRASTORNOS ESOFÁGICOS Y GASTRODUODENALES selectivos de la recaptura de serotonina e incluso intervenciones no farmacológicas.9 1.2 Globo faríngeo. La palabra proviene del latín globus, que significa globo, esfera o pelota, y se utiliza para dar referencia a la sensación de un “nudo” o cuerpo extraño que ocupa a la garganta. Éste, a diferencia de la disfagia, se presenta en ausencia de la deglución, es episódico, no es doloroso, e incluso puede mejorar ante la misma deglución.2 En caso de que el síntoma de globus se asocie también a disfagia orofaríngea, el abordaje deberá estar encaminado a evaluar la disfagia, al igual que si esta sensación se presenta ante historia de tabaquismo, es constante, se asocia a disfunción laríngea o disfonía, requerirá de la valoración otorrinolaringológica con nasolaringoscopia e incluso estudios de imagen para descartar organicidad.2,4 La ERGE puede ser causa de globus, al igual que la presencia de mucosa gástrica ectópica en el esófago cervical o incluso las neoplasias esofágicas, por lo que debe realizarse panendoscopia con el fin de descartar algunas de estas causas.10 Se han propuesto como posibles factores desencadenantes al reflujo, la disfunción laríngea y faríngea, los trastornos de la motilidad, incluyendo la disfunción del esfínter esofágico superior, así como a hipersensibilidad visceral y los factores psicológicos.11,12 Los criterios de Roma III que definen el globus son: a) sensación no dolorosa, persistente o intermitente de un bulto o cuerpo extraño en la garganta, b) presencia de sensación entre comidas, c) ausencia de disfagia u odinofagia, d) ausencia de evidencia de que el reflujo sea el causante del síntoma, e) ausencia de un trastorno motor esofágico, y f) síntomas presentes en los últimos 3 meses y presentes al menos 6 meses previos al diagnóstico.2,4,9 Las opciones terapéuticas para el globo faríngeo se basan en los posibles mecanismos fisiopatogénicos, y los ensayos clínicos aleatorizados existentes se basan en esto; pero difieren en las definiciones y en las técnicas usadas y no son completamente comparables. Ante la duda de que la ERGE sea la causante del síntoma se recomienda la prueba terapéutica con IBP. La amitriptilina en dosis bajas puede mejorar los síntomas y la calidad de vida en algunos pacientes. Entre las terapias alternativas se cita la relajación con asistencia hipnótica, así como terapias del habla y del lenguaje y la psicoterapia.10 53 ANA TERESA ABREU Y ABREU 1.3. Disfagia funcional. El término disfagia se usa para describir la sensación de dificultad en el paso del bolo a través del cuerpo del esófago. Ésta puede ser a alimentos sólidos, lo que sugiere una alteración estructural, o bien, tanto a sólidos como a líquidos, lo que hace pensar en un trastorno motor esofágico, por lo que también es importante conocer si esta sensación se presenta a nivel proximal o distal, así como su progresión. El interrogatorio y la exploración del paciente deben buscar causas no esofágicas, como tumoraciones cervicales, bocio, o hallazgos neurológicos. Si se sospecha disfagia funcional, ésta se excluye ante la evidencia de una alteración no esofágica o una lesión estructural en la panendoscopia, o en un estudio de videofluoroscopia. Debido a que la disfagia es un síntoma común en una multitud de trastornos esofágicos inflamatorios y estructurales, su detección excluye siempre una entidad funcional.2 En caso de ausencia de lesiones endoscópicas visibles, se deben obtener biopsias para evaluar la posibilidad de esofagitis eosinofílica (mínimo cinco), una entidad que se caracteriza por disfagia e impactación alimentaria.13,14 Si no se encuentran alteraciones estructurales se recomienda la realización de estudios manométricos (de preferencia de alta resolución), ya que puede discriminar entre trastornos motores generadores de disfagia, como cualquiera de las tres variantes de acalasia, y el espasmo esofágico distal. Si este estudio tiene disponible el análisis del tránsito esofágico mediante impedanciometría, ésta puede aportar más datos en relación con el grado de aclaramiento del bolo y su tránsito en el esófago.8,15,16 Los criterios diagnósticos de Roma III para disfagia funcional son: a) sensación de que los alimentos sólidos o líquidos se atoran, alojan o pasan de manera anormal a través del esófago, b) ausencia de evidencias de que el reflujo gastroesofágico sea la causa del síntoma, c) ausencia de trastornos de la motilidad esofágica que tengan una base histopatológica, y d) los criterios se satisfacen durante los últimos 3 meses con síntomas presentes al menos 6 meses antes del diagnóstico.2,5 No hay estudios clínicos que hayan evaluado los tratamientos de la disfagia funcional. Habitualmente se utiliza un enfoque empírico con moduladores del dolor y antidepresivos, como los tricíclicos, 54 CAPÍTULO 4 x OTROS TRASTORNOS ESOFÁGICOS Y GASTRODUODENALES pregabalina, y los inhibidores de recaptura de serotonina. Dado que la disfagia funcional es un trastorno benigno debe reafirmarse este concepto, aconsejando evitar comidas que puedan desencadenar los síntomas y masticar bien los alimentos.9 1.4. Rumiación. Es un fenómeno que ocurre en animales como ovejas, corderos, camellos, que tienen estómagos compartamentalizados en varias cámaras; en ellos el alimento regresa a la boca del estómago proximal por una peristalsis retrógrada que se coordina con una relajación del esfínter esofágico inferior, los animales mastican el bolo por una segunda vez y vuelven a deglutirlo; con este proceso se ayuda en la digestión y la absorción reduciendo el tamaño de las partículas alimentarias. Sin embargo, cuando este síndrome sucede en humanos se refiere a la entidad clínica caracterizada por el esfuerzo abdominal repetitivo, que regurgita el alimento recientemente ingerido a la boca, es por tanto un acto voluntario o inconsciente que no va precedido ni de náusea ni de arqueo. Si bien fue un síndrome inicialmente descrito en niños con alteraciones conductuales, actualmente se le ubica en pacientes de cualquier edad, con cualquier habilidad cognitiva, pero más frecuentemente en mujeres.17 Los criterios de Roma III para adultos, adolescentes y niños incluyen cualquiera de los dos siguientes: a) regurgitación persistente o recurrente de alimento recientemente ingerido hacia la boca con la expulsión (al escupir), o bien remasticación y deglución; b) la regurgitación no va precedida de arqueo. Apoyan estos criterios: a) eventos de regurgitación no precedidos por náusea, b) cese del proceso cuando el material regurgitado se percibe ácido, y c) el contenido regurgitado es alimentario y con sabor agradable.2,17 A esta entidad habitualmente no se le da la importancia clínica que merece y, en ocasiones, se le cataloga como ERGE y se confunde a la rumiación con simple regurgitación. El abordaje diagnóstico incluye demostrarle al paciente el mecanismo de incremento abdominal voluntario que obliga a la relajación del esfínter esofágico inferior (EEI). En el monitoreo de pH-impedancia de 24 horas puede observarse el trazo característico de un patrón errático de ida y vuelta y la redeglución, sin evidencia de reflujo ácido. En la manometría se puede observar el incremento de la presión intragástrica que precede un flujo retrógrado 55 ANA TERESA ABREU Y ABREU intraesofágico cuando se analizan los canales de impedancia, así como las aperturas del EEI y del esfínter esofágico superior (EES).17 La principal acción del tratamiento es explicar al paciente la condición, del hábito, los mecanismos inherentes a la conducta y modificación de la conducta y hábito. Puede inducirse respiraciones diafragmáticas y hay reportes de un pequeño grupo que no revierten el hábito, que mejoran con una funduplicatura tipo Nissen. 2. EPIDEMIOLOGÍA GLOBAL 2.1. Dolor torácico de presunto origen esofágico. Aunque no se conoce con precisión cuál es la prevalencia de esta entidad, se estima que es un trastorno frecuente, ya que entre 15% a 30% de los casos que van a coronariografías por dolor torácico no muestran anormalidad cardíaca alguna.18 Sin embargo, estos datos pueden estar subestimados, ya que es raro que a un paciente menor de 40 años de edad se le realice una coronariografía. Aunque esta fue una entidad inicialmente descrita en mujeres de edad avanzada, un estudio en población abierta en los Estados Unidos de América (EUA) demostró que afecta por igual a hombres y mujeres, y que es más común (casi el doble) en población entre los 15 y 34 años de edad, que en población mayor de 45 años.19 2.2. Globo faríngeo. Contrario a lo que se pensaría, la sensación de globo faríngeo es bastante frecuente, y este síntoma puede estar presente entre 7% y 46% de individuos “aparentemente” sanos, con una incidencia pico entre la cuarta y quinta décadas de la vida, y las mujeres consultan con mayor frecuencia por esta molestia que los hombres.19-21 Este síntoma puede representar hasta 4% de las consultas en los servicios de otorrinolaringología.22 2.3. Disfagia funcional. Hay muy poca información respecto de la epidemiología de este síntoma. En una encuesta general sobre trastornos funcionales digestivos en población abierta, entre 7% y 8% tuvo disfagia que no era explicada por alguna causa orgánica aparente y más de la mitad de estos sujetos había acudido a consulta por dicha molestia.20 Más recientemente, en un estudio que validó los criterios de Roma II en Asia .6% de 102 sujetos tuvo disfagia funcional.23 De acuerdo con estos escasos informes, la disfagia funcional sería el trastorno funcional menos frecuente en la población. 56 CAPÍTULO 4 x OTROS TRASTORNOS ESOFÁGICOS Y GASTRODUODENALES 2.4 Rumiación. No hay evidencia acerca de la epidemiología de la rumiación en población adulta y, en general, se considera como un trastorno extremadamente raro. Es más común en niños, adolescentes y sujetos con discapacidad mental. Por ejemplo, en un estudio de 2,163 niños se determinó que 5.1% cumplía con criterios para este trastorno.24 3. EPIDEMIOLOGÍA EN MÉXICO En México hay reportes que indican la prevalencia de estos trastornos funcionales esofagogástricos, considerados como raros. En el primer estudio, 324 sujetos sin síntomas gastrointestinales (en la ciudad de México) fueron invitados a participar en el llenado del cuestionario modular de Roma II y se encontró 8.3% (IC 95% 5.7 a 11.9) de frecuencia para dolor torácico de presunto origen esofágico, 4.6% (IC 95% 2.6 a 7.5) para globo faríngeo, 2.5% (IC 95% 1.1 a 4.8) para disfagia funcional y 1.2% (IC 95% .3 a 3.1) para rumiación.25 En el estudio más reciente que incluyó a 500 personas de una población de Tlaxcala (también usando criterios de Roma II), se encontró 3% (IC 95% 1.7 a 4.9) de frecuencia para dolor torácico de presunto origen esofágico, 1.8% (IC 95% .8 a 3.4) para globo faríngeo, 1.8% (IC 95% .8 a 3.4) para disfagia funcional y .8% (IC 95% .2 a 2.0) para rumiación.26 4. RESULTADOS DEL ESTUDIO SIGAME 4.1. Dolor torácico de presunto origen esofágico. Del total de la muestra evaluada 72 sujetos (1.9%, IC 95% 1.5 a 2.42) cumplieron con los criterios de Roma III. Con base en el análisis univariado, de acuerdo con los síntomas esofágicos y las características sociodemográficas, la edad promedio para los sujetos que sufren de dolor torácico fue de 41.4 ± 11.9. El 61% de los casos se presentó en mujeres y las zonas de mayor prevalencia fueron Oeste y Centro Sur de la República Mexicana (Cuadro 1). Al efectuarse la regresión nominal se encontró que los pacientes con este tipo de dolor torácico tienen más edad (p < .001) y provienen de la zona Centro Sur (p = .049) del país, en comparación con el grupo control. No hubo diferencias en cuanto a 57 ANA TERESA ABREU Y ABREU las otras variables demográficas, ni una ocupación particular que los identifique. En cuanto a la calidad de vida que llevan estos pacientes, según la encuesta PAGI-SYM, se encontró que el deterioro en la calidad de vida de estos pacientes se observa en la puntuación global con 76 ± 27, con mayor impacto en vestido, dieta y afectación psicológica en: 63 ± 23, 77 ± 21 y 68.13 ± 20, respectivamente, con un valor estadísticamente significativo de p < .05 (Cuadro 2). 4.2. Globo faríngeo. Solo 26 sujetos (.6%, IC 95% .4 a .9) pudieron ser clasificados con síntomas de globus de acuerdo con los criterios de Roma III. El 65.4% estuvo constituido por mujeres y 34.6%, por hombres (proporción 2:1), sin un predominio de zona geográfica específica, aunque sí con un nivel socioeconómico medio (50%) y la mayoría con estudios de licenciatura (76.9%); estos últimos datos fueron significativos en el análisis univariado (Cuadro 1). Respecto de la calidad de vida, ésta es significativamente menor, de forma global, cuando se compara con la población control (Cuadro 2). 4.3. Disfagia funcional. La prevalencia para este trastorno funcional fue de 3.4% (n = 134, IC 95% 2.8 a 4.0). De igual forma que en los trastornos esofágicos anteriores, 63% de los casos fue de mujeres (Cuadro 1). De acuerdo con los análisis uni y multivariado, los factores sociodemográficos asociados fueron el vivir en zona geográfica Centro Sur, en zona económica Medio Alto y el ser desempleado (Cuadro 1). 4.4. Rumiación. Solo 19 sujetos tuvieron rumiación, según criterios de Roma III (.5%, IC 95% .3 a .8). El 52.6% fue de mujeres, la edad promedio fue 43.7 ± 12, y con mayor frecuencia en el nivel socioeconómico bajo (52.6%) (Cuadro 1). En el análisis univariado se observó que pacientes con rumiación son mujeres de mayor edad, amas de casa y viven en zona económica de nivel bajo (p < .001). De acuerdo con la encuesta de calidad de vida PAGI-SYM, la rumiación es un trastorno funcional que afecta significativamente la calidad de vida de forma global, las actividades diarias, la vestimenta, la dieta y la esfera psicológica (p < .05, Cuadro 2). 58 CAPÍTULO 4 x OTROS TRASTORNOS ESOFÁGICOS Y GASTRODUODENALES Cuadro 1. Análisis univariado de acuerdo con los síntomas esofágicos y las características sociodemográficas SIGAME 2014 DTNC (n=72) Disfagia (n=134) Globus (n=26) Rumiación (n=19) Controles (n=1,110) 41.4 ± 11.9* 35 ± 16* 32 ± 7.6* 43.7 ± 12* 37.6 ± 12 (%) 39 61 (%) 37 63 (%) 34.6 65.4* (%) 44.4 52.6 (%) 58.7 * 48.6 Zona geográfica 1. Noroeste 2. Noreste 3. Centro Norte 4. Oeste 5. Centro Sur 6. Suroeste 7. Este 8. Sureste 8 3 5 32* 26* 2 16 8 15.7 4.5 6 27.6 29.1* 5.2 11.9 0 15.4 7.7 15.4 38.5 7.7 0 7.7 7.7 26.3 10.5 0 10.5 0 42.1* 10.5 0 15.7 6.4 6.0 22.4 22 7.8 10 9.6 Zona económica con ingreso 1. Alto 2. Medio Alto 3. Medio 4. Bajo 28 40 23 8 32.8 46.3 5.2* 15.7 15.4 50* 34.6 0 10.5 36.8 0 52.6* 32.4* 35.4* 17.9 14.3 Ocupación 1. Ama de casa 2. Desempleado 3. Estudiante 4. Jubilado 5. Otro 6. Profesionista 24 0 8 0 32* 35 20.1 0 21.6* 2.2 24.6 31.3 23.1 0 26.9 7.7 11.5 30.8 42.1* 0 0 0 10.5 47.4 21.2 3.7 7.7 8.2 18.6 40.6* Escolaridad 1. Primaria 2. Secundaria 3. Preparatoria 4. Universidad 5. Otro 5 18 20 54 8 7.5 6.7 35.1 48.5 2.2 7.7 0 7.7 76.9* 7.7 0 0 42.1* 57.9* 0 9.5 12.9 23.5 49.3* 4.8 Edad x+RPEUH x0XMHU * p < .001 DTNC = dolor torácico no cardíaco 59 ANA TERESA ABREU Y ABREU Cuadro 2. Calidad de vida de los pacientes que sufren trastornos funcionales esofágicos, de acuerdo con PAGI-SYM SIGAME 2014 Sanos (n=925) DTNC (n=72) Disfagia (n=134) Globus (n=26) Rumiación (n=19) Puntaje Global 93.8 ± 17 76 ± 27* 82 ± 11* 85 ± 9* 83 ± 12* Actividades diarias 95.2 ± 17 80.9 ± 17 86 ± 17* 90 ± 14 80 ± 22 * Vestido 91.2 ± 24 63 ± 23* 71 ± 23* 86 ± 15 77 ± 26* Dieta 93.16 ± 22 77 ± 21* 80 ± 12* 84 ± 18 78 ± 12 * Relaciones 96.3 ± 18 87.6 ± 17 90 ± 15 90 ± 14 93 ± 14 Psicológicas 91.1 ± 17 68.13 ± 20* 77 ± 14 * 69 ± 13 71 ± 18 * *p < .05 DTNC = dolor torácico no cardíaco 5. CONCLUSIONES El dolor torácico de presunto origen esofágico pareciera no ser una entidad frecuente ni de alta prevalencia; al menos en nuestro país parece afectar más a mujeres que a hombres en una proporción de 2:1, al igual que la mayoría de los trastornos funcionales, sin predominio de estrato socioeconómico, pero sí genera deterioro en la calidad de vida en la puntuación global, afectando más a la población de la tercera y cuarta década de la vida. El globus y la rumiación son los trastornos funcionales menos frecuentes. El globus, al igual que los otros trastornos esofágicos, es más frecuente en mujeres, mientras que la rumiación es una entidad donde no hay diferencias en cuanto al sexo. La disfagia funcional parece no ser tan infrecuente como en otras poblaciones, pero siempre debiera descartarse organicidad mediante estudios. 60 CAPÍTULO 4 x OTROS TRASTORNOS ESOFÁGICOS Y GASTRODUODENALES REFERENCIAS 1. Drossman DA, Richter JE, Talley NJ, et al. The functional gastrointestinal disorders: diagnosis, patophysiology and treatment. McLean, VA: Degnon Associates; 1994. 2. Drossman DA. The functional gastrointestinal disorders and the Rome III process. Gastroenterology 2006;130:1377-90. 3. Locke GR, Zinsmeister A, et al. Overlap of gastrointestinal symptom complexes in a US comunity. Neurogastroenterol Motil 2005;17:29-34. 4. Galmiche JP, Couse RE, et al. Functional esophageal disorders. Gastroenterology 2006;130:1459-65. 5. Kharilas P, Smout A. Algoritmos de la fundación de Roma para diagnóstico de síntomas gastrointestinales comunes. Rev Gastroenterol Mex 2010;75:453-62. 6. Fenster PE. Evaluation of chest pain: a cardiology perspective for gastroenterologists. Gastroenterol Clin North Am 2004;33:35-40. 7. Mudjpalli RS, Remes-Troche JM, et al. Functional chest pain: esophgeal or overlapping functional disorder. J Clin Gastroenterol 2007;41:264-9. 8. Bredenoord AJ, Fox M, Kahrilas PJ, et al. International High Resolution Manometry Working Group. Chicago classification criteria of esophageal motility disorders defined in high resolution esophageal pressure topography. Neurogastroenterol Motil 2012;24(Suppl 1):57-65. 9. Amarasinghe G, Sifrim D. Functional esophageal disorders: Pharmacological options. Drugs 2012;74:1335-44. 10. Harar RP, Kumar S, Saeed MA, et al. Management of globus pharyngeus: review of 699 cases. J Laryngol OtoI 2004;118:522-7. 11. Chung IY, Levine MS, Weinstein GS, et al. Globus sensation: findings on videofluoroscopic examinations. Can Assoc Radiol J 2003;54:35-40. 12. Takwoingi YM, Kale US, Morgan DW. Rigid endoscopy in globus SKDU\QJHXVKRZYDOXDEOHLVLW"-/DU\QJRO2WR, 13. Mackenzie SH, Go M, Chadwick B, et al. Eosinophilic oesophagitis in patients presenting with dysphagia-a prospective analysis. Aliment Pharmacol Ther 2008;28:1140-6. 14. Prasad GA, Talley NJ, Romero Y, et al. Prevalence and predictive factors of eosinophilic esophagitis in patients presenting with dysphagia: a prospective study. Am J GastroenteroI 2007;102:2627-32. 15. Fox MR, Bredenoord AI. Oesophageal high-resolution manometry: moving from research into clinical practice. Gut 2008;57:405-23. 16. Langmore SE. Evaluation of oropharyngeal dysphagia: which diagnostic WRROLVVXSHULRU"&XUU2SLQ2WRODU\QJRO+HDG1HFN6XUJ 61 ANA TERESA ABREU Y ABREU 17. Tack J, Blondeau K, Boecxstaens V, Rommel N. Review article: the pathophysiology, differential diagnosis and management of rumination syndrome. Aliment Pharmacol Ther 2011;33:782-8. 18. Kemp HG, Vokonas PS, Cohn PF, et al. The angynal syndrome associated with normal coronary arteriograms. Report of a six year experience. Am J Med 1973;54:735-42. 19. Drossman DA, Li Z, Andruzzi E, et al. U.S householder survey of functional gastrointestinal disorders. Prevalence, sociodemography and health impact. Dig Dis Sci 1993;38:1569-80. 20. Locke GR, Talley NJ, Fett SL, et al. Prevalence and clinical spectrum of gastroesophageal reflux: a population-based study in Olmstead County, Minnesota. Gastroenterology 1997;112:1448-56. 21. Batch AJG. Globus pharyngeus (part I). J Laryngol Otol 1988;102:152-8. 22. Moloy P, Charter R. The globus symptom. Incidence, therapeutic response, and age and sex relationships. Arch Otolaryngol 1982;108:740-4. 23. Kwan AC, Bao TN, Chakkaphak S, et al. Functional gastrointestinal disorders, validation of Rome II criteria for functional gastrointestinal disorders by factor analysis of symptoms in Asian patient sample. J Gastroenterol Hepatol 2003;18:796-802. 24. Rajindrajith S, Devanarayana NM, Crispus-Perera BJ. Rumination syndrome in children and adolescents: a school survey assessing prevalence and symptomatology. BMC Gastroenterol 2012;12:163. 25. Schmulson M, Ortiz O, Santiago-Lomelí M, et al. Frequency of functional bowel disorders among healthy volunteers in Mexico City. Dig Dis 2006;24:342-7. 26. López-Colombo A, Morgan D, Bravo-González D, et al. The epidemiology of functional gastrointestinal disorders in Mexico: A population-based study. Gastroenterol Res Pract 2012;2012:606174. 62 Capítulo 5 Epidemiología de los síntomas dispépticos RAMÓN ISAÍAS CARMONA SÁNCHEZ 1. INTRODUCCIÓN El término dispepsia se refiere a la presencia de malestar o dolor crónico y recurrente en la porción alta del abdomen.1 El malestar se ha definido como una sensación negativa, no necesariamente dolorosa, que puede incorporar una variedad amplia de síntomas. Éstos incluyen molestia, distensión, saciedad temprana, plenitud tardía, eructos, náusea o vómito y pueden ser continuos o intermitentes.2 La dispepsia comprende un conjunto de síntomas que pueden presentarse sin causa evidente o como manifestación de diversas enfermedades y es un problema frecuente de consulta en la práctica diaria. A pesar de su elevada frecuencia, el conocimiento de la epidemiología y de la prevalencia real de la dispepsia ha sido limitado debido a dos problemas prácticos: la definición del problema y la sobreposición sintomática con otras entidades. Se han empleado distintas definiciones para describir a la dispepsia, todas ellas obtenidas en forma arbitraria y por consenso. El empleo indistinto de las mismas ha generado confusión y es una de las principales causas de la amplia variabilidad en la prevalencia informada de este trastorno a nivel mundial. El término dispepsia no investigada se usa para describir a los pacientes que aún no han sido sometidos a estudios diagnósticos. El término dispepsia orgánica se refiere a los que ya han sido sometidos a estudios diagnósticos y en quienes se ha comprobado la presencia de patología orgánica, sistémica o metabólica como origen de sus síntomas. Por el contrario, el término dispepsia funcional (antes conocida como dispepsia no ulcerosa) se refiere a los pacientes con dispepsia sin evidencia de patología orgánica, sistémica o metabólica. Existen múltiples criterios de diagnóstico que se han utilizado para definir la presencia de la dispepsia funcional, los más conocidos han sido desarrollados por la Fundación de Roma en sus diferentes versiones. Los criterios de Roma III definen a la dispepsia funcional como la presencia de uno o más de los siguientes síntomas: plenitud posprandial o llenura, saciedad temprana, dolor epigástrico o ardor 65 RAMÓN ISAÍAS CARMONA SÁNCHEZ epigástrico en ausencia de enfermedad estructural que pueda explicar los síntomas, incluyendo la realización de una endoscopia superior.3 La dispepsia abarca a un grupo heterogéneo de enfermos con manifestaciones clínicas y mecanismos fisiopatológicos diferentes que, por lo tanto, podrían requerir tratamientos diferenciados. Sin embargo, en la práctica clínica ha sido especialmente difícil lograr la identificación de estos subgrupos. Durante mucho tiempo el enfoque ha sido detectar y tratar el “síntoma predominante” con la intención de que esto permita agrupar a los casos con factores fisiopatológicos subyacentes similares que puedan responder a tratamientos específicos; por ejemplo: inhibidores de la acidez gástrica en pacientes con ardor epigástrico o procinéticos en pacientes con plenitud posprandial.3 Desafortunadamente, el abordaje del “síntoma predominante” tiene claras desventajas, ya que el alivio de la molestia principal no garantiza la respuesta del resto de los síntomas, las manifestaciones clínicas de la dispepsia son fluctuantes a lo largo del tiempo y existe una gran sobreposición con otros malestares.4 Los criterios de Roma III proponen cambiar el concepto del “síntoma predominante” por el del “complejo de síntomas” mediante la identificación del grupo de molestias que se presentan en conjunto en forma consistente, para establecer un perfil.5 Así, la presencia de plenitud y llenura caracterizan al síndrome de distrés posprandial y la presencia de dolor y ardor caracteriza al síndrome de dolor epigástrico y se reconoce que ambos síndromes pueden coexistir.3,5 Esta clasificación ha logrado identificar algunos factores de riesgo comunes en los diferentes grupos, lo que posiblemente indique la existencia de fenómenos fisiopatológicos comunes que pueden convertirse en blancos terapéuticos.6 En México desconocemos la prevalencia de estos subgrupos en personas con dispepsia, así como la magnitud de la sobreposición, si es que existe. La eficacia práctica de esta clasificación ha sido puesta en duda debido a que estudios recientes han demostrado que ambos síndromes se traslapan en la mayoría de los casos,7 que la efectividad de los tratamientos no parece ser diferente entre los subgrupos8 y que esta clasificación no indica ninguna diferencia en la fisiopatogenia ni parece predecir la respuesta al tratamiento.9 66 CAPÍTULO 5 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS DISPÉPTICOS Pero la sobreposición no se da únicamente entre los diferentes grupos de la dispepsia, sino entre la dispepsia y otros síndromes digestivos, hecho que es muy común en la práctica diaria. Se debe ser cuidadoso al establecer la presencia de síntomas en cada paciente, pues la dispepsia puede ser la manifestación de una gran variedad de padecimientos del aparato digestivo;4 por ejemplo: la distensión es un síntoma característico del síndrome de intestino irritable (SII) y puede no estar localizado en forma exclusiva en la parte alta del abdomen. La pirosis se observa en una elevada proporción de pacientes con dispepsia y, de la misma forma, muchos pacientes con enfermedad por reflujo presentan síntomas dispépticos. La náusea que se observa con frecuencia en la dispepsia puede ser una manifestación de enfermedades extradigestivas. Por esa razón ninguno de estos tres síntomas debe ser considerado como dispepsia cuando se presentan en forma aislada o predominante. A pesar del uso de definiciones consensuadas se acepta que una proporción variable de pacientes con dispepsia puede tener esofagitis erosiva, úlcera péptica y neoplasias gástricas.10 En este libro el lector podrá encontrar un capítulo específico acerca de la sobreposición de los trastornos funcionales digestivos. Es bien sabido que los trastornos del aparato digestivo, especialmente los funcionales, deterioran la calidad de vida de los enfermos y la dispepsia no es la excepción. El impacto de estos padecimientos puede incluso ser mayor que el causado por enfermedades orgánicas potencialmente graves, especialmente en pacientes con síntomas moderados y severos atendidos en centros de referencia.11 El impacto es de tal magnitud que reducirlo, e idealmente evitarlo, se ha convertido en un objetivo del tratamiento de estas enfermedades. Una revisión sistemática de la literatura demostró una menor calidad de vida en pacientes con dispepsia funcional moderada y grave que buscaban atención médica, en comparación con controles sanos.12 Este estudio también demostró que la respuesta terapéutica favorable en relación con el malestar o dolor resultaba en la correspondiente mejoría en la calidad de vida. Existen varios estudios en México que evalúan la calidad de vida de pacientes con enfermedades digestivas, especialmente SII, pero poco se ha investigado respecto de la dispepsia. En un estudio realizado en un hospital de referencia de la ciudad de México, cuyo objetivo fue evaluar el cambio en la calidad de vida luego de la erradicación de 67 RAMÓN ISAÍAS CARMONA SÁNCHEZ Helicobacter pylori en pacientes con dispepsia funcional, no se encontró una mejoría significativa luego de la eliminación de la bacteria.13 Es evidente que queda mucho por conocer en relación con el impacto de la dispepsia en la calidad de vida en nuestro medio. La dispepsia también genera elevados costos para los enfermos, sus comunidades y los sistemas de salud.14 En nuestro país se han publicado estudios que evidencian el efecto económico negativo que tienen algunos trastornos funcionales, especialmente el síndrome del intestino irritable, pero en nuestro conocimiento no existen estudios al respecto en relación con la dispepsia. 2. EPIDEMIOLOGÍA GLOBAL La dispepsia es probablemente el síndrome digestivo más común en la población general. Se calcula que aproximadamente de 10% a 40% de la población adulta en países occidentales sufre o ha sufrido dispepsia, aunque solo la mitad de los enfermos busca atención médica.15 La prevalencia de la dispepsia no investigada varía considerablemente en diferentes poblaciones y, aunque estas variaciones pueden deberse a diferencias epidemiológicas genuinas, también es cierto que las distintas definiciones utilizadas contribuyen a tal discrepancia. En un meta-análisis reciente que incluyó más de 100 informes y más de 300 mil sujetos, Ford et al16 evidenciaron que la prevalencia informada de la dispepsia variaba de acuerdo al país entre 1.8% y 57%, y de acuerdo con la definición, entre 16% y 22%. Los estudios que emplean como definición de la dispepsia “dolor abdominal alto” muestran una prevalencia de 7% a 34%.17 Esta prevalencia es menor en países asiáticos (7% a 8%), intermedia en países escandinavos y en Estados Unidos de América (EUA) (14% a 26%), y alta en la India y Nueva Zelanda (> 30%). En países latinoamericanos, como Brasil, se ha informado una prevalencia de 20% en la población general empleando la definición de “distensión” o “hinchazón abdominal”.18 En un estudio realizado en Argentina con más de 800 sujetos para quienes se utilizó como definición “dolor o malestar abdominal en la parte central del abdomen” se encontró prevalencia de 43.2%.19 Cuando se emplea una definición más amplia, como “síntomas digestivos altos”, la prevalencia de dispepsia no investigada varía de entre 20% a 45%.20-28 Aun empleando 68 CAPÍTULO 5 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS DISPÉPTICOS definiciones estructuradas con criterios clínicos las diferencias son notables. Los estudios que han usado los criterios de Roma I para definir la presencia de la dispepsia han señalado prevalencias que varían entre 18% y 38%; en los que aplican Roma II la prevalencia es de alrededor de 24%17 y con Roma III se informa prevalencia de entre 5.3% y 11.9% en Asia.29,30 La verdadera prevalencia de la dispepsia funcional en población general no ha sido adecuadamente estudiada debido a las dificultades que implica buscar y descartar enfermedades orgánicas en grandes grupos de población. Sin embargo, de acuerdo con algunos estudios se puede estimar que la prevalencia global real de la dispepsia funcional varía entre 11% y 29%.17 3. EPIDEMIOLOGÍA DE LA DISPEPSIA EN MÉXICO La prevalencia de dispepsia ha sido poco estudiada en nuestro país y la mayoría de los estudios se han realizado en poblaciones específicas, lo que impide tener una idea clara de la magnitud del problema. Por ejemplo: en un estudio hecho con el objetivo de conocer la prevalencia de síntomas gastrointestinales en pacientes con sobrepeso y obesidad, los investigadores aplicaron una encuesta en 1,139 voluntarios que fueron divididos, según su índice de masa corporal, en sujetos con peso normal (controles), con sobrepeso y obesidad.31 Los resultados de este estudio mostraron una prevalencia de “ardor o vacío epigástrico” en 30% de los sujetos con peso normal, en 36% de los pacientes con sobrepeso y en 37% de los obesos. El “dolor epigástrico” tuvo una prevalencia de 22%, 23% y 25%, respectivamente; mientras que la “plenitud posprandial precoz” se observó en 17%, 21% y 31%, respectivamente. En este estudio todos los síntomas dispépticos, al igual que los síntomas de reflujo gastroesofágico y la mayor producción de gases intestinales, fueron significativamente más frecuentes en pacientes obesos. A pesar de lo anterior, existen estudios de buena calidad realizados en grupos amplios de población. Un estudio retrospectivo que incluyó 1,021 sujetos (61% mujeres) universitarios y asistentes a una clínica de gastroenterología y a un hospital general en la ciudad de México, en quienes se aplicó el cuestionario de Roma II en su versión en español 69 RAMÓN ISAÍAS CARMONA SÁNCHEZ se encontró una prevalencia de dispepsia no investigada de 4%.32 La prevalencia de síndrome de intestino irritable encontrada en este estudio fue muy superior y se determinó en 28%. En un estudio llevado a cabo en 324 estudiantes universitarios de la ciudad de México, en quienes se aplicó el cuestionario modular de Roma II para conocer la prevalencia de todos los trastornos funcionales digestivos, se encontró una prevalencia de dispepsia no investigada de 8%, muy por debajo de la prevalencia de la pirosis no investigada (35%), del SII (35%) y del estreñimiento funcional (19%), por mencionar solo algunos de los trastornos detectados.33 Otro estudio realizado mediante una encuesta directa, utilizando el cuestionario modular de Roma II aplicado casa por casa en 500 sujetos que conformaron una muestra representativa del estado de Tlaxcala, se encontró una prevalencia de dispepsia no investigada de 7%.34 Nuevamente, aunque 58.4% de los entrevistados tuvo criterios para al menos un trastorno funcional digestivo, la dispepsia quedó muy por debajo de la pirosis y del SII, que mostraron prevalencias de 19.6% y 16%, respectivamente. La información utilizando los criterios de Roma III había sido hasta ahora más limitada, ya que los estudios realizados se han presentado solo en forma de resúmenes. En un trabajo realizado en Mexicali, BC, en el que los investigadores encuestaron a 1,004 sujetos en población abierta se encontraron criterios de dispepsia no investigada en 683, con prevalencia de 68%.35 Más recientemente, en una pequeña encuesta aplicada a población abierta en Cosamaloapan, Veracruz, empleando los mismos criterios se encontró una prevalencia de dispepsia no investigada de 26%.36 Aunque en ambos estudios los autores hacen una buena descripción de las características de los enfermos con dispepsia, no se obtuvo información respecto de otros trastornos digestivos, que permitiera establecer comparaciones. Respecto de la dispepsia funcional, en México no existen estudios de calidad que permitan conocer la prevalencia de este trastorno. Los estudios publicados analizan grupos pequeños, muy específicos, con metodología y criterios diversos, lo que hace difícil establecer la prevalencia real. 70 CAPÍTULO 5 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS DISPÉPTICOS Muchos de los estudios epidemiológicos realizados hasta ahora han intentado establecer factores de riesgo para el desarrollo de dispepsia, pero esto ha resultado difícil en algunos rubros. Diversos estudios han demostrado mayor frecuencia de dispepsia en distintos grupos de edad, pero dichas diferencias no han sido consistentes, aun cuando se hayan hecho en países de la misma región del mundo, por lo que hasta ahora no existe un punto de corte en la edad que pueda definirse como factor de riesgo para el desarrollo de dispepsia.17 Cabe recordar que la dispepsia afecta a todas las edades y existen criterios específicos en la versión de Roma III para definir este trastorno en niños de 4 a 18 años de edad.3 En la práctica clínica la mayoría de los enfermos asocia sus síntomas dispépticos con el consumo de algún alimento específico. Dado que el picante es un elemento común en la dieta de países como el nuestro y algunos de Asia, podría pensarse que la dispepsia sería más frecuente en estas zonas geográficas. Por el contrario, la dispepsia es ubicua y afecta en proporción similar a las poblaciones de todo el mundo. Si bien existen estudios que relacionan la dispepsia con el consumo de bebidas altas en cafeína37 esta asociación es controversial,38 por lo que hasta el momento no es posible establecer algún patrón dietético o el consumo de algún componente específico de la dieta como factor de riesgo para el desarrollo de la dispepsia.17 Tampoco ha sido posible determinar predominancia de algún grupo étnico o relación con el estado socioeconómico en la presentación de la dispepsia.17 Por el contrario, algunos de los factores que se han encontrado en forma predominante y consistente en pacientes con dispepsia son el sexo femenino, el tabaquismo, la infección por Helicobacter pylori y el consumo de antiinflamatorios no esteroideos (AINE). Sin embargo, es necesario aclarar en este punto que los factores de riesgo son diferentes en la dispepsia no investigada y en la dispepsia funcional. El sexo femenino y la presencia de factores psicológicos subyacentes son muy importantes en la dispepsia funcional, en la que frecuentemente se observa sobreposición con otros trastornos funcionales digestivos.39 En contraste, factores ambientales y del estilo de vida, como el tabaquismo, el consumo de AINE y la infección por Helicobacter pylori parecen ser más relevantes en dispepsia no investigada, posiblemente 71 RAMÓN ISAÍAS CARMONA SÁNCHEZ por la presencia de enfermedades orgánicas subyacentes en algunos casos. 4. RESULTADOS DEL ESTUDIO SIGAME De los 3,925 sujetos encuestados en el estudio SIGAME se incluyeron 3,398 para el análisis de los síntomas dispépticos: 1,936 mujeres (57%) y 1,462 hombres (43%). La edad promedio de este grupo fue de 39.8 ± 13 años. La presencia e intensidad de los síntomas dispépticos en las 2 semanas previas (utilizando el cuestionario de síntomas digestivos PAGI-SYM) a la entrevista, de acuerdo al instrumento, se muestran en el cuadro 1. Mil ochocientos ochenta y dos sujetos (55.4%) refirieron haber tenido la sensación de malestar abdominal alto, mientras que 1,813 (53.6%) informaron haber presentado dolor epigástrico en las 2 semanas previas a la entrevista. De forma similar, 2,303 sujetos (67.8%) manifestaron haber tenido sensación de distensión abdominal por arriba del ombligo, mientras que 2,289 (67.4%) informaron la necesidad de aflojarse la ropa por la presencia de síntomas dispépticos. Dos mil treinta y dos sujetos (59.8%) manifestaron sensación de plenitud y llenura excesiva en las 2 semanas previas a la entrevista, mientras que 1,549 (45.6%) informaron ser incapaces de terminar sus alimentos de forma regular. De los 3,398 sujetos entrevistados, 1,414 informaron haber tenido náusea (41.6%), 989 (29.1%) sufrieron arqueadas y 807 (23.7%) refirieron haber tenido vómitos en las últimas 2 semanas. Finalmente, 1,485 sujetos entrevistados (43.7%) refirieron sufrir de pérdida del apetito en las últimas 2 semanas por la presencia de síntomas digestivos. Todos los síntomas dispépticos explorados mediante el cuestionario estructurado fueron más prevalentes en mujeres que en hombres, pero solo el malestar y el dolor epigástrico, la distensión abdominal por arriba del ombligo, la necesidad de aflojarse la ropa, la incapacidad para terminar el alimento, la presencia de náuseas y la pérdida del apetito alcanzaron significancia estadística. 72 CAPÍTULO 5 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS DISPÉPTICOS Cuadro 1. Presencia e intensidad de los síntomas dispépticos en las 2 semanas previas a la entrevista (utilizando el cuestionario de síntomas digestivos PAGI-SYM) SIGAME 2014 Intensidad del síntoma Grave Muy grave % (n) Hombre % (n) Mujer % (n) Muy leve – leve % (n) Moderado % (n) Malestar abdominal alto (n = 1,882) 40.4 (761) 59.6* (1,121) 75.9 (1,429) 18.0 (339) 6.0 (114) Dolor epigástrico (n = 1,813) 39.9 (724) 60.1* (1,089) 71.0 (1,289) 19.3 (350) 9.6 (174) Distensión abdominal por arriba del ombligo (n = 2,303) 40.5 (933) 59.5* (1,370) 65.7 (1,513 19.7 (454) 14.6 (336) Aflojarse la ropa (n = 2,289) 40.7 (932) 59.3* (1,357) 66.2 (1,515) 21.2 (485) 12.6 (289 43.3 (880) 56.7 (1,152) 71.8 (1,459) 17.7 (844) 10.5 (213) Incapacidad para terminar alimento (n = 1,549) 39.1 (605) 60.9* (944) 74.6 (1,156) 18.5 (286) 6.9 (107) Náusea (n = 1,414) 38.9 (550) 61.1* (864) 79.9 (1,130) 16.6 (235) 3.5 (49) Arqueadas (n = 989) 42.6 (421) 57.4 (568) 80.4 (795) 15.9 (157) 3.7 (37) Vómito (n = 807) 43.1 (349) 56.9 (458) 87.0 (702) 9.7 (78) 3.3 (27) Pérdida de apetito (n = 1,485) 41.3 (613) 58.7* (872) 78.7 (1,168) 14.4 (214) 6.9 (103) Plenitud y llenura excesiva (n = 2,032) *p <.05 73 RAMÓN ISAÍAS CARMONA SÁNCHEZ Cuadro 2. Características sociodemográficas de los pacientes con dispepsia funcional (Roma III) SIGAME 2014 DF (n = 409) Controles (n = 1,110) 36.6 ± 25 37.6 ± 12 % 38.6 61.4* % 58.7 * 48.6 17.4 3.9 6.1 27.6* 25.7* 1.2* 16.9 1.2 15.7 6.4 6.0 22.4 22 7.8 10 9.6 32 41 15.4 11.5 32.4 35.4 17.9 14.3 Ocupación 1. Ama de casa 2. Desempleado 3. Estudiante 4. Jubilado 5. Otro 6. Profesionista 29.1* 4.2 12.7 10.5 19.6 24 21.2 3.7 7.7 8.2 18.6 40.6 Escolaridad 1. Primaria 2. Secundaria 3. Preparatoria 4. Universidad 5. Otro 14.4 15.6 22 40.8 7.1 9.5 12.9 23.5 49.3 4.8 Edad x+RPEUH x0XMHU Zona geográfica 1. Noroeste 2. Noreste 3. Centro Norte 4. Oeste 5. Centro Sur 6. Suroeste 7. Este 8. Sureste Zona económica con ingreso 1. Alto 2. Medio Alto 3. Medio 4. Bajo * p < .05 74 CAPÍTULO 5 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS DISPÉPTICOS La intensidad de los síntomas fue calificada como muy leve o leve en la gran mayoría de los síntomas y solo la distensión abdominal por arriba del ombligo, la necesidad de aflojarse la ropa y la plenitud y llenura excesiva fueron calificados como graves o muy graves por más de 10% de los encuestados. La prevalencia de dispepsia funcional no investigada (basada en ausencia de datos de alarma), de acuerdo con los criterios de Roma III, fue de 12% (n = 409, IC 95%,10.9 a 13.7). Las características sociodemográficas se muestran en el cuadro 2. De acuerdo con estos datos el perfil del paciente con dispepsia funcional es una mujer, ama de casa, con escolaridad más baja en comparación con el grupo control y probablemente habitante del suroeste de México. Al aplicar los criterios de Roma III para establecer los subgrupos de la dispepsia, 142 (34.6%) sujetos tuvieron criterios del síndrome de distrés posprandial, 236 (57.8%) tuvieron síndrome de dolor epigástrico y 31 (7.6%), de ambos subtipos (Figura 1). Figura 1. Prevalencia de los diferentes subtipos de dispepsia funcional (Roma III) SIGAME 2014 250 236 Número de casos 200 150 142 100 50 31 637 238 0 Síndrome de distrés posprandial Síndrome de dolor epigástrico Ambos 75 RAMÓN ISAÍAS CARMONA SÁNCHEZ La calidad de vida de los pacientes con dispepsia fue menor en comparación con sujetos sanos, de acuerdo con el PAGI-QoL, y las diferencias se muestran en la figura 2. Los pacientes con síndrome de distrés posprandial y dolor en epigastrio obtuvieron puntuaciones similares en el instrumento PAGI-QoL, pero la puntuación fue significativamente menor en enfermos con sobreposición de ambos subtipos (Figura 3). Total PAGI-QoL Figura 2. Calidad de vida de los pacientes con dispepsia vs. sanos, según el PAGI-QoL SIGAME 2014 Sanos 76 Dispepsia CAPÍTULO 5 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS DISPÉPTICOS Total PAGI-QoL Figura 3.Subtipos de dispepsia funcional y puntaje total PAGI-QoL SIGAME 2014 Distrés posprandial Dolor epigástrico Ambos Suptipo de Dispepsia 5. CONCLUSIONES El estudio SIGAME es el trabajo de investigación que incluye al mayor número de sujetos hasta ahora realizado en México. A diferencia de estudios similares previamente publicados, este trabajo permite tener información de la población que habita la mayor parte del territorio nacional. De acuerdo con los datos obtenidos en el estudio SIGAME, una elevada proporción de la población mexicana presenta síntomas dispépticos. El malestar abdominal y el dolor epigástrico se observaron en más de la mitad de los sujetos, mientras que la distensión abdominal, la plenitud y la llenura fueron informadas por 2 de cada 3 entrevistados. Todos los síntomas dispépticos fueron más prevalentes en mujeres, pero solo el malestar y el dolor epigástrico, la distensión abdominal, la 77 RAMÓN ISAÍAS CARMONA SÁNCHEZ necesidad de aflojarse la ropa, la incapacidad para terminar el alimento, las náuseas y la pérdida del apetito alcanzaron significancia estadística. La intensidad de los síntomas fue calificada como muy leve o leve en la mayoría de los síntomas, pero 1 de cada 10 sujetos refirió que la distensión abdominal, la necesidad de aflojarse la ropa y la plenitud excesiva fueron graves o muy graves. La prevalencia de dispepsia no investigada de acuerdo con los criterios de Roma III fue de 12% en el presente trabajo. Pero el estudio SIGAME aporta por primera vez información a gran escala sobre la prevalencia de los subgrupos que integran la dispepsia. De acuerdo con los resultados, 34.6% de los sujetos tiene síndrome de distrés posprandial, 57.8% tiene síndrome de dolor epigástrico y ambos grupos coexisten en 7.6% de los casos. Finalmente, cabe destacar que por primera vez contamos con información objetiva acerca del impacto de la dispepsia no investigada en la calidad de vida de pacientes mexicanos. Utilizando el cuestionario PAGI-QoL, el estudio SIGAME demostró que la calidad de vida de los pacientes con dispepsia fue menor que la de sujetos sanos y que dentro de la dispepsia los pacientes con sobreposición de los subtipos de dispepsia tienen la peor calidad de vida. REFERENCIAS 1. Ford AC, Moayyedi P. Current guidelines for dyspepsia management. Dig Dis 2008;26:225–30. 2. Bielsa-Fernández MV, Aguilera-Carrera J, Manrique MA, et al. Guías clínicas de diagnóstico y tratamiento de la dispepsia. Epidemiología, definición, clasificación. Rev Gastroenterol Mex 2007;72:286-7. 3. Drossman DA. Rome III: The functional gastrointestinal disorders. 3rd ed. MacLean, VA: Degnon Associates; 2006. 4. Fujiwara T, Arakawa T. Overlap in patients with dyspepsia/functional dyspepsia. J Neurogastroenterol Motil 2014;20:447-57. 5. Tack J, Talley NJ, Camilleri M, et al. Functional gastroduodenal disorders. Gastroenterology 2006;130:1466-79. 6. Fang YJ, Liou JM, Chen CC, et al. Distinct aetiopathogenesis in subgroups of functional dyspepsia according to the Rome III criteria. Gut 2014. doi: 10.1136/gutjnl-2014-308114. [Publicación electrónica previa a la impresa]. 7. Vakil N1, Halling K, Ohlsson L, Wernersson B. Symptom overlap between postprandial distress and epigastric pain syndromes of the Rome III dyspepsia classification. Am J Gastroenterol 2013;108:767-74. 78 CAPÍTULO 5 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS DISPÉPTICOS 8. Hsu YC, Liou JM, Yang TH, et al. Proton pump inhibitor versus prokinetic therapy in patients with functional dyspepsia: is therapeutic response predicted by Rome III subgroups" J Gastroenterol 2011;46:183-90. 9. Ochi M, Tominaga K, Tanaka F, et al. Clinical classification of subgroups according to the Rome III criteria cannot be used to distinguish the associated respective pathophysiology in Japanese patients with functional dyspepsia. Intern Med 2013;52:1289-93. 10. Faintuch JJ, Silva FM, Navarro-Rodriguez T, et al. Endoscopic findings in uninvestigated dyspepsia. BMC Gastroenterol 2014;14:19. 11. Chang L. Review article: epidemiology and quality of life in functional gastrointestinal disorders. Aliment Pharmacol Ther 2004;20 (Suppl 7):31-9. 12. El-Serag HB, Talley NJ. Health-related quality of life in functional dyspepsia. Aliment Pharmacol Ther 2003;18:387-93. 13. Ladrón de Guevara L, Peña-Alfaro NG, Padilla L, et al. [Evaluation of the symptomatology and quality of life in functional dyspepsia before and after Helicobacter pylori eradication treatment]. Rev Gastroenterol Mex 2004;69:203-8. 14. Moayyedi P, Mason J. Clinical and economic consequences of dyspepsia in the community. Gut 2002;50 (Suppl 4): iv10-2. 15. El-Serag HB, Talley NJ. Systematic review: the prevalence and clinical course of functional dyspepsia. Alimen Pharmacol Ther 2004;19:643-54. 16. Ford AC, Marwaha A, Sood R, Moayyedi P. Global prevalence of, and risk factors for, uninvestigated dyspepsia: a meta-analysis. Gut 2014 Aug 21 [Publicación electrónica previa a la impresa]. 17. Mahadeva S, Goh KL. Epidemiology of functional dyspepsia: A global perspective. World J Gastroenterol 2006;12:2661-6. 18. do Rosário Dias de Oliveira Latorre M, Medeiros da Silva A, Chinzon D, Eisig JN, Dias-Bastos TR. Epidemiology of upper gastrointestinal symptoms in Brazil (EpiGastro): A population-based study according to sex and age group. World J Gastroenterol 2014;20:17388-98. 19. Olmos JA, Pogorelsky V, Tobal F, et al. Uninvestigated dyspepsia in Latin America: a population-based study. Dig Dis Sci 2006;51:1922-9. 20. Shaib Y, El-Serag HB. The prevalence and risk factors of functional dyspepsia in a multiethnic population in the United States. Am J Gastroenterol 2004;99:2210-6. 21. Tougas G, Chen Y, Hwang P, Liu MM, Eggleston A. Prevalence and impact of upper gastrointestinal symptoms in the Canadian population: findings from the DIGEST study. Domestic/International Gastroenterology Surveillance Study. Am J Gastroenterol 1999;94:2845-54. 22. Jones RH, Lydeard SE, Hobbs FD, et al. Dyspepsia in England and Scotland. Gut 1990;31:401-5. 23. Jones R, Lydeard S. Prevalence of symptoms of dyspepsia in the community. BMJ 1989;298:30-2. 79 RAMÓN ISAÍAS CARMONA SÁNCHEZ 24. Penston JG, Pounder RE. A survey of dyspepsia in Great Britain. Aliment Pharmacol Ther 1996;10:83-9. 25. Moayyedi P, Forman D, Braunholtz D, et al. The proportion of upper gastrointestinal symptoms in the community associated with Helicobacter pylori, lifestyle factors, and nonsteroidal anti-inflammatory drugs. Leeds HELP Study Group. Am J Gastroenterol 2000;95:1448-55. 26. Caballero-Plasencia AM, Sofos-Kontoyannis S, Valenzuela-Barranco M, et al. Irritable bowel syndrome in patients with dyspepsia: a community-based study in Southern Europe. Eur J Gastroenterol Hepatol 1999;11:517-22. 27. Ihezue CH, Oluwole FS, Onuminya JE, Okoronkwo MO. Dyspepsias among the highlanders of Nigeria: an epidemiological survey. Afr J Med Med Sci 1996;25:23-9. 28. Kim SE, Park HK, Kim N, et al. Prevalence and risk factors of functional dyspepsia: a nationwide multicenter prospective study in Korea. J Clin Gastroenterol 2014;48:e12-8. 29. Lee YY, Wahab N, Mustaffa N, Daud N, Mohd Noor N, Shaaban J, et al. Rome III survey of functional dyspepsia among the ethnic Malays in a primary care setting. BMC Gastroenterol 2013;13:84. 30. Chang FY, Chen PH, Wu TC, et al. Prevalence of functional gastrointestinal disorders in Taiwan: questionnaire-based survey for adults based on the Rome III criteria. Asia Pac J Clin Nutr 2012;21:594-600. 31. Bernal-Reyes R, Monzalvo-López A, Bernal-Serrano M. Prevalencia de síntomas gastrointestinales en personas con sobrepeso y obesidad. Estudio epidemiológico en una población mexicana. Rev Gastroenterol Mex 2013;78:28–34. 32. Schmulson M, Adeyemo M, Gutiérrez-Reyes G, et al. Differences in gastrointestinal symptoms according to gender in Rome II positive IBS and dyspepsia in a Latin American population. Am J Gastroenterol 2010;105:925-32. 33. Schmulson M, Ortíz O, Santiago-Lomeli M, et al. Frequency of functional bowel disorders among healthy volunteers in Mexico City. Dig Dis 2006;24:342-7. 34. Lopez-Colombo A, Morgan D, Bravo-González D, et al. The epidemiology of functional gastrointestinal disorders in Mexico: A population-based study. Gastroenterol Res Pract 2012;2012:606174. 35. González-Varela RI, Durán-Arizaga H, Ramos B, et al. Características generales de la dispepsia en una población abierta del noroeste de la República. Rev Gastroenterol Mex 2012;77 (Supl 2):110. 36. Cortés-Torres K, Cano-Contreras AD, Roesch-Dietlen F, Remes-Troche JM. Prevalencia de dispepsia funcional en población abierta en la ciudad de Cosamaloapan, Veracruz, México. Rev Gastroenterol Mex 2014;79 (Supl 2):47. 80 CAPÍTULO 5 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS DISPÉPTICOS 37. Tougas G, Chen Y, Hwang P, Liu MM, Eggleston A. Prevalence and impact of upper gastrointestinal symptoms in the Canadian population: findings from the DIGEST study. Domestic/International Gastroenterology Surveillance Study. Am J Gastroenterol 1999;94:2845-54. 38. Boekema PJ, Samsom M, van Berge Henegouwen GP, Smout AJ. Coffee and gastrointestinal function: facts and fiction. A review. Scand J Gastroenterol Suppl 1999;230:35-9. 39. Yarandi SS, Christie J. Functional dyspepsia in review: Pathophysiology and challenges in the diagnosis and management due to coexisting gastroesophageal reflux disease and irritable bowel syndrome. Gastroenterol Res Pract 2013, Article ID 351086. Doi: 10.1155/2013/351086. 81 Capítulo 6 Epidemiología del síndrome de intestino irritable en México MERCEDES AMIEVA BALMORI JOSÉ MARÍA REMES TROCHE 1. INTRODUCCIÓN Dentro del grupo de trastornos funcionales digestivos, el más representativo es el síndrome de intestino irritable (SII). Es un padecimiento crónico y recurrente con signos y síntomas caracterizados por la presencia de dolor o malestar abdominal acompañado de alteraciones en la frecuencia y en la consistencia de las evacuaciones. Además, este dolor o malestar abdominal mejora cuando los pacientes logran tener una evacuación. De acuerdo con los criterios de Roma III1 los síntomas deben estar presentes al menos tres veces por semana en los últimos 3 meses y estar presentes cuando menos 6 meses antes del diagnóstico. El SII se subclasifica según la forma de las evacuaciones, utilizando la clasificación de Bristol para la consistencia de las heces; el SII con predominio de estreñimiento (SII-E), está caracterizado por heces duras en al menos 25% y menos de 25% de heces blandas. El subtipo de diarrea (SII-D) se caracteriza por heces disminuidas de consistencia en más de 25% del tiempo y heces duras en menos de 25% de las evacuaciones. El subgrupo mixto (SII-M) se caracteriza por heces duras en 25% de las ocasiones y heces líquidas en 25% de las evacuaciones; el último subtipo es el inclasificable, en el cual las características de las evacuaciones no clasifican para ninguno de los subtipos descritos previamente. En la actualidad se considera que el SII es una enfermedad heterogénea, multifactorial y con mecanismos fisiopatológicos complejos que incluyen: predisposición genética, alteraciones en los neurotransmisores, inflamación de bajo grado, malabsorción de ácidos biliares, flora intestinal, disfunciones motoras, alteraciones viscerales sensitivas, agentes infecciosos y alteraciones psicosociales.2 El SII genera importantes costos en materia de salud y laboral de manera directa e indirecta; los síntomas pueden interferir con la vida social y laboral, afectando la calidad de vida de quien la padece y de sus familiares.3 Además, existen enfermedades coexistentes que pueden presentarse en conjunto o tener exacerbaciones por separado en los pacientes con SII, como la fibromialgia, el síndrome de fatiga crónica, dolor de espalda crónico, dolor pélvico crónico, migraña y disfunción temporomandibular.4 85 MERCEDES AMIEVA BALMORI 2. EPIDEMIOLOGÍA GLOBAL La prevalencia e incidencia a escala mundial es variable, y la información existente a veces es difícil de comparar.5,6 Además del déficit de información en algunas regiones del mundo, los estudios existentes han utilizado diferentes metodologías y criterios diagnósticos, no en todos se ha realizado exclusión o inclusión de trastornos comórbidos o descartado patología orgánica como causa de los síntomas, los distintos niveles socioculturales de cada región y la variedad de la población estudiada (abierta, asilos, enfermos, personal de salud), así como los estilos de vida, hacen que las muestras estudiadas sean muy heterogéneas, lo que dificulta tener resultados equiparables. La prevalencia reportada en estudios de la comunidad varía entre 10% y 25%.7-9 Un meta-análisis muestra una estimación de prevalencia internacional de 11.2% (IC 95% 9.8 a 12.8), que varía por regiones geográficas, con la incidencia más baja en Asia del sur (7%) y la más alta en Sudáfrica (21%).10 Esta es una enfermedad que se presenta en ambos sexos, en todas las razas y a cualquier edad. Las mujeres buscan más atención en el Occidente; sin embargo, la prevalencia en Asia es mayor en los hombres, esto está asociado a la disparidad en género, a la cultura y al acceso a los servicios de salud.11 Las tasas de prevalencia van de 1.5 a 3 veces más en las mujeres.12 En el ámbito internacional la prevalencia en mujeres es de más del doble (67%) que en los hombres (razón de momios –RM– 1.67, IC 95% 1.53 a 1.82).13 Sin embargo, en estudios en población abierta esta proporción es mucho menor, e incluso no se encuentran diferencias significativas en cuanto al sexo.14 El SII está presente en todas las edades, desde niños, hasta ancianos, sin que se encuentre una diferencia en la frecuencia de los subtipos;15 existe mayor prevalencia entre los adultos jóvenes, buscando atención médica entre los 30 y 50 años,16 con un descenso a mayor edad en el Occidente y un aumento en Oriente; en los ancianos se ha asociado a enfermedad diverticular, es más prevalente en el Oriente,17 y la calidad de vida en este grupo es menor. Hay estudios de agregación familiar que revelan un doble de riesgo en pacientes que tengan familiares en primer grado con SII.18 Si esto se relaciona con alteraciones genéticas o a compartir un mismo medio ambiente nocivo, es aún controversial. 86 CAPÍTULO 6 x EPIDEMIOLOGÍA DEL SÍNDROME DE INTESTINO IRRITABLE EN MÉXICO El nivel socioeconómico de los pacientes que sufren de SII es variable; sin embargo, en la mayoría de los estudios se ha reportado que en niveles socioeconómicos altos existe una mayor prevalencia, esto puede estar dado por mayor nivel de estrés y un fácil acceso a la atención médica.19 Solo hay un estudio donde se asoció el SII a nivel socioeconómico bajo.14 Los síntomas asociados al SII experimentados por la población en general tienen un inicio insidioso, pero en muchas ocasiones estos pacientes no acuden a valoración médica; es por esto que existe discrepancia entre la primera ocurrencia de los síntomas y el diagnóstico.20 Regularmente, cuando los pacientes (entre 10% y 70%) buscan atención médica lo hacen en el primer nivel de atención.21,22 En general, no existen diferencias en los síntomas gastrointestinales entre los que buscan atención médica y los que no, pero sí existe mayor puntaje en las escalas de dolor, mayores niveles de ansiedad y mayor reducción en la calidad de vida en estos últimos.23,24 Recientemente se ha organizado un grupo de trabajo internacional para el estudio del SII;25 ellos describen las dificultades y las variables que pudieran ser factores confusores, por ejemplo: la relevancia en naciones en vías de desarrollo de la coinfección parasitaria que condiciona síntomas similares al SII, como Giardia, Entamoeba, Toxocara y Triquinella.26,27 El SII condiciona un importante deterioro en la calidad de vida de los pacientes. En una encuesta hecha en Estados Unidos de América (EUA), 68% de los participantes reporta dejar de realizar una actividad social por semana, la mayoría se siente molesta y cansada por su enfermedad.28,29 Incluso, la afección de la calidad de vida en los pacientes con SII es equiparable a la que experimentan pacientes con enfermedad celíaca, enfermedad inflamatoria intestinal y cáncer de colon en etapas tempranas.30,31 Además, las parejas y familiares cercanos de estos pacientes reportan mayores niveles de estrés y tensión, comparables con aquellos cuidadores de personas con demencia o pacientes terminales.32 Los costos en salud relacionados con el SII son considerables. En los Estados Unidos de América, el gasto en salud es 50% mayor en una persona con SII que en un sujeto sano de la misma edad. De 25% a 49% de los pacientes con SII reportan una consulta en el primer 87 MERCEDES AMIEVA BALMORI nivel de atención por sus síntomas; 19% a 30%, en el segundo nivel, y hasta 36% recibirá atención en el tercer nivel.33 Un total de 2% a 5% de los pacientes acudirá al servicio de urgencias por sus molestias y, de éstos, .5% a 6.5% se hospitalizará por esta causa.34 Se estima que el costo total de estudios no invasivos para el diagnóstico de exclusión de otras patologías en pacientes con SII es de $11,800 pesos mexicanos, aproximadamente, y se ha valorado contra el solo realizar biometría hemática y marcadores inflamatorios con un costo de $800 pesos, aproximadamente, sin que hubiera una diferencia significativa en cuanto a cambio de los síntomas, severidad o satisfacción en ambos grupos.35 Se estima un costo anual por paciente de $9,600 a $ 100,000 pesos en Estados Unidos de América, de $1,980 a $6,956 pesos en el Reino Unido, de $13,447 en Alemania y de $1,300 en Irán.36 Además, existe el problema de ausentismo, ya que una cuarta parte de los pacientes con SII falta en promedio 3 días al año y 7% hasta 2 semanas al año;37 existe también el término presentismo, que se refiere a un bajo desempeño laboral reportado en 2% hasta 32% de pacientes con SII.38 Finalmente, está descrito que pacientes con SII tienen un riesgo incrementado de que se les practiquen procedimientos quirúrgicos innecesarios tras diagnósticos inapropiados. Por ejemplo, el riesgo de practicárseles una colecistectomía es entre dos y tres veces mayor que en la población general y dos veces más alto para histerectomías y apendicetomías.39 3. EPIDEMIOLOGÍA EN MÉXICO Existen varios trabajos donde se han valorado diversas poblaciones en el Distrito Federal, Tlaxcala y Veracruz. En 2001 Huerta et al realizaron una revisión sistemática de 18 publicaciones de 1996 al 2000, donde se reporta una prevalencia de 17% a 20% de SII en población mexicana utilizando los criterios diagnósticos de Manning y Roma I.40 En 2006 Schmulson et al publicaron la frecuencia de enfermedades funcionales intestinales en voluntarios sanos en una universidad en la ciudad de México; ellos hicieron la traducción al español del cuestionario aprobada por el comité de Roma y valoraron 88 CAPÍTULO 6 x EPIDEMIOLOGÍA DEL SÍNDROME DE INTESTINO IRRITABLE EN MÉXICO a 324 personas sanas, para documentar una prevalencia de 35.5%, con edades promedio de 30.8 años, la variedad SII-E fue cuatro veces más frecuente en la población femenina y no encontraron diferencias de acuerdo al tipo de ocupación en la población.41 En 2010 se publicaron dos estudios; el primero, acerca de la prevalencia del SII en población abierta de la ciudad de Veracruz utilizando los criterios de Roma II; seleccionaron de manera aleatoria a 10% de la población (459 individuos), distribuidos en las diferentes colonias del municipio, en quienes se detectó una prevalencia de 16.9%, con una media de edad de 31.2 años, la variedad con estreñimiento fue la mayor, con 50% sobre los otros subtipos de la enfermedad, y más prevalente en el género femenino.42 El segundo fue realizado por el grupo mexicano de estudio para el SII; es el primer reporte utilizando los criterios de Roma III y estudia a pacientes ya con diagnóstico de SII. Se estudiaron pacientes con SII que acudieron a consulta particular en 21 estados de la República y el Distrito Federal; se evaluaron 1,677 pacientes, con una media de 36.9 años de edad. En este estudio la prevalencia de SII entre las mujeres fue de 76%, con una relación 3.3 veces mayor que la población masculina. La frecuencia relativa de los subtipos fue SII-M 48.4%, SII-E 43%, SII-D 5.6% y SII-NC 2.8%. También se reportó que SII-M se asocia más con síntomas dispépticos, el SII-E con síntomas del tracto de salida y el SII-D con síntomas de incontinencia.43 Finalmente, López-Colombo et al en 2012 publicaron la epidemiología de trastornos funcionales gastrointestinales en Tlaxcala; valoraron a 500 personas en población abierta utilizando el cuestionario de Roma II. En este estudio se encontró una prevalencia menor a la publicada previamente: 16% de SII, más frecuente en el sexo femenino y el subtipo de estreñimiento y el mixto fueron los más comunes en esta misma población.44 4. RESULTADOS DEL ESTUDIO SIGAME Un total de 301 sujetos (7.6%, IC 95% 6.8 a 8.5) cumplieron con los criterios para SII. El 59% conformado por mujeres, de tal forma que la proporción mujer:hombre fue 1.48 a 1. La edad promedio de las 89 MERCEDES AMIEVA BALMORI personas con SII fue de 42.4 ± 12 años. La profesión y escolaridad de los pacientes con SII se muestran en la figura 1. En la figura 2 se presenta la prevalencia según zonas geográficas del país; se observa la prevalencia más baja en el Suroeste (3.8%, IC 95% 2.2 a 6.6) y la más alta en la zona Centro Norte (9.4%, IC 95% 6.6 a 13.2). Sin embargo, no hubo diferencias estadísticamente significativas en el análisis entre las ocho zonas geográficas. En la figura 3 se muestra la prevalencia de acuerdo a las cuatro zonas económicas en las que se divide el país y la prevalencia más alta se reporta en la zona Media Baja (8.4%, IC 95% 6.6 a 10.6) y la más baja en la zona Baja (5.4%, IC 95% 3.8 a 7.7). Figura 1. Profesión y escolaridad de los pacientes con síndrome de intestino irritable SIGAME 2014 35 32.2 30 25 24 20 20 % 15 10 8.3 5.3 5.3 Jubilado Desempleado 5 0 Ama de casa Profesionista Otro Estudiante Profesión 48.5 50 40 30 24.5 % 20 13.6 9 10 2.5 0 Primaria 90 Secundaria Preparatoria Escolaridad Universidad Otro CAPÍTULO 6 x EPIDEMIOLOGÍA DEL SÍNDROME DE INTESTINO IRRITABLE EN MÉXICO Figura 2. Prevalencia de síndrome de intestino irritable, por zonas geográficas del país SIGAME 2014 Noroeste n=42/612 6.6 % (5.1-9.1) Noreste n=14/284 Centro Norte n=29/306 9.4% (6.6-13.2) 4.9% (2.9-8.1) Sureste n=17/325 Este 5.2% (3.2-8.8) n=38/413 Oeste n=79/934 8.4% (6.8-10.4) 9.2% (6.7-12.3) Centro Sur n=70/742 9.3% (7.5-11.7) Suroeste n=12/309 p >.05 3.8% (2.2-6.6) Figura 3. Prevalencia de síndrome de intestino irritable, de acuerdo a las diferentes zonas económicas del país SIGAME 2014 n=122/1497 8.1% (6.8-9.6) n=86/1132 6.4 (5.2-9.9) o Alto Medio-Alto Medio-Bajo Bajo n=63/748 8.4 (6.6-10.6) n=30/548 5.4% (3.8-7.7) P>.05 91 MERCEDES AMIEVA BALMORI Según los subtipos, el más frecuente fue el SII-E (47%, n = 141) seguido del SII-M (43%, n = 129), el SII-D (9%, n = 28) y el SII no clasificable (1%, n = 3) (Figura 4 ). Figura 4. Clasificación de acuerdo a subtipos del síndrome de intestino irritable SIGAME 2014 9% 1% SII-NC SII-D SII-M SII-E 43% 47% De acuerdo con la comparación establecida con un grupo control los pacientes con SII tuvieron mayor edad (p = .023), hubo un mayor porcentaje de mujeres (p = .05), de amas de casa (p = .005) (.02), y tuvieron mayor nivel de escolaridad (p = .01) (Cuadro 1). Durante el análisis multivariado se demostró que la edad (p = .0001), la ocupación (p = .14) y la escolaridad (p = .033) son factores asociados al desarrollo de SII en México. La sobreposición con otros trastornos funcionales digestivos en los pacientes con SII fue la siguiente: síntomas de ERGE se presentó en 67 sujetos (22.3%, IC 95% 17.9 a 29.2), síntomas dispépticos, en 54 (17.9%, IC 95% 14 a 22.6) y 37 sujetos tuvieron eructos excesivos (12.2% IC 95% 9 a 16). Al analizar las características sociodemográficas y la sobreposición con otros síntomas digestivos de acuerdo a los subtipos los pacientes con SII-E tienen mayores síntomas de dispepsia (Cuadro 2). 92 CAPÍTULO 6 x EPIDEMIOLOGÍA DEL SÍNDROME DE INTESTINO IRRITABLE EN MÉXICO Cuadro 1. Distribución de los pacientes con defecación discinérgica y comparación con población control SIGAME 2014 SII (n = 301) Controles (n = 1,110) p 42 ± 13 37 ± 12 .023 x0XMHUn (%) 180 (59.8%) 595 (40.2%) .05 Zona geográfica 1. Noroeste 2. Noreste 3. Centro Norte 4. Oeste 5. Centro Sur 6. Suroeste 7. Este 8. Sureste (%) 14 2.3 12 26.2 23.3 4.0 12.6 5.6 (%) 13.7 5.8 8.4 21.5 14.7 10.2 8.8 6.9 .0001 Zona económica con ingreso 1. Alto 2. Medio Alto 3. Medio 4. Bajo 28.6 40.5 20.9 10 31.3 36.7 17 15 Ocupación 1. Ama de casa 2. Desempleado 3. Estudiante 4. Jubilado 5. Otro 6. Profesionista 24.3 8.3 39.2 5.3 2.3 20.6 14.3 13.6 45.7 5.3 1.4 19.7 Escolaridad 1. Primaria 2. Secundaria 3. Preparatoria 4. Universidad 5. Otro 3.2 6.9 22.4 62.3 5.1 13.6 9 24.6 48.5 4.3 Edad (promedio ± DE) .048 .001 .0001 SII=síndrome de intestino irritable 93 MERCEDES AMIEVA BALMORI Cuadro 2. Análisis de acuerdo a los subtipos de síndrome de intestino irritable SIGAME 2014 SII-E n=141 SII-D n=28 SII-M n=129 SII-NC n=3 p 42 ± 15 42 ± 15 42 ± 15 42 ± 15 .24 38 41 17 17 44 39 0 2.8 .8 Pirosis (%) 21 13 27 0 .10 Dispepsia (%) 27 9 13 9 .007 Edad x0XMHU x+RPEUH SII-E= síndrome de intestino irritable con estreñimiento, SII-D= síndrome de intestino irritable con diarrea, SII-M= síndrome de intestino irritable mixto, SIINC= síndrome de intestino irritable no clasificable 5. CONCLUSIONES La prevalencia en población abierta del SII en México es de 7.6% (IC 95% 6.8 a 8.5) y la proporción mujer:hombre es de 1.48 a 1; afecta primordialmente a personas entre la tercera y cuarta década de la vida, amas de casa, sujetos con nivel de escolaridad alto; aunque geográficamente existen variaciones en general, la prevalencia es muy similar. La sobreposición con ERGE está por arriba de 20%. REFERENCIAS 94 1. Longstreth G, Thompson WG, Chey W. Functional bowel disorders. Drossman D, Corazziari E, DelvauxM. ROME III. The functional gastrointestinal disorders. Drossman D, Corazziari E, DelvauxM. 3ra ed. USA. Allen Press. 2006. 487-555. 2. Gómez-Escudero O, Macías-Lara CC. Síndrome de intestino irritable: de la fisiopatogenia al tratamiento. Yamamoto-Furusho JK, Uscanga L, editores. Gastroenterología traslacional. México, DF: Permanyer; 2014: 81-100. 3. Chang JY, Locke GR 3rd, McNally MA, et al. Impact of functional gastrointestinal disorders on survival in the community. Am J Gastroenterol 2010;105:822–32. 4. Hillilä MT, Siivola MT, Färkkilä MA. Comorbidity and use of health-care services among irritable bowel syndrome sufferers. Scand J Gastroenterol 2007;42:799–806. CAPÍTULO 6 x EPIDEMIOLOGÍA DEL SÍNDROME DE INTESTINO IRRITABLE EN MÉXICO 5. Spiegel BM, Farid M, Esrailian E, Talley J, Chang L. Is irritable bowel V\QGURPHDGLDJQRVLVRIH[FOXVLRQ"$VXUYH\RISULPDU\FDUHSURYLGHUV gastroenterologists, and IBS experts. Am J Gastroenterol 2010;105: 848– 58. 6. Quigley EM. The ‘con’ case. The Rome process and functional gastro¬intestinal disorders: the barbarians are at the gate! Neurogastroenterol Motil 2007;19:793–7. 7. Husain N, Chaudhry IB, Jafri F, Niaz SK, Tomenson B, Creed F. A populationbased study of irritable bowel syndrome in a non-Western population. Neurogastroenterol Motil 2008;20:1022–9. 8. Jones R, Lydeard S. Irritable bowel syndrome in the general population. BMJ 1992;304:87–90. 9. Hungin AP, Whorwell PJ, Tack J, Mearin F. The prevalence, patterns and impact of irritable bowel syndrome: an international survey of 40,000 subjects. Aliment Pharmacol Ther 2003;17:643–50. 10. Lovell RM, Ford AC. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clin Gastroenterol Hepatol 2012;10:712–21. 11. Ghoshal UC, Abraham P, Bhatt C et al. Epidemiological and clinical profile of irritable bowel síndrome in India: report of the Indian Society of Gastroenterology Task Force. Indian J Gastroenterol 2008;27:22-8. 12. Drossman DA, Funch-Jensen P, Janssens J. Identification of subgroups of functional bowel disorders.Gastroenterol Int 1990;3:159–72. 13. Lovell RM, Ford AC. Effect of gender on prevalence of irritable bowel syndrome in the community: systematic review and meta-analysis. Am J Gastroenterol 2012;107:991–1000. 14. Drossman DA, Li Z, Andruzzi E, et al. U.S. householder survey of functional gastrointestinal disorders: prevalence, sociodemography and health impact. Dig Dis Sci 1993;38:1569-80. 15. Tang YR, Yang WW, Liang ML, Xu XY, Wang MF, Lin L. Age-related symptom and life quality changes in women with irritable bowel syndrome. World J Gastroenterol 2012;18:7175–83. 16. Quigley E, Fried M, Gwee K, et al. Guía Global de la Organización Mundial de Gastroenterología. Síndrome de intestino irritable: una perspectiva mundial. WGO, 2009: 1-32. 17. Camilleri M, Lee JS, Viramontes B, et al. Insights into the pathophysiology and mechanisms of constipation, irritable bowel syndrome, and diverticulosis in older people. J Am Geriatr Soc 2000;48:11142–50. 18. Locke GR 3rd, Zinsmeister AR, Talley NJ, Fett SL, Melton LJ 3rd. Familial association in adults with functional gastrointestinal disorders. Mayo Clin Proc 2000;75:907–12. 19. Talley NJ, Phillips SF, Bruce B, Twomey CK, Zinsmeister AR, Melton LJ. Relation among personality and symptoms in nonulcer dyspepsia and the irritable bowel syndrome. Gastroenterology 1990;99:327–33. 95 MERCEDES AMIEVA BALMORI 20. Hungin AP, Chang L, Locke GR, Dennis EH, Barghout V. Irritable bowel syndrome in the United States: prevalence, symptom patterns and impact. Aliment Pharmacol Ther 2005;21:1365–75. 21. Koloski NA, Talley NJ, Huskic SS, Boyce PM. Predictors of conventional and alternative health care seeking for irritable bowel syndrome and functional dyspepsia. Aliment Pharmacol Ther 2003;17:841–51. 22. Canavan C, West J, Card T. The epidemiology of irritable bowel syndrome. Clin Epidemiol 2014;6:71-80. &UHHG):KRQHHGVDGRFWRUIRU,%6"*XWy 24. Lee V, Guthrie E, Robinson A, et al. Functional bowel disorders in primary care: factors associated with health-related quality of life and doctor consultation. J Psychosom Res 2008;64:129–38. 25. Quigley E, Abel-Hamid H, Barbara G, et al. A Global Perspective on Irritable Bowel Syndrome. A Consensus Statement of the World Gastroenterology Organisation Summit Task Force on Irritable Bowel Syndrome. J Clin Gastroenterol 2015;46:356-65. 26. Dizdar V, Gilja OH, Hausken T, et al. Increased visceral sensitivity in Giardia-induced postinfectious irritable bowel syndrome and functional dyspepsia. Effect of the 5HT3-antagonist ondasetron. Neurogastroenterol Motil 2007;19:977-82. 27. Sinha P, Ghoshal UC, Choudhuri G, et al. Does Entamoeba histolytica FDXVHLUULWDEOHERZHOV\QGURPH",QGLDQ-*DVWURHQWHURO 28. Hulisz D. The burden of illness of irritable bowel syndrome: current challenges and hope for the future. J Manag Care Pharm 2004;10:299–309. 29. Smith GD, Steinke DT, Kinnear M, Penny KI, Pathmanathan N, Penman ID. A comparison of irritable bowel syndrome patients managed in primary and secondary care: the Episode IBS study. Br J Gen Pract 2004;54:503–7. 30. Bushnell DM, Reilly MC, Galani C, et al. Validation of electronic data capture of the Irritable Bowel Syndrome-Quality of Life Measure, the Work Productivity and Activity Impairment Questionnaire for Irritable Bowel Syndrome and the EuroQol. Value Health 2006;9:98–105. 31. Stark RG, Reitmeir P, Leidl R, König HH. Validity, reliability, and responsiveness of the EQ-5D in inflammatory bowel disease in Germany. Inflamm Bowel Dis 2010;16:42–51. 32. Wong RK, Drossman DA, Weinland SR, et al. Partner burden in irritable bowel syndrome. Clin Gastroenterol Hepatol 2013;11:151–5. 33. Levy RL, Von Korff M, Whitehead WE, et al. Costs of care for irritable bowel syndrome patients in a health maintenance organization. Am J Gastroenterol 2001;96:3122–9. 34. Longstreth GF, Wilson A, Knight K, et al. Irritable bowel syndrome, health care use, and costs: a U.S. managed care perspective. Am J Gastroenterol 2003;98:600–7. 96 CAPÍTULO 6 x EPIDEMIOLOGÍA DEL SÍNDROME DE INTESTINO IRRITABLE EN MÉXICO 35. Begtrup LM, Engsbro AL, Kjeldsen J, et al. A positive diagnostic strategy is noninferior to a strategy of exclusion for patients with irritable bowel syndrome. Clin Gastroenterol Hepatol 2013;11:956–62. 36. Canavan C, West J, Card T. Review article: the economic impact of the irritable bowel syndrome. Aliment Pharmacol Ther 2014;40:1023-34. 37. Silk DB. Impact of irritable bowel syndrome on personal relationships and working practices. Eur J Gastroenterol Hepatol 2001;13:1327–32. 38. Reilly MC, Bracco A, Ricci J-F, Santoro J, Stevens T. The validity and accuracy of the Work Productivity and Activity Impairment questionnaire– irritable bowel syndrome version (WPAI:IBS). Aliment Pharmacol Ther 2004;20:459–67. 39. Longstreth GF, Yao JF. Irritable bowel syndrome and surgery: a multivariable analysis. Gastroenterology 2004;126:1665–73. 40. Huerta I, Valdovinos MA, Schmulson M. Irritable bowel síndrome in Mexico. Dig Dis 2001;19:251-7. 41. Schmulson M, Ortiz O, Santiago-Lomeli M, et al. Frequency of functional bowel disorders among healthy volunteers in Mexico City. Dig Dis 2006;24:342-7. 42. Valerio-Ureña J, Pérez-Sosa JA, Jiménez-Pineda A, et al. Prevalencia del síndrome de intestino irritable en población abierta de la ciudad de Veracruz. Rev Gastroenterol Mex 2006;71 (Suppl 2):124. 43. Schmulson M, Vargas JA, Lopez-Colombo A, Remes-Troche JM, et al. Prevalencia y caracterización de los subtipos de SII según los criterios de ROMA III, en un estudio clínico, multicéntrico. Reporte del grupo mexicano de estudio para el SII. Rev Gastroenterol Mex 2010;4:421-38. 44. López-Colombo A, Morgan D, Bravo-González D, et al. The Epidemiology of Functional Gastrointestinal Disorders in Mexico: A Population-Based Study. Gastroenterol Res Pract 2012;2012:606174. 97 Capítulo 7 Epidemiología del dolor abdominal funcional JOSÉ LUIS TAMAYO DE LA CUESTA 1. INTRODUCCIÓN En 1989, y con el fin de mejorar la capacidad diagnóstica sobre los trastornos funcionales gastrointestinales (TFGI), se establecieron los criterios de Roma I;1 a seguir los de Roma II2 (2000) y más recientemente los de Roma III (2006).3 Uno de los principales cambios en los criterios de Roma III respecto a los de Roma II fue que el síndrome del dolor abdominal funcional se separó de los trastornos funcionales intestinales, por lo que ahora es una categoría independiente; esto se debe a su relación con alteraciones en el procesamiento nociceptivo central más que con afectaciones propiamente funcionales del intestino. 1.1. Definición. Con base en los criterios de Roma III (Cuadro I), el síndrome de dolor abdominal funcional (SDAF) es una entidad que se caracteriza por la presencia de dolor abdominal crónico constante o casi constante, o al menos recurrente sin causa orgánica, estructural, bioquímica o metabólica aparente que lo explique, condición en la que el dolor no tiene relación con la provocación, exageración o el alivio que pueden causar estímulos fisiológicos cotidianos, como la alimentación, el ejercicio, la defecación o la menstruación, característica que lo diferencia de los otros TFGI que se acompañan de dolor abdominal, como el síndrome de intestino irritable (SII) o la dispepsia funcional (DF).1-3 El dolor abdominal puede presentarse sin causa o motivo aparente, pero, igual que en el SII, también puede aparecer posterior a una infección u otro tipo de agresión intestinal, así como asociado a eventos traumáticos de la vida, como la muerte de un familiar o amigo cercano, un divorcio, historia de abuso físico, abuso sexual o cualquier otra situación que ocasione estrés. 101 JOSÉ LUIS TAMAYO DE LA CUESTA Cuadro 1. Criterios* de Roma III para el diagnóstico del síndrome de dolor abdominal funcional SIGAME 2014 1. Dolor abdominal continuo o casi continuo 2. Ninguna o solo una relación ocasional del dolor con eventos fisiológicos (comer, defecar, menstruación) 3. Alguna repercusión en la vida diaria del paciente 4. El dolor no es fingido 5. Síntomas insuficientes para cumplir criterios de otro TFGI que explique el dolor * Los criterios deben cumplirse en los últimos 3 meses con síntomas presentes al menos 6 meses antes del diagnóstico El SDAF es uno de los TFGI que con mayor frecuencia se asocia a problemas psicológicos o psiquiátricos, entre los cuales ha sido catalogado como dolor somatomorfo pues cumple con los criterios para trastorno de somatización.4 Los trastornos psicológicos (ansiedad, depresión, somatización, ideación catastrofizante, entre otros) son más probables cuando el dolor persiste durante un largo periodo, lo que se asocia con conductas de dolor crónico que dominan la vida del paciente. Un hecho preocupante son los resultados de una revisión sistemática,5 en la que se señala que los pacientes con dolor abdominal crónico sin SII muestran conducta suicida con una frecuencia 3 a 11 veces mayor, en comparación con los controles. Por lo anterior, e igual que en otros TFGI, los pacientes con SDAF muestran un alto índice de ausentismo laboral y de uso de los recursos sanitarios, lo cual ocasiona una carga económica considerable.6 Algunas de las características clínicas del SDAF son:7 1. Los pacientes suelen negar que existan factores psicosociales causantes de estrés, si bien el dolor puede reducirse cuando ellos realizan actividades que los distraen y aumenta cuando comentan algún problema que les cause angustia psicológica 2. Expresan el dolor con métodos verbales y no verbales, y refieren urgentemente síntomas intensos y desproporcionados 102 CAPÍTULO 7 x EPIDEMIOLOGÍA DEL DOLOR ABDOMINAL FUNCIONAL 3. 4. 5. 6. con relación a los datos clínicos y de laboratorio (por ejemplo: reportan puntuación de dolor de “10” en una escala del 1 al 10) Precisan asistencia médica con frecuencia y acuden en repetidas ocasiones a los servicios de urgencias para solicitar analgésicos opiáceos Piden que se les realicen estudios diagnósticos o incluso una cirugía exploratoria para determinar el origen orgánico de su afección Centran su atención en aliviar por completo el dolor y no en adaptarse al hecho de que padecen una enfermedad No asumen más que un grado limitado de responsabilidad a la hora de cuidar de sí mismos En el SDAF parece ser que existen alteraciones o disfunción de los sistemas endógenos que modulan el dolor, como los circuitos que modulan el dolor descendente y el cortical. 1.2. Fisiopatología. Los estudios acerca de la fisiopatología del SDAF son limitados, si bien se conoce que las interacciones entre cerebro e intestino influyen de manera crucial en la mayoría de los TFGI relacionados con el dolor, en especial en el SII. Se ha propuesto que el dolor crónico es una experiencia multidimensional (sensorial, emocional y cognitiva), la cual se explica de manera más comprensiva como anormalidades en la función neurofisiológica en distintos niveles (aferente, médula espinal y SNC).8 La señal aferente visceral asciende hasta el tracto espinotalámico y transmite los estímulos al tálamo, a partir del cual la señal se expande a la ínsula, la circunvolución del cíngulo y las demás estructuras de la neuromatriz del dolor. En la mayoría de los TFD existe una percepción anormal o exagerada a los estímulos provenientes del intestino por las vías aferentes viscerales (parasimpáticas y simpáticas), lo cual puede estar relacionado con alimentos, experiencias tempranas en la vida, inflamación de la mucosa intestinal, menstruación, estrés, antecedente de cirugía previa o infecciones gastrointestinales agudas. La intensidad de esta percepción sensorial es regulada por mecanismos centrales del cerebro y la médula espinal, los cuales a su vez pueden ser modulados por factores genéticos y psicosociales.9,10 Todo lo anterior lleva al paciente a un 103 JOSÉ LUIS TAMAYO DE LA CUESTA estado de hipersensibilidad central e hipervigilancia, lo cual es la parte esencial del mecanismo de percepción del dolor.11 También se ha propuesto que entre los pacientes afectados por el SII existe un subgrupo (5% o menos) que presenta síntomas severos, más constantes y persistentes, que utilizan más los recursos de salud y con mayor prevalencia de comorbilidad psiquiátrica, cuyos rasgos fisiopatológicos se asemejan a los del SDAF. A diferencia de lo que ocurre en el caso del SII, en el SDAF no se dispone de experiencia suficiente en estudios de neuroimagen del eje cerebro-intestinal; sin embargo, el hecho de que el dolor abdominal que se presenta en el SDAF no guarde relación con acontecimientos fisiológicos es un indicador de sensibilización o aprendizaje asociativo del área cerebral en la cual se percibe el dolor, y no de sensibilización periférica. Un estudio publicado en fechas recientes comparó la fisiología de los pacientes con SII y SDAF y demostró que los pacientes con SII eran hipersensibles a la distensión rectal no-nociva con baróstato, mientras que los afectados con SDAF presentaban umbrales de percepción normal o incluso bajo ante la misma estimulación, lo cual sugiere que los sujetos con SDAF presentan mecanismos fisiopatológicos distintos al SII.1 1.3. Tratamiento. No existe alguno específico, definitivo, ni curativo para este síndrome; la evidencia actual es limitada respecto a estudios clínicos específicamente diseñados para tratar el SDAF, y la terapéutica actual se basa prácticamente en las estrategias para tratar los casos de SII considerados como graves o difíciles de manejar. Es un hecho relevante que para el tratamiento del SDAF resulta fundamental establecer una buena relación médico-paciente. Los médicos debemos tratar de convencer al paciente de que creemos en la existencia de su dolor; de que padece una enfermedad conocida sin causa evidente, y que el realizar estudios adicionales no le serán de ayuda, sobre todo en los casos tan frecuentes de pacientes que han tenido que soportar una larga y frustrante serie de pruebas diagnósticas, medicación y cambios de especialista, lo cual pudo haber minado su confianza en los médicos. Muchos médicos, incluidos los especialistas, no poseen el conocimiento necesario y algunos ni siquiera el interés para entender el modelo biopsicosocial para comprender y tratar a los pacientes con TFGI.3 En 104 CAPÍTULO 7 x EPIDEMIOLOGÍA DEL DOLOR ABDOMINAL FUNCIONAL una reciente revisión11 los autores mencionan que estos pacientes se perciben como “difíciles”, pero no es el paciente, sino la naturaleza del problema, así como la actitud y el conocimiento del médico lo que los hace “difíciles”. Como médicos, debemos interesarnos en estos casos, saber escucharlos y entenderlos, establecer empatía y recuperar su confianza. Es muy importante explicarles de manera sencilla la naturaleza de su problema, establecer límites de tratamiento y presentarles las opciones terapéuticas para involucrar al paciente en la selección de ellas, haciendo conciencia de que cualquier estrategia deberá centrarse en mejorar la calidad de vida y en controlar sus síntomas, en lugar de intentar eliminarlos. Es por ello que uno de los principales objetivos del tratamiento es ayudar a los pacientes a desarrollar expectativas realistas. El tratamiento farmacológico suele ser sintomático; el dolor se trata con analgésicos y en algunos casos con narcóticos, u orientado al mecanismo subyacente del dolor, con analgésicos viscerales, específicamente con antidepresivos (tricíclicos e inhibidores de la recaptura de serotonina), debido a su potencial como moduladores de la percepción del dolor.12 Las terapias psicológicas, como la cognitivo-conductual, técnicas de relajación, terapias psicodinámicas interpersonales, meditación e hipnoterapia constituyen métodos razonables para tratar pacientes con SDAF y existe experiencia con ellas, sobre todo en niños y adolescentes.13 Los principales objetivos de las intervenciones psicológicas son: a) establecer un modelo racional de enfermedad, b) atenuar los efectos de una respuesta exagerada al estrés, c) mejorar las respuestas psicológicas mal adaptativas (ansiedad, catastrofismo, sentimiento de culpa o vergüenza), y d) modificar los comportamientos negativos ante los síntomas (agorafobia, búsqueda persistente de pruebas diagnósticas). Los resultados de una revisión sistemática y meta-análisis, en la que se analizó la eficacia de los antidepresivos y la de las terapias psicológicas en el tratamiento del SII, mostró que los antidepresivos son eficaces en su tratamiento, y que a pesar de que en el caso de las terapias psicológicas la evidencia es de menor calidad, los resultados también mostraron eficacia comparable.14 105 JOSÉ LUIS TAMAYO DE LA CUESTA 2. EPIDEMIOLOGÍA GLOBAL Estrictamente la epidemiología del SDAF se desconoce, debido a la escasez de estudios y a las dificultades que implica establecer de forma apropiada el diagnóstico, en especial para establecer su diferenciación con el SII. En general, se considera una condición rara y la información que se conoce es tomada de estudios que incluyen los TFD en general, de tal manera que la prevalencia para SDAF oscila entre .5% y 1.7%.6,15 En general, se le considera como uno de los TFD menos frecuentes, comparado con la pirosis funcional, la dispepsia y el SII. La mejor evidencia disponible se ha obtenido del estudio de Drossman et al,6 que estimaron la prevalencia de dolor abdominal crónico en los Estados Unidos de América (EUA) en 2.2%, en tanto que en un estudio canadiense se estimó de .5%.15 En el estudio de Drossman la frecuencia de SDAF fue mayor en mujeres que en hombres (1.5:1), mientras que en el estudio canadiense la proporción fue similar en ambos sexos. Es un trastorno que en general se presenta en la cuarta década de la vida y produce un impacto socioeconómico importante. Por ejemplo: en el estudio de Drossman et al6 los pacientes con SDAF visitan en promedio a 1.52 médicos por presentar crisis de dolor abdominal y hasta 5.6 visitas por molestias no digestivas. En un estudio realizado en Australia se demostró que 75.9% de los casos con SDAF ha acudido a consulta médica y cerca de la mitad acudió entre 1 y 3 veces a consulta en el último año.16 A este tipo de pacientes se les ha practicado 6.4 estudios diagnósticos (endoscópicos o de radiología) e incluso se les ha realizado cerca de tres intervenciones quirúrgicas (principalmente histerectomía o laparotomía exploradora) en los últimos 7 años.17 En EUA6, los pacientes con SDAF se ausentan al trabajo en promedio 11.8 días al año y 11% refiere sentirse mal durante su jornada laboral. 3. EPIDEMIOLOGÍA EN MÉXICO Dos estudios han evaluado la prevalencia de TFD en población mexicana, de los cuales se puede obtener la epidemiología del DAF. En el estudio de Schmulson et al,18 en 324 voluntarios sanos de una población universitaria, la prevalencia determinada para SDAF fue de 106 CAPÍTULO 7 x EPIDEMIOLOGÍA DEL DOLOR ABDOMINAL FUNCIONAL .6% (IC 95%, .1 a 2.2) y la de dolor abdominal inespecífico de 4.6% (2.6 a 7.5). Estos datos fueron obtenidos con base en los criterios de Roma II. En el estudio realizado por López-Colombo et al,19 en población abierta en el estado de Tlaxcala (n = 500) utilizando los criterios de Roma II, se establece que la prevalencia del SDAF en nuestro país es de 1% (IC 95%, .3 a 2.3) y que la prevalencia de dolor abdominal inespecífico es de 1.6% (.7 a 3.1). Hasta el momento, estos estudios reflejan que la prevalencia de SDAF es similar a la evidenciada en otros países. 4. RESULTADOS DEL ESTUDIO SIGAME De los 3,925 sujetos encuestados, 37 (.9% IC 95%, .6 a 1.3) cumplieron criterios para SDAF. Esta prevalencia es similar a la reportada en EUA y Canadá. La proporción hombre:mujer en nuestro estudio fue de 3 a 1, e igual que en otras series, el trastorno se presenta en la cuarta década de la vida. El resto de las características sociodemográficas se muestra en el cuadro 2. Cuando se realizó análisis multivariado, el sexo femenino, la procedencia de las zonas Oeste y Este, y el hecho de no ser profesionista se asociaron con el desarrollo de SDAF (p < .05). La sobreposición con otros síntomas gastroduodenales (como eructos, náusea y vómito) se muestra en la figura 1. Cuando se evaluó el cuestionario sobre la calidad de vida, PAGIQoL, los pacientes con SDAF tuvieron puntajes significativamente menores que la población control (Cuadro 3). Además, llama la atención que en los sujetos con SDAF se obtuvieron los puntajes más bajos de calidad de vida en todo el estudio. 5. CONCLUSIONES Como en otras partes del mundo, el SDAF es un trastorno funcional digestivo poco frecuente; en nuestro país afecta predominantemente a mujeres, entre la tercera y cuarta década de la vida y tiene un impacto negativo en la calidad de vida de los sujetos que lo padecen. 107 JOSÉ LUIS TAMAYO DE LA CUESTA Cuadro 2. Características sociodemográficas de los pacientes con síndrome de dolor abdominal funcional SIGAME 2014 Edad Controles (n = 1,110) 36.8 ± 6.8 37.6 ± 7.6 % % 25 75* 58.7 48.6 2.7 0 8.1 40.5* 24.3 0 24.3* 0 15.7 6.4 6.0 22.4 22 7.8 10 9.6 30 32 13.5 24.3 32.4 35.4 17.9 14.3 Ocupación 1. Ama de casa 2. Desempleado 3. Estudiante 4. Jubilado 5. Otro 6. Profesionista 29.7 8.1 7.6 16.2* 29.7 16.2* 21.2 3.7 7.7 8.2 18.6 40.6* Escolaridad 1. Primaria 2. Secundaria 3. Preparatoria 4. Universidad 5. Otro 2.7 0 29.7 62.2 5.4 9.5 12.9 23.5 49.3 4.8 x+RPEUH x0XMHU Zona geográfica 1. Noroeste 2. Noreste 3. Centro Norte 4. Oeste 5. Centro Sur 6. Suroeste 7. Este 8. Sureste Zona económica con ingreso 1. Alto 2. Medio Alto 3. Medio 4. Bajo * p < .05 108 DF (n = 37) CAPÍTULO 7 x EPIDEMIOLOGÍA DEL DOLOR ABDOMINAL FUNCIONAL Cuadro 3. Calidad de vida de los pacientes con ERGE vs. sanos, de acuerdo al PAGI-QoL SIGAME 2014 Parámetro evaluado sanos (n = 925) DAF (n = 505) Valor de p Puntaje Global 93.8 ± 17 62 ± 14 .001 Actividades diarias 95.2 ± 17 80.1 ± 17 .001 Vestido 91.2 ± 24 46 ± 30 .001 Dieta 93.16 ± 22 56 ± 23 .001 Relaciones 96.3 ± 18 71.9 ± 18 .001 Psicológicas 91.1 ± 17 55.8 ± 23 .001 Figura 1. Prevalencia de los diferentes subtipos de dispepsia funcional (Roma III) SIGAME 2014 50 45 45 40 30 30 20 10 5.2 0 DTNC Eructos excesivos Náuseas Vómitos DTNC= dolor torácico no cardiaco 109 JOSÉ LUIS TAMAYO DE LA CUESTA REFERENCIAS 1. Drossman DA, Richter JE, Talley NJ, et al. The functional gastrointestinal disorders: diagnosis, patophysiology and treatment. McLean, VA: Degnon Associates; 1994. 2. Drossman DA. Rome II the functional gastrointestinal disorders. diagnosis, pathophysiology and treatment: A multinational consensus. 2nd Ed. McLean, TX: Dregon Associates; 2000. 3. Drossman DA. The functional gastrointestinal disorders and the Rome III process. Gastroenterology 2006;130:1377-90. 4. American Psychiatric Association. Diagnostic and statistical manual of mental disorders-DSM-IV. Washington, DC: American Psychiatric Association; 2000. 5. Spiegel B, Schoenfeld P, Naliboff B. Systematic review: the prevalence of suicidal behaviour in patients with chronic abdominal pain and irritable bowel syndrome. Aliment Pharmacol Ther 2007;26:183-93. 6. Drossman DA, Li Z, Andruzzi E, et al. U.S. householder survey of functional gastrointestinal disorders. Prevalence, sociodemography and health impact. Dig Dis Sci 1993;38:1569-80. 7. Clouse RE, Mayer EA, Aziz Q, et al. Functional abdominal pain syndrome; Gastroenterology 2006;130:1492-97. 8. Casey KL. Match and mismatch identifying the neuronal determinants of pain. Ann Intern Med 1996;124:995-8. 9. Mayer EA, Tillisch K. The brain-gut axis in abdominal pain syndromes. Annu Rev Med 2011;62:381-96. 10. Fukudo S, Kanazawa M. Gene, environment and brain-gut interactions in irritable bowel syndrome. J Gastroenterol Hepatol 2011;26 Suppl 3:110-5. 11. Sperber AD, Drossman DA. Review article: the functional abdominal pain syndrome. Aliment Pharmacol Ther 2011;33:514-24. 12. McQuay HJ, Tramer M, Nye BA, et al. A systematic review of antidepressants in neuropathic pain. Pain 1996;68:217-27. 13. Huertas-Ceballos A, Logan S, Bennett C, et al. Psychosocial interventions for recurrent abdominal pain (RAP) and irritable bowel syndrome (IBS) in childhood. Cochrane Database Syst Rev 2008;1:CD003014. 14. Ford AC, Talley NJ, Schoenfeld PS, et al. Efficacy of antidepressants and psychological therapies in irritable bowel syndrome: systematic review and meta-analysis. Gut 2009;58:367-78. 110 CAPÍTULO 7 x EPIDEMIOLOGÍA DEL DOLOR ABDOMINAL FUNCIONAL 15. Thompson WG, Irvine EJ, Pare P, et al. Functional gastrointestinal disorders in Canada: first population-based survey using Rome II criteria with suggestions for improving the questionnaire. Dig Dis Sci 2002;47:22535. 16. Koloski NA, Talle NJ, Boyce PM. epidemiology and health care seeking in functional GI disorders. A population based-study. Am J Gastroenterol 2002;97:2290-9. 17. Maxton DG, Whorwell PJ. Use of medical resource and attitudes to health care of patients with abdominal pain. Br J Med Econ 1992;2:75-9. 18. Schmulson M, Ortiz O, Santiago-Lomelí M, et al. Frequency of functional bowel disorders among healthy volunteers in Mexico City. Dig Dis 2006;24:342-7. 19. López-Colombo A, Morgan D, Bravo-González D, et al. The epidemiology of functional gastrointestinal disorders in Mexico: A population-based study. Gastroenterol Res Pract 2012;2012:606174. 111 Capítulo 8 Epidemiología del estreñimiento MA. EUGENIA ICAZA CHÁVEZ BEATRIZ EUGENIA PALOMO TORRES JOSÉ ALBERTO PAREDES UC ARTURO SEGURA MORENO 1. INTRODUCCIÓN El estreñimiento crónico es uno de los principales problemas que se atienden cotidianamente. Es una condición muy frecuente en la población general y también en los enfermos que acuden a clínicas de atención gastrointestinal. Es más prevalente en las mujeres y en personas de edad avanzada. Los pacientes sufren debido a evacuaciones difíciles, infrecuentes o aparentemente incompletas. El estreñimiento tiene el potencial de provocar complicaciones (hemorroides o impacto fecal) que pueden asociarse con alteraciones concomitantes, como la inflamación rectal, la incontinencia fecal y el sangrado rectal.1 Aunque el impacto en la calidad de vida, los costos en visitas médicas y los medicamentos son muy importantes, una asociación que genera preocupación es la posible relación entre el estreñimiento crónico, el cáncer de colon y recto y su concomitante mortalidad.2 Las prevalencias reportadas en distintas poblaciones son muy variadas, y van desde .7% a 81%,3 aunque en general están entre 9% y 20%, dependiendo del área geográfica estudiada.4 El sexo femenino, la edad, el nivel socioeconómico y la escolaridad tienen el mayor impacto sobre la prevalencia del estreñimiento.5 La carga económica y de atención a la salud debida al estreñimiento son altos.6 Conocer la epidemiología de este trastorno en nuestro país es muy importante para establecer medidas terapéuticas y de prevención. ¢4XÌ HV XQD HYDFXDFLÖQ QRUPDO" (V LPSRUWDQWH GHILQLU TXÌ son las evacuaciones normales. La población general reconoce la importancia de los hábitos intestinales, pero la percepción de lo que significa un hábito intestinal normal puede variar mucho de persona a persona y en distintas poblaciones, esto por razones sociales y culturales.7 En un cuestionario postal enviado por un grupo de médicos de primer contacto en Londres, de 171 pacientes mayores de 55 años de edad que respondieron a las preguntas, 79% manifestaron tener una evacuación diaria y 90% opinaron que ser regular en las evacuaciones es importante para una buena salud.8 En España, se envió un cuestionario 115 MARÍA EUGENIA ICAZA CHÁVEZ a una población de trabajadores asintomáticos y se obtuvieron 414 respuestas. La edad promedio de los individuos fue de 33 años (20 a 64 años), 45% mujeres. El número promedio de evacuaciones por semana fue de 7.1 ± 3.3. El 62.4% de los individuos informó tener entre 5 y 8 evacuaciones a la semana y 36% mencionó pujar durante las evacuaciones por lo menos 25% del tiempo.9 En un estudio de población abierta en Suecia con 2,000 individuos de entre 31 y 76 años de edad, 67.8% de quienes contestaron reportó tener una evacuación al día. El 95.6% de los individuos tuvo entre 3 evacuaciones al día a 3 evacuaciones a la semana.10 En Nueva Zelanda, en el análisis de 717 respuestas a un cuestionario en individuos mayores de 18 años de edad, la mediana reportada de la frecuencia de las evacuaciones fue de siete por semana (intervalo de 1 a 70). La frecuencia normal de movimientos intestinales fue de 2 a 17 por semana.11 En México se realizó un estudio transversal en población abierta en 1,041 individuos en seis ciudades de diferentes estados para evaluar sus hábitos defecatorios por medio de un cuestionario. Dentro de este estudio se preguntó a los participantes sobre sus hábitos de defecación de acuerdo con la escala de Bristol. En la figura 1 se muestran las frecuencias reportadas de las evacuaciones en este estudio. Figura 1. Porcentaje de pacientes y frecuencia de la evacuación SIGAME 2014 80 70 69 60 50 % 40 30 18 20 10 0 116 Diario C/ 48 h Modificado de Remes-Troche JM, et al7 7 6 C/72 h < C/72 h CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO En un estudio realizado en Suecia con 120 individuos sin enfermedades orgánicas o gastrointestinales, estudiados con colonoscopia, estudios de laboratorio y revisados por un gastroenterólogo, 98% reportó que evacuan entre 3 veces al día a 3 veces a la semana, 12% tenía evacuaciones duras y 10%, sueltas. Es importante destacar que 36% reportó urgencia; 47%, pujo y 46%, sensación de evacuación incompleta, por lo que los autores opinan que cierto grado de urgencia, pujo y sensación de evacuación incompleta debe ser considerado normal.12 Con base en estos y otros estudios, se ha considerado que los individuos normales evacuan en general, entre 3 veces a la semana y 3 veces al día. 1.2. Definición de estreñimiento y estreñimiento funcional. Parecería que por la frecuencia del padecimiento y lo “sencillo” que es, el diagnóstico de estreñimiento debería ser muy fácil y los criterios diagnósticos muy claros. Sin embargo, el estreñimiento es un síndrome heterogéneo compuesto por varias molestias relacionadas con la frecuencia de las evacuaciones, su consistencia, la facilidad para evacuar y la sensación de evacuación incompleta.13 El estreñimiento autorreportado es una molestia subjetiva influenciada por costumbres sociales y no se ha demostrado que sea sensible o específico, en comparación con los criterios basados en síntomas. Las diferencias en la definición médica del estreñimiento y la percepción del paciente sobre lo que significa dificulta la evaluación de los datos epidemiológicos. Para la mayoría de los gastroenterólogos, la esencia del estreñimiento son las evacuaciones infrecuentes o la evacuación de heces pequeñas o duras. Idealmente, tendríamos que medir en los pacientes el tiempo de tránsito colónico para establecer si son estreñidos, pero esto es imposible en un estudio de población general, por lo que dependemos del recuento que hacen los pacientes de sus movimientos intestinales.14 La mayoría de las definiciones de estreñimiento se basa en una frecuencia disminuida de la defecación a menos de 2 a 3 evacuaciones por semana como síntoma único o en combinación con otras molestias, como malestar o esfuerzo excesivo para defecar.15 En 1986 Davies et al describieron una escala de ocho tipos de evacuación para investigar las diferencias en cuanto a forma y peso de las heces, comparando individuos omnívoros, vegetarianos y veganos. En 51 individuos sanos midieron el tiempo de tránsito intestinal con 117 MARÍA EUGENIA ICAZA CHÁVEZ marcadores radiopacos. Correlacionaron este tiempo con la escala de evacuaciones y con la ingestión de fibra. Encontraron que a mayor consumo de fibra, menor tiempo de tránsito intestinal, mayor peso y consistencia más suave de las heces. El tiempo de tránsito intestinal tuvo una buena correlación, sobre todo con la forma de las evacuaciones en la escala que utilizaron.16 Heaton et al describieron en 1992 una escala de seis tipos de evacuaciones y realizaron un estudio prospectivo en individuos en Bristol del Este, Inglaterra.17 La escala se denominó Escala de Bristol de la forma de las evacuaciones y fue validada por medio del tiempo total de tránsito intestinal medido con marcadores radiopacos, el cual se correlacionó con la frecuencia y la cantidad de las evacuaciones, pero sobre todo con su forma.18 En un análisis más reciente con 110 sujetos, 46 de ellos con estreñimiento crónico, con el objetivo de evaluar si la forma y la consistencia de las evacuaciones se correlaciona con el tiempo de tránsito intestinal en sanos y en estreñidos, se realizaron estudios con cápsula inalámbrica y marcadores radiopacos. Los autores encontraron que en individuos estreñidos hay una correlación moderada entre la forma de la evacuación y el tiempo de tránsito intestinal total. Las formas de Bristol < 3 tuvieron sensibilidad de 85% y especificidad de 82% para el tránsito gastrointestinal retrasado en pacientes estreñidos. No se demostró alguna correlación con la frecuencia de las evacuaciones.19 Los pacientes asocian la dificultad para expulsar las heces y la sensación de evacuación incompleta con el estreñimiento; sin embargo, esos síntomas son comunes en el síndrome de intestino irritable, pero también en la población general, como se mencionó anteriormente.12,20 En un estudio de 731 mujeres de entre 25 a 69 años de edad, se evaluó la correlación entre la autopercepción de estreñimiento y el tiempo de tránsito intestinal calculado a partir de la escala de Bristol. Encontraron que de 62 que se percibieron estreñidas, solo 33% cumplía con los criterios de Roma I y 45% tenía tránsito colónico lento. En especial, todas las pacientes que cumplían criterios de Roma I solo por pujar mucho al evacuar y por sensación de evacuación incompleta, tuvieron un tránsito intestinal normal.14 En México, en un estudio transversal hecho en seis ciudades de diferentes estados en 1,041 individuos, con el objetivo de investigar la autopercepción de estreñimiento por medio de un cuestionario, 118 CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO al ser interrogados sobre cuáles son los síntomas que caracterizan al estreñimiento, 47% opinó que la sensación de pujo o esfuerzo para evacuar, y solo 27%, que las evacuaciones duras o en bolitas lo definían. Al preguntarles si consideraban que no evacuar diario es ser estreñido, 60% respondió “sí”.7 En un estudio realizado en cinco clínicas de medicina familiar urbanas y rurales en Israel, 27% de los individuos definió estreñimiento como defecaciones cada 2 días o menos, 25% opinó que estreñimiento se definía por la presencia de evacuaciones cada 3 días o menos y 13%, que cada 4 días o menos. El 25% definió estreñimiento solo en términos de consistencia dura de las evacuaciones.21 Es interesante que, en este mismo estudio, 27% de los individuos encuestados consideró que el estreñimiento está presente cuando existen evacuaciones cada 2 días o menos frecuentes, mientras que 0% de los médicos encuestados consideró que esa es la definición de estreñimiento. El 46% de los médicos consideró que la definición de estreñimiento consiste en evacuaciones cada 4 días o menos frecuentes. Por lo tanto, los autores concluyen que hay un riesgo de que los pacientes no se sientan entendidos por su médico cuando expresan tener estreñimiento. El estreñimiento puede ser funcional, o secundario a una larga lista de factores predisponentes. El estreñimiento funcional se describe como una alteración que se caracteriza por evacuaciones persistentemente difíciles o en apariencia incompletas o infrecuentes (cada 3 o 4 días, o menos) en ausencia de síntomas de alarma u otras causas secundarias.22 Cuadro 1. Ejemplos de algunos estudios y sus criterios de inclusión Criterios de inclusión utilizados Artículo Edad (años) N° de pacientes Comorbilidades* País Garrigues V, 200423 18 - 65 349 No excluidas España Bassoti G, 200424 No especificado 488 No excluidas Italia Howell SC, 200625 25 - 64 1673 No excluidas Australia López-Colombo A, 201226 >18 500 Excluidas México Stewart WF, 199927 >18 10 018 No excluidas Estados Unidos *Entre comorbilidades se tomaron en cuenta pacientes con cualquier enfermedad grave, o bien, enfermedades crónico-degenerativas, cirugía gastrointestinal, enfermedades psiquiátricas o mujeres embarazadas 119 MARÍA EUGENIA ICAZA CHÁVEZ Las enfermedades a las que se asocia el estreñimiento son sobre todo neurológicas, metabólicas y al uso de varios medicamentos. Muchos de los estudios realizados en población general no descartan a profundidad la frecuencia de estreñimiento funcional o secundario, como se puede ver en los ejemplos del cuadro 1, sino que utilizan criterios variados, tanto los de Roma I, II y III, que se muestran en el cuadro 2, así como el estreñimiento autodefinido o criterios de estreñimiento seleccionados por los autores de cada estudio.28 Cuadro 2. Comparación de los distintos criterios de Roma Roma I Roma II Roma III Duración Síntoma Dos o más de los siguientes, por al menos 3 meses: Al menos 12 semanas, no necesariamente consecutivas, en los 12 meses anteriores, de dos o más de los siguientes: Dos o más de los siguientes durante los últimos 3 meses, con síntoma(s) de inicio al menos 6 meses antes del diagnóstico: Esfuerzo > 25% de las veces > 25% de las veces t 25% de las evacuaciones Heces apelmazadas/ duras > 25% de las veces > 25% de las veces t 25% de las defecaciones Tenesmo Sensación de evacuación incompleta >25% de las evacuaciones Sensación de evacuación incompleta >25% de las evacuaciones Sensación de evacuación incompleta t 25% de las evacuaciones Maniobras para facilitar la defecación - > 25% de las defecaciones (ej.: evacuación digital, apoyo del piso pélvico) t 25% de las defecaciones (ej.: evacuación digital, apoyo del piso pélvico) Número de evacuaciones d 2 por semana < 3 por semana < 3 por semana Dolor abdominal No requerido - - Deposiciones sueltas No presenta No presenta Rara vez se presenta sin usar laxantes Datos insuficientes para síndrome de intestino irritable No cumple criterios para síndrome de intestino irritable No cumple criterios para síndrome de intestino irritable Otros Modificado de: Sanchez MI et al, 2011.5 120 CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO De manera general, existen dos mecanismos fisiopatológicos que explican el estreñimiento, aunque pueden sobreponerse, porque el primero puede ser secundario al segundo y el segundo puede en ocasiones ser secundario al primero, a saber:22,29 x 7UDVWRUQRVGHOWUÄQVLWR x 7UDVWRUQRVGHODHYDFXDFLÖQ Para catalogar a un paciente como portador de un trastorno funcional de la defecación es indispensable que cumpla los criterios diagnósticos de estreñimiento funcional, pero que además tenga alteraciones en el mecanismo de la evacuación, ya sea por la prueba de expulsión de balón o por contracción inadecuada de los músculos del piso pélvico (Cuadro 3). En un estudio epidemiológico realizado en España investigaron en 600 mujeres sanas la presencia de estreñimiento y de evacuación discinérgica por medio de un cuestionario. La prevalencia de estreñimiento funcional fue de 28.8%. Los síntomas de evacuación discinérgica se identificaron en 8.2% de las participantes.30 Cuadro 3. Criterios de Roma III para trastorno funcional de la defecación (criterios presentes en los últimos 3 meses) - El paciente debe satisfacer los criterios diagnósticos de estreñimiento funcional - En intentos repetidos de defecar, debe tener por lo menos dos de los siguientes: x(YLGHQFLDGHDOWHUDFLÖQHQODHYDFXDFLÖQFRQEDVHHQSUXHEDVGH expulsión de balón o imagen x&RQWUDFFLÖQLQDSURSLDGDGHORVPÝVFXORVGHOSLVRSÌOYLFR HV decir, el esfínter anal o el puborrectal) o una relajación menor que 20% de la presión en reposo medido por manometría, imagen o electromiografía x)XHU]DSURSXOVLYDLQDGHFXDGDGLDJQRVWLFDGDSRUPHGLRGH manometría o imagen Modificado de: Longstreth GF, 2006.28 121 MARÍA EUGENIA ICAZA CHÁVEZ 2. EPIDEMIOLOGÍA GLOBAL Las diferencias en los factores demográficos, el muestreo y las definiciones usadas pueden explicar en parte la variabilidad de la prevalencia reportada del estreñimiento funcional.31 Es importante que los diferentes reportes indiquen cómo se define el estreñimiento, en qué población se describe y cuál es la herramienta empleada para evaluarlo. Muchos estudios de tipo transversal han reportado la prevalencia del estreñimiento, y en la mayoría de ellos queda implícito que, como las enfermedades orgánicas son poco frecuentes en la comunidad, la mayoría de los pacientes que reportan estreñimiento, son funcionales o idiopáticos. Varios de estos estudios han empleado el autorreporte de síntomas o cuestionarios, y en los años recientes se emplean cada vez más los cuestionarios de Roma.32 Se han realizado estudios transversales de prevalencia en todo el mundo, pero particularmente en Estados Unidos de América (EUA) y en Europa. Se reporta que la prevalencia de estreñimiento más baja se ha demostrado en el Sureste de Asia y la más alta en Sudamérica.32 Suares et al realizaron una revisión sistemática y analizaron la prevalencia del estreñimiento según el año de publicación de los estudios seleccionados. Documentaron que la prevalencia de estreñimiento en los estudios publicados entre 1981 y 1990 fue de 11%, y tanto en los publicados entre 1991 y 2000 como en los publicados entre 2001 y 2010 la prevalencia fue de 15% (p < .001).32 En una revisión sistemática de estudios realizados en Europa y Oceanía, Peppas et al encontraron 21 estudios elegibles realizados en 34 distintos grupos de población. Estos estudios incluían diferentes criterios de inclusión, desde estreñimiento autorreportado, hasta criterios de Roma II. En Europa, el porcentaje promedio de personas con estreñimiento fue de 17.1% y en Oceanía, de 15.3%.3 Las prevalencias reportadas en todo el mundo son parecidas.32-34 En el cuadro 4 se muestra la prevalencia de estreñimiento según las diferentes regiones. En un estudio realizado en la India y publicado recientemente, los resultados son sumamente parecidos en cuanto a prevalencia, prevalencia autorreportada y factores de riesgo.35 122 CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO Cuadro 4. Prevalencia combinada de los estudios, por regiones del mundo Número de estudios N Prevalencia combinada IC 95% Todos los estudios 41 261,040 14 12 - 17 Norteamérica 10 105,634 14 9 - 20 Norte de Europa 14 88,615 16 10 - 24 Sur de Europa 3 3,349 16 7 - 27 Oriente medio 2 18,887 14 2 - 36 Sureste de Asia 11 17,699 11 7 - 15 Sudamérica 4 7,259 18 15 - 22 Australasia 5 14,016 13 5 - 27 Multinacionales 3 27,560 14 10 - 16 Modificado de: Suares N, 2011.32 En un estudio realizado en países de Latinoamérica,36 que incluyó a Argentina, Colombia y Brasil, se entrevistaron 6,000 individuos. La prevalencia de estreñimiento fue de 14.2% en Argentina, 21.7% en Colombia y 16.7% en Brasil. En mayores de 60 años de edad ésta se incrementó a 25.4%, 26.7% y 25.8%, respectivamente. La frecuencia de los síntomas de estreñimiento y la duración del padecimiento reportado en este estudio se muestran en el cuadro 5. Cuadro 5. Frecuencia de los síntomas de estreñimiento y duración del padecimiento, por país Argentina (% pacientes) Colombia (% pacientes) Brasil (% pacientes) > 1 por semana 48.9 59.8 55.3 < 1 por semana a 1 por mes 28.1 30.9 24.5 23 9.3 20.2 Hasta 3 años 43.7 61.2 51.7 > 3 años 56.3 38.3 48.3 Parámetro Frecuencia de los síntomas > 1 por mes Duración Modificado de: Wald A, 2009.36 123 MARÍA EUGENIA ICAZA CHÁVEZ 2.1. Factores de riesgo. Peppas et al3 realizaron una revisión sistemática de estudios publicados en Europa y Oceanía; encontraron que en la mayoría de los estudios ser mujer fue un factor de riesgo, con una relación mujer:hombre de 1.78. Kinunen et al37 realizaron un estudio en Finlandia; mediante un cuestionario analizaron en 912 individuos la prevalencia de estreñimiento de acuerdo con la presencia de d 3 evacuaciones por semana. La prevalencia de estreñimiento para quienes vivían en un hospital, en un asilo, en hospitales de día, en casa y > 74 años de edad, o en casa y de entre 41 a 50 años de edad fueron de 79%, 59%, 29%, 38% y 12%, respectivamente. Los riesgos relativos (RR) para padecer estreñimiento fueron de 2.9 para quienes tenían entre 75 y 84 años de edad, 4.9 para los mayores de 84 años, 1.7 para quienes caminaban < .5 km/día, 3.4 para quienes caminaban con ayuda, 6.9 para quienes usaban silla de ruedas y 15.9 para quienes estaban en cama. Suares et al32 analizaron la prevalencia de acuerdo a edad en estudios de varias áreas geográficas del mundo. En el cuadro 6 se muestra que la edad es un factor de riesgo para el estreñimiento crónico en una revisión amplia de la literatura internacional. Bytzar et al38 analizaron el efecto de la clase socioeconómica en el estreñimiento en una población de 9,000 individuos a quienes se les envió una encuesta; encontraron que a menor nivel socioeconómico el porcentaje de pacientes que reportó síntomas de estreñimiento fue significativamente mayor. Cuadro 6. Prevalencia de acuerdo con la edad Intervalo de edad (años) n Prevalencia (IC 95%) Razón de momios (IC 95%) < 29 7,153 12 (10 - 14) 1.0 30 - 44 7,092 15 (12 - 19) 1.2 (1.09 - 1.58) 45 - 59 5,014 16 (11 - 21) 1.31 (1.09 - 1.58) > 60 3,443 17 (13 - 22) 1.41 (1.117 - 1.7) Modificado de Suares N, 2011 32 2.2. Calidad de vida y efectos en la salud. La reacción de un paciente al diagnóstico de una enfermedad funcional gastrointestinal suele ser distinta a la reacción del médico. Los pacientes no entienden su situación 124 CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO y pueden sufrir aislamiento social pues temen que la comida precipite sus síntomas y se sienten frustrados por la falta de tratamientos eficaces.39 Varios estudios en población abierta estadounidense han mostrado que el estreñimiento es un problema físico y mental17 y puede interferir con la vida diaria y el bienestar, especialmente en grupos de más edad.40 Irvine et al 41 estudiaron a pacientes que se autorreportaban como estreñidos y también los clasificaron por medio de la definición de Roma II; encontraron disminuciones en las calificaciones mental y física del SF-36 en pacientes con estreñimiento, en comparación con los controles. Los sujetos con autorreporte de estreñimiento tenían las puntuaciones medias más bajas en casi todos los ámbitos entre los grupos investigados. Los individuos con diagnóstico de estreñimiento, ya sea por Roma II o por autorreporte, tuvieron puntuaciones significativamente peores que la población normal canadiense. En México existen pocos datos sobre la calidad de vida de los pacientes con estreñimiento funcional crónico. Sin embargo, en un pequeño estudio prospectivo en pacientes con estreñimiento funcional estudiados por medio del cuestionario de Roma I y que consultaron en un centro de referencia en la ciudad de México, se evidenció que en comparación con los pacientes con estreñimiento crónico y tránsito colónico normal, aquellos con tránsito colónico prolongado presentaban menor calificación en la subescala del componente físico del SF-36, un instrumento genérico para medición de calidad de vida.42 Adicionalmente, la subescala del componente mental fue menor en aquellos con sobreposición de estreñimiento crónico y síndrome de intestino irritable con predominio de estreñimiento (SII-E), en comparación con el subgrupo que solo llenaba criterios para SII-E, sugiriendo que el retardo en el tránsito colónico puede comprometer la calidad de vida de dichos pacientes.43 Curiosamente, en el estudio de Glia y Lindberg,44 se demostró que en los pacientes con estreñimiento crónico asociado a tránsito lento, la afectación en la calidad de vida era menor que en los individuos con tránsito normal, lo que nos remite a la discusión sobre si el SII-E y el estreñimiento funcional son, por lo menos en algún grupo de pacientes, la misma enfermedad. Los estudios en este sentido son contradictorios.45,46 Belsey et al47 realizaron una revisión de 13 estudios de la literatura, 10 en adultos y tres en niños. En la mayor parte de los 125 MARÍA EUGENIA ICAZA CHÁVEZ estudios en adultos se utilizó el cuestionario SF-36. Los ocho dominios que estudia este cuestionario fueron significativamente menores en personas con estreñimiento, comparados con la población de adultos sanos, particularmente en los aspectos de salud general, función social y salud mental. La calificación promedio normalizada de las puntuaciones compuestas física y mental (PCS y MCS) fueron de 47.5 y 45.8, respectivamente, en comparación con los individuos sanos (51.3 y 48.8, respectivamente). Las diferencias son más notorias cuando se toman en cuenta individuos hospitalizados. Las calificaciones en los estudios de la comunidad muestran que la calidad de vida en pacientes de la comunidad con estreñimiento es comparable con la de aquellos con colitis ulcerativa, alergias crónicas, diabetes mellitus y dermatitis. En los estudios en pacientes hospitalizados, la calidad de vida es comparable con la de quienes padecen enfermedad inflamatoria intestinal descompensada, dispepsia funcional y algunas enfermedades reumatológicas. Si bien es útil comprender el impacto del estreñimiento en los pacientes, idealmente buscamos mejorar su calidad de vida por medio del tratamiento. Esto se ha demostrado en varios estudios, cuando tanto el uso de fármacos como la cirugía logran resolver el estreñimiento.48-50 Tradicionalmente no se considera que enfermedades gastrointestinales funcionales están asociadas con el aumento en la mortalidad del paciente; sin embargo, en algunos estudios se ha cuestionado la posible asociación entre el cáncer de colon, la mortalidad general y el estreñimiento crónico.51 Entre 1988 y 1993 se enviaron cuestionarios en Olmsted County en el estado de Minnesota, EUA, para identificar a individuos con diversos síndromes funcionales. Chang et al reportaron en 2010 un análisis de estos cuestionarios en que se evaluó la asociación entre los síndromes funcionales y la sobrevida de quienes los padecen. Se analizaron 3,933 individuos. El 16% tenía estreñimiento crónico. El estreñimiento crónico se asoció con peor sobrevida, aun cuando se ajustaron otros factores de riesgo, como edad y tabaquismo (RR 1.23, IC 95%, 1.07 a 1.42). Los demás síndromes funcionales no tuvieron riesgo de menor sobrevida.2 126 CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO 3. EPIDEMIOLOGÍA EN MÉXICO López-Colombo et al realizaron un estudio en población abierta en el estado de Tlaxcala. La muestra consistió en 500 individuos con edad promedio de 39.8 ± 16.3 años, 305 mujeres y 195 hombres; fue seleccionada de manera aleatoria, pero excluyendo a individuos con embarazo y enfermedades crónicas. Se aplicó el Cuestionario Modular de Roma II. Encontraron 7.4% de los individuos con criterios diagnósticos de estreñimiento funcional, 9.2% en mujeres y 4.9% en hombres, con una tendencia hacia la significancia estadística al comparar hombres y mujeres (p = .057).26 Schmulson et al33 analizaron los cuestionarios modulares de Roma II aplicados a un grupo de 324 voluntarios sanos, que eran personal académico y no académico de la Universidad Autónoma Metropolitana Iztapalapa de la Ciudad de México. La edad promedio de los voluntarios fue de 35.7 años y 66% eran mujeres. El 18.8% (IC 95%, 14.7 a 23.5) de los participantes reportó estreñimiento funcional. La prevalencia de estreñimiento en hombres fue de 14.7% y en mujeres, de 21.4%. En 3.1% se pudo establecer la sospecha de discinergia del piso pélvico, de acuerdo a Roma II. Remes Troche et al realizaron un estudio transversal prolectivo en seis ciudades de la República Mexicana ubicadas en cuatro zonas geográficas diferentes del país. Se aplicó un cuestionario de Roma III en 1,041 sujetos de la población general. El 63% eran mujeres, cuya edad promedio fue de 34 ± 14 y en los hombres, de 35 ± 15. Solo 6% era mayor de 60 años de edad. La mediana de las evacuaciones fue de dos al día y la mediana en la escala de Bristol fue de 3 a 4 (promedio 3.4). De acuerdo con los criterios de Roma III, 20% de los sujetos padecía estreñimiento funcional.7 En el meta-análisis publicado en México en 2011, se analizaron los estudios mexicanos mencionados previamente; se reportó que la prevalencia de estreñimiento funcional estimada en la población mexicana es de 14.4% (IC 95%, 12.6 a 16.6).34 3.1. Impacto económico. En el estudio de López Colombo et al realizado en el estado de Tlaxcala, en población general, con diseño transversal, en una muestra aleatoria de 500 casas, se estableció que 127 MARÍA EUGENIA ICAZA CHÁVEZ 7.4% de los encuestados padecía estreñimiento funcional de acuerdo a Roma II. Estos pacientes reportaron que 37.8% de los casos usaba medicamentos y 35.1% realizaba visitas médicas por sus problemas gastrointestinales.26 En el estudio de Remes Troche et al, 28% de los individuos que se consideraba estreñido tomó laxantes. Sin embargo, no hubo diferencias entre el consumo de suplementos de fibra, ejercicio, ingesta de agua o consumo de tés para evacuar, respecto de los sanos.7 En un estudio realizado en países de Latinoamérica que incluyó a Argentina, Colombia y Brasil se entrevistaron 6,000 individuos. En el cuadro 7 se muestra que entre 23% y 33% de los individuos de cada país usaba laxantes. En un estudio en Suiza con 2,000 personas, por medio de un cuestionario, se reportó que 22% de las mujeres y 10% de los hombres ancianos utilizaba laxantes.52 Cuadro 7. Porcentaje de individuos que utiliza laxantes, por cada país Argentina % Colombia % Brasil % 14.2 21.7 16.7 Mujeres 23 28 33 Hombres 17 38 17 Mujeres 16.7 10.7 16.5 Hombres 7.1 3.7 7.1 Parámetro Prevalencia total de estreñimiento Usaban laxantes Usando laxantes por más de 10 años Modificado de: Wald A, 2009 36 128 CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO Cuadro 8. Costos de atención en pacientes con estreñimiento crónico Referencia Año Costos (actualizados a 2012) Tipo de gasto % Ahn J53 2008 EUA US $2,778.00 Consulta Hospitalización Fármacos Largo plazo 62.3 13.4 22.6 1.7 Nguyen T54 2008 EUA US $7,510.00 Pekmazaris R55 2002 EUA US $101.30/día N Consulta externa 936 Medicamentos, atención médica, estudios 31 Modificado de: Nellesen D, 201357 Independientemente de los costos en medicamentos y consultas, el estreñimiento crónico provoca pérdidas en la productividad y las actividades sociales: en Canadá, 30% de los individuos estreñidos dijo ser menos productivo en el trabajo o la escuela, 13% perdió días de trabajo o escuela y casi 10% llegó tarde o tuvo que abandonar el trabajo o la escuela más temprano por sus síntomas.56 En el cuadro 8 se muestran varios estudios hechos en EUA, de pacientes con estreñimiento y los gastos generados por su atención.57 El impacto global del ausentismo se estima como una ausencia del trabajo de.4 días/año, equivalente a 13.7 millones de días de actividad disminuida en EUA cada año.47 4. RESULTADOS DEL ESTUDIO SIGAME Los aspectos metodológicos están descritos en el Capítulo 2 “Estudio SIGAME: generalidades y diseño del estudio”. Del total de la muestra evaluada, 879 sujetos (22.3%, IC 95% 21.2 a 23.3) cumplieron con los criterios para estreñimiento funcional, es decir, al menos dos de los síntomas sugeridos por Roma III. Las características demográficas de los pacientes con estreñimiento funcional se muestran en el cuadro 9. En el análisis univariado la edad fue significativamente mayor (p < .01) 129 MARÍA EUGENIA ICAZA CHÁVEZ en los individuos con estreñimiento funcional, en comparación con los controles. La relación mujeres:hombres con estreñimiento funcional fue de 1.2, aunque la diferencia no alcanzó significancia estadística (p = .32). No se demostraron diferencias estadísticas en cuanto a la prevalencia del estreñimiento funcional entre las distintas regiones estudiadas; sin embargo, al comparar las regiones económicamente altas con las económicamente bajas, se encuentra una diferencia estadísticamente significativa (p = .0001), pues del total de individuos con estreñimiento funcional, 59.6% corresponde a zonas económicamente altas y medio-altas y 40.4% de los individuos a zonas bajas y medio-bajas, con una relación de 1.5. La ocupación de ama de casa fue significativamente mayor en el grupo de estreñimiento funcional, en comparación con los controles (p < .001). Los individuos con estreñimiento funcional tenían con mayor frecuencia como nivel máximo de estudios la secundaria (13.1%), en comparación con los controles (6.9%) (p < .001). De acuerdo con el análisis multivariado, las variables detectadas en el análisis univariado mantuvieron su significancia estadística. Es decir, la edad es mayor, el ser ama de casa y el tener preparación máxima secundaria (puede interpretarse como escolaridad limitada) se asocian con estreñimiento funcional. Parece ser que la región Noreste tiene la frecuencia más baja de estreñimiento funcional. 130 CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO Cuadro 9. Análisis univariado sobre las características sociodemográficas, comparadas con un grupo control SIGAME 2014 Edad EF (n = 879) Controles (n = 1,110) 39.5 ± 13 * 37.6 ± 12 % % 45.3 54.7 58.7 48.6 Zona geográfica 1. Noroeste 2. Noreste 3. Centro Norte 4. Oeste 5. Centro Sur 6. Suroeste 7. Este 8. Sureste 13.5 8.9 11 21 14.3 9.9 10.6 10.8 13.7 15.8 8.4 21.5 14.7 10.2 8.8 6.9 Zona económica con ingreso 1. Alto 2. Medio Alto 3. Medio 4. Bajo 23.1 36.9 24.2 15.8 31.3 36.7 17 15 Ocupación 1. Ama de casa 2. Desempleado 3. Estudiante 4. Jubilado 5. Otro 6. Profesionista 21.2* 1.4 12.6 4.7 22.9 37.3 14.3 1.4 13.6 5.3 19.7 45.7 Escolaridad 1. Primaria 2. Secundaria 3. Preparatoria 4. Universidad 5. Otro 4.6 13.1* 22.3 55.9 4.2 3.2 6.9 23.4 62.3 5.1 x+RPEUH x0XMHU * p < .001 EF: estreñimiento funcional 131 MARÍA EUGENIA ICAZA CHÁVEZ 4.1. Síntomas asociados o que definen el estreñimiento funcional. Respecto de los síntomas que con mayor frecuencia son utilizados por los pacientes para definir estreñimiento funcional, de acuerdo a Roma III, la sensación de bloqueo, el esfuerzo al evacuar y la sensación de evacuación incompleta son los más frecuentes. En la figura 2 se observa que 27.8% de individuos no considerados como estreñidos por Roma III, refiere sensación de evacuación incompleta, 24.1% tiene sensación de bloqueo, 26.1% refiere esfuerzo al defecar, 27.5% tiene evacuaciones duras y hasta 10.9% de los individuos sanos realiza maniobras digitales. En la figura 3 observamos la coexistencia en los individuos con estreñimiento funcional de otros trastornos funcionales digestivos y otros síntomas digestivos frecuentes. Al analizar la calidad de vida en los individuos con estreñimiento funcional y compararlo con los individuos sanos, se encontraron diferencias significativas en el puntaje global, actividades diarias, el vestido, la dieta y psicológicas, con p < .05 (Cuadro 10). Figura 2. Porcentaje de síntomas que definen el estreñimiento referido, por los individuos estreñidos y los voluntarios sanos SIGAME 2014 100 90 EF 83.2* Sanos 80 76.2* 72.5* 68.7* 70 60 50 40 36* 27.5 30 26.1 27.8 24.1 21.4 27* 20 10.9 10 0 Poca frecuencia Evacuaciones duras Esfuerzo EF: estreñimiento funcional 132 Evacuación incompleta Sensación de bloqueo Maniobras digitales CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO Figura 3. Coexistencia de otros síntomas y trastornos funcionales digestivos en individuos con estreñimiento funcional SIGAME 2014 10 8.3 8 6 5.7 4.7 4 2.5 2 0 DTNC Pirosis Eructos excesivos Dispepsia DTNC= dolor torácico no cardiaco Cuadro 10. Calidad de vida de los pacientes que sufren estreñimiento funcional (de acuerdo a PAGI-QoL) SIGAME 2014 Sanos (n = 925) EF (n = 879) 93.8 ± 17 85 ± 15* Actividades diarias 95.2 ± 17 87 ± 15 * Vestido 91.2 ± 24 75 ± 23* Dieta 93.16 ± 22 84 ± 13 * Relaciones 96.3 ± 18 91 ± 13 Psicológicas 91.1 ± 17 80 ± 15 * Puntaje global *p < .05 EF: estreñimiento funcional 133 MARÍA EUGENIA ICAZA CHÁVEZ 5. CONCLUSIONES La prevalencia general del estreñimiento funcional en este estudio fue de 22.3%. Esta cifra es alta en comparación con otras partes del mundo, donde va de entre 12% a 17%.32 También es mayor a la señalada en otros países de Latinoamérica, como Brasil (16.7%) y Argentina (14.2%), pero similar a la reportada en Colombia (21.7%).36 En el metaanálisis publicado previamente en México, la prevalencia reportada fue de 14.4%,34 por lo que nuestro estudio a nivel nacional muestra una prevalencia mayor. Con excepción de algunos estudios, en la mayoría de los realizados en el ámbito internacional,3 ser mujer es un factor de riesgo, con una proporción mujer:hombre de 1.78. En nuestro reporte se identificó una proporción de 1.2, que no alcanzó diferencia estadísticamente significativa. Cuando se compararon las distintas regiones del país solo se obtuvieron diferencias al agruparlas en zonas con mayor poder económico y menor poder económico; el número de individuos estreñidos de las zonas de más alto poder adquisitivo fue mayor. Esto difiere de estudios realizados previamente en otros países,38 en los que se ha demostrado que a menor nivel socioeconómico, mayor estreñimiento. En cuanto a la escolaridad, en nuestro estudio solo el nivel de educación secundaria se asoció con mayor estreñimiento, lo que puede interpretarse como un bajo nivel de estudios. Previamente y en muchas publicaciones se ha demostrado que el estreñimiento tiene efectos sobre la calidad de vida, incluidos estudios realizados en México.17,40-44 En el reporte de SIGAME encontramos una peor calidad de vida en los individuos con estreñimiento funcional, en comparación con los sanos. No son pocos los individuos que no entran en la definición de estreñimiento funcional, pero que tienen algunos síntomas de dificultad para evacuar. Prácticamente 25% de la población expresó tener esfuerzo al evacuar o sensación de evacuación incompleta o sensación de bloqueo a la salida, estos mismos datos se han mencionado en otros estudios.12 Por esto, se puede pensar que cierto grado de esfuerzo o dificultad al evacuar es muy común y no necesariamente patológico. 134 CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO El estreñimiento funcional es un trastorno digestivo muy común en nuestro país, tiene una de las prevalencias más altas a nivel mundial y afecta de manera significativa la calidad de vida de quien lo padece. REFERENCIAS 1. Map of Digestive Disorders & Diseases. Disponible en: http://www.worldgastroenterology.org/assets/downloads/pdf/wdhd/2008/ events/map_of_digestive_disorders_2008.pdf 2. Chang JY, Locke III GR, McNally M, et al. Associations between medication use and functional gastrointestinal disorders: A population-based study 2010;105:822-32. 3. Peppas G, Alexiou VG, Mourtzoukou E, et al. Epidemiology of constipation in Europe and Oceania: a systematic review. BMC Gastroenterol 2008;8:5. 4. Gaburri M, Bassotti G, Bacci G, et al. Functional gut disorders and health care seeking behavior in an Italian non-patient population. Recent Prog Med 1989;80:241–4. 5. Sanchez MI, Bercik P. Epidemiology and burden of chronic constipation. Can J Gastroenterol 2011;25(Suppl B):11B–15B. 6. Sonnenberg A, Koch TR. Physician visits in the United States for constipation: 1958 to 1986. Dig Dis Sci 1989;34:606-11. 7. Remes-Troche JM, Carmona-Sánchez R, González-Gutiérrez M, et al. ¢4XÌ VH HQWLHQGH SRU HVWUHÔLPLHQWR" 8Q HVWXGLR HQ SREODFLÖQ DELHUWD Rev Gastroenterol Mex 2009;74:321-8. 8. MacDonald L, Freeling P. Bowels: beliefs and behavior. Fam Pract 1986;3:80-4. 9. Roig-Vila JV, García-García A, Flores-Alandi C, et al. The defecation habits in a normal working population. Rev Esp Enferm Dig 1993;84:224-30. 10. Walter S, HalbookO, Gotthard R, et al. A population-based study on bowel habits in a Swedish community: prevalence of faecal incontinence and constipation. Scand J Gastroenterol 2002;37:911-6. 11. Lynch AC, Dobbs BR, Keating J, Frizelle FA. The prevalence of faecal incontinence and constipation in a general New Zealand population: a postal survey. N Z Med J 2001:26;114:474-7. 12. Walter SA, Kjellstrom L, Nyhlin H, et al. Assessment of normal bowel habits in the general adult population: the Popcol study. Scand J Gastroenterol 2010;45:556-66. 135 MARÍA EUGENIA ICAZA CHÁVEZ 13. Thompson WG, Longstreth GF, Drossman DA, et al. Functional bowel disorders and functional abdominal pain. En: Drossman DA, Corazziari E, Talley NJ, Ed. The functional gastrointestinal disorders. McLean, VA: Degnon; 2000:351–432. 14. Probert CSJ, Emmet PM, Cripps HA. Evidence for the ambiguity of the term constipation: the role of irritable bowel syndrome. Gut 1994;35:1455-8. 15. Dennison C, Prasad M, Lloyd A, et al. The health-related quality of life and economic burden of constipation. Pharmacoeconomics 2005;23:461-76. 16. Davies GJ, Crowder M, Reid B, Dickerson JW. Bowel function measurements of individuals with different eating patterns. Gut 1986;27:164–9. 17. Heaton KW, Radvan J, Cripps H, et al. Defecation frequency and timing, and stool form in the general population: a prospective study. Gut 1992;33:818–24. 18. Lewis S, Heaton KW. Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol 1997;32:920-4. 19. Saad RJ, Rao SS, Koch KL, et al. Do stool form and frequency correlate ZLWK ZKROHJXW DQG FRORQLF WUDQVLW" 5HVXOWV IURP D PXOWLFHQWHU VWXG\ in constipated individuals and healthy controls. Am J Gastroenterol 2010;105:403-11. 20. Heaton KW, Ghosh S, Braddon FEM. How bad are the symptoms and bowel G\VIXQFWLRQRISDWLHQWVZLWKWKHLUULWDEOHERZHOV\QGURPH"$SURVSHFWLYH controlled study with emphasis on stool form. Gut 1991;32:73-9. 21. Herz MJ, Kahan E, Zalevski S, Aframian R, Kuznitz D, Reichman S. Constipation: a different entity for patients and doctors. Fam Pract 1996;13:156-9. 22. Greger L, Hamid S, Malfertheiner P, et al. Constipation: a global perspective. World Gastroenterology Organization Global Guidelines. 2010 http://www.worldgastroenterology.org/assets/export/userfiles/05_ constipation.pdf 23. Garrigues V, Galvez C, Ortiz V, et al. Prevalence of constipation: agreement among several criteria and evaluation of the diagnostic accuracy of qualifying symptoms and self-reported definition in a population-based survey in Spain. Am J Epidemiol 2004;159:520-6. 24. Bassotti G, Bellini M, Pucciani F, et al. An extended assessment of bowel habits in a general population. World J Gastroenterol 2004;10:713-6. 25. Howell SC, Quine S, Talley NJ. Low social class is linked to upper gastrointestinal symptoms in an Australian simple of urban adults. Scand J Gastroenterol 2006;41:657-66. 136 CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO 26. López-Colombo A, Morgan D, Bravo-González D, et al. The epidemiology of functional gastrointestinal disorders in Mexico: A population-based study. Gastroenterol Res Pract 2012;2012:606174. 27. Stewart WF, Liberman JN, Sandler RS, et al. Epidemiology of constipation (EPOC) study in the United States: relation of clinical subtypes to sociodemographic features. Am J Gastroenterol 1999;94:3530-40. 28. Longstreth GF, Thompson WG, Chey WD, et al. Functional bowel disorders. Gastroenterology 2006;130:1480-91. 29. Longstreth GF, Thompson WG, Chey WD, et al. Functional Bowel Disorders. En: Drossman DA, Corazziari E, Spiller RC, et al. Rome III. The functional gastrointestinal disorders. Tercera edición. Allen Press,Inc., Lawrence, Kansas, USA: 515 . 30. Ribas Y, Saldaña E, Martí-Ragué J, Clavé P. Prevalence and pathophysiology of functional constipation among women in Catalonia, Spain. Dis Colon Rectum 2011;54:1560-9. 31. Pare P, Ferrazzi S, Thompson WG, et al. An epidemiological survey of constipation in Canada: Definitions, rates, demographics, and predictors of health care seeking. Am J Gastroenterol 2001;96:3130–7. 32. Suares NC, Ford AC. Prevalence of and risk factors for chronic idiopathic constipation in the community: systematic review and meta-analysis. Am J Gastroenterol 2011;106:1582-91. 33. Schmulson M, Ortiz O, Santiago-Lomelí M, et al. Frequency of functional bowel disorders among healthy volunteers in Mexico City. Dig Dis 2006;24:342-7. 34. Remes-Troche JM, Tamayo de la Cuesta JL, Raña Garibay R, et al. Guías clínicas para el diagnóstico y tratamiento de la constipación en México. A). Epidemiología (meta-análisis de la prevalencia), patofisiología y clasificación. Rev Gastroenterol Mex 2011;2:126-32. 35. Rajput M, Saini SK. Prevalence of constipation among the general population: a community-based survey from India. Gastroenterol Nurs 2014;37:425-9. 36. Wald A, Mueller-Lissner S, KammMa, et al. Survey of laxative use by adults with self-defined constipation in South America and Asia: a comparison of six countries. Aliment Pharmacol Ther 2009;31:274-84. 37. Kinnunen O. Study of constipation in geriatric hospital, day hospital, old people´s home and home. Aging 1991;3:161-70. 38. Bytzar P, Howel S, Leemon M, et al. Low socioeconomic class is a risk factor for upper and lower gastrointestinal symptoms: a population based study in 15,000 Australian adults. Gut 2001;49:66-72. 137 MARÍA EUGENIA ICAZA CHÁVEZ 39. Shaheen NJ, Hansen RA, Morgan DR, et al. The burden of gastrointestinal and liver diseases 2006. Am J Gastroenterol 2006;101:2128–30. 40. O’Keefe EA, Talley NJ, Zinsmeister AR, et al. Bowel disorders impair functional status and quality of life in the elderly: A population-based study. J Gerontol 1995;50:184–9. 41. Irvine EJ, Ferrazzi S, Pare P, et al. Health-related quality of life in functional GI disorders: Focus on constipation and resource utilization. Am J Gastroenterol 2002;97:1986–93. 42. Ruiz JC, Ortiz OM, Hinojosa C, et al. El tránsito colónico prolongado se asocia a menor calidad de vida (CV) en los pacientes constipados. Rev Gastroenterol Mex 2003;68(Suppl 2):99. 43. Schmulson M. Constipation and colonic transit in Mexican patients [letter]. Rev Gastroenterol Mex 2010;75:5. 44. Glia A, Lindberg G. Quality of life in patients with different types of functional constipation. Scand J Gastroenterol 1997;32:1083–9. 45. Chang JY, Locke GR 3rd, Schleck CD, et al. Lack of familial aggregation in chronic constipation excluding irritable bowel syndrome: A populationbased study. Dig Dis Sci 2014 Dec 23. [Publicación electrónica previa a la impresa]. 46. Shekhar C, Monaghan PJ, Morris J, et al. Rome III functional constipation and irritable bowel syndrome with constipation are similar disorders within a spectrum of sensitization, regulated by serotonin. Gastroenterology 2013;145:749-57. 47. Belsey J, Greenfield DC, Geraint M. Systematic review: impact of constipation on quality of life in adults and children. Aliment Pharmacol Ther 2010;31:938-49. 48. Chan AO, Mo HW, Leung G, et al. Efficacy of tegaserod for functional constipation in Chinese subjects: A randomized double-blind controlled trial in a single centre. Aliment Pharmacol Ther 2007;25:463–9. 49. Charach G, Greenstein A, Rabinovich P, et al. Alleviating constipation in the elderly improves lower urinary tract symptoms. Gerontology 2001;47:72–6. 50. Nyam DC, Pemberton JH, Ilstrup DM, Rath DM. Long-term results of surgery for chronic constipation. Dis Colon Rectum 1997;40:273–9. 51. Suzuki K, Japan Collaborative Cohort Study for Evaluation of Cancer. Health conditions and mortality in the Japan Collaborative Cohort Study for Evaluation of Cancer (JACC). Asian Pac J Cancer Prev 2007;8 Suppl:25-34. 138 CAPÍTULO 8 x EPIDEMIOLOGÍA DEL ESTREÑIMIENTO 52. Walter S, Hallbook O, Gotthard R, et al. A population-based study on bowel habits in a Swedish community: prevalence of faecal incontinence and constipation. Scand J Gastroenterol 2002;37:911-6. 53. Ahn J, Brook R, Nichol B, et al. Similarities between constipation with and without irritable bowel syndrome in a California Medicaid (Medi-Cal) population: costs trends by category in the 12 months after diagnosis from 1997-2002. Gastroenterology 2008;134:A-468. 54. Nguyen T, Palsson O, Von Korff M, et al. Health care costs and utilization in patients with chronic constipation. Gastroenterology 2008;134(4 Suppl 1):A280. 55. Pekmezaris R, Aversa L, Wolf-Klein G, Cedarbaum J, Reid-Durant M. The cost of chronic constipation. J Am Med Dir Assoc 2002;3:224-8. 56. Hunt R, Dhaliwal S, Tougas G, et al. Prevalence, impact and attitudes toward lower gastrointestinal dysmotility and sensory symptoms and their treatment in Canada: A descriptive study. Can J Gastroenterol 2007;21:31-7. 57. Nellesen D, Yee K, MPH, Chawla A, et al. A Systematic Review of the Economic and Humanistic Burden of Illness in Irritable Bowel Syndrome and Chronic Constipation. J Manag Care Pharm 2013;19:755-64. 139 Capítulo 9 Epidemiología de los trastornos anorrectales ENRIQUE COSS ADAME 1. INTRODUCCIÓN Los trastornos anorrectales son heterogéneos en su presentación y comprenden tres grandes grupos de complejos sintomáticos: a) incontinencia fecal, b) dolor anorrectal y c) discinergia de piso pélvico.1 Cabe destacar que estos trastornos han sido catalogados de acuerdo con criterios derivados del consenso de Roma, y que se han refinado para su última edición publicada desde 2006.2 A pesar de lo frecuente de su presentación, estos trastornos son reportados de forma inconstante, bien sea por desconocimiento del médico acerca de la patología o porque el paciente no lo informa debido a la pena que éstos generan. 1.1. Incontinencia fecal (IF). Es un trastorno que impacta en la calidad de vida de quien la padece ocasionando aislamiento, incapacidad laboral y afectación de la esfera psicológica del paciente. Estadísticas generadas en otras partes del mundo establecen que afecta a 2% a 5% de sujetos menores de 65 años de edad, 10% a 18% en mayores de esa edad y hasta en 50% de pacientes ancianos que viven en asilos.3 La IF se puede clasificar según la presentación clínica en tres tipos: a) pasiva (incapacidad de retener materia fecal sólida), b) de urgencia (incapacidad de contener la evacuación) y c) escape o fuga fecal (manchado debido a escape de pequeñas cantidades de heces).4 De acuerdo con los criterios de Roma III, la IF funcional se diagnostica después de haber descartado causas orgánicas y realizado estudios funcionales, incluyendo manometría anorrectal, así como evaluación estructural con ultrasonido endoanal (Cuadro 1). 1.2. Proctalgia crónica y proctalgia fugax. La proctalgia crónica tiene etiología heterogénea y se considera dentro de los diagnósticos diferenciales de dolor pélvico crónico. La proctalgia crónica es también conocida como síndrome del elevador del ano, síndrome de piriforme y mialgia pélvica crónica. Estudios de encuesta en los Estados Unidos de América (EUA) refieren una prevalencia de 6.6%.5 Los criterios de Roma III para el diagnóstico de proctalgia crónica se resumen en el cuadro 2. 143 ENRIQUE COSS ADAME Cuadro 1. Criterios de Roma III para el diagnóstico de incontinencia fecal2 Incontinencia fecal funcional Emisión de heces recurrente e incontrolada de heces al menos una vez al mes, en un individuo de más de 4 años de edad y asociado con UNO o MÁS de lo siguiente: x)XQFLRQDPLHQWRDQRUPDOGH musculatura con estructura e innervación intactas x$QRUPDOLGDGHVPHQRUHVGH la estructura e inervación del esfínter x+ÄELWRVGHHYDFXDFLRQHV normales o alteradas (diarrea/ impacto fecal) x&DXVDVSVLFROÖJLFDV Exclusión de lo siguiente: x,QHUYDFLÖQDQRUPDOFDXVDGD por lesiones cerebrales (demencia), médula espinal, raíces nerviosas o parte de neuropatías locales o generalizadas x$QRPDOÐDVGHOHVIÐQWHUDQDO causadas por enfermedades sistémicas (escleroderma) x$QRUPDOLGDGHVHVWUXFWXUDOHV o neurogénicas que se consideren como causa principal de IF Cuadro 2. Criterios de Roma III para el diagnóstico de dolor anorrectal funcional2 Dolor anorrectal funcional A) Proctalgia crónica Presentar TODO lo siguiente: x'RORURPROHVWLDUHFWDO crónica o recurrente x'XUDFLÖQGHPLQRPÄV x([FOXLURWUDVFDXVDV isquemia, fisuras, fístulas, EII, hemorroides Asociada a dolor durante la tracción posterior del músculo puborrectal C) Dolor anorrectal funcional inespecífico Presentar criterios para proctalgia crónica D) Proctalgia fugax (debe incluir TODO) Episodios de dolor localizado en ano o recto Sin asociación con dolor durante la tracción posterior del músculo puborrectal Duración de segundos a minutos Sin dolor entre episodios EII: Enfermedad inflamatoria intestinal 144 B) Síndrome del elevador del ano Presentar criterios para proctalgia crónica CAPÍTULO 9 x EPIDEMIOLOGÍA DE LOS TRASTORNOS ANORRECTALES 1.3. Evacuación discinérgica. Se refiere a una alteración de la coordinación anorrectal, en donde el mecanismo de propulsión (maniobra de pujo) o la capacidad de relajación del esfínter anal durante la maniobra defecatoria no son apropiadas. Se desconoce el origen de la incoordinación; sin embargo, se reporta en esta población historia de abuso físico o sexual. Por otra parte, al ser más prevalente en mujeres, puede estar relacionado con trauma obstétrico. Otro postulado indica que este problema se debe a un fallo en el aprendizaje de la maniobra defecatoria desde la infancia temprana.6 La defecación discinérgica se da en el contexto del estreñimiento crónico funcional y puede sobreponerse con otros mecanismos fisiopatológicos del estreñimiento, tales como el tránsito lento o el síndrome de intestino irritable (SII).3 Se estima una prevalencia de 16% de estreñimiento crónico funcional y alrededor de 40% a 50% de estos pacientes tiene evidencia de defecación discinérgica basada en estudios de función anorrectal (manometría, defecografía, incapacidad de expulsión de balón).7 Para el diagnóstico de defecación discinérgica es necesario cumplir con criterios de estreñimiento crónico funcional, además de criterios específicos: pruebas paraclínicas, como manometría anorrectal o defecografía (Cuadro 3).2 2. EPIDEMIOLOGÍA GLOBAL Se han realizado estudios epidemiológicos en diferentes latitudes, cuyos resultados arrojan prevalencias variables debido en parte a las distintas metodologías y población encuestada. En una revisión extensa hecha por los Institutos Nacionales de Salud (NIH) de EUA se reportó una prevalencia de trastornos anorrectales de entre 2.2% a 25%. Las definiciones operacionales fueron variadas; así, los estudios de población abierta mostraron prevalencias de 2.2% a 7.5%, los de población mayor de 50 años de edad, 9.6% a 17.8% y en población con historia de trauma obstétrico se observó hasta en 25%.8 En una revisión sistemática que incluyó pacientes con alteraciones cognoscitivas se reportó IF de 18% a 27%, incluyendo a pacientes que viven en asilos.9 145 ENRIQUE COSS ADAME Cuadro 3. Criterios de Roma III para el diagnóstico de trastornos funcionales de la defecación2 Criterios diagnósticos para estreñimiento funcional Criterios diagnósticos para defecación discinérgica Cumplir con criterios en los últimos 3 meses e inicio de síntomas al menos 6 meses antes del diagnóstico 1. El paciente debe cumplir con criterios diagnósticos de estreñimiento funcional** 1. Incluir dos o más de los siguientes: Esfuerzo excesivo en más de 25% de las evacuaciones Heces duras o en “bolitas” en más de 25% de las evacuaciones Sensación de evacuación incompleta en 25% de las evacuaciones Sensación de obstrucción o bloqueo en 25% de las evacuaciones Maniobras para facilitar expulsión en 25% de las evacuaciones Menos de tres evacuaciones por semana 2. Heces disminuidas en consistencia rara vez sin uso de laxantes 3. Criterios insuficientes de síndrome de intestino irritable 2. Durante intentos repetidos para defecar, el paciente debe satisfacer al menos dos de los siguientes: x(YLGHQFLDGHHYDFXDFLÖQ alterada, basada en una prueba de expulsión de balón o estudios de imagen x&RQWUDFFLÖQLQDSURSLDGDGH los músculos del piso pélvico (esfínter anal o músculo puborrectal) o menos de 20% de relajación desde la presión en reposo del esfínter, determinado por manometría anorrectal, imagen o EMG x)XHU]DVSURSXOVLYDV inadecuadas valoradas por manometría o imagen Defecación discinérgica Criterios diagnósticos de contracción inapropiada del piso pélvico o < 20% de relajación del esfínter desde la presión en reposo con fuerza propulsiva adecuada durante la evacuación ** De acuerdo con los criterios de Roma III EMG= electromiografía Las encuestas en población abierta también han estudiado la prevalencia de otras enfermedades anorrectales. En Australia se determinó una prevalencia de 7.9% de IF, mientras que la frecuencia de síndrome del elevador del ano y de proctalgia fugax fue de 1.2% y 6.6%, 146 CAPÍTULO 9 x EPIDEMIOLOGÍA DE LOS TRASTORNOS ANORRECTALES respectivamente. Por último, la frecuencia de discinergia de piso pélvico fue de 1.6%. Estos datos fueron obtenidos utilizando el cuestionario de Roma II.10 3. EPIDEMIOLOGÍA EN MÉXICO En México hay reportes que indican la prevalencia de diferentes trastornos funcionales digestivos. En un informe que incluyó a pacientes de una población de Tlaxcala se encontró una frecuencia de 4.6% de IF, utilizando los criterios de Roma II, mientras que el síndrome del elevador del ano y proctalgia fugax mostraron prevalencias de 1.4% y 6.2%, respectivamente. Para discinergia de piso pélvico la frecuencia reportada fue de 2%.11 En otro estudio de encuesta, 324 sujetos sin síntomas gastrointestinales fueron invitados a participar en el llenado del cuestionario modular de Roma II y se encontró una frecuencia de 7.1% para IF, de 2.5% para el síndrome de elevador del ano e interesantemente una muy elevada respuesta sobre proctalgia fugax con 21%. Por último, solo 3.1% cumplió criterios para discinergia de piso pélvico.12 En un estudio que evaluó la presencia de lesiones del esfínter en primíparas e IF se encontró que 14 de 60 pacientes presentaron IF posparto. La mayoría de estas pacientes presentó lesión del canal del parto y del esfínter anal interno y externo. La episiotomía media posterior pareció proteger del desarrollo de episodios de IF.13 Otro estudio analizó la prevalencia de incontinencia urinaria e IF en pacientes del área metropolitana de Guadalajara; se encuestaron 352 mujeres de entre 15 a 85 años de edad. Se encontró que el promedio de partos fue de 3, la mayoría profesionistas, con sobrepeso u obesidad, y una frecuencia de IF de 3.4% y de incontinencia urinaria de 27.8%.14 Por último, en relación con IF, un estudio que utilizó el cuestionario de Wexner para evaluar la gravedad de la IF en pacientes ambulatorios y hospitalizados en un hospital de 3er nivel de atención y en un hospital psiquiátrico mostró que la frecuencia de IF de forma global fue de hasta 33%, distribuida como sigue: 26% en pacientes ambulatorios, 20% en hospitalizados y 53% en pacientes psiquiátricos. La asociación de IF con incontinencia urinaria fue de 58% y los casos más graves se presentaron a mayor edad de los pacientes.15 147 ENRIQUE COSS ADAME El estreñimiento es un síntoma comúnmente reportado en la población; sin embargo, el espectro de este síntoma es muy heterogéneo. En un estudio de encuesta en población abierta en seis ciudades de la República Mexicana se encontró que de un total de 1,041 encuestados 34% se reportó con estreñimiento, 21% se clasificó como estreñimiento funcional y 18% con síndrome de intestino irritable con estreñimiento. Sin embargo, llama la atención que 61% no cumplió criterios diagnósticos de estreñimiento y los síntomas que definieron mejor al estreñimiento fueron pujo o esfuerzo para defecar, síntomas que pueden observarse más en pacientes con discinergia de piso pélvico.16 De igual manera, otro estudio en el que se realizó tránsito con marcadores radioopacos en 105 pacientes que reportaron estreñimiento se encontró que el esfuerzo incrementado e infrecuencia de la evacuación fueron los síntomas más comunes, el tránsito colónico en la mayoría fue normal (84%), mientras que tan solo seis pacientes tuvieron tránsito lento y ocho en quienes la retención de marcadores a nivel rectosigmoideo sugirió discinergia de piso pélvico. En estos últimos pacientes se reportó mayor consumo de recursos de salud, incluyendo visitas al servicio de Urgencias, y con necesidad de tratamientos más agresivos (supositorios y enemas), indicando mayor gravedad de su estreñimiento.17 Finalmente, en un estudio que evaluó la calidad de vida de los pacientes con estreñimiento, de acuerdo con los criterios de Roma III, se determinó que con base en el cuestionario de salud SF-36 los pacientes con SII con estreñimiento reportan una menor calidad de vida en algunos rubros (fatiga/energía); así mismo, utilizando un cuestionario específico de calidad de vida en estreñimiento, de nuevo los pacientes con SII con estreñimiento reportaron menor calidad de vida en todos los rubros evaluados.18 4. RESULTADOS DEL ESTUDIO SIGAME 4.1. Incontinencia fecal. Derivado del Estudio SIGAME, cuyos aspectos metodológicos se describen en el Capítulo 2, a partir del cuestionamiento sobre la presencia de al menos un episodio de IF en los últimos 3 meses, tal como se establece en el cuestionario de Roma III para el diagnóstico de enfermedades gastrointestinales funcionales, 148 CAPÍTULO 9 x EPIDEMIOLOGÍA DE LOS TRASTORNOS ANORRECTALES del total de la muestra evaluada, 187 personas (4.7%, IC 95% 4.4 a 5.8) refirieron la presencia de este problema. La edad media de los sujetos encuestados fue de 49.5 ± 13 años, predominaron las mujeres (67%), la mayoría dedicadas al hogar (26.2%) . Se dividió a la República Mexicana en ocho zonas geográficas; se encontraron variaciones de acuerdo con la localización y se observó una mayor prevalencia en la zona Oeste (Nayarit, Jalisco, Colima y Michoacán), con 20.1%. En relación con la escolaridad, la IF se presentó con mayor frecuencia en personas con alto nivel de escolaridad (49.9%); los menos afectados fueron aquellos con escolaridad baja: primaria, 11.6% y secundaria, 12.1% (Cuadro 4). Sin embargo, al hacer un comparativo con controles pareados por edad y por sexo, en el análisis multivariado, se encontró que una edad mayor, ser ama de casa y tener bajo nivel de escolaridad son factores asociados a incremento de riesgo de presentar episodios de IF. La calidad de vida se evaluó utilizando un cuestionario específico para síntomas gastrointestinales (PAGI-QoL) que evalúa cinco dominios: a) actividades diarias, b) vestido, c) dieta, d) relaciones personales y e) aspectos psicológicos. En comparación con la población control (síntomas gastrointestinales negativos), los pacientes con IF mostraron puntuaciones más bajas en todos los dominios, excepto en el de relaciones personales (Cuadro 5). 4.1. Proctalgia crónica y fugax. Del total de pacientes encuestados, 245 cumplieron con criterios diagnósticos para proctalgia crónica, lo que traduce un 6.2% (IC 95% 5.5 a 7.1,) de la población estudiada. Por otra parte, 311 pacientes reportaron proctalgia fugax, es decir, 7.9% (IC 95% 7.1 a 8.8) del total de encuestados. La media de edad de los pacientes con proctalgia crónica fue de 42 ± 12, significativamente más alta al compararla con la de los sujetos con criterios para proctalgia fugax (38 ± 18, p < .05). En el análisis univariado de las variables investigadas en las diferentes zonas geográficas, se observó que a pesar de que en la zona Oeste y Centro Sur se presentaron la mayoría de casos de proctalgia crónica y fugax no hubo diferencia en comparación con la población control. Así mismo, no se observaron diferencias en relación con el estatus socioeconómico. Sin embargo, sí se encontró diferencia significativa (p < .05) en prevalencia de encuestados que realizan labores del 149 ENRIQUE COSS ADAME hogar en proctalgia crónica (22.9%) y fugax (21.2%), al comparar con controles sanos (14.3%), sin otras diferencias según la ocupación. Cuadro 4. Distribución de los pacientes con incontinencia fecal y comparación con población control SIGAME 2014 Incontinencia fecal (n = 187) Controles sanos (n = 1,110) 49.5 ± 13 * 37.6 ± 12 (%) 33 67* (%) 58.7 48.6 Zona geográfica 1. Noroeste 2. Noreste 3. Centro Norte 4. Oeste 5. Centro Sur 6. Suroeste 7. Este 8. Sureste 14.4 13.9 9 21 15.3 9.9 7.6 7.8 13.7 15.8 8.4 21.5 14.7 10.2 8.8 6.9 Zona económica con ingreso 1. Alto 2. Medio Alto 3. Medio 4. Bajo 30.1 34.9 20.2 14.8 31.3 36.7 17 15 Ocupación 1. Ama de casa 2. Desempleado 3. Estudiante 4. Jubilado 5. Otro 6. Profesionista 26.2* 1.4 12.6 8.7* 20.9 32.3 14.3 1.4 13.6 5.3 19.7 45.7 Escolaridad 1. Primaria 2. Secundaria 3. Preparatoria 4. Universidad 5. Otro 11.6* 12.1* 22.3 49.9 4.2 3.2 6.9 23.4 62.3 5.1 Edad x+RPEUH x0XMHU * p < .001 150 CAPÍTULO 9 x EPIDEMIOLOGÍA DE LOS TRASTORNOS ANORRECTALES Cuadro 5. Calidad de vida evaluada con el cuestionario PAGI-QoL entre pacientes con incontinencia fecal y controles sanos SIGAME 2014 Parámetro evaluado Incontinencia fecal (n = 187) Controles sanos (n = 925) Puntaje global 85 ± 15* 93.8 ± 17 Actividades diarias 87 ± 15 * 95.2 ± 17 Vestido 75 ± 23* 91.2 ± 24 Dieta 84 ± 13 * 93.16 ± 22 Relaciones 91 ± 13 96.3 ± 18 Psicológicas 80 ± 15 * 91.1 ± 17 p < .05 Por último, se observó que las proctalgias son más frecuentes en los sujetos con mayor grado de escolaridad (Cuadro 6). Al realizar un análisis multivariado, se mantuvo la significancia estadística de las variables detectadas por el modelo univariado. Al analizar los cinco dominios de PAGI-QoL y comparativamente con la población control, se observó una reducción significativa para proctalgia crónica en el puntaje global del cuestionario y específicamente en los dominios actividades diarias y esfera psicológica, en tanto que para pacientes con proctalgia fugax el puntaje global se encontró significativamente disminuido, solo asociado a una afectación del dominio de la esfera psicológica (Cuadro 7). 4.3. Defecación discinérgica. Del total de la muestra nacional (3,925 sujetos), solo 54 de ellos cumplieron criterios para defecación discinérgica, lo que corresponde a 1.3% (IC 95% 1.0 a 1.7), con una media de edad de 45 ± 12 años, significativamente más alta que la edad de la población control (37.6 ± 12, p < .05). 151 ENRIQUE COSS ADAME Cuadro 6. Distribución de los pacientes con proctalgia crónica y proctalgia fugax y comparación con población control SIGAME 2014 Proctalgia crónica (n = 245) Proctalgia fugax (n = 311) Controles sanos (n = 1,110) 42. ± 12* 38 ± 18 37.6 ± 12 (%) (%) (%) 41 59* 53 47 58.7 48.6 Zona geográfica 1. Noroeste 2. Noreste 3. Centro Norte 4. Oeste 5. Centro Sur 6. Suroeste 7. Este 8. Sureste 16.4 6.3 6.1 23.7 22.6 6.8 9.2 8.9 15.2 6.8 5.5 22.4 22.7 8.9 9.0 9.6 13.7 15.8 8.4 21.5 14.7 10.2 8.8 6.9 Zona económica con ingreso 1. Alto 2. Medio Alto 3. Medio 4. Bajo 34.6 32.7 17.6 15.1 35.5 32.8 18.3 13.4 31.3 36.7 17 15 Ocupación 1. Ama de casa 2. Desempleado 3. Estudiante 4. Jubilado 5. Otro 6. Profesionista 22.9* 3.6 6.2 7.4 18.7 41.2 21.2* 3.7 7.7 8.2* 18.6 40.6 14.3 1.4 13.6 5.3 19.7 45.7 Escolaridad 1. Primaria 2. Secundaria 3. Preparatoria 4. Universidad 5. Otro 9.6 12.6 24.2 49.4* 4.2 9.5 12.9 23.5 49.3* 4.8 3.2 6.9 23.4 62.3 5.1 Edad x+RPEUH x0XMHU * p < .05 152 CAPÍTULO 9 x EPIDEMIOLOGÍA DE LOS TRASTORNOS ANORRECTALES Cuadro 7. Calidad de vida evaluada con el cuestionario PAGI-QoL entre pacientes con proctalgia crónica y proctalgia fugax y controles sanos SIGAME 2014 Puntaje global x$FWLYLGDGHVGLDULDV x9HVWLGR x'LHWD x5HODFLRQHVSHUVRQDOHV x3VLFROÖJLFDV Proctalgia crónica (n=245) Proctalgia fugax (n=311) Controles sanos (n=925) 87 ± 14* 87 ± 14* 93.8 ± 17 83 ± 12 * 91 ± 18* 89 ± 13 93 ± 13 86 ± 14 * 87 ± 12 * 80 ± 14* 87 ± 18 91 ± 13 78 ± 14 * 95.2 ± 17 91.2 ± 24 93.16 ± 22 96.3 ± 18 91.1 ± 17 * p < .05 Al igual que otros trastornos funcionales, el sexo femenino fue el más afectado (56%). Se encontró que la distribución nacional fue heterogénea, con mayor prevalencia en la población de la zona Sureste (Guerrero, Oaxaca y Chiapas), que fue significativamente mayor al comparar con la población control (p < .05). En el modelo univariado se observó también que la población con defecación discinérgica fue significativamente más alta (p < .05) en el nivel socioeconómico medio (42.6%), con escolaridad de primaria y secundaria (16.7% y 27.8%, respectivamente) y fue más prevalente en población jubilada (25.9%). Al realizar el modelo de análisis multivariado, se mantuvieron las mismas variables con significancia estadística al compararse con la población control (Cuadro 8). Al evaluar la calidad de vida de la población con defecación discinérgica se observó que presentan una reducción significativa al comparar con la población control sana, tanto a nivel global del cuestionario PAGI-QoL (Cuadro 9) como individualmente; estas diferencias relativas se refieren a las actividades diarias, el vestido y las relaciones personales (p < .05). 153 ENRIQUE COSS ADAME Cuadro 8. Distribución de los pacientes con defecación discinérgica y comparación con población control SIGAME 2014 Edad Controles sanos (n = 1,110) 45.± 12* 37.6 ± 12 (%) (%) 44 56* 58.7 48.6 Zona geográfica 1. Noroeste 2. Noreste 3. Centro Norte 4. Oeste 5. Centro Sur 6. Suroeste 7. Este 8. Sureste 16.7 14 8 11.1 14.8 3.7 14.8 20.9* 13.7 15.8 8.4 21.5 14.7 10.2 8.8 6.9 Zona económica con ingreso 1. Alto 2. Medio Alto 3. Medio 4. Bajo 20.4 22.2 42.6* 14.8 31.3 36.7 17 15 Ocupación 1. Ama de casa 2. Desempleado 3. Estudiante 4. Jubilado 5. Otro 6. Profesionista 16.7 0 3.7 25.9* 18.5 32 14.3 1.4 13.6 5.3 19.7 45.7 Escolaridad 1. Primaria 2. Secundaria 3. Preparatoria 4. Universidad 5. Otro 16.7* 27.8* 13 42.6 0 3.2 6.9 23.4 62.3 5.1 x+RPEUH x0XMHU * p < .05 154 Defecación discinérgica (n = 54) CAPÍTULO 9 x EPIDEMIOLOGÍA DE LOS TRASTORNOS ANORRECTALES Cuadro 9. Calidad de vida evaluada con el cuestionario PAGI-QoL entre pacientes con defecación discinérgica y controles sanos SIGAME 2014 Defecación discinérgica (n = 54) Controles sanos (n = 925) 73 ± 22* 93.8 ± 17 79 ± 18 * 95.2 ± 17 Vestido 62 ± 27 91.2 ± 24 Dieta 89 ± 18 93.16 ± 22 Relaciones 87 ± 12* 96.3 ± 18 Psicológicas 84 ± 23* 91.1 ± 17 Puntaje global Actividades diarias *p < .05 Figura 1. Distribución de la frecuencia de episodios de incontinencia fecal con al menos un episodio en los últimos 3 meses SIGAME 2014 40 36 35 30 24 25 21 % 20 15 12 10 7 5 0 Menos de una vez al mes Un día al mes Dos a tres días al mes Frecuencia Un día a la semana Más de un dia a la semana 155 ENRIQUE COSS ADAME 5. CONCLUSIONES La incontinencia fecal tiene una prevalencia en población general similar a lo reportado en otras partes del mundo y genera un impacto negativo en la calidad de vida de quien la padece. Los factores identificados son consistentes con experiencias en otras latitudes, indicando que el envejecimiento y la baja escolaridad son una constante en la población afectada. Respecto de la proctalgia crónica y fugax tienen una prevalencia de 6.2% y 7.9%, respectivamente, y se presentan con mayor frecuencia en personas dedicadas al hogar y con más alto nivel de escolaridad, como la reportada en adultos sanos universitarios en la ciudad de México (21%). Ambas, alteran significativamente de forma global la calidad de vida. Se requiere interrogar a los pacientes acerca de este problema, para realizar un abordaje diagnóstico y terapéutico adecuado. Finalmente, la defecación discinérgica se presentó con una prevalencia baja en este estudio, probablemente menor a lo reportado en otros países. Esta diferencia puede estar relacionada con la dificultad para realizar el diagnóstico basado exclusivamente en síntomas, bien sea individual o en conjunto, pues se requiere de estudios para su confirmación (manometría anorrectal). La defecación discinérgica genera un impacto desfavorable en la calidad de vida de las personas, por lo cual es importante detectar esta alteración en sujetos con estreñimiento, con el objetivo de tratarla de manera correcta y mejorar la calidad de vida de quien la padece. REFERENCIAS 1. Bharucha AE, Rao SS. An update on anorectal disorders for gastroenterologists. Gastroenterology 2014;146:37-45. 2 Drossman DA. The functional gastrointestinal disorders and the Rome III process. Gastroenterology 2006;130:1377-90. 3. Rao SSC. Advances in diagnostic assessment of fecal incontinence and dyssynergic defecation. Clin Gastroenterol Hepatol 2010;8:910–9. 4. Remes-Troche JM, Rao SSC. Novedades en la fisiopatología. Diagnóstico y tratamiento de la incontinencia fecal. Rev Gastroenterol Mex 2006;71:496507. 5. Chiarioni G, Asteria C, Whitehead WE. Chronic proctalgia and chronic pelvic pain syndromes: new etiologic insights and treatment options. World J Gastroenterol 2011;17:4447-55. 156 CAPÍTULO 9 x EPIDEMIOLOGÍA DE LOS TRASTORNOS ANORRECTALES 6. Rao SSC. Dyssynergic defecation and biofeedback therapy. Gastroenterol Clin North Am 2008;37:569–86. 7. Rao SSC, Tuteja AK, Vellema T, et al. Dyssynergic defecation: demographics, symptoms, stool patterns, and quality of life. J Clin Gastroenterol 2004;38:680–5. 8. Bharucha AE, Dunivan G, Goode PS, et al. Epidemiology, Pathophysiology, and Classification of Fecal Incontinence: State of the Science Summary for the National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK) Workshop. Am J Gastroenterol 2015;110:127-36. 9. Drennan VM, Rait G, Cole L, et al. The prevalence of incontinence in people with cognitive impairment or dementia living at home: a systematic review. Neurourol Urodyn 2013;32:314-24. 10. Boyce PM, Talley NJ, Burke C, Koloski NA. Epidemiology of the functional gastrointestinal disorders diagnosed according to Rome II criteria: an Australian population-based study. Intern Med J 2006;36:28-36. 11. López-Colombo A, Morgan D, Bravo-González D, et al. The epidemiology of functional gastrointestinal disorders in Mexico: A population-based study. Gastroenterol Res Pract 2012;2012:606174. 12. Schmulson M, Ortiz O, Santiago-Lomelí M, et al. Frequency of functional bowel disorders among healthy volunteers in Mexico City. Dig Dis 2006;24:342-7. 13. Belmonte-Montes C, Cervera-Servín JA, García-Vázquez JL. Fecal incontinence, occult lesions to the anal sphincter and related factors in primiparous patients without median routine episiotomy. Cir Cir 2006;74:449-55. 14. Martínez-Espinoza CJ, Flores-Carreras O, García de Alba-García JE, et al. Prevalence of urinary and anal incontinence in women from metropolitan area of Guadalajara. Ginecol Obstet Mex 2006;74:300-5. 15. Remes-Troche JM, Sáenz P, Riaño D, et al. Fecal incontinence in the elderly. Rev Invest Clin 2004;56:21-6. 16. Remes-Troche JM, Carmona-Sánchez R, González-Gutiérrez M, et al. :KDW SHRSOH PHDQ E\ FRQVWLSDWLRQ" $ JHQHUDO SRSXODWLRQ EDVHGVWXG\ Rev Gastroenterol Mex 2009;74:321-8. 17. Carmona-Sánchez R, Remes-Troche JM, Gómez-Escudero O, et al. Selfperception, colonic transit and characteristics of subjects seeking medical care for constipation in Mexico. Rev Gastroenterol Mex 2009;74:187-94. 18. Ruiz-López MC, Coss-Adame E. Calidad de vida en pacientes con diferentes subtipos de estreñimiento de acuerdo a los criterios de Roma III. Rev Gastroenterol Mex 2015 (aceptado para publicación). 157 Capítulo 10 Sobreposición de trastornos funcionales digestivos OCTAVIO GÓMEZ ESCUDERO 1. INTRODUCCIÓN Los trastornos funcionales digestivos (TFD) son la primera causa de consulta con el especialista en gastroenterología del paciente que acude con síntomas gastrointestinales (GI) crónicos. Tradicionalmente, los TFD se han clasificado de acuerdo con los criterios del grupo de Roma, y se han dividido según el órgano de origen en: trastornos esofágicos, gastroduodenales, intestino delgado y colon, anorrecto y vías biliares.1,2 Desde hace algunos años, múltiples estudios epidemiológicos han reportado la asociación de síntomas gastrointestinales altos y bajos, y pacientes que cumplen con los criterios diagnósticos de Roma para más de un TFD, a lo que se ha denominado “síndrome de sobreposición” o “sobreposición funcional digestiva”. La importancia de identificar estos pacientes radica en entender el significado de la confluencia de múltiples síntomas, de uno o más mecanismos fisiopatológicos, y la necesidad, en muchas ocasiones, de diferentes opciones terapéuticas. El objetivo general de este capítulo es describir la epidemiología de esta combinación de TFD a nivel global y, en forma particular, en nuestro país. 2. EPIDEMIOLOGÍA GLOBAL Uno de los primeros trabajos que describió la asociación de síntomas gastrointestinales múltiples fue publicado por Talley.3 Este estudio evaluó la prevalencia de subgrupos de pacientes con síntomas gastrointestinales independientes, pero consistentes con los criterios de Roma. Se enviaron cuestionarios en forma aleatoria a sujetos en cuatro naciones (Rochester, MN, en Estados Unidos de América (EUA), Sydney en Australia, Essen en Alemania y Osthammar en Suecia). Todos los países reportaron grupos de síntomas homogéneos consistentes con 1 de 4 grupos: síndrome de intestino irritable (SII), dispepsia (no investigada –DNI– o funcional –DF–), enfermedad por reflujo gastroesofágico (ERGE) y estreñimiento, y mostraron un patrón similar entre países.3 Estudios posteriores han demostrado que los 161 OCTAVIO GÓMEZ ESCUDERO pacientes pueden tener síntomas múltiples en un mismo momento, y hasta 69% puede tener en un momento dado uno de los 20 síndromes funcionales digestivos.2 Un estudio posterior realizado en Olmsted County, con la misma metodología y con un total de 643 pacientes, demostró que entre 4% a 9% de la población podía tener sobreposición de dos TFD y entre 1% a 4% tendría hasta tres TFD.4 En este estudio la prevalencia de ERGE fue de 20%; de dispepsia,14%; de SII, 12%; de estreñimiento, 17%, y de diarrea, 21%. Al menos 1% de la población tuvo una combinación de 2 o 3 TFD, e incluso .6% de los pacientes expresaron los cinco complejos de síntomas al mismo tiempo.4 2.1. ERGE y dispepsia. Una de las asociaciones más comúnmente descritas es la presencia de ERGE y dispepsia en el mismo paciente. Tanto ERGE como dispepsia son dos enfermedades altamente prevalentes. Aproximadamente 7% de la población sufre de pirosis diaria, 10% a 21% una vez por semana, 44% al menos una vez al mes,5 y entre 32% a 57% de la población general adulta en países occidentales han sufrido de síntomas típicos de ERGE en el año previo.6 En países asiáticos la prevalencia es menor y se ha calculado que entre 3% a 7% tienen síntomas semanales de pirosis o regurgitación.7 Por otra parte, la prevalencia de dispepsia se ha reportado entre 20% y 30%.8 Se ha propuesto que los síntomas dispépticos son parte del complejo sintomático en ERGE, y que la presencia de ambas debe excluir ERGE como primera posibilidad. Dado que ambas enfermedades responden en la mayoría de los casos a supresión ácida y no necesariamente requieren estudios diagnósticos invasivos como primera elección, es difícil saber la prevalencia exacta de sobreposición entre ambas entidades. En una revisión sistemática reciente que incluyó 37 estudios y 2,057 pacientes, la prevalencia media de ERGE fue de 30% ± 8% (rango 20% a 40%), y de síntomas dispépticos 38% ± 14% (rango 21% a 63%). La prevalencia de síntomas dispépticos específicos no fue calculada por falta de datos, pero se reportó náusea en 24% en cinco estudios y saciedad temprana en 26% en tres trabajos.9 Aunque se observó una mayor asociación entre dispepsia y ERGE no erosivo (ERNE), algunos de los trabajos incluidos mostraron que los sujetos con dispepsia tuvieron un mayor riesgo de desarrollar ERGE en el futuro. Uno de los estudios incluidos siguió a 6,781 sujetos por 5 años: 162 CAPÍTULO 10 x SOBREPOSICIÓN DE TRASTORNOS FUNCIONALES DIGESTIVOS al inicio del estudio 54% de los pacientes con ERGE tenía dispepsia y 62% de los dispépticos tenía ERGE. Tras 5 años, solo 25% de los pacientes inicialmente diagnosticados con dispepsia desarrolló ERGE.10 La prevalencia de sobreposición ERGE-DF en el estudio de Locke fue de 7.5% (IC 95% 5.2 a 9.8).4 Dos estudios provenientes de Asia reportaron prevalencias menores que los trabajos occidentales.11,12 Un trabajo coreano que estudió 1,688 sujetos encontró prevalencia de ERGE de 4.6%, de dispepsia 6.3% y de sobreposición ERGE-dispepsia de 2.3% (IC 95% 1.4 a 3.0), con una mayor asociación de sobreposición en personas con ansiedad.11 Finalmente, un estudio japonés con 2,680 sujetos observó una prevalencia de 7.7% de ERGE y 10% de DF, con sobreposición ERGE-DF de 1.3%.12 2.2. ERGE y SII. En los últimos 20 a 25 años la evidencia ha apoyado cada vez con mayor frecuencia la sobreposición entre ERGE y SII. Algunos estudios han descrito que entre 30% a 71% de los pacientes con SII tienen pirosis y que la prevalencia de SII en ERGE es mayor que en la población general.13,14 Otros trabajos han calculado la prevalencia de SII en 5.1% al eliminar de la población sujetos con ERGE. Una revisión sistemática publicada en 2006, que incluyó 15 publicaciones, determinó una prevalencia máxima promedio de ERGE de 39.3% en pacientes previamente diagnosticados con SII. En siete estudios que evaluaron la prevalencia de SII en sujetos previamente diagnosticados con ERGE, ésta fue de 48.8%. Con base en la prevalencia de SII (12.1%) y de ERGE (19.4%) los autores determinaron la prevalencia de sobreposición entre ambas en 5.1%, excediendo la prevalencia individual de cada entidad por separado.15 En el trabajo de Locke la prevalencia de sobreposición ERGE-SII fue similar: 5.6% (IC 95% 3.5 a 7.7),4 pero en el de Lee fue menor: 2% (IC 95% 1.2 a 2.6),11 similar a la de otro grupo asiático proveniente de Corea.16 Otros estudios han confirmado una asociación recíproca entre ambas entidades. Kennedy et al reportaron que 19% de los pacientes con ERGE tenía síntomas de SII, y 32% de aquellos con SII, tenía ERGE.17 De Vries también observó que el SII es más prevalente en personas con ERGE que en la población general (35% vs. .6% a 6%),18 al igual que Pimentel (71% vs. 35%).13 Zimmermann evaluó la prevalencia de SII en ERNE, y encontró que la mitad de los pacientes cumplía criterios de SII (Roma I), aunque sin encontrar una relación directa entre exposición 163 OCTAVIO GÓMEZ ESCUDERO esofágica al ácido medida por pH-metría de 24 horas y la presencia de síntomas abdominales.19 Fass también observó que 60% de los pacientes con ERGE erosiva y ERNE tenía síntomas abdominales tras sumar los resultados de 14 estudios clínicos.20 Finalmente, un metaanálisis recientemente publicado en 2012 evaluó la prevalencia de “síntomas tipo reflujo” en pacientes con SII. La prevalencia global de ERGE en SII fue de 42% (IC 95% 30 a 55), y de 16% en personas sin SII (p < .001), con una razón de momios (OR) de 4.17 (IC 95% 2.8 a 6). Este riesgo permaneció significativamente mayor independientemente de los criterios utilizados para SII: Roma II OR 4.6, Roma III OR 9.5. El grado de sobreposición varió de 14.2% a 26.7%.21 La prevalencia tan variable de sobreposición ERGE-SII depende de los criterios utilizados para definir cada enfermedad. Mientras algunos trabajos han definido ERGE con base en frecuencia de síntomas, otros lo han confirmado mediante medición ambulatoria de pH intraesofágico; en el caso de SII sucede algo similar, y depende de los criterios clínicos utilizados (Manning, Roma I, Roma II, Roma III). En el meta-análisis de Lovell la prevalencia de sobreposición ERGE-SII fue mayor al aplicar los criterios de Manning, intermedia al usar Roma III, y menor al utilizar Roma II.21 Un estudio publicado por Talley reportó la sobreposición de ambas entidades subdividiendo los pacientes con SII en aquellos con predominio de estreñimiento (SII-E), y diarrea (SII-D); encontró sobreposición ERGE-SII-C de 32.9%, y ERGE-SII-D de 40.9%.22 Varios autores han propuesto diferentes hipótesis para explicar esta asociación tan frecuente, las dos más comunes son: a) ERGE y SII son dos trastornos diferentes pero con un proceso fisiopatológico común, que incluye anormalidades motoras y de sensibilidad, y b) los síntomas de SII son manifestaciones “extraesofágicas” de ERGE, dado que se ha reportado que los síntomas abdominales pueden mejorar con inhibidores de la bomba de protones (IBP),14,16 aunque estos resultados requieren confirmación en estudios prospectivos mayores. 2.3. Dispepsia y SII. Múltiples trabajos han reportado la asociación de síntomas gastrointestinales bajos, incluyendo SII, en pacientes con dispepsia y viceversa. Dado que ambas condiciones son altamente prevalentes en la comunidad (20% a 30%), existe la posibilidad de que una parte de los casos en que coinciden lo hagan por azar. Los criterios de Roma han tratado de definir mejor cada entidad, intentando 164 CAPÍTULO 10 x SOBREPOSICIÓN DE TRASTORNOS FUNCIONALES DIGESTIVOS hacerlas mutuamente excluyentes. Algunos estudios han incluido sujetos con DNI, lo cual puede abarcar causas orgánicas y otros solo DF. La DF es además un grupo heterogéneo con diferentes subgrupos, que de acuerdo con los criterios de Roma III se divide en síndrome de dolor epigástrico y síndrome de malestar posprandial (previamente llamada dispepsia tipo dismotilidad, por Roma II). Algunos grupos han intentado reclasificar la dispepsia de acuerdo con la presencia o ausencia de síntomas gastrointestinales bajos concomitantes, como diarrea o estreñimiento.23 Los primeros estudios poblacionales en describir esta asociación encontraron una prevalencia estimada de SII en sujetos dispépticos de entre 13% a 29%, mientras que la prevalencia de DF en SII fue de entre 29% a 87%.24 Sin embargo, en estudios basados en pacientes los números son diferentes, con prevalencias de sobreposición mayores: de 26% a 46% de DF con SII concomitante y de 20% a 87% de SII con DF concomitante.25 Un meta-análisis publicado en 201026 evaluó 239 artículos, de los cuales 150 reportaron prevalencia de dispepsia y 19 la proporción de SII en dispepsia. En este estudio, la prevalencia de dispepsia fue de 27% (IC 95% 23 a 31), y la de SII en DF fue de 37% (IC 95% 30 a 45), comparada con 7% (IC 95% 5 a 10) en pacientes sin dispepsia. El riesgo de tener SII en dispepsia fue ocho veces mayor que en la población sin dispepsia (OR 8, IC 95% 5.74 a 11.16). El grado de sobreposición SII-DF varió entre 15% a 42%, dependiendo de los criterios diagnósticos utilizados para cada condición. El riesgo de SII en DF fue mayor al utilizar criterios de Roma I o II para definir ambas condiciones, y menor al definir SII de acuerdo con los criterios de Manning.26 El grado de sobreposición también fue menor al aplicar los criterios de Manning para SII (18.2% vs. 42%). Finalmente, la definición utilizada para dispepsia afectó el grado de sobreposición: al utilizar una definición “amplia” la sobreposición fue menor (15%, acoplada con criterios de Manning), y al definirla como epigastralgia o dolor abdominal alto únicamente la prevalencia fue mayor (29.4%, acoplada con criterios de Roma I).26 Los riesgos relativos de SII en dispepsia de acuerdo con cada criterio se observan en el cuadro 1. 165 OCTAVIO GÓMEZ ESCUDERO Cuadro 1. Razón de momios para SII en dispepsia, comparada con pacientes sin dispepsia de acuerdo con los criterios utilizados para definir dispepsia y SII26 Estudios Pacientes OR IC 95% p Todos los estudios 19 18,173 8.00 5.74-11.16 <.001 Definición amplia dispepsia 6 5,450 4.85 2.25-10.45 <.001 Roma I dispepsia 4 5,236 10.32 6.41-16.61 <.001 Roma II dispepsia 6 5,853 13.05 3.11-54.73 <.001 Epigastralgia o dolor alto 5 6,433 7.44 5.49-10.07 .01 Manning SII 6 4,611 4.52 3.18-6.42 .03 Roma I SII 7 7,629 7.63 4.16-13.98 <.001 Roma II SII 4 4,079 13.33 6.41-27.70 <.001 Definición amplia dispepsia + Manning SII 4 3,461 4.30 2.43-7.60 .01 Epigastralgia o dolor alto + Roma I SII 4 4,415 7.29 4.77-11.16 .04 Roma II dispepsia y SII 4 3,999 7.89 1.26-49.47 <.00 El estudio de Locke, usando definiciones comunes y criterios de Roma I, reportó una prevalencia de sobreposición dispepsia-SII de 5.8% (IC 95% 3.7 a 7.9).4 Talley et al evaluaron 121 pacientes con SII agrupándolos según el síntoma predominante; observaron que aquellos con SII-C reportaron una mayor cantidad de síntomas gastrointestinales y patrones de dolor diferentes que los pacientes con SII-D. En este trabajo, la presencia de síntomas consistentes con DF fue de 36.8% en SII-C, y de 24.4% en SII-D. La prevalencia de sobreposición DF-SII en este estudio ha sido la más alta reportada en la literatura (DF-SII-C 85.5%, DF-SII-D 75%).22 Pocos trabajos han analizado diferencias étnicas en la sobreposición de TFD. Un trabajo que comparó prevalencia de sobreposición SII-DNI en población caucásica vs. africoamericana observó una menor prevalencia en este último grupo (30% vs. 50%). La prevalencia global de sobreposición en ambos grupos fue de 9.2%, pero fue 2.5 veces más frecuente en caucásicos, particularmente en aquellos con baja educación.27 166 CAPÍTULO 10 x SOBREPOSICIÓN DE TRASTORNOS FUNCIONALES DIGESTIVOS Al igual que con sobreposición ERGE-dispepsia y ERGE-SII, la prevalencia de dispepsia-SII es diferente en la población asiática. El estudio publicado por Lee reportó una prevalencia de sobreposición muy baja: 1.3% (IC 95% .6 a 1.8).11 Sin embargo otro estudio, publicado en 2008, en el cual se utilizaron cuestionarios con la versión china de Roma III, la prevalencia de DF y SII fue de 15.2% y 10.9%, respectivamente, con una sobreposición entre ambas de 5%, similar a la de grupos occidentales. En este estudio la presencia de llenura posprandial fue un factor de riesgo independiente para sobreposición, así como para mayor puntaje de severidad de síntomas.28 Los números provenientes de otros países asiáticos muestran resultados conflictivos debido a los criterios diagnósticos usados: en India, la prevalencia de DF sola fue de 30%, pero fue de 58% en pacientes con SII. En forma similar, la prevalencia de SII en dispepsia fue de 14%, comparada con una prevalencia de SII solo de 7.5%.25 Estudios recientes han demostrado que SII y dispepsia comparten características fisiopatológicas similares, incluyendo trastornos de motilidad y sensibilidad visceral, por lo que algunos investigadores han propuesto el término de “tubo digestivo irritable” para referirse a un solo trastorno gastrointestinal. Dada la sobreposición de ambas entidades, es común malinterpretar los síntomas del paciente debido a varias causas: 1. Localización del dolor: se ha demostrado que al distender el colon transverso con balón o baróstato se induce dolor en epigastrio, similar al de dispepsia. 2. Mismos factores detonantes: incluyendo alimentos desencadenantes similares, situaciones de estrés, trastornos psiquiátricos y asociación similar a mayores puntajes de ansiedad y a menor calidad de vida.29 3. Factores culturales y dietéticos regionales diferentes: en algunos países de Asia, como Singapur, hasta 77% de los pacientes que cumplen criterios para más de un TFD considera que su hábito intestinal es normal, aunque para los criterios occidentales sea anormal. 4. Especialidad médica que atiende al paciente: hasta 8% de los sujetos con SII en EUA ha tenido colecistectomías y otras cirugías 167 OCTAVIO GÓMEZ ESCUDERO previas innecesarias, y en Taiwán los pacientes con SII tienen el doble de tasas de colecistectomía que la población sin SII, lo cual orienta a que los criterios diagnósticos y la conducta terapéutica pueden diferir en forma importante entre gastroenterólogos, internistas, cirujanos y otros especialistas afines.25 6. Mejoría de síntomas abdominales bajos con IBP: algunos estudios controlados han demostrado que un subgrupo de pacientes con ERGE o dispepsia, y que tienen síntomas de SII, al ser tratados con IBP pueden experimentar mejoría de todos sus síntomas en forma global sin necesidad de medicamentos antiespasmódicos,30 aunque este beneficio podría representar efecto placebo. 2.4. ERGE, dispepsia y SII. Varios de los estudios que han investigado la presencia de sobreposición ERGE-DF, ERGE-SII y SIIDF han encontrado que con frecuencia los pacientes tienen más de un síndrome de sobreposición funcional digestivo. En el estudio de Locke4 la prevalencia de sobreposición de los tres principales TFD -ERGE-DFSII- fue de 3.8% (IC 95% 2.0 a 5.6). Un trabajo japonés realizado en población general de trabajadores mediante cuestionarios reportó una prevalencia de ERGE de 7.7%, DF 10%, y de SII 14.2%. La sobreposición más común fue SII-DF en 2.3%, y 1.1% del grupo estudiado reportó sobreposición de los tres TFD.12 Un estudio europeo investigó la prevalencia de DF y SII en pacientes con ERGE. Un grupo de pacientes referidos y otro grupo control fueron evaluados mediante cuestionarios y pH-metría de 24 horas, y se reportó prevalencia de DF en ERGE de 25%, SII en ERGE 35% de ambos (DF-SII en ERGE) en 5%.18 La prevalencia de ambos TFD fue mayor en el grupo referido, y el grupo con sobreposición de los tres TFD obtuvo menores puntajes en las subescalas de los cuestionarios de calidad de vida. Otro estudio europeo, realizado en Berlín, encontró sobreposición basal antes de tratamiento ERGE-DF en 61.8%, ERGESII en 13.3%, y DF-SII en 13.3%, además de sobreposición de los tres padecimientos en 12.9%.30 Después de recibir tratamiento con pantoprazol por 16 semanas, los grados de sobreposición variaron: ERGE-DF, 25%; ERGE-SII, 1.8%; DF-SII, 2.1% y sobreposición ERGE- 168 CAPÍTULO 10 x SOBREPOSICIÓN DE TRASTORNOS FUNCIONALES DIGESTIVOS DF-SII en 1.6%. Al final de una fase de observación por 6 meses sin tratamiento los resultados fueron: ERGE-DF, 15.6%; ERGE-SII, 2.6%; DF-SII, 2.2%, y ERGE-DF-SII, 1.9%.30 2.5 Dolor retroesternal esofágico, dispepsia y SII. El dolor retroesternal es un síntoma alarmante muy común, que puede ser originado por problemas cardíacos, pulmonares, musculoesqueléticos o esofágicos. Dentro de las causas esofágicas se incluyen ERGE, trastornos motores y dolor retroesternal funcional. Un grupo de pacientes con dolor retroesternal y evaluación normal cardíaca, endoscópica y por manometría esofágica fue evaluado para hipersensibilidad esofágica mediante prueba de distensión con balón. Posteriormente se les envió un cuestionario modificado basado en criterios de Roma II. Se evaluó la prevalencia de SII y otros TFD, además de la de dolor retroesternal en pacientes con estreñimiento funcional. De un total de 100 pacientes, 69 respondieron el cuestionario, y 82% cumplió criterios para otros TFD, además de dolor retroesternal. Los padecimientos asociados más comunes fueron: SII (27%), distensión funcional (22%) y dispepsia funcional (7%). De los respondedores, 78% tenía hipersensibilidad visceral. La prevalencia de TFD fue similar en ambos grupos con dolor retroesternal, independientemente de la presencia de hipersensibilidad. Finalmente, 46% de los pacientes con estreñimiento funcional reportó dolor retroesternal.31 2.6. Pirosis funcional y dispepsia. Un estudio evaluó la presencia de dispepsia en diferentes grupos de ERNE. Se incluyeron 200 pacientes con síntomas sugestivos de ERGE y una endoscopia normal. Se les realizó medición ambulatoria de 24 horas de impedancia con pH-metría sin tratamiento: 41% tuvo exposición anormal al ácido; 32%, exposición fisiológica al ácido, pero índices de síntomas positivos (esófago hipersensible), y 27%, exposición normal al ácido e índices de síntomas negativos (pirosis funcional). Al comparar los tres grupos, los pacientes con pirosis funcional reportaron con mayor frecuencia síntomas de dismotilidad gástrica, incluyendo llenura posprandial, saciedad temprana y náusea, comparados con los otros tres grupos (p < .01). La presencia de dolor epigástrico, a diferencia de dismotilidad, fue similar en los tres grupos.32 169 OCTAVIO GÓMEZ ESCUDERO 2.7 Otras sobreposiciones menos comunes. Al evaluar la prevalencia de los principales TFD en población abierta, con frecuencia se ha reportado asociación con otros síntomas gastrointestinales en forma aislada, sin cumplir criterios completos para otro TFD. De estos trabajos, el de Locke4 reportó la mayor cantidad de asociaciones, las cuales se muestran en el cuadro 2. Cuadro 2. Asociaciones entre uno o dos trastornos funcionales digestivos y otro síntoma gastrointestinal aislado, sin cumplir criterios de Roma para dos o tres trastornos funcionales digestivos Prevalencia (%) IC 95% ERGE-diarrea 8.4 5.8-10.9 ERGE-estreñimiento 5.7 3.6-7.7 Dispepsia-diarrea 4.5 3.0-7.0 Dispepsia-estreñimiento 3.9 2.2-5.6 SII-dispepsia-estreñimiento 3.2 1.6-4.7 SII-dispepsia-diarrea 3.6 1.8-5.3 ERGE-dispepsia-diarrea 3.7 1.9-5.5 ERGE-dispepsia-estreñimiento 2.4 1.0-3.7 ERGE-SII-diarrea 3.7 1.9-5.5 ERGE-SII-estreñimiento 2.8 1.3-4.4 ERGE-diarrea-estreñimiento 2.3 .8-3.7 Dispepsia-diarrea-estreñimiento 1.3 .2-2.3 SII, estreñimiento funcional-diarrea 7.4 5.0-9.8 SII no estreñimiento-estreñimiento 6.5 4.3-8.7 SII inespecífico-diarrea-estreñimiento 2.3 1.0-3.7 Asociación Modificado de Locke GR III4 170 CAPÍTULO 10 x SOBREPOSICIÓN DE TRASTORNOS FUNCIONALES DIGESTIVOS 3. EPIDEMIOLOGÍA EN MÉXICO No existen estudios formales previos que hayan evaluado la prevalencia de sobreposición funcional digestiva en México. Sin embargo, un estudio que se realizó en 2,270 sujetos con SII para evaluar la eficacia, seguridad y tolerabilidad de 100 mg de bromuro de pinaverio más 300 mg de dimeticona b.i.d durante 4 semanas demostró que los principales factores predisponentes para distensión abdominal fueron la existencia de otros síntomas, como la sensación de evacuación incompleta, el esfuerzo para evacuar, el meteorismo, la flatulencia, la plenitud posprandial y cefalea.33 Estos datos pudieran interpretarse como sobreposición de SII con otros TFD. En otro análisis de la misma cohorte de pacientes se estudiaron algunas características asociadas al desarrollo de SII-M, el subtipo más frecuente de SII en nuestro país, pero el menos estudiado.34 Se pudo demostrar que los pacientes con SII-M reportan mayor intensidad de síntomas gastrointestinales superiores, como saciedad temprana, plenitud posprandial, náusea, vómitos y eructos. Estos hallazgos sugieren que los pacientes con SII-M pudieran tener una mayor sobreposición con otro trastorno funcional digestivo, como la dispepsia funcional.34 4. RESULTADOS DEL ESTUDIO SIGAME Para el análisis de sobreposición se definió ERGE como pirosis al menos 1 vez a la semana, de acuerdo con Roma III; dispepsia como DNI, y SII, según los criterios de Roma III. La prevalencia tanto de ERGE como de SII fue de 5.5% (IC 95% 4.7 a 6.3, n = 187 en cada entidad), mientras que de dispepsia fue de 6.6% (IC 95% 5.8 a 7.4, n = 224). Al analizar la prevalencia de sobreposición entre los principales TFD, se encontró sobreposición ERGE-dispepsia en 3.9% (IC 95% 3.3 a 4.6, n = 133), ERGE-SII 1.1% (IC 95% .7-1.5%, n = 37), y dispepsia-SII en .9% (IC 95% .6 a 1.2, n = 31). Un total de 21 sujetos cumplió criterios de sobreposición para los tres TFD: ERGE-dispepsia-SII .6% (IC 95% .4 a .9). Los resultados de prevalencia se resumen en el cuadro 3, y el diagrama de Venn en la figura 1. 171 OCTAVIO GÓMEZ ESCUDERO Cuadro 3: Prevalencia de sobreposición funcional digestiva SIGAME 2014 n Prevalencia (%) IC 95% ERGE-dispepsia 133 3.9 3.3 - 4.6 ERGE-SII 37 1.1 .7 - 1.5 Dispepsia-SII 31 .9 .6 - 1.2 ERGE-dispepsia-SII 21 .6 .4 - .9 Tipo de sobreposición Figura 1: Sobreposición funcional digestiva en población abierta en México Dispepsia 6.6% .9% 3.9% .5% ERGE 5.5% 172 1.1% SII 5.5% CAPÍTULO 10 x SOBREPOSICIÓN DE TRASTORNOS FUNCIONALES DIGESTIVOS Cuadro 4. Distribución de los pacientes con defecación discinérgica y comparación con población control SIGAME 2014 ERGE + Edad dispepsia ERGE + ERGE + Dispepsia + SII dispepsia SII + SII Solo SII Solo Solo ERGE dispepsia (n=21) (n=133) (n=37) (n=31) (n=187) (n=187) (n=224) 39.2 ± 18 35.9 ± 16 35.4 ± 19 37.7 ± 13 36.9 ± 16 38.5 ± 14 38.5 ± 15 (%) (%) (%) (%) (%) (%) (%) x+RPEUH 42.9 49.6 45.9 45.2 48.1 43.3 40.6 x0XMHU 57.1 50.4 54.1 54.8 51.9 56.7 59.4 1. Noroeste 19 * 9.8 18.9 9.7 15 19.3 11.2 2. Noreste 4.8 7.5 8.1 0 9.1 14.4 16.1 3. Centro Norte 9.5 15.8 24.3 32.3* 13.9 12.3 9.4 4. Oeste 19 26.3* 18.9 48.4* 25.7 24.1 32.6 Zona geográfica 4.8 19.5 13.5 0 16.6 11.8 14.3 23.8 * 8.3 0 0 4.8 6.4 7.6 7. Este 14.3 9.0 13.5 6.5 10.7 9.6 8 8. Sureste 4.8 3.8 2.7 3.2 4.3 2.1 .9 5. Centro Sur 6. Suroeste Zona económica con ingreso 1. Alto 27.5 23.8 27.8 29.7 3.2 29.9 30.8 43.8* 28.6 42.1* 32.4 64.5* 42.2 44.6* 3. Medio 18 14.3 14.3 24.3 29 17.1 11.6 4. Bajo 10 33.3 15.8 13.5 3.2 10.7 12.9 1. Ama de casa 23.8 21.1 24.3 12.9 23 22.5 23.2 2. Desempleado 0 2.3 2.7 0 .5 4.3 1.3 3. Estudiante 4.8 10.5 27 16.1 17.6 10.7 8 4. Jubilado 4.8 6 10.8 3.2 5.3 2.7 4.9 5. Otro 23.8 26.3 8.1 29 17.6 20.3 21.4 6. Profesionista 42.9 33.8 27 38.7 35.8 36.9 41.1 5.8 2. Medio Alto Ocupación Escolaridad 1. Primaria 0 5.3 8.1 3.2 4.8 6.4 2. Secundaria 9.5 9.8 10.8 6.5 13.9 8.6 8.9 3. Preparatoria 23.8 22.6 16.2 35.5 20.9 24.6 23.7 4. Universidad 52.4 56.4 56.8 54.8 54 56.1 57.1 5. Otro 14.3 6 8.1 0 6.4 4.3 4.5 * p < .001 173 OCTAVIO GÓMEZ ESCUDERO Las características demográficas de los diferentes grupos de sobreposición se observan en el cuadro 4. No se encontró asociación entre el sexo, la edad, ocupación, profesión y grado de escolaridad. Al analizar por zona geográfica se observó una prevalencia mayor de sobreposición ERGE-dispepsia en la zona Oeste del país (p < .001), de ERGE-dispepsia en las zonas Centro-Norte y Oeste (p < .001), y de ERGE-dispepsia-SII en la zona Suroeste y Noroeste (p < .001). No hubo diferencias estadísticamente significativas en la prevalencia de ERGE-SII por regiones. Un análisis de acuerdo con zona económica concluyó que las personas que viven en zona medio-alta tuvieron una mayor prevalencia de dispepsia sola, SII sola, ERGE-SII y ERGE-dispepsia-SII, al compararse con las zonas alta, media y baja (p < .001). Al comparar calidad de vida mediante el cuestionario PAGI-QoL, los pacientes con TFD en general tuvieron menores puntajes, aunque esto no alcanzó significancia estadística. Sin embargo, los pacientes con sobreposición ERGE-dispepsia y ERGE-SII tuvieron significativamente menores puntajes en las escalas de vestido y psicológicas (p < .05), y el grupo con sobreposición ERGE-dispepsia-SII se asoció a menores puntajes de calidad de vida asociada a trastornos psicológicos relacionados con los síntomas de su enfermedad (p < .05) (Cuadro 5). Cuadro 5: Calidad de vida de los pacientes con sobreposición funcional digestiva, según la PAGI-QoL SIGAME 2014 Puntaje global Controles ERGE + dispepsia + SII (n=21) ERGE + dispepsia (n=133) ERGE + SII (n=37) Dispepsia + SII (n=31) Solo SII (n=187) Solo ERGE (n=187) Solo dispepsia (n=224) 93.8 ± 17 85.6 ± 15 82.2 ± 19 82.2 ± 19 83 ± 14 84 ± 17 84 ± 17 87 ± 14 x$FWLYLGDGHVGLDULDV 95.2 ± 17 89 ± 16 85 ± 19 86 ± 15 88 ± 13 87 ± 16 88 ± 16 91 ± 13 x9HVWLGR 91.2 ± 24 75 ± 26* 77 ± 23* 71 ± 29 78 ± 21 78 ± 21 80 ± 21 81 ± 22 x'LHWD 93.16 ± 22 81 ± 19 81 ± 21 81 ± 24 80 ± 21 81 ± 21 82 ± 20 86 ± 19 x5HODFLRQHVSHUVRQDOHV 96.3 ± 18 83 ± 12 86 ± 20 87 ± 19 93 ± 12 89 ± 17 89 ± 17 92 ± 14 x3VLFROÖJLFDV 91.1 ± 17 74 ± 17* 77 ± 20* 77 ± 23* 79± 15 81 ± 20 81 ± 21 82 ± 14 * p < .05, ANOVA PAGI-QoL: Evaluación del paciente con trastornos gastrointestinales altosCalidad de vida 174 CAPÍTULO 10 x SOBREPOSICIÓN DE TRASTORNOS FUNCIONALES DIGESTIVOS 5. CONCLUSIONES 1. La asociación entre diferentes TFD es común, tanto en estudios poblacionales como en los realizados en pacientes. 2. Dado que la prevalencia de cada TFD es alta, la posibilidad de que ocurra sobreposición puede deberse al azar. 3. Algunos trastornos como ERGE y dispepsia pueden responder a la misma terapia, y otros, como dispepsia y SII, pueden compartir los mismos mecanismos fisiopatológicos, por lo que es difícil establecer el grado verdadero de sobreposición entre ambos. 4. La prevalencia de sobreposición entre los principales TFD depende de los criterios diagnósticos utilizados para cada entidad, incluyendo pruebas diagnósticas en el caso de ERGE y dispepsia, y criterios clínicos para dispepsia y SII. 5. En estudios en población abierta, la prevalencia de sobreposición ERGE-dispepsia es de alrededor de 7%; ERGE-SII, 5%; dispepsia-SII, 5% y ERGE-dispepsia-SII, 3.8%, aunque los números provenientes de estudios asiáticos son menores (1% a 3%, 2%, 1.5% y 1%, respectivamente). 6. Los trabajos con pacientes reportan asociaciones mayores, con prevalencias que sobrepasan las de cada entidad por separado. 7. Existen asociaciones menores entre ERGE, dispepsia y SII con otros TFD, como dolor retroesternal y pirosis funcional. 8. Aunque no existen reportes previos de sobreposición funcional digestiva en nuestro país, el estudio SIGAME encontró sobreposición ERGE-dispepsia de 3.9%, ERGE-SII 1.1%, dispepsia-SII .9% y ERGEdispepsia-SII .6%. 9. Esta prevalencia parece diferir según la zona geográfica y la condición económica, lo que deviene alteraciones en calidad de vida, al compararse con controles sanos. 175 OCTAVIO GÓMEZ ESCUDERO REFERENCIAS 1. Locke GR. The epidemiology of functional gastrointestinal disorders in North America. Gastroenterol Clin North Am 1996;25:1-19. 2. Drossman DA, Li Z, Andruzzi E, et al. US householder survey of functional gastrointestinal disorders. Prevalence, sociodemography, and health impact. Dig Dis Sci 1993;38:1569-80. 3. Talley NJ, Holtmann G, Agneus L, Jones M. Gastrointestinal symptoms and subjects cluster into distinct upper and lower groupings in the community: a four nations study. Am J Gastroenterol 2000;95:1439-47. 4. Locke GR III, Zinsmeister AR, Fett SL, et al. Overlap of gastrointestinal symptom complexes in a US community. Neurogastroenterol Motil 2005;17:29-34. 5. Valle C, Broglia F, Pistorio A, et al. Pevalence and impact of symptoms suggestive of gastroesophageal reflux disease. Dig Dis Sci 1999;44:184852. 6. Fullard M, Kang JY, Neild P, et al. Systematic review: does gastroRHVRSKDJHDOUHIOX[GLVHDVHSURJUHVV"$OLPHQW3KDUPDFRO7KHU 45. 7. Cheung TK, Lam KF, Hu WH, et al. Positive association between gastrooesophageal reflux disease and irritable bowel syndrome in a Chinese population. Aliment Pharmacol Ther 2007;25:1099-104. 8. Ford AC, Forman D, Bailey AG, et al. Initial poor quality of life and new onset of dyspepsia results from a longitudinal 10-year follow-up study. Gut 2007;56:321-7. 9. Gerson LB, Kahrilas PJ, Fass R. Insights into gastroesophageal reflux disease-associated dyspeptic symptoms. Clin Gastroenterol Hepatol 2011;9:824-33. 10. Hansen JM, Wildner-Christensen M, Schaffalitzky de Muckadell OB. Gastroesophageal reflux symptoms in a Danish population: a prospective follow-up analysis of symptoms, quality of life, and health-care use. Am J Gastroenterol 2009;104:2394-403. 11. Lee SY, Lee KJ, Kim SJ, Cho SW. Prevalence and risk factors for overlaps between gastroesophageal reflux disease, dyspepsia, and irritable bowel syndrome: a population-based study. Digestion 2009;79:196-201. 12. Kaji M, Fujiwara Y, Shiba M, et al. Prevalence of overlaps between GERD, FD and IBS and impact on health-related quality of life. J Gastroenterol Hepatol 2010;25:1151-6. 13. Pimentel M, Rossi F, Chow EJ, et al. Increased prevalence of irritable bowel syndrome in patients with gastroesophageal reflux. J Clin Gastroenterol 2002;34:221-4. 176 CAPÍTULO 10 x SOBREPOSICIÓN DE TRASTORNOS FUNCIONALES DIGESTIVOS 14. Gasiorowska A, Poh CH, Fass R. Gastroesophageal reflux disease (GERD) and irritable bowel syndrome (IBS) – Is it one disease or an overlap of two GLVRUGHUV"'LJ'LV6FL 15. Nastaskin I, Mehdikhani E, Conklin J, et al. Studying the overlap between IBS and GERD: A systematic review of the literature. Dig Dis Sci 2006;51:2113-20. 16. Park H. Functional gastrointestinal disorders and overlap syndrome in Korea. J Gastroenterol Hepatol 2011;26(Suppl)3:12-4. 17. Kennedy TM, Jones RH, Hungin AP, et al. Irritable bowel syndrome, gastroesophageal reflux, and bronchial hyper-responsiveness in the general population. Gut 1998;43:770-4. 18. deVries DR, VanHerwaarden MA, Barion A, et al. Concomitant functional dyspepsia and irritable bowel syndrome decrease health-related quality of life in gastroesophageal reflux disease. Scand J Gastroenterol 2007;42:951-6. 19. Zimmermann B. Irritable bowel, smoking and oesophageal acid exposure: an insight into the nature of symptoms of gastro-oesophageal reflux. Aliment Pharmacol Ther 2004;20:1297-303. 20. Fass R, Stanghellini V, Monnikes H. Baseline analysis of symptom spectrum in GERD clinical trial patients: result from ReQuest database. Gastroenterology 2006;130:A629. 21. Lovell RM, Ford AC. Prevalence of gastro-esophageal reflux-type symptoms in individuals with irritable bowel syndrome in the community: a meta-analysis. Am J Gastroenterol 2012;107:1793-801. 22. Talley NJ, Dennis EH, Schettler Duncan V, et al. Overlapping upper and lower gastrointestinal symptoms in irritable bowel syndrome patients with constipation or diarrhea. Am J Gastroenterol 2003;98:2454-9. 23. Matsuzaki J, Suzuki H, Asakura K, et al. Classification of functional dyspepsia based on concomitant bowel symptoms. Neurogastroenterol Motil 2012;24:325-31, e1164. 24. Agreus L, Svardsudd K, Nyren O, Tibblin G. Irritable bowel syndrome and dyspepsia in the general population: overlap and lack of stability over time. Gastroenterology 1995;109:671-80. 25. Gwee KA, Boon Chua AS. Functional dyspepsia and irritable bowel V\QGURPH DUH WKH\ GLIIHUHQW HQWLWLHV DQG GRHV LW PDWWHU" :RUOG - Gastroenterol 2006;12:2708-12. 26. Ford AC, Marwaha A, Lim A, Moayyedi P. Systematic review and metaanalysis of the prevalence of irritable bowel syndrome in individuals with dyspepsia. Clin Gastroenterol Hepatol 2010;8:401-9. 27. Minocha A, Chad W, Johnson WD. Racial differences in epidemiology of irritable bowel syndrome alone, uninvestigated dyspepsia alone, and “overlap syndrome” among African Americans compared to Caucasians: a population-based study. Dig Dis Sci 2006;51:218-26. 177 OCTAVIO GÓMEZ ESCUDERO 28. Wang AJ, Liao XH, Xiong LS, et al. The clinical overlap between functional dyspepsia and irritable bowel syndrome based on Rome III criteria. BMC Gastroenterol 2008;8:43. 29. Piacentino D, Cantarini D, Alfonsi M, et al. Psychopathological features of irritable bowel syndrome patients with and without functional dyspepsia: a cross sectional study. BMC Gastroenterol 2011;11:94. 30. Mönnikes H, Schwan T, van Rensburg C, et al. Randomised clinical trial: sustained response to PPI treatment of symptoms resembling functional dyspepsia and irritable bowel syndrome in patients suffering from an overlap with erosive gastro-oesophageal reflux disease. Aliment Pharmacol Ther 2012;35:1279-89. 31. Mudipalli RS, Remes-Troche JM, Andersen L, Rao SSC. Functional chest pain, esophageal or overlapping functional disorder. J Clin Gastroenterol 2007;41:264-9. 32. Savarino E, Pohl D, Zentilin P, et al. Functional heartburn has more in common with functional dyspepsia than with non-erosive reflux disease. Gut 2009;58:1185-91. 33. Remes-Troche JM, Tamayo-de-la-Cuesta JL, Vargas JA, Soto-Perez JC, Crespo Y, Ramirez A, et al. Relation of bloating with food intake and other symptoms in IBS. A report of the Mexican Working Group. Gastroenterology 2009;136(S1):A327-8. 34. Schmulson MJ, Remes-Troche JM, Lopez-Alvarenga JC, Vargas JA, LopezColombo A, Crespo Y, et al. Rome III IBS-M subgroup is associated with increased severity of upper gastrointestinal symptoms. A report of the Mexican IBS working group. Neurogastroenterol Motil 2009;1(S1):69. 178 Capítulo 11 Epidemiología de los síntomas gastrointestinales en diabetes OSCAR TERAMOTO MATSUBARA 1. INTRODUCCIÓN La diabetes mellitus (DM) afecta a más de 285 millones de personas en el mundo y se espera que alcance los 438 millones en el 2030. Más de 80% de las muertes por diabetes se registra en países de ingresos bajos y medios; casi la mitad de esas muertes corresponde a personas de menos de 70 años de edad, y hasta 55% son mujeres. Los trastornos en la motilidad gastrointestinal son comunes en la DM y son de origen neuromuscular; se estima que afectan hasta a 75% de pacientes en esta población, y que en la mayoría de los casos se deben a complicaciones directas de la DM, como la neuropatía y la micro y macroangiopatía diabética. La morbilidad es considerable, e incluye un amplio espectro de manifestaciones que va desde cambios subclínicos a síntomas severos, y que afectan desde el esófago hasta el colon. En el sistema digestivo existen afecciones hepáticas y pancreáticas, las cuales están fuera del alcance de los objetivos de la presente revisión (Cuadro 1).1 En cambio, se tratará de hacer énfasis en la epidemiología de las manifestaciones del tracto gastrointestinal y entender la importancia de tener un control metabólico adecuado para el manejo de los síntomas, que al final son parte de los mecanismos fisiopatológicos multifactoriales en donde se involucran no solo los cambios distróficos y metabólicos que afectan los mecanismos del sistema nervioso entérico y autonómico, el músculo liso y las células intersticiales de Cajal, sino en gran medida los cambios sistémicos en este padecimiento. Una parte interesante de los trastornos motores gastrointestinales es que son comunes, pero en la mayoría de los casos no existe una correlación entre su presencia y la severidad de los síntomas; por ello, muchos pacientes diabéticos asintomáticos presentan cambios en la motilidad gastrointestinal. Además, hay padecimientos, como la gastroparesia -retardo en el vaciamiento gástrico-, en donde la manifestación más temprana es, en ocasiones, el mal control de la glucemia. Por otro lado, es frecuente que los pacientes no reporten síntomas como disfagia o llenura prandial debido a la presencia de complicaciones mayores, como la nefropatía, la retinopatía o la enfermedad cardiovascular. 181 ÓSCAR TERAMOTO MATSUBARA Cuadro 1. Resumen de las gastroenteropatías diabéticas y sus mecanismos patogénicos Órgano Anormalidad Síntomas Esófago Dismotilidad, candidiasis Disfagia, reflujo, odinofagia Estómago Gastroparesia Intestino delgado Dismotilidad, problemas de absorción Colon Dismotilidad, isquemia Patogénesis Multifactorial: x&DPELRVHQIXQFLÖQ motora (miopatía, Náusea, vómito, disfunción de las células saciedad temprana, intersticiales de Cajal, bezoar < densidad neuronal, Diarrea, < óxido nítrico) malabsorción, x+LSHUVHQVLELOLGDG sobrecrecimiento visceral (central o bacteriano periférica) Estreñimiento, x'LVIXQFLÖQDXWRQÖPLFD diarrea, colitis x$OWHUDFLRQHVHQ isquémica secreción de hormonas (grelina) x(VWUÌVR[LGDWLYR x*HQÌWLFD JHQ$QR x,QIODPDFLÖQ x)DFWRUHVGHFUHFLPLHQWR (tipo insulina) x+LSHUJOXFHPLD La patogénesis es común para todos los órganos, por lo cual es de suponer que la afección es generalizada, aunque se presenten algunos síntomas en forma preferente, o su afección no sea de la misma intensidad Fuente: Gatopoulou A, et al. Eur J Intern Med 2012;23:499–5051 Durante períodos de descompensación de la DM se presentan alteraciones gastrointestinales que son temporales. Durante la cetoacidosis diabética se ha documentado dilatación gástrica. La presencia de íleo es posible por hipermagnesiemia, que se presenta por insuficiencia renal. Es por esto que es importante descartar la presencia de problemas que sean reversibles, incluso es necesario descartar otras enfermedades gastrointestinales primarias o secundarias antes de atribuírselas a la DM. Por último, es frecuente que los trastornos motores gastrointestinales sean la causa de que el paciente se descompense o que inicie una complicación aguda, de ahí la importancia de descartar y controlar estos trastornos. 182 CAPÍTULO 11 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS GASTROINTESTINAL ES EN DIABETES Estas son algunas de las razones por las cuales el estudio de los trastornos motores en la DM es de interés para entender su fisiopatología y su importancia para la homeostasis en el control de la diabetes y de la calidad de vida que presenta el paciente. 2. EPIDEMIOLOGÍA GLOBAL El manejo óptimo de la DM y de sus complicaciones, entre las cuales se encuentran las manifestaciones gastrointestinales, es un reto para el médico en su práctica clínica.2 La presencia de reflujo gastroesofágico y úlcera péptica afecta la calidad de vida del paciente y el control de la glucemia, y, debido a que la capacidad de percepción del dolor disminuye en la DM, su pronóstico empeora. Además, la DM es un factor independiente relacionado con la presencia de lesiones premalignas y malignas gastrointestinales, como el cáncer de colon.2 En un estudio que comparó una población normal, una población diabética controlada y otra con niveles elevados de HbA1c se vio que en este último grupo se presentó menor número de síntomas, pero hay un mayor número de lesiones en los estudios endoscópicos. Además, los diabéticos que presentaron complicaciones gastrointestinales tuvieron una prevalencia mayor de cáncer de colon (39.2% vs. 24.5%, p = .002).2 Feldman y Schiller documentaron que 76% de los pacientes que acudían a una clínica de DM en los Estados Unidos de América (EUA) por lo menos padecían un síntoma gastrointestinal y que 60% reportó estreñimiento.3 Clouse y Lustman encontraron que 20% de pacientes diabéticos que se registraron en un Centro de Investigación Clínica General tuvo náusea, dolor abdominal y diarrea; sin embargo, solo 12% manifestó estreñimiento.4 Un tercer estudio efectuado en Alemania reportó que el estreñimiento fue más frecuente en pacientes con DM tipo II que en sujetos normales.4 Estos estudios se efectuaron en centros de tercer nivel. El estudio de Malecki et al efectuado en población abierta documentó que muchos de los síntomas gastrointestinales, como náusea, vómito y dispepsia no eran más prevalentes que en la población general; mientras la prevalencia de otros, como la pirosis, 183 ÓSCAR TERAMOTO MATSUBARA era ligeramente menor; que el estreñimiento y uso de laxantes era mayor, en especial en hombres, que en la población general; y que esta diferencia es por el uso de bloqueadores del canal de calcio, por lo que no se debe asumir que muchos de los síntomas gastrointestinales son por problemas motores primarios.3 Al observar la epidemiología de la gastroparesia, uno de los trastornos motores que padecen los pacientes con diabetes, destaca que la prevalencia es desconocida debido a que existen pacientes asintomáticos y con síntomas mínimos o vagos. Por sondeos o encuestas se estima que 4% de la población general tiene manifestaciones de gastroparesia.5 En poblaciones especiales que cursan con gastroparesia la prevalencia de pacientes con DM es de entre 11% a 18%. En contraste, un estudio en hospital universitario refiere que, por gamagrafía, 65% de los pacientes diabéticos presentaba retardo en el vaciamiento gástrico a sólidos o líquidos.6-11 En un estudio de cohorte de base poblacional se encontró que en un período de 10 años hubo una proporción acumulada de 5.2% en pacientes con diabetes mellitus tipo I y de 1% en diabetes mellitus tipo 2, comparado con .2% de la población control; es decir, pacientes con DM tipo 1 tienen 30 veces más riesgo de presentar gastroparesia, mientras que con DM tipo II el riesgo es 8 veces mayor que en la población pareada por edad y sexo. Sin embargo, la incidencia sigue siendo baja. Se entiende que el estudio epidemiológico de la gastroparesia diabética debe continuar para saber su riesgo real.12 La incidencia acumulada en la población de Olmsted County, en Minnesota, EUA, en donde se localiza la Clínica Mayo, es de 4.8% en la DM tipo I y de 1% en la DM tipo 2, mientras que en la población general es de .1%. Esta incidencia aumenta con la edad, lo cual es consistente con el hecho de que la gastroparesia inicia en pacientes con DM tipo 1 con más de 10 años de evolución y con la trilogía de neuropatía, nefropatía y retinopatía. Aunque la gastroparesia pareciera ser más común en la DM tipo I, en comparación con la tipo II, la prevalencia mayor en la DM tipo II se debe al mayor número de pacientes que existe en este grupo.13 Kim et al comparó síntomas gastrointestinales que presentaron pacientes consecutivos con DM, con los de una población control que acudía a un centro de alta especialidad; encontró que en el 184 CAPÍTULO 11 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS GASTROINTESTINAL ES EN DIABETES grupo de DM 43% presentó síntomas gastrointestinales altos y 58%, gastrointestinales bajos; comparado con la población control, solo la presencia de síntomas gastrointestinales altos era significativamente mayor. Otro dato interesante es que el único factor predictivo de importancia que se encontró fue la presencia de cifras anormales en la hemoglobina glucosilada, lo cual habla de la importancia del control de la glucemia en la presencia de síntomas gastrointestinales, entre otras complicaciones.14 En niños y adolescentes con DM tipo I la presencia de síntomas gastrointestinales también es mayor que en su grupo control (44.9% vs. 36%; p < .05).15 En un estudio de seguimiento durante por lo menos 9 años a 86 pacientes diabéticos con gastroparesia, ésta no parece tener una relación directa con mortalidad; el tiempo promedio de muerte en 24 pacientes fue de 6 años y las principales causas fueron cardiovasculares o renales. De los 62 pacientes que continuaban vivos, el vaciamiento gástrico a sólidos estaba lento en 32 (52%); el retraso a líquidos en 18 (29%) y con retraso en el tránsito esofágico en 17 (27%).13 Sin embargo, autores como Jung demuestran que la morbilidad es mayor en los pacientes con DM y gastroparesia y, por lo mismo, con mayor mortalidad asociada, aunque no sea en forma directa. Es decir, es más probable que pacientes con gastroparesia sintomática presenten enfermedad cardiovascular, hipertensión y retinopatía, lo cual se debe a la presencia de micro y macroangiopatía, las cuales son secundarias a un pobre control glucémico.13 Aunque la historia clínica es importante en la gastroparesia diabética, algunos pacientes presentan síntomas atípicos, como reflujo gastroesofágico, dolor abdominal, entre otros, sin náusea, vómito o llenura prandial. La falta de respuesta clínica terapéutica inicial en estos padecimientos debe sugerir al médico la posibilidad de estudiar y descartar la gastroparesia.16-18 El uso de antiácidos que contienen magnesio puede causar diarrea, mientras que los que contienen carbonato de calcio o aluminio causan constipación. De 1995 a 2004 se ha visto un aumento en la tasa de pacientes diabéticos hospitalizados por gastroparesia. Sin embargo, ésta no representa el factor principal para este incremento. Los factores que se han asociado a la gastroparesia se relacionan con complicaciones 185 ÓSCAR TERAMOTO MATSUBARA por un control inadecuado de la glucemia, infección, reacciones a medicamentos e insuficiencia adrenal.13 Y aunque la mayor parte de los estudios se refieren a la gastroparesia, también se debe tener presente al vaciamiento gástrico acelerado de sólidos y líquidos. Los síntomas que se relacionan con este trastorno son el síndrome de dumping y la diarrea.13 Camillieri reportó que en una cohorte de 129 pacientes consecutivos con DM se evaluó el tránsito intestinal en forma clínica a través de estudios de medicina nuclear. Del total, 55 (42%) tuvieron una función de vaciamiento gástrico normal; 46 (36%), retardada; y en 28 (22%), rápida. Si bien el vaciamiento gástrico lento se ha relacionado con la DM tipo I, el acelerado se presenta más en diabéticos tipo II, con frecuencia en fases tempranas de la enfermedad.12 Y aunque la gastroparesia ha sido uno de los problemas gastrointestinales más estudiados se debe recordar que otros síntomas y padecimientos del tracto gastrointestinal se presentan y son secundarios a cambios fisiopatológicos locales. Se reporta que en centros de tercer nivel hasta 60% de pacientes presenta estreñimiento, 22% diarrea y 20% tiene incontinencia fecal. Es un hecho que los trastornos motores del colon son en parte debido a la presencia de un tránsito intestinal inadecuado, en especial cuando es lento, pero existen otros factores que contribuyen a este fenómeno, como reflejo gastrocolónico inadecuado, tono del esfínter anal interno menor y distensibilidad y sensibilidad rectal disminuidas.19 La diarrea en el diabético es una causa frecuente de consulta médica. Generalmente se presenta en pacientes con neuropatía autonómica. Se piensa que afecta hasta a 20% de los diabéticos, aunque las series presentan variaciones de 4% a 22%; su presentación puede ser nocturna y es frecuente en hombres. La causa es desconocida pero se cree que es multifactorial. Por otro lado, el estreñimiento es uno de los síntomas más frecuentes en el paciente diabético y la incidencia llega a ser en algunas series de hasta 60%.1 Aunque la causa es desconocida, se han encontrado factores similares a los de la gastroparesia, y se piensa que es por neuropatía autonómica, más que por cambios miopáticos. Esto en parte se basa en el hecho de que la neostigmina y la metoclopramida estimulan al músculo liso del colon, por lo tanto, a la motilidad colónica. El reflujo gastrocolónico se encuentra retardado, 186 CAPÍTULO 11 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS GASTROINTESTINAL ES EN DIABETES disminuido o ausente posterior a la ingesta de alimentos. Además, no hay respuesta mioeléctrica del colon ante la ingesta de alimentos, lo que se traduce en un tránsito colónico lento. La incontinencia anal, debida a hipotensión del tono del esfínter anal interno, es una manifestación de la DM y se encuentra hasta en 40% de pacientes que cursan con diarrea. La incontinencia es mayor en la noche y empieza con el inicio de la diarrea diabética. Existe evidencia de que esto es resultado de la neuropatía periférica y autonómica, la cual afecta al esfínter anal interno. Se ha visto que los cambios en la glucemia tienen efecto en la función del esfínter anal interno. De hecho, la hiperglucemia inhibe la función tónica del esfínter anal externo y disminuye la distensibilidad rectal, con lo cual aumenta el riesgo de que se presente la incontinencia fecal.1 3. EPIDEMIOLOGÍA EN MÉXICO La prevalencia de la DM ha aumentado en forma alarmante en los últimos años, por lo que se considera un problema de salud pública en muchos países; afecta a más de 285 millones de personas en el mundo y se espera que alcance los 438 millones en el 2030. De conformidad con la información de la Encuesta Nacional de Salud y Nutrición 2006 (ENSANUT), la prevalencia aumentó en 14%, lo que representa un total de 8 millones de personas con diabetes en la República Mexicana, lo cual da una prevalencia nacional de 10.7% en personas de entre 20 a 69 años de edad. Pero esta prevalencia fluctúa en otras regiones del país, como es la frontera entre México y EUA, donde la prevalencia llega a ser de hasta 15%.20,21 México ocupa el décimo lugar de diabetes en el mundo y se estima que para el 2030 tenga el séptimo puesto; sin embargo, es el primero en obesidad (específicamente infantil), uno de los más importantes factores de riesgo, por lo que se espera que en los próximos años la incidencia de DM se incremente dramáticamente. Los costos que genera la enfermedad son elevados: se calcula que en el Instituto Mexicano del Seguro Social (IMSS) hay un promedio de 29.5 consultas diarias por consultorio; en la Secretaría de Salud, 14.9; en el Instituto de Seguridad y Servicios Sociales de los Trabajadores 187 ÓSCAR TERAMOTO MATSUBARA del Estado (ISSSTE), 16.8; en el programa IMSS–Oportunidades, 17.2; en los hospitales de Petróleos Mexicanos (PEMEX), 12.4, y en los servicios que otorga la Secretaría de la Defensa Nacional, 7.3. El Instituto Nacional de Salud Pública (INSP) documenta que el gasto anual por diabetes en instituciones de salud equivale, en la Secretaría de Salud, a 475 millones de pesos. Un estudio que evaluó el costo de la DM con el producto nacional bruto en México informa que tan solo en el IMSS, en el año 1996, fue de $708.00 dólares americanos (USD) por diabético por año, lo cual equivale a un gasto de $2,618,000,000.00 USD, para ese año; el porcentaje del gasto en salud que se realizó solo en DM fue de 15.48% y en relación con el producto nacional bruto, de .79%.22,23 La DM fue una de las principales causas de demanda de consulta externa en instituciones públicas y privadas así como uno de los principales motivos para la hospitalización en nuestro país. La esperanza de vida de un individuo diabético es de dos tercios de la esperada, y se sabe que los pacientes con complicaciones crónicas tienen el doble de posibilidades de morir, comparados con la población general. Es decir, la DM se relaciona con una disminución en la expectativa de vida, en donde, en promedio, los hombres con diabetes mueren a una edad más temprana: 67 años de edad, contra 70 años que, en promedio, viven las mujeres. En México, 13 de cada 100 muertes son provocadas por la diabetes; el grupo de edad con más muertes por diabetes se ubica entre los 40 y los 55 años. Se dice que en personas de 40 a 59 años de edad, 1 de cada 4 muertes se debe a complicaciones de la diabetes. Algo que alarma es que la tasa de mortalidad aumentó de 43.3 a 53.2/100,000 habitantes de 1998 a 2002, lo que representa 30% de la mortalidad total en adultos, por lo que las medidas de prevención primaria no han resultado eficaces, y las complicaciones tardías de la enfermedad no se han logrado prevenir ni controlar en forma adecuada.20,21,24 Además, la tasa de mortalidad muestra una tendencia ascendente en ambos sexos con más de 70 mil muertes y 400,000 casos nuevos anuales atribuibles a DM. La Dirección General de Información en Salud en el 2007 publicó que hubo un número mayor de defunciones en el grupo de las mujeres (37,202 muertes), comparado con el de los hombres (33,310), con una tasa de 69.2 por 100,000 habitantes en mujeres y de 64 en hombres.25,26 188 CAPÍTULO 11 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS GASTROINTESTINAL ES EN DIABETES El grupo del Dr. Villalpando trató de evaluar la prevalencia y distribución de la DM tipo II en una muestra nacional probabilística en adultos mayores de 20 años de edad. De 45,000 personas entrevistadas, se determinó en suero la glucemia y la hemoglobina glucosilada de 12,633, de las cuales se efectuó un análisis en 6,350 muestras; se estimó que la incidencia era de 14.42%. Además, se encontró que el control de la DM era bueno solo en 5.3%, malo en 38.4% y muy malo en 56.2%. Como factores relacionados con un buen control de la glucemia estaban el tener mayor edad y un índice de masa corporal bajo, mientras que factores relacionados con el mal control eran una larga duración de la DM, tener atención médica privada o recibir hipoglucemiantes más insulina.24 Para el 2012, de los 6.4 millones de adultos mexicanos que se saben diabéticos, solo 25% se encuentra en un buen control metabólico y 1.8 millones presentan complicaciones.5 De acuerdo con la Encuesta Nacional de Salud, de las complicaciones más frecuentes relacionadas con la diabetes, del total de individuos que reportan diagnóstico previo, 47.6% (3 millones) reportó visión disminuida; 38% (2.4 millones), ardor, dolor o pérdida de sensibilidad en los pies; 13.9% (889 mil), daños en la retina. Por gravedad, 2% (128 mil) reportó amputaciones; 1.4% (89 mil), se encuentra en diálisis por padecer insuficiencia renal crónica terminal, y 2.8% (182 mil), cardiopatía isquémica.25 Ante este panorama, en donde existen necesidades por atender complicaciones tardías importantes de la DM, el comportamiento epidemiológico de los diferentes trastornos gastrointestinales no se conoce con exactitud, y todos se desprenden de estimaciones parciales. Por ejemplo, en México no se conoce la prevalencia de la gastropatía diabética, pero de acuerdo con los estudios anteriores se logra calcular que, de casi 7 millones de diabéticos que hay en nuestro país, 1 millón presenta síntomas gastrointestinales altos y poco más de 600,000 tienen síntomas asociados a gastroparesia. Si la prevalencia de la diabetes no cambia, estas cifras se duplicarán en los próximos 15 años. Además, la evaluación de la prevalencia de síntomas de alteración digestiva alta en diabetes se ve limitada, tanto en México como en el mundo, por la dificultad de realizar estudios poblacionales sin sesgo de selección y de clasificación exacta entre diabetes tipo 1 y tipo 2, 189 ÓSCAR TERAMOTO MATSUBARA aunque existen datos sugestivos de mayor sintomatología digestiva alta en pacientes con diabetes tipo 1, que de tipo 2. No obstante, cuando están presentes, los síntomas digestivos empeoran la calidad de vida de los pacientes, independientemente del tipo de diabetes. Existen factores externos que van a modificar o a iniciar síntomas gastrointestinales, desde la presencia de las complicaciones degenerativas crónicas de la DM, en las cuales es frecuente que a los trastornos gastrointestinales no se les dé la importancia adecuada, o los secundarios a mal control de la glucemia, o por los medicamentos que se utilizan. Uno de los ejemplos lo da el uso de terapias basadas en incretinas para el control de glucosa en diabéticos tipo 2: es un riesgo adicional para desarrollar gastroparesia en este tipo de pacientes. En México, la comercialización y uso cada vez más frecuente de al menos dos GLP-1 (péptido-1 similar al glucagon) hará, sin duda, que se incremente el riesgo de presentar gastroparesia, por lo que habrá que tomar en cuenta esta circunstancia al evaluar a estos pacientes.26 Existen dos estudios que han evaluado el impacto o frecuencia de síntomas gastrointestinales en pacientes mexicanos con diabetes. El primero de ellos es un estudio realizado en pacientes con DM tipo 2 (47 pacientes con síntomas gastrointestinales y 46 sin síntomas) en un centro de tercer nivel de la ciudad de México. En este estudio los síntomas más frecuentes fueron los de reflujo gastroesofágico (41.6%), dispepsia (14.6%), síndrome de intestino irritable (21.3%), incontinencia fecal (21%) y combinaciones de múltiples trastornos digestivos (2.2%). Además, los autores demostraron que los pacientes con síntomas GI y DM tuvieron una menor calidad de vida evaluada mediante el cuestionario SF-36, ejerciendo así un impacto negativo.27 El otro estudio, realizado por Sánchez-Maza et al,28 evaluó de forma consecutiva a 100 pacientes con DM tipo 2 (edad promedio 56 años, HbA1c promedio de 10.1) mediante la aplicación del cuestionario PAGISIM demostró que 80% de los pacientes con DM tiene al menos un síntoma gastrointestinal asociado. Los síntomas más frecuentes fueron llenura posprandial (39%), agruras (36%), náusea (33%), regurgitación (30%) y vómito (13%). Considerando los síntomas sugerentes de gastroparesia en este estudio se asumió que 51% de los sujetos pudiera tener síntomas de gastroparesia. Los factores asociados a los síntomas gastrointestinales fueron neuropatía y retinopatía. 190 CAPÍTULO 11 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS GASTROINTESTINAL ES EN DIABETES 4. RESULTADOS DEL ESTUDIO SIGAME Los aspectos metodológicos de este estudio se describen en el Capítulo 4. Aunque la intención inicial fue la de identificar pacientes con trastornos funcionales, también permitió identificar la presencia de 389 sujetos (10.9%, IC 95% 9.8 a 11.9%) con DM. Esto fue más frecuente en hombres que en mujeres (13.4% vs. 8.9% de la población general, p = .001) y la edad promedio fue de 35.9 ± 18 años (Cuadro 2). Los síntomas gastrointestinales reportados con mayor frecuencia, de acuerdo con el cuestionario PAGY-SIM, fueron: náusea, en 235 personas (63.7%, IC 95% 58.6 a 68.4); vómito, en 162 sujetos (43.9%, IC 95% 38.9 a 49); plenitud prandial, en 301 individuos (81.5%, IC 95% 77.3 a 85); saciedad temprana, en 252 sujetos (68.2%, IC 95% 63.3 a 72.8); anorexia o hiporexia, en 250 personas (67.7%, IC 95% 62.8 a 72.3); sensación de distensión abdominal alta, en 306 pacientes (82.9%, IC 95% 78.7 a 86.42). Estos síntomas pueden estar relacionados con la presencia de gastroparesia o de dispepsia funcional. Por otro lado, se reportaron síntomas de dolor epigástrico en 268 sujetos (72.6%, IC 95% 67.8 a 76.9); agruras diurnas, en 314 personas (85%, IC 95% 81 a 88.3) y nocturnas en 296 individuos (80.2%, IC 95% 75.3 a 85.6); regurgitación, en 284 sujetos (76.9%, IC 95% 72.4 a 80.9). Estos síntomas pueden sugerir la presencia de enfermedad por reflujo gastroesofágico o de enfermedad ácido-péptica. Además, si se toman en cuenta los síntomas de acuerdo a Roma II y basados en la pregunta de ausencia de datos de alarma estas serían las prevalencias de los TFD, de acuerdo a Roma III: Pirosis funcional: 65 sujetos (17.6%, IC 95% 14 a 21) Dispepsia no investigada (difícil saber si es dispepsia o gastroparesia): 106 sujetos (28.7%, IC 95% 24.3 a 33.5) SII: 52 sujetos (14.1%, IC 95% 10.9 a 18.1) SII-E = 25 (48%) SII-M = 21 (40%) SII-D = 6 (12%) Estreñimiento: 68 sujetos (18.4%, IC 95% 14.8 a 22.7) 191 ÓSCAR TERAMOTO MATSUBARA Cuadro 2. Características sociodemográficas de los pacientes con DM en población mexicana SIGAME 2014 DM (n = 369) Edad 35.9 ± 18* (%) x+RPEUH x0XMHU Zona geográfica 1. Noroeste 2. Noreste 3. Centro Norte 4. Oeste 5. Centro Sur 6. Suroeste 7. Este 8. Sureste 19.5 5.1 5.7 22 27.4 1.6 7.3 11.4 Zona económica con ingreso 1. Alto 2. Medio Alto 3. Medio 4. Bajo 35 41.7 17.9 5.4 Ocupación 1. Ama de casa 2. Desempleado 3. Estudiante 4. Jubilado 5. Otro 6. Profesionista 33.9 5.9 1.6 18.4 17.1 23.8 Escolaridad 1. Primaria 2. Secundaria 3. Preparatoria 4. Universidad 5. Otro 21.7 25.7 21.7 23.8 7 *p<.05 192 53.1 46.9 CAPÍTULO 11 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS GASTROINTESTINAL ES EN DIABETES De acuerdo con lo anterior y evaluando la calidad de vida que presentan los sujetos diabéticos con síntomas gastrointestinales se observa disminución importante en todos los aspectos. Los pacientes que tienen peor calidad de vida son los que tienen síntomas de dispepsia, y esto ocurre en todos los dominios. Los sujetos con DM y pirosis se ven afectados más en su vestido, dieta y esfera psicológica, más que los que tienen pirosis. Los que tienen DM y síndrome de intestino irritable (SII) tienen menor puntaje en todas las esferas, menos en la psicológica (Cuadro 3). Cuadro 3. Calidad de vida de los pacientes diabéticos que sufren alguno de los tres trastornos funcionales digestivos más comunes, según el PAGI-SYM SIGAME 2014 Sanos (n=925) DM y pirosis SI (n=65) NO (n=304) DM y síntomas dispépticos SI (n=106) DM y SII NO (n=263) SI (n=52) NO (n=317) 45 ± 18 50 ± 25* 38 ± 25 42 ± 29 40 ± 24 30 ± 26* 42 ± 25 93.8 ± 17 61.8 ± 27* 69 ± 21* 56 ± 22*,# 72 ± 20* 60 ± 18*,# 69 ± 23* 95.2 ± 17 67 ± 29* 73 ± 22* 59 ± 26*,# 77 ± 20 * 65 ± 22*,# 73 ± 24* 91.2 ± 24 56 ± 28*,# 66 ± 24* 54 ± 22*,# 68 ± 25* 55 ± 25*,# 66 ± 24* x9HVWLGR 93.16 ± 22 57 ± 28*,# 67 ± 25* 56 ± 25 *,# 69 ± 26 * 51 ± 21*,# 67 ± 26* x'LHWD 96.3 ± 18 72 ± 33* 75 ± 23* 61.4 ± 30*,# 80 ± 21 67 ± 23*,# 76 ± 25* x5HODFLRQHVSHUVRQDOHV 91.1 ± 17 55 ± 27*,# 64 ± 23 * 49 ± 21*,# 68 ± 23 * 58 ± 21* 63 ± 25 Edad Puntaje global x$FWLYLGDGHV diarias x3VLFROÖJLFDV *p < .05 comparado contra el grupo control # p < .05 comparado con los pacientes con DM sin el síntoma digestivo 5. CONCLUSIONES Los trastornos motores gastrointestinales en la DM son frecuentes. La prevalencia de la DM ha aumentado en forma alarmante en los últimos años, por lo que en muchos países se considera como un problema de salud pública, y México no es la excepción. La DM en nuestro país es una de las enfermedades cuya morbilidad y mortalidad ha ido en aumento alarmante, por lo que el conocimiento de estas manifestaciones gastrointestinales es de la mayor importancia. El 193 ÓSCAR TERAMOTO MATSUBARA manejo óptimo de la enfermedad, así como de sus complicaciones, entre las cuales se encuentran las manifestaciones gastrointestinales, es un reto para los médicos en su práctica clínica. La presencia de reflujo gastroesofágico, llenura prandial y posprandial, distensión abdominal, constipación y diarrea son algunos de los síntomas que los pacientes refieren padecer. El primer problema es definir si esto es secundario a la DM o si es un proceso independiente. Otro aspecto importante es que en muchas ocasiones cursan en forma asintomática, con síntomas mínimos, o vagos, como pérdida de peso o dificultad en el control de la glucemia, o severos, como desnutrición. La prevalencia de los trastornos de motilidad no se conoce; se pensó que su origen estaba relacionado con la presencia de neuropatía autonómica diabética, luego, el conocimiento se amplió y los estudios llevaron a otros factores relacionados, como la presencia de neurotransmisores diversos -la grelina y la obestatina, entre otros-. Pero como la fisiopatología es compleja y no es solo una disfunción tisular, sino que la gastroenteropatía diabética presenta cambios importantes en la composición celular de la túnica muscular y los nervios extrínsecos que la inervan, debemos considerar a este aspecto como una distrofia neuromuscular, más que como un trastorno funcional. La DM causa distrofia y degeneración de las neuronas, del músculo liso y de las células intersticiales de Cajal a través de los cambios en la homeostasis entre los factores pro y antioxidantes, los estímulos tróficos que se encargan de madurar a las células y sus precursores, y la presencia de factores autoinmunes (Figura 1). Los cambios celulares conducen a cambios tisulares, cuyo progreso reduce la reserva funcional y, eventualmente, se traduce en falla del órgano blanco. Es por eso que inicialmente los cambios metabólicos son reversibles, pero con el tiempo causan daño progresivo que no es posible reparar. Las nuevas estrategias terapéuticas se enfocan en desarrollar medicamentos que bloqueen los factores citotóxicos, que mejoren la regeneración celular en fases tempranas de la enfermedad. Es por eso que los estudios epidemiológicos van encaminados a conocer una realidad de la enfermedad, su estado actual, las necesidades propias de nuestra población y la adaptabilidad de las tendencias mundiales a la misma. En especial, el conocimiento y el 194 CAPÍTULO 11 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS GASTROINTESTINAL ES EN DIABETES estudio adecuado de los trastornos digestivos en los pacientes con DM es de importancia por las consecuencias en la calidad de vida, y los cambios fisiológicos, por sus consecuencias locales -la gastroparesia, diarrea, estreñimiento-, y extradigestivas, como el descontrol de la glucemia, entre otros. Figura 1: Esquema del modelo sobre la patogénesis de la gastroenteropatía diabética Diabetes Factor de crecimiento dep. insulina Hiperglucemia $XWRLQPXQLGDG " Antioxidantes Óxido nítrico, histamina Músculo liso Célula intersticial de Cajal Sistema nervioso entérico Sistema nervioso autonómico La degeneración celular de los tejidos en la DM es secundaria a la acción combinada del estrés oxidativo y la disminución de mediadores tróficos. La autoinmunidad es un factor que puede contribuir en la DM tipo I, pero sigue en debate su función real. La hiperglucemia es el factor que inicia el estrés oxidativo. El óxido nítrico que se produce en el sistema nervioso entérico y autonómico es susceptible a la presencia de factores de estrés oxidativo, además de una reducción en los factores tróficos de las células intersticiales de Cajal, lo cual ayuda en la disminución en su número y función. También la disminución en los factores tróficos afecta al músculo liso, por la disminución en la producción de factores de crecimiento derivados de la insulina y los factores para células madre. Modificado de: Ördög T, Hayashi Y, Gibbons SJ. Minerva Gastroenterol Dietol 2009;55:315–4318 195 ÓSCAR TERAMOTO MATSUBARA REFERENCIAS 1. Gatopoulou A, Papanas N, Maltezos E. Diabetic gastrointestinal autonomic neuropathy: Current status and new achievements for everyday clinical practice. Eur J Intern Med 2012;23:499–505. 2. Fujimiya M, Ataka K, Asakawa A, et al. Regulation of gastroduodenal motility: acyl ghrelin, des-acyl ghrelin and obestatin and hypothalamic peptides. Digestion 2012;85:90-4. 3. Maleki D, Locke III GR, Camillieri M, et al. Gastrointestinal tract symptoms among persons with diabetes mellitus in the community. Arch Intern Med 2000;160:2808-16. 4. Kodof-Anderson K, Tarnow L. Pevalence of gastroparesis-related symptoms in an unselected cohort of patients with type 1 diabetes. J Diabetes Compl 2012;26:89-93. 5. Abell TL, Bernstein RK, Cutts T, et al. Treatment of gastroparesis: a multidisciplinary clinical review. Neurogastroenterol Motil 2006;18:26383. 6. Thumshirn M. Pathophisiology of functional dyspepsia. Gut 2002;51:63-6. 7. Bouras EP, Scolapio JS. Gastric motility disorders. Management that optimizes nutritional status. J Clin Gastroenterol 2004;38:549-57. 8. Parkman HP, Hasler Wl, Fisher RS. American Gastroenterological Association technical review on the diagnosis and treatment of gastroparesis. Gastroenterology 2004;127:1592-622. 9. Chitkara DK, DiLorenzo C. Pharmacotherapy for functional gastrointestinal disorders in children. Curr Opin Pharmacol 2006;6:536-40. 10. Kindt S, Tack J. Impaired gastric accommodation and its role in dyspepsia. Gut 2005;55:1685-91. 11. Bisschops R, Tack J. Dysaccommodation of the stomach: therapeutic QLUYDQD"1HXURJDVWURHQWHURO0RWLO 12. Choung RS, Locke III GR, Schleck CD, et al. Risk of gastroparesis in subjects with type 1 and 2 diabetes in the general population. Am J Gastroenterol 2012;107: 82-8. 13. Camilleri M, Bharucha AE, Farrugia G. Epidemiology, mechanisms and management of diabetic gastroparesis. Clin Gastroenterol Hepatol 2011;9: 5–12. 14. Kim JH, Park HS, Ko SY, et al. Diabetic factors associated with gastrointestinal symptoms in patients with type 2 diabetes World J Gastroenterol 2010;16:1782-7. 15. Celino ML, Farias ME. Mechanisms and factors associated with gastrointestinal symptoms in patients with diabetes mellitus. J Pediatr (Rio J) 2012;88:17-24. 196 CAPÍTULO 11 x EPIDEMIOLOGÍA DE LOS SÍNTOMAS GASTROINTESTINAL ES EN DIABETES 16. Tang DM, Friedenberg FK. Gastroparesis: approach, diagnostic evaluation and management. Dis Mon 2011;57:74-101. 17. Hoogerwerf WA, Pasricha PJ, Kalloo AN, et al. Pain: the overlooked symptom in gastroparesis. Am J Gastroenterol 1999;94:1029-33. 18. Richter J. The patient with refractory gastroesophageal reflux disease. Dis Esophagus 2006;19:443-7. 19. Ördög T, Hayashi Y, Gibbons SJ. Cellular pathogenesis of diabetic gastroenteropathy Minerva Gastroenterol Dietol 2009; 55:315–43. 20. Instituto Nacional de Estadística y Geografía. Boletín de Estadísticas Vitales 2008. Disponible en: www. inegi.org.mx 21. Flores-Ramírez J, Aguilar-Rebolledo F. Diabetes mellitus y sus complicaciones. La epidemiología, las manifestaciones clínicas de la diabetes tipo 1 y 2. Diabetes gestacional. Parte 1. Plast Rest Neurol 2006;5:139-51. 22. Villarreal-Ríos E, Salinas-Martínez AM, Medina-Jáuregui A, et al. The cost of diabetes mellitus and its impact on health spending in Mexico. Arch Med Res 2000;31:511-14. 23. Olaiz-Fernández G, Rojas R, Aguilar-Salinas CA, Rauda J, Villalpando S. Diabetes mellitus en adultos mexicanos. Resultados de la Encuesta Nacional de Salud 2000. Salud Publica Mex 2007;49 supl 3:S331-S337. 24. Villalpando S, Rojas R, Shamah-Levy T, Ávila MA, Gaona B, De la Cruz V, et al. Prevalencia y distribución de la diabetes mellitus tipo 2 en población adulta mexicana. Una encuesta probabilística. Salud Publica Mex 2010;52 supl 1:S19-S26. 25. ENSANUT [Internet]. Diabetes mellitus: la urgencia de reforzar la respuesta en políticas públicas para su prevención y control. 2012. [Citada 2012 Enero 19]. Disponible en: http://ensanut.insp.mx/doctos/analiticos/ DiabetesMellitus.pdf 26. Harder H, Nielsen L. The Effect of Liraglutide, a Long-Acting Expenditure Glucagon-Like Peptide 1 Derivative, on Glycemic Control, Body Composition, and 24-h Energy expenditure in Patients With Type 2 Diabetes . Diabetes Care 2004 Aug;27:1915-21. 27. Zetina-López A, Custodio-Vázquez A, Hinojosa-Becerril CA, Juárez-Paiz L, Schmulson-Wasserman MJ. Impacto de los síntomas gastrointestinales sobre la calidad de vida de los pacientes diabéticos tipo 2. Rev Invest Clin 2003;55:594-9. 28. Sánchez-Maza Y, Valentín SE, Meixueiro-Daza A, Martínez-de-Jesús F, Baca-Quero EP, Hernández-López AJ, et al. Prevalencia de síntomas gastrointestinales superiores en pacientes con diabetes mellitus y factores asociados: un estudio prospectivo utilizando el cuestionario PAGI SYM. 197 &ODYHGHDOPDFpQ View publication stats