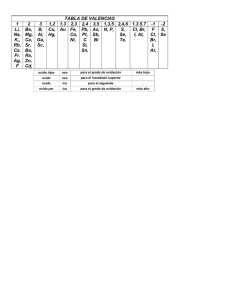
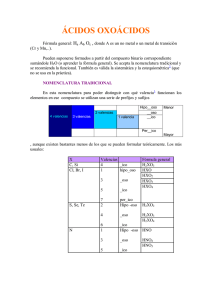
Unidad N°3: Nomenclatura Inorgánica Asignatura: Química Tatiana Morimitsu OA: 19 Explicar la formación compuestos de binarios y fuerzas entre ternarios, eléctricas la partículas yconsiderand la nomenclatura s o inorgánica correspondiente. QUÍMICA INORGÁNICA QUÍMICA INORGÁNICA Se encarga del estudio de la formación, composición, estructura y reacciones químicas de los elementos y compuestos inorgánicos, es decir, los que NO poseen CARBONO (C) unido a un hidrógeno (H). Por ejemplo: O O O C O Nomenclatura Química https://bdescolar.mineduc.cl/info/000407 67 VALENC IA Es la capacidad de combinación de un elemento. Cada elemento puede tener una o mas valencias. Otra definición es que; la valencia de un átomo es el número de electrones que están siendo compartidos por un átomo en un enlace iónico o covalente. Como puedes ver hay Elementos que presentan mas de una valencia. También se clasifican en metales y no metales, según sus propiedades. www.colegioandresbello. ¿Cómo podemos clasificar los compuestos inorgánicos? Compuest os Inorgánico s Compuest os Binarios (2 elementos) Compuest Compuestos os Cuaternarios Ternarios (Cuatro (Tres elementos) elementos) Nomenclatura Inorgánica Los binarioscompuestoy sternarios pueden clasificarse grupos en , tres como e observar puede l siguiente es n esquema. A)Óxidos Básicos Ejemplo de óxidosbásicos • Cu2 O meta l Cu+1 Valencia +1 + Oxigeno + O-2 Valencia 2 Cu2O Las valencias (subíndices) se cruzan al unirse los elementos, quedando como subíndices (los signos + o – de las valencias Recuerda que en química desaparecen). los 1 no se escriben. B)Óxidos Ácidos Ejemplos de ÓxidosÁcidos • CO2 No metal + Oxigen o OC+4 + 2 Valencia +4 Valencia CO 2 2 El Oxigeno sigue teniendo valencia -2 y las valencias vuelven a entrecruzarse, como en el ejemplo del oxido básico. 4 CO2 Acá los subíndices se simplificaron por 2, quedando finalmente el CO2 A) Nomenclatura de Óxidos Básicos (METAL + OXIGENO) IUPAC: Óxido de …………………….....(estadode oxidación en números romanos del metal) (Nombre del elemento) Ejemplo: Na2O : Oxido de Sodio (I) Cu2O: Oxido de Cobre (I) CuO: Oxido de Cobre (II) Ejemplo • Al y O 1- Escribir las Valencias entre paréntesis: Al (+3) y O (2) 2- Colocar las valencias sobre el elemento 3 2 Al O 3-Intercambiar las valencias: 3 2 Al 3 2 Al O O Simplificar si es necesario (no se puede simplificar) Quedand o Al2O3 4- Escribir el nombre: Al2O3 Oxido de ………………………………….(Numero romano del metal) Oxido de ………………………………………………(………) Oxido de aluminio (III) o simplemente Oxido de aluminio (ya que el Al sólo tiene una valencia). B) Nomenclatura de ÓxidosÁcidos (NO METAL +OXIGENO) IUPAC: Óxido de …………………………(estadode oxidación en números romanos del NO metal) (Nombre del elemento) Ejemplo s: Ejemplo • C (carbono) y O (oxigeno) 1- Escribir las Valencias entre paréntesis: C (+2,+4) y O(2) sobre el 2- Colocar las valencias elemento 2 2 CO 4 C 2 O En este ejemplo se puede ver que el Carbono tiene 2 valencias +2 y +4, es por ello que se pueden formar dos óxidos ácidos diferentes. 3-Intercambiar las valencias: 2 2 2 C 2 CO O Simplificar si es necesario (Se puede simplificar por 2) Así qued a: 4- Escribir el nombre: C O Oxido de ………………………………….(Numero romano del metal) Oxido de Carbono (II) 3-Intercambiar las valencias: 4 4 2 C 2 C O Simplificar si es necesario (Se puede simplificar por 2) Así queda : CO2 O 4- Escribir el nombre: CO2 Oxido de ………………………………….(Numero romano del metal) Oxido de Carbono (IV) ACTIVIDAD: Completa la siguientetabla Formula Nombre CaO Oxido de Azufre (VI) Cl2O7 Oxido de Nitrógeno (V) Fe2O3 Oxido de Potasio (I) Oxido de Magnesio (II) Clasificació n A continuación te dejo unos videos que te servirán para complementar los contenidos vistos en esta clase. VALENCIA DE UN ÁTOMO https://www.youtube.com/watch?v=-vuBetx1rak ESTADOS DE OXIDACIÓN https://www.youtube.com/watch?v=GSkCdOOPa s0 OXIDOS BÁSCIOS Y ÁCIDOS https://www.youtube.com/watch?v=Mp6ZN2Dhv ec NOMENCLATURA DE OXIDOS Colegio Andrés https://www.youtube.com/watch?v=hE2EYR856 1Y 2- Compuestos Hidrogenados Colegio Andrés www.colegioandresbello. Departamento de 2- Compuestos Hidrogenados Se Hidruro s Metálico s Colegio Andrés clasific an en Hidruros No Metálicos www.colegioandresbello. Hidrácido s Departamento de A) Hidruros Metálicos Metal (M) + Hidrogeno (H) Fórmula General: MHy y (Valencia del metal) Para Nombrar: Hidruro de ………………………..(Valenciadel Metal en números romanos) (Nombre del elemento) Colegio Andrés www.colegioandresbello. Departamento de Ejemplo • Mg y H 1- Escribir las Valencias entre paréntesis: Mg (+2) y H(1) sobre el 2- Colocar las valencias elemento El hidrógeno en estos compuestos utiliza valencia -1 2 1 Mg H Colegio Andrés www.colegioandresbello. Departamento de 3-Intercambiar las valencias: 2 1 Mg MgH2 H Nombrar el compuesto: Hidruro de Magnesio (II) O Hidruro de Magnesio Colegio Andrés www.colegioandresbello. Recuerda que si el elemento tiene sólo una valencia no es necesario escribir el número romano (). Departamento de B) Hidruros NoMetálicos No Metal (A) + Hidrogeno (H) No Metal (Grupo VA) Fórmula General: AHy y = (Valencia del No metal) Colegio Andrés www.colegioandresbello. Departamento de Para Nombrar: Hidruro de ………………………..(Valenciadel NO Metal en números romanos) (Nombre del elemento) Y ¿Cómo los escribo? Colegio Andrés Igual que los hidruros metálicos, la diferencia es que el hidrogeno utiliza valencia +1 www.colegioandresbello. Departamento de C) HIDRÁCIDOS No Metal (A) + Hidrogeno (H) No Metal (Grupo VIA y VIIA) Fórmula General: HyA y = (Valencia del No metal) Colegio Andrés www.colegioandresbello. Departamento de Para Nombrar: El no metal con el sufijo “uro” de Hidrogeno Cloro = Cloruro Azufre= Sulfuro Fluor= Bromo= Fluoruro Yodo =Yoduro Bromuro Para Nombrar: ÁCIDO ………………………………….Hídrico (Nombre del elemento) HCl: Cloruro de Hidrogeno o Acido Clorhídrico Colegio Andrés www.colegioandresbello. Departamento de ACTIVIDAD: Completa la siguiente tabla conel nombre del compuesto hidrogenado yclasifícalo en Hidruro metálico, no metálico ohidrácido. FORMUL A NOMBRE CLASIFICACI ÓN HF CaH2 PH3 FeH2 LiH H2S AsH3 Colegio Andrés www.colegioandresbello. Departamento de 3- Sales Binarias Formados por dos elementos distintos que no contienen H ni O. • Elemento metálico + No metálico (Grupo VI A o VII A) • Su fórmula general es : MxAy Donde : M: Metal A: No metal “x” es la valencia del no metal “y” es la valencia del metal https://www.youtube.com/watch?v=xRSkwbvtW8c Colegio Andrés www.colegioandresbello. Departamento de Para Nombrar: Primero: Escribimos el nombre del no metal con el sufijo “uro”. Segundo: Escribimos el nombre del metal (Valencia del metal con números romanos) FeS: Sulfuro de Hierro (II) Colegio Andrés www.colegioandresbello. Departamento de COMPUESTOS TERNARIOS Colegio Andrés www.colegioandresbello. Departamento de Compuestos Ternarios 1HIDRÓXIDOS 2OXIÁCIDOS Colegio Andrés 3- SALES DE OXIÁCID www.colegioandresbello. OS Departamento de 1- HIDRÓXIDOS METAL + (OH) M(OH) Fórmula general: y Donde: M = símbolo del metal OH = grupo hidróxilo (La valencia es -1) y = valencia del metal Colegio Andrés www.colegioandresbello. Departamento de • Para Nombrar: • Hidróxido de ..…………………………..(valenciadel metal) (nombre del metal) Colegio Andrés www.colegioandresbello. Departamento de Ejemplo sAl (3) y OH(1) - Al(OH)3 Hidróxido de aluminio Fe(2,3) y OH(1) - Fe(OH)2 - Fe(OH)3 Hidróxido de Hierro (II) Hidróxido de Hierro (III) Cu (2,1) OH(-1) - CuOH - Cu(OH)2 Colegio Andrés Recuerda que las valencias se entrecruzan y Hidróxido de Cobre (I) Hidróxido de Cobre (II) www.colegioandresbello. Departamento de 2- OXIÁCIDOS Hidrógeno + No Metal + Oxigeno Fórmula general: HyExOz Donde: H y O = símbolos del hidrógeno y oxígeno. E = símbolo del no metal y, x, z = subíndices determinados para cada compuesto Colegio Andrés www.colegioandresbello. Departamento de • Se obtiene como combinación de: Óxido ácido + H2O OXIÁCID O • Ejemplo: CO2 (óxido de carbono IV) + H2O CO2 + H2O H2CO3 Ácido Carbónico Colegio Andrés www.colegioandresbello. Departamento de Ejercicio: Realiza la reacción - N2O5 Oxido de Nitrógeno (V) + H2O Colegio Andrés www.colegioandresbello. Departamento de Ejercicios S (2,4,6) H2O Colegio Andrés + www.colegioandresbello. Departamento de PARA NOMBRAR 1- Una valencia: Ácido ...ico Ejemplo: Cr(6) Colegio Andrés www.colegioandresbello. Departamento de 2- Dos valencias: Menor valencia: Ácido ...oso Mayor valencia: Ácido ...ico EJEMPLO: N(3 y 5) Colegio Andrés www.colegioandresbello. Departamento de Ejemplos • HNO2 ÁCIDO NITROSO • HNO3 ÁCIDO NITRICO Colegio Andrés www.colegioandresbello. Departamento de 3- Tres valencias: Menor valencia: Ácido hipo...oso Valencia intermedia: Ácido ...oso Mayor valencia: Ácido ...ico Ejemplo: S(2,4,6) Colegio Andrés www.colegioandresbello. Departamento de Ejemplo: • H2SO2 Ácido hiposulfuroso • H2SO3 Ácido Sulfuroso • H2SO4 Ácido Sulfúrico Colegio Andrés www.colegioandresbello. Departamento de 4- Cuatro valencias: - Primera valencia (baja): Ácido hipo...oso - Segunda valencia: Ácido ...oso - Tercera valencia: Ácido ...ico - Cuarta valencia (alta): Ácido per...ico Ejemplo: Cl(1, 3,5,7) Colegio Andrés www.colegioandresbello. Departamento de Ejemplos de los ácidos formados por el Cloro (Cl): • HClO Ácido • HClO hipocloroso 2 Ácido Cloroso • HClO Ácido Clorico 3 • HClO Ácido perclorico 4 Colegio Andrés www.colegioandresbello. Departamento de Una Valencia ÁCIDO ICO DOS VALENCIAS TRES VALENCI AS CUATR O VALRNCI AS Colegio Andrés ÁCIDO ÁCIDO OSO ICO ÁCIDO ÁCIDO ÁCIDO HIPO ……OSO OSO ICO ÁCIDO ÁCIDO ÁCIDO ÁCIDO HIPO ……OSO OSO ICO PER…..ICO www.colegioandresbello. Departamento de Ejercicios A) B) C) D) E) F) Colegio Andrés Br(1, 3, 5,7) As(3, 5) Si (4) Te(2,4,6) B(3) Se (4,6) www.colegioandresbello. Departamento de 3- SALES DEOXIÁCIDOS Combinación: Oxiácido con un Hidróxido Oxiácido + Hidróxido Colegio Andrés www.colegioandresbello. SAL + H2O Departamento de Fórmula general: MyAz M = símbolo del metal. A = anión cuya capacidad de combinación (y) está dada por el número de átomos de hidrógeno que fueron remplazados en el oxiácido. z = valencia del metal Colegio Andrés www.colegioandresbello. Departamento de Para Nombrar • Para nombrar la sal ternaria, debes fijarte en el nombre del oxácido y cambiar el sufijo: • Si es (OSO) en el oxiácido, es (ITO) en la sal. • Si es (ICO) en el oxiácido, es (ATO) en la sal. Colegio Andrés www.colegioandresbello. Departamento de Ejemplo Hidróxido de Sodio (I) + Acido Nítrico NaOH + HNO3 NaNO 3 H2O + La reacción es un tipo de sustitución doble. Recuerda que lo vimos en la primera unidad del año Colegio Andrés www.colegioandresbello. Departamento de • Completa las siguientes reacciones de sustitución doble que formaran la sal de oxiácido. Colegio Andrés Ácido Sulfúrico (H2SO4) hierro (II) H2SO4 + + Hidróxido de Fe(OH)2 Ácido Fosfórico (H3PO4) Calcio(II) H3PO4 + + Hidróxido de Ca(OH)2 www.colegioandresbello. Departamento de Colegio Andrés www.colegioandresbello. Departamento de !Felicitaciones has terminado de verel contenido¡ • Ahora puedes trabajar la guía relacionada con la unidad de Nomenclatura Inorgánica. Colegio Andrés www.colegioandresbello. Departamento de