Propiedades Coligativas: Cuestionario y Ejercicio Resuelto
Anuncio

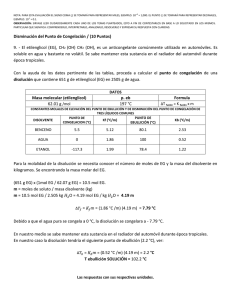
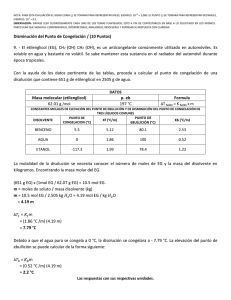
Cuestionario sobre el video: 1) define la propiedad coligativa de presión de vapor y bajo qué ley se rigen. R= Los líquidos no volátiles presentan una gran interacción entre soluto y solvente, por lo tanto su presión de vapor es pequeña, mientras que los líquidos volátiles tienen interacciones moleculares más débiles, lo que aumenta la presión de vapor. Si el soluto que se agrega es no volátil, se producirá un descenso de la presión de vapor, ya que este reduce la capacidad del disolvente a pasar de la fase líquida a la fase vapor. El grado en que un soluto no volátil disminuye la presión de vapor es proporcional a su concentración. La ley que rige esta propiedad es: Ley de Raoult = "A una temperatura constante, el descenso de la presión de vapor es proporcional a la concentración de soluto presente en la disolución" 2) define la propiedad coligativa de punto de ebullición y a partir de que formula lo podemos calcular. R= Un disolvente tiene menor número de partículas que se convierten en gas por la acción de las moléculas del soluto en la superficie. Esto provoca el descenso del punto de ebullición, pues la presión de vapor se igualará a la presión atmosférica a mayor temperatura. El descenso del punto de ebullición se obtiene por la diferencia entre el punto de ebullición de la disolución y el punto de ebullición del disolvente puro.” Es afectado por la presencia de soluto en el solvente, es el paso de liquido a gas” Fórmula para calcular el punto de ebullición: Te= Keb (m) Donde: Keb es la constante de elevación del punto de ebullición, m es la molalidad de la solución y Te= Teb solución – Teb disolvente. 3) define la propiedad coligativa de punto de congelación y a partir de que formula lo podemos calcular. R= En una solución, la solidificación del solvente se producirá cuando éste rompa sus interacciones con el soluto y se enlace nuevamente como si estuviera puro. Para ello la temperatura debe bajar más que el punto en el cual el disolvente se congelaría puro, por lo tanto, el punto de congelación es siempre más bajo que el disolvente puro y directamente proporcional a la concentración del soluto. “Hay disminución del punto de congelación por la presencia de solutos”. Fórmula para calcular el punto de congelación: Tc= Kc (m) Donde: Kc es la constante de congelación (1.86ªC/mol/kg), m es la molalidad y Tc (temperatura de congelación)= 0ªC - Tc. 4) define la propiedad coligativa de presión osmótica y a partir de que formula lo podemos calcular. R= Al poner en contacto dos disoluciones de diferente concentración a través de una membrana semipermeable se producirá el paso del disolvente desde la disolución más diluida hacia la más concentrada, fenómeno conocido como osmosis. La Presión osmótica es aquella que establece un equilibrio dinámico entre el paso del disolvente desde la disolución diluida hacia la más concentrada y viceversa. Fórmula para calcular la presión osmótica: Ecuación de Van´t Hoff: pi = nRT/V; donde pi es la presión osmótica; R = 0,082 L atm/K mol; T la temperatura en °K; V el volumen en L. Si el volumen de la solución fuera 1L entonces n/V = Molaridad y la ecuación quedaría como: pi = MRT 5) ¿Cuáles son las aplicaciones de las propiedades coligativas? R= a. separar los componentes de una solución por destilación fraccionada b. formular y crear mezclas frigoríficas y anticongelantes c. determinar masas molares de solutos desconocidos d. formular sueros fisiológicos para animales e. formular caldos de cultivos para microorganismos f. formular soluciones de nutrientes especiales para regadíos de vegetales 6) ¿Qué es la osmosis? R= fenómeno físico relacionado con el comportamiento de un sólido como soluto de una disolución ante una membrana semipermeable para el solvente mas no para el soluto, tal comportamiento entraña una difusión simple a través de la membrana sin gasto de energía. 7) ¿en la osmosis se requiere gasto de energía? R= no, ya que se da por difusión simple a favor de un gradiente de concentración. 8) ¿De acuerdo con la osmosis cuantos tipos de soluciones podemos encontrar? R= soluciones isotónicas, hipotónicas e hipertónicas. 9) ¿De qué depende el movimiento del agua a través de la membrana? R= depende de la concentración relativa de moléculas de soluto en ambos lados de la membrana. Ejercicios del libro de Whitten: Calcula la temperatura de ebullición y de congelación de una disolución de glicerina, (C3H8O3), en agua, cuya concentración es del 7,2%, en masa.Constantes crioscópica y ebulloscópica del agua son respectivamente: 1,86 ºC·kg/mol y 0,52 ºC·kg/mol Datos: C = 12, H = 1, O = 16. Solución: Datos: Concentración = 7,2% en masa; Kc = 1,86 ºC·kg/mol; Ke = 0,52 ºC·kg/mol Incremento de la temperatura de ebullición de una disolución: Δte = Ke m siendo m la molalidad de la disolución (moles de soluto dividido por kg de disolvente), o sea: m = ns/mD por tanto, lo primero que debemos hallar es la molalidad de la disolución. Moles de soluto: Como la concentración de la disolución en masa es del 7,2%, si tomamos 100 g de disolución, tendremos 7,2 g de soluto (glicerina) y 92,8 g de disolvente, o sea, 0,0928 kg de agua. Peso molecular de la glicerina: Pm (C3H8O3) = 36 + 8 + 48 = 92 ns = 7,2 g·(mol/92 g) = 0,0783 moles Molalidad: m = 0,0783 moles/0,0928 kg = 0,844 moles/kg Δte = (0,52 kg ºC/mol)·(0,844 mol/kg) = 0,44 ºC Como el disolvente es agua su temperatura de ebullición es 100 ºC, luego la temperatura de ebullición de la disolución será: te,d = 100 ºC + 0,44 ºC = 100,44 ºC Incremento de la temperatura de congelación de una disolución: Δtc = Kc m Como ya sabemos la molalidad de la disolución, tenemos que: Δtc = (1,86 kg ºC/mol)·(0,844 mol/kg) = 1,57 ºC La temperatura de congelación del agua es 0 ºC, luego la temperatura de congelación de la disolución será: tc,d = 0 ºC – 1,57 ºC = –1,57 ºC