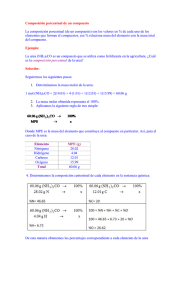
UREA CE Ref.: 27 Instrucciones de Uso Finalidad . Sistema enzimático colorimétrico para la determinación de la Urea en muestras de sangre y orina por reacción de punto final. Precauciones y cuidados especiales No almacenar los reactivos en proximidad de soluciones de amoníaco. Uso profesional. [Solamente para uso diagnóstico in vitro.] Principio . La urea es hidrolizada por la ureasa a iones amoníaco y Como el volumen de la muestra es pequeño, se debe pipetear directamente en el fondo del tubo de ensayo realizando una medición cuidadosa para minimizar problemas de imprecisión. CO2. Los iones amoníaco reaccionan en pH alcalino con salicilato e hipocloruro de sodio, bajo la acción catalizadora del nitroprusiato de sodio para formar azul de indofenol. La contaminación del agua o de la vidriería y un ambiente con amoníaco pueden producir resultados falsamente elevados. Evitar fumar próximo al local de las dosificaciones. La intensidad del color formado es proporcional a la cantidad de urea en la muestra. Se deben aplicar cuidados habituales de seguridad en el manejo de los reactivos. Caracteristicas del sistema . El sistema Urea CE Labtest enzimático colorimétrico utiliza concentraciones optimas de reactivos y principalmente la ureasa, permitiendo operar con cinética de orden cero hasta una concentración de 300 mg/dL. El estándar de urea contiene azida sódica, que es tóxica. Se debe tomar cuidado para evitar la ingestión y en caso de contacto con los ojos se deben lavar inmediatamente con gran cantidad de agua y procurar auxilio médico. Utilizar grandes volúmenes de agua para deshacerse del reactivo. Se consigue obtener una banda dinámica bastante extensa, reduciéndose acentuadamente la repetición de pruebas en valores elevados. El método utiliza la técnica manual y es fácilmente aplicable en analizadores semiautomáticos y automáticos capaces de pipetear dos reactivos y medir con exactitud la absorbancia entre 580 y 620 nm. Por todas estas razonesl, Urea CE Labtest es el método a ser escogido cuando se desea utilizar una metodología enzimática colorimétrica para la determinación de la urea. Metodología . Ureasa-Labtest. ( ) * < Reactivos 1. - Ureasa - Conservar entre 2 - 8 ºC. Contiene tampón fosfato 10 mmol/L y ureasa ³268 KU/L. 2. - Tampón - Estoque - Conservar entre 2 - 8 ºC. Contiene tampón fosfato 100 mmol/L pH 6,9, salicilato de sodio 312 mmol/L y nitroprusiato de sodio 16,8 mmol/L. 3. - Oxidante - Estoque - Conservar entre 2 - 8 ºC. Contiene hidróxido de sodio 2,8 mol/L e hipoclorito de sodio 121 mmol/L. 4. - Estándar 70 mg/dL - Conservar entre 2 - 8 ºC. Contiene azida sódica 7,7 mmol/L. Almacenar bien cerrado para evitar evaporación. Los reactivos no abiertos, cuando almacenados en las condiciones indicadas, son estables hasta la fecha de expiración impresa en el rótulo. Durante su manipuleo están sujetos a contaminaciones de naturaleza química y microbiana que pueden provocar reducción de la estabilidad. 01 Español - Ref.: 27 Los reactivos no abiertos, cuando almacenados en las condiciones indicadas, son estables hasta la fecha de expiración impresa en el rótulo. Durante su manipuleo están sujetos a contaminaciones de naturaleza química y microbiana que pueden provocar reducción de la estabilidad. Material necesario y no suministrado 1. Baño maría mantenido a temperatura constante (37 ºC). 2. Fotómetro capaz de medir con exactitud la absorbancia entre 580 y 620 nm. 3. Pipetas para medir muestras y reactivos. 4. Medidor de tiempo en minutos. Influencias preanaliticas . Los niveles de urea en el suero o plasma suben considerablemente después de ejercicios físicos y con la edad. En mujeres embarazadas, los niveles de urea en el suero y en la orina bajan considerablemente. La alimentación aumenta los niveles de urea en el suero o plasma, principalmente en mujeres. Para control terapéutico, es aconsejable recoger la muestra siempre en el mismo horario debido a variaciones circadianas de la urea. Muestra Se debe crear un Procedimiento Operacional Estándar (POE) que establezca procedimientos adecuados para recogida, preparación y almacenamiento de la muestra. Subrayamos que los errores debidos a la muestra pueden ser bastante más grandes que los errores acaecidos durante el procedimiento analítico. Usar suero o plasma (fluoruro, oxalato, heparina, EDTA) y orina. No usar anticoagulantes que contengan amoníaco. La concentración de fluoruro en la muestra no debe ser más alta que 3 mg/mL ya que el fluoruro en altas concentraciones es inhibidor de la ureasa. El uso de anticoagulante Glistab de Labtest (Ref.: 29) permite la recogida de una sola muestra para las dosificaciones de urea, glucosa y creatinina. La urea es estable en el suero o plasma por 12 horas entre 15 - 25 ºC y varios días entre 2 - 8 ºC. No utilizar muestras con señales de contaminación microbiana. La orina de 24 horas debe ser recogida en frasco conteniendo 2,0 mL de HCI 50% y centrifugada antes de usar. No utilizar formol como preservativo para la orina. Como ninguna prueba conocida puede asegurar que muestras de sangre no transmiten infecciones, todas deben ser consideradas como potencialmente infectantes. Por lo cual, al manejarlas se debe seguir las normativas establecidas para bioseguridad. Para deshacerse de los reactivos y del material biológico sugerimos aplicar las normativas locales, regionales o nacionales de protección ambiental. Interferencias Valores de Bilirrubina de hasta 32 mg/dL, Hemoglobina hasta 80 mg/dL y Triglicéridos hasta 900 mg/dL no producen interferencias significativas. Valores de Hemoglobina más altos que 80 mg/dL y Triglicéridos más altos que 900 mg/dL producen interferencias positivas que no pueden ser minimizadas con el uso del blanco de la muestra. Para evaluar la concentración aproximada de la hemoglobina en una muestra hemolisada se puede proceder del modo expuesto a continuación: Diluir 0,05 mL de la muestra en 2,0 mL de NaCl 150 mmol/L (0,85%) y medir la absorbancia en 405 ó 415 nm, ajustando el cero con agua desionizada o destilada. Hemoglobina(mg/dL) @ Absorbancia405 x 601 Hemoglobina(mg/dL) @ Absorbancia415 x 467 Preparo de reactivos . Ver observaciones 1 y 2. Tampón de Uso . Añadir el contenido del frasco nº 2 (100 mL) a 400 mL de agua destilada o desionizada y mezclar. Estable 12 meses en frasco ambar entre 2 - 8 ºC. Oxidante de Uso . Añadir el contenido del frasco nº 3 (25 mL) a 475 mL de agua destilada o desionizada y mezclar. Estable 12 meses en frasco plástico entre 2 - 8 ºC. 02 Español - Ref.: 27 El agua debe tener una resistividad ³1 megaohm.cm o una conductividad £1 microsiemens/cm y concentración de silicatos <0,1 mg/L. Ureasa Tamponada . Añadir 1,0 mL de Ureasa (nº 1) a 20 mL del Tampón de Uso. Estable 21 días en frasco de cristal ámbar entre 2 - 8 ºC. No almacenar los reactivos en proximidad de soluciones de amoníaco. Procedimiento Ver Precauciones y Cuidados Especiales. Para la dosificación de urea en la orina diluir la muestra 1:50 (0,1 mL de orina + 4,9 mL de agua destilada o desionizada). Multiplicar el resultado obtenido por 50. Disponer 3 tubos de ensayo y proceder como expuesto a continuación: Muestra Estándar (nº 4) Urease Tamponada Blanco Prueba 0,01 mL 1,0 mL 1,0 mL Estándar 0,01 mL 1,0 mL Mezclar e incubar a 37 ºC durante 5 minutos. Blanco 1,0 mL Oxidante de Uso Prueba 1,0 mL Estándar 1,0 mL Mezclar e incubar a 37 ºC durante 5 minutos. Determinar las absorbancias de la prueba y estándar en 600 nm (580 a 620), ajustando el cero con el blanco. El color es estable 2 horas. El procedimiento sugerido para la medición es adecuado para fotómetros cuyo volumen mínimo de solución para lectura es igual o más bajo que 2,0 mL. Se debe hacer una verificación de la necesidad de ajuste del volumen para el fotómetro utilizado. Los volúmenes de muestra y reactivos pueden ser modificados proporcionalmente sin perjuicio para el desempeño de la prueba y el procedimiento de cálculo se mantiene inalterado. En caso de reducción de los volúmenes es fundamental que se observe el volumen mínimo necesario para la lectura fotométrica. Calculos . Ver Linealidad. Absorbancia de la prueba mg/dL = x 70 Absorbancia del estándar Ejemplo Absorbancia de la prueba = 0,269 Absorbancia del estándar = 0,610 0,269 Urea (mg/dL) = x 70 = 31 0,610 Debido a la gran reproducibilidad que se puede obtener con la metodología, se puede utilizar el método del factor. 70 Factor de calibración = Absorbancia del estándar mg/dL = Absorbancia de la prueba x Factor Intervalo de referencia . Estos valores deben ser utilizados únicamente a modo de orientación. Se recomienda que cada laboratório establezca, en la población atendida, su propia banda de valores de referencia. Suero o Plasma Ejemplo Niños y Adolescentes6 Edad 1 día a 12 meses 1 a 13 años 70 Factor = = 114,8 0,610 mg/dL 2 a 34 8 a 36 Urea (mg/dL) = 0,269 x 114,8 = 31 mg/dL x volumen de 24 horas (mL) Orina (mg/24 horas) = 100 Conversión de la urea en el orina para g/24h: Urea (mg/24 horas) Urea (g/24 horas) = Suero o Plasma Edad Adultos mg/dL 15 a 45 Orina . (Todas las edades): 26 a 43 g/24 horas Conversión: Unidades Convencionales (mg/dL) x 0,166 = Unidades SI (mmol/L) 1000 8 Calibración . El Estándar es trazable al Standard Reference Material (SRM) 912a del National Institute of Standards and Technology (NIST). Calibraciones Manuales Obtener semanalmente el factor de calibración. Sistemas Automáticos Blanco de reactivos: agua o solución del NaCl 150 mmol/L (0,85%); Estándar: usar calibradores proteicos. Las concentraciones de la Urea en los calibradores de la línea Calibra de Labtest son trazables al SRM 912a del NIST. Intervalo de las calibraciones Se debe recalibrar el sistema en las siguientes situaciones: Calibración de 2 o 3 puntos al cambiar el lote; Calibración de 2 o 3 puntos cuando el control interno de la calidad indicar. Linealidad El resultado de la medición es lineal hasta 300 mg/dL. Cuando la absorbancia de la prueba sea más alta que 1,0, diluir el producto teñido y el blanco 1:5 con agua destilada o desionizada, hacer nueva lectura y multiplicar el resultado obtenido por 5. Si después de la dilución se obtiene un valor igual o más alto que 300 mg/dL, diluir la muestra con NaCl 150 mmol/L (0,85 %), realizar nueva medición y multiplicar el resultado obtenido por el factor de dilución. Diluir la muestra de tal modo que el valor encontrado se sitúe entre 50 y 100 mg/dL. Control interno de la calidad . El laboratorio debe mantener un programa de control interno de calidad que defina con claridad los reglamentos aplicables, objetivos, procedimientos, criterios para especificaciones de la calidad y límites de tolerancia, acciones correctivas y registro de las actividades. Controles deben ser utilizados para evaluar la imprecisión e desviaciones de calibración. Se sugiere que las especificaciones para el coeficiente de variación máximo y el error 5,7 total sean basados en los componentes de la variación biológica (VB) . 03 Español - Ref.: 27 Caracteristicas del desempeño Exactitud . En dos muestras con concentraciones de Urea iguales a 20 y 50 mg/dL se añadieron cantidades distintas del analito obteniéndose recuperaciones de entre 97 y 100%. El error sistemático proporcional medio obtenido en un valor de 60 mg/dL fue igual a 0,9 mg/dL ó 1,5%. Especificidad . El método propuesto fue comparado con un método similar utilizando 40 muestras con valores situados entre 17 y 116 mg/dL. La comparación resultó en la ecuación de la regresión: y = 1,147 + 0,973x y un coeficiente de correlación (r) igual a 0,998. El error sistemático total (constante y proporcional) verificado en el nivel de decisión (60 mg/dL) fue igual a 0,47 mg/dL ó 0,78%. Como las muestras fueron seleccionadas aleatoriamente en pacientes de ambulatorio y pacientes hospitalizados, se puede concluir que el método tiene una especificidad metodológica adecuada. Repetitividad - imprecisión intra-ensayo Muestra 1 Muestra 2 N 20 20 Media 24 60 DE 0,12 0,48 CV (%) 0,5 0,8 Reproducibilidad - imprecisión total Muestra 1 Muestra 2 N 20 20 Media 24 60 DE 0,30 0,57 CV (%) 1,3 0,9 Sensibilidad metodológica . Una muestra proteica que no contenía urea fue utilizada para calcular el límite de detección del ensayo habiendo sido encontrado un valor igual a 2,03 mg/dL, equivalente a la media de 20 ensayos más dos desviaciones estándar. Utilizándose la absorbancia del estándar como parámetro, se verificó que el límite de detección fotométrica es de 0,11 mg/dL, correspondiendo a una absorbancia igual a 0,001. Efectos de la dilución de la matriz . Dos muestras con valores iguales a 74 y 264 mg/dL fueron utilizadas para evaluar la respuesta del sistema en las diluciones de la matriz con NaCl 150 mmol/L (0,85%). Usando factores de dilución que variaron de 2 a 16 se hallaron recuperaciones de entre 99 y 108%. Presentación Producto Referencia Urea CE 27-500 Observaciones 1. La limpieza y el secado adecuados del material utilizado son factores fundamentales para la estabilidad de los reactivos y obtención de resultados correctos. 2. El laboratorio clínico tiene como objetivo fornecer resultados exactos y precisos. La utilización de agua de calidad inadecuada es una causa potencial de errores analíticos. El agua deionizada o destilada utilizada en el laboratorio debe tener la calidad adecuada para cada aplicación. Así, para preparar reactivos y usar en las mediciones y para su uso en enjuague final de la vidrería, debe tener resistividad ³1 megaohm.cm o conductividad £1 microsiemens/cm y concentración de silicatos <0,1 mg/L. Cuando la columna desionizadora está con su capacidad saturada, se produce agua alcalina con liberación de varios iones, silicatos y sustancias con gran poder de oxidación o reducción que deterioran los reactivos en pocos días o incluso horas, alterando los resultados de modo imprevisible. Por lo cual es fundamental establecer un programa de control de la calidad del agua. 3. Para una revisión de las fuentes fisiopatológicas y medicamentosas de interferencia en los resultados y en la metodología, se sugiere consultar Young DS, ,Effects of Drugs on Clinical Laboratory Tests, 3a edición, Washington: AACC Press, 1990. Referencias 1. Bergmeyer HU. Methods of Enzymatic Analisis, Tomo 9, pág. 449-453, VCH Publishers, Florida, 1985. 2. Bollet WT, Bushman CJ, Tidwell PT. Anal Chem 1961;33:592-594. 3. Tonks DB. Quality Control in Clinical Laboratories. Diagnostic Reagents Division, Ontario, 1970. 4. Weatherburn MW. Anal Chem 1967;39:971-974. 5. http://www.westgard.com/biodatabase1.htm (acesso em 25/10/07) 6. Soldin SJ, Brugnara C, Wong EC: Pediatric Reference Ranges, 5a. edição, Washington: AACC Press, 2005:195-196. 7. Sociedad Española de Bioquímica Clínica y Patología Molecular, B a s e d e D a t o s d e Va r i a c i ó n B i o l ó g i c a . D i s p o n í v e l em:<http://www.seqc.es/ar ticle/ar ticleview/330/1/170> (acesso em 04/2006). 8. Labtest: Datos de Archivo. 04 Español - Ref.: 27 Contenido 1 2 3 1 x 25 mL 1 x 100 mL 1 x 25 mL 1 x 3 mL *El número de pruebas en aplicaciones automáticas depende de los parámetros de programación. Están disponibles aplicaciones para sistemas automáticos. Informaciones al consumidor [Términos y Condiciones de Garantía] Labtest Diagnóstica garantiza el desempeño de este producto dentro de sus especificaciones hasta la fecha de expiración indicada en los rótulos, siempre que los cuidados de utilización y almacenamiento indicados en los rótulos y en estas instrucciones sean seguidos correctamente. Labtest Diagnóstica S.A. CNPJ: 16.516.296 / 0001 - 38 Av. Paulo Ferreira da Costa, 600 - Vista Alegre - CEP 33400-000 Lagoa Santa . Minas Gerais Brasil - www.labtest.com.br Customer Service Revisión: Octubre, 2013 Ref.: 100717 e-mail: customerservice@labtest.com.br Copyright by Labtest Diagnóstica S.A. Reproducción bajo previa autorización 05 Español - Ref.: 27 06 Español - Ref.: 27