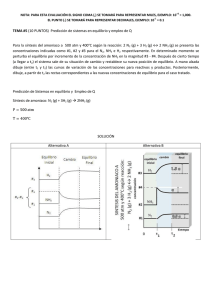
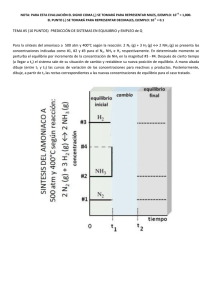
PRODUCCIÓN DE AMONIACO El amoníaco es un gas de olor picante, incoloro, de fórmula NH3, muy soluble en agua. Su punto de fusión es -77,7 °C, su punto de ebullición -33,35 °C. El amoníaco era conocido por los antiguos, quienes lo obtenían a partir de la sal amónica, producida por destilación del estiércol de camello; este proceso se desarrolló cerca del templo de Júpiter Amón en Libia. En Europa, durante la edad media, el amoníaco se obtenía calentando los cuernos y pezuñas de bueyes, y se llamaba espíritu de cuerno de ciervo. El alquimista alemán Basil Valentine obtuvo el amoníaco libre, y el químico francés Claude Berthollet determinó su composición en torno al año 1777. En el siglo XIX, la principal fuente de amoníaco fue la destilación de la hulla; que era un derivado importante en la fabricación de los combustibles gaseosos. Actualmente, la mayoría del amoníaco se produce sintéticamente por reacción de nitrógeno con hidrógeno en presencia de catalizadores basado en óxidos de hierro, denominándolo proceso de Haber-Bosch. El amoníaco se usa ampliamente en la industria química, principalmente en la fabricación de fertilizantes, ácido nítrico y explosivos. Se comercializa líquido en recipientes a presión y en soluciones acuosas. tensión de vapor del NH3 en soluciones acuosas en función de la temperatura. La síntesis del amoniaco a partir de nitrógeno e hidrógeno se desarrolla de acuerdo a la reacción: N2 + 3H2 2NH3 + 21,85 Kcal Se trata de una reacción exotérmica, el valor de la constante de equilibrio disminuye a medida que aumenta la temperatura. A partir de 4 moles de reactivos se obtienen 2 moles de producto, hay una disminución importante de volumen, un aumento de presión favorece en forma notable el rendimiento en la producción de amoniaco. Las reacciones exotérmicas deberían producirse en forma espontánea. En el caso de la síntesis del amoniaco se requiere un importante aporte de energía para que las moléculas de nitrógeno alcancen su estado activado. La energía de disociación del N2 es de 225 Kcal/mol. Para que se inicie la síntesis en un medio homogéneo se requiere de una energía de activación de entre 50 y 100 Kcal por mol. Para suministrar esta energía calentando se requiere de temperaturas entre 600 y 1000oC, a estas temperaturas el rendimiento del proceso es mínimo debido al desplazamiento inverso del equilibrio. A presiones de 2000 atm. la síntesis procede a temperaturas en que el equilibrio es favorable, posiblemente porque las paredes del recipiente actúan como catalizador. En presencia de catalizadores apropiados, la energía de activación disminuye a valores del orden de 25 Kcal/mol y la reacción procede a velocidades razonables a temperaturas sobre 300oC. EJERCICIOS DE PRÁCTICA 1. Una unidad de síntesis de amoniaco sintético con un solo convertidor se alimenta con gas fresco de análisis 75,8% H2 ; 23,7 % N2 y 0,5% de Inertes. El gas abandona el convertidor conteniendo 18,6% NH3 y 70% N2 . Este gas se alimenta a un enfriador o condensador bajo condiciones de temperatura y presión tales que la mayoría del amoniaco se condensa. Luego de separado, los gases se comprimen y reciclan a la entrada del convertidor excepto por una purga en la línea de reciclo. El amoniaco no condensado que abandona el convertidor es el 8% del que abandona el convertidor. Determine: a. Composición % de la corriente de purga. b. Cantidad de Amoniaco Condensado. c. Cantidad de Gas Reciclado. SOLUCIÓN Base de Cálculo: 100 moles de Gas Fresco (Corriente A) Corriente A : % H2 = 75,8 % % N2 = 23,7 % % Inertes = 0,5 % Corriente B : % NH3 = 18,6 % % H2 = 70 % N2 = x Fracción Molar Inertes = y Fracción Molar Corriente R = Corriente P = Corriente C : NH3 = a Fracción Molar H2 = c Fracción Molar N2 = x Fracción Molar Inertes = y Fracción Molar Corriente L NH3 liquido = 92 % del NH3 que sale en la Corriente B Del NH3 que sale del convertidor el 92% se condensa y el resto (8%) se recicla NH3)R = 8% NH3)B Entonces: NH3)L : (0,92).(0,186)B = L ………….Ecuación I NH3)R = (0,08).(0,186)B = a.R …….Ecuación II Balance global de masa en el Enfriador B = L + R ……Ecuación III De III se tiene : L = B – R Sustituyendo III en I : (0,92).(0,186).B = B – R R = (0,8289).B ……. Ecuación IV Sustituyendo IV en II : (0,08).(0,186).B = a.(0,8289).B a= (0,01488).B = a.(0,8289).B 𝟎,𝟎𝟏𝟒𝟖𝟖 𝟎,𝟖𝟐𝟖𝟗 = 𝟎, 𝟎𝟏𝟖 % a = % NH3 en la corriente R , P y C : % a = 0,018x 100% = 1,8 % Balance de H2 en el Enfriador (0,70).B = c.R (0,70).B = c.(0,8289).B c= 𝟎,𝟕𝟎 𝟎,𝟖𝟐𝟖𝟗 = 𝟎, 𝟖𝟒𝟒 %c = 84,4% Balance global en átomos de N 𝟐 𝒂𝒕.𝒅𝒆 𝑵 𝟏 𝒂𝒕. 𝑵 𝟏 𝒂𝒕.𝑵 𝟐 𝒂𝒕. 𝑵 . 𝟐𝟑, 𝟕 𝒎𝒐𝒍.𝑵𝟐 = . 𝑳 𝒎𝒐𝒍 𝑵𝑯𝟑 + . (𝟎, 𝟎𝟏𝟎𝟖)𝑷 + . 𝒙. 𝑷 𝟏 𝒎𝒐𝒍.𝑵𝟐 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 𝟏 𝒎𝒐𝒍 𝑵𝟐 𝟒𝟕, 𝟒 = 𝑳 + (𝟎, 𝟎𝟏𝟎𝟖) 𝑷 + 𝟐. 𝒙. 𝑷 𝟒𝟕, 𝟒 = 𝑳 + ( 𝟎, 𝟎𝟏𝟎𝟖 + 𝟐𝒙 ). 𝑷 ………Ecuación V Balance global en átomos de H 𝟐 𝒂𝒕.𝒅𝒆 𝑯 𝟏 𝒎𝒐𝒍.𝑯𝟐 . 𝟕𝟓, 𝟖 𝒎𝒐𝒍.𝑯𝟐 = 𝟑 𝒂𝒕.𝑯 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 . 𝑳 𝒎𝒐𝒍 𝑵𝑯𝟑 + 𝟑 𝒂𝒕.𝑯 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 . (𝟎, 𝟎𝟏𝟎𝟖)𝑷 + 𝟏𝟓𝟏, 𝟔 = 𝟑𝑳 + (𝟏, 𝟕𝟒𝟐). 𝑷 ……….. Ecuación VI Balance global en Inertes 𝟎, 𝟓 = 𝒚. 𝑷 𝟎, 𝟓 = ( 𝟏 − 𝒂 − 𝒄 − 𝒙 ) . 𝑷 𝟎, 𝟓 = ( 𝟎, 𝟏𝟑𝟖 − 𝒙 ). 𝑷 ………. Ecuación VII Entonces se tiene: Ecuación V : 𝟒𝟕, 𝟒 = 𝑳 + ( 𝟎, 𝟎𝟏𝟎𝟖 + 𝟐𝒙 ). 𝑷 Ecuación VI : 𝟏𝟓𝟏, 𝟔 = 𝟑𝑳 + (𝟏, 𝟕𝟒𝟐). 𝑷 Ecuación VII : 𝟎, 𝟓 = ( 𝟎, 𝟏𝟑𝟖 − 𝒙 ). 𝑷 Resolviendo se tiene: a. Corriente P = 8,06 moles % NH3 = 1,8 % H2 = 84,4 % N2 = 7,6 % Inertes = 6,2 b. Corriente L = 45,85 moles c. Corriente R = 222,09 moles 𝟐 𝒂𝒕.𝑯 𝟏 𝒎𝒐𝒍 𝑯𝟐 (𝟎, 𝟖𝟒𝟒)𝑷 2. Una unidad de síntesis de amoniaco se alimenta con una mezcla gaseosa de composición: 23,5% de N2 ; 70,5% de H2 y 6% de inertes. Los gases productos de la conversión pasan por un sistema de refrigeración donde se condensa amoniaco, que se retira como líquido. Una parte de los gases que abandonan el condensador se recicla a la alimentación y el resto se purga. La concentración de inertes a la entrada del convertidor es de 23% y la concentración de NH3 a la sálida del convertidor es de 10%. La purga contiene 25% de inertes. Determine: a. Composición de la corriente de purga. b. Composición de la corriente a la entrada del convertidor. c. Composición de la corriente a la salida del convertidor. SOLUCIÓN Base de Cálculo: 100 moles de Gas Fresco (Corriente A) d. Corriente A : % H2 = 23,5 % % N2 = 70,5 % % Inertes = 6 % e. Corriente B : % NH3 = 10 % H2 = e % N2 = d % Inertes = f f. Corriente R = Corriente P = Corriente C : %NH3 = i %H2 = h %N2 = g %Inertes = 25 Balance global en Inertes (𝟎, 𝟎𝟔). 𝑨 = (𝟎, 𝟐𝟓) . 𝑷 (𝟎, 𝟎𝟔). 𝟏𝟎𝟎 = (𝟎, 𝟐𝟓). 𝑷 𝑷 = 𝟐𝟒 𝒎𝒐𝒍𝒆𝒔 Balance de Inertes en el pto. de mezcla a la entrada del convertidor (𝟎, 𝟎𝟔). 𝑨 + (𝟎, 𝟐𝟓). 𝑪 = (𝟎, 𝟐𝟑) . 𝑴 (𝟎, 𝟎𝟔). (𝟏𝟎𝟎) + (𝟎, 𝟐𝟓) . 𝑪 = (𝟎, 𝟐𝟑). 𝑴 𝟔 + (𝟎, 𝟐𝟓). 𝑪 = (𝟎, 𝟐𝟑). 𝑴 (𝟎, 𝟐𝟑). 𝑴 − (𝟎, 𝟐𝟓). 𝑪 = 𝟔 ….. Ecuación I En el pto. de mezcla a la entrada del convertidor 𝑨 +𝑪 = 𝑴 𝟏𝟎𝟎 + 𝑪 = 𝑴 𝑴 − 𝑪 = 𝟏𝟎𝟎 …… Ecuación II Resolviendo I y II, se tiene 𝑴 = 𝟗𝟓𝟎 𝒎𝒐𝒍𝒆𝒔 𝑪 = 𝟖𝟓𝟎 𝒎𝒐𝒍𝒆𝒔 Además, se tiene 𝑹=𝑪 +𝑷 𝑹 = 𝟖𝟕𝟒 𝒎𝒐𝒍. Balance global en átomos de N 𝟐 𝒂𝒕.𝒅𝒆 𝑵 𝟏 𝒎𝒐𝒍.𝑵𝟐 𝟐 𝒂𝒕.𝒅𝒆 𝑵 𝟏 𝒎𝒐𝒍.𝑵𝟐 . 𝟐𝟑, 𝟓 𝒎𝒐𝒍. 𝑵𝟐 = . 𝟐𝟑, 𝟓 𝒎𝒐𝒍. 𝑵𝟐 = 𝟏 𝒂𝒕.𝑵 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 𝟏 𝒂𝒕.𝑵 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 . 𝑳 𝒎𝒐𝒍 𝑵𝑯𝟑 + . 𝑳 𝒎𝒐𝒍 𝑵𝑯𝟑 + 𝟏 𝒂𝒕.𝑵 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 𝟏 𝒂𝒕.𝑵 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 .( .( 𝒊 𝟏𝟎𝟎 𝒊 𝟏𝟎𝟎 )𝑷 + 𝟐 𝒂𝒕.𝑵 𝟏 𝒎𝒐𝒍 𝑵𝟐 .( 𝟐 𝒂𝒕.𝑵 ) . 𝟐𝟒 + 𝟏 𝒎𝒐𝒍 𝑵𝟐 𝒈 𝟏𝟎𝟎 .( ).𝑷 𝒈 𝟏𝟎𝟎 ) . 𝟐𝟒 𝟒𝟕 = 𝑳 + (𝟎, 𝟐𝟒). 𝒊 + (𝟎, 𝟒𝟖). 𝒈 …… Ecuación III Balance global en átomos de H 𝟐 𝒂𝒕.𝒅𝒆 𝑯 𝟏 𝒎𝒐𝒍.𝑯𝟐 𝟐 𝒂𝒕.𝒅𝒆 𝑯 𝟏 𝒎𝒐𝒍.𝑯𝟐 . 𝟕𝟎, 𝟓 𝒎𝒐𝒍. 𝑯𝟐 = . 𝟕𝟎, 𝟓 𝒎𝒐𝒍. 𝑯𝟐 = 𝟑 𝒂𝒕.𝑯 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 𝟑 𝒂𝒕.𝑯 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 . 𝑳 𝒎𝒐𝒍 𝑵𝑯𝟑 + . 𝑳 𝒎𝒐𝒍 𝑵𝑯𝟑 + 𝟑 𝒂𝒕.𝑯 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 𝟑 𝒂𝒕.𝑯 𝟏 𝒎𝒐𝒍 𝑵𝑯𝟑 .( .( 𝒊 𝟏𝟎𝟎 𝒊 𝟏𝟎𝟎 ).𝑷 + 𝟐 𝒂𝒕.𝑯 𝟏 𝒎𝒐𝒍 𝑯𝟐 ) . 𝟐𝟒 + .( 𝟐 𝒂𝒕.𝑯 𝟏 𝒎𝒐𝒍 𝑯𝟐 .( 𝟏𝟒𝟏 = 𝟑𝑳 + (𝟎, 𝟕𝟐). 𝒊 + (𝟎, 𝟒𝟖). 𝒉 ……….. Ecuación VI Como debe cumplirse : g + h + i + 25 = 1 Sustituyendo en III : 𝟒𝟕 = 𝑳 + (𝟎, 𝟐𝟒). 𝒊 + (𝟎, 𝟒𝟖). (𝟕𝟓 – 𝒉 – 𝒊 ) 𝟒𝟕 = 𝑳 − (𝟎, 𝟐𝟒). 𝒊 − (𝟎, 𝟒𝟖). 𝒈 …… Ecuación V Entonces resolviendo III , IV y V 𝒊 = 𝟔, 𝟏𝟔 % 𝒊 = 𝟔, 𝟏𝟔 % 𝑳 = 𝟑𝟕, 𝟐𝟔 𝒎𝒐𝒍𝒆𝒔 𝒈 = 𝟏𝟕, 𝟐𝟕 % 𝒊 = 𝟏𝟕, 𝟐𝟕 % 𝒉 = 𝟓𝟏, 𝟔𝟑 % 𝒉 = 𝟓𝟏, 𝟔𝟑 % Entonces: a. Composición de la corriente de Purga (P) 𝒉 𝟏𝟎𝟎 g = 75 – h – i ).𝑷 𝒉 𝟏𝟎𝟎 ) . 𝟐𝟒 %NH3 = 6,16 %H2 = 51,63 %N2 = 17,21 %Inertes = 25 b. Corriente M ( Entrada del convertidor ) NH3 = 52,36 mol % NH3 = 5,51 H2 = 70,5 mol + 438,9 mol = 509,39 mol % H2 = 53,62 N2 = 23,5 mol + 146,29 mol = 169,79 mol % N2 = 17,87 Inertes = 6 mol + 212,5 mol = 218,50 mol % Inertes= 23 c. Corriente B B=L+R %NH3 = 10 %H2 = 49,52 %N2 = 16,51 %Inertes = 23,98 B = 911,26 mol