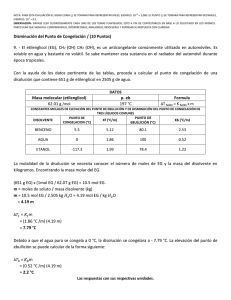
INFORME 11 DE DICIEMBRE DEL 2020 N.L UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO Facultad de Estudios Superiores Zaragoza Ingeniería Química Laboratorio de Ciencia Básica 1 Grupo: 3165 15-17 h Experimento 8: Propiedades Coligativas Franco Pena Ariadna Valeria Martínez González Javier Olivares Fuentes Carlos Eduardo Semestre 2021 – 1 francovaleria605@gmail.com camaleon42161@gmail.com olivares.fuentes.carloseduardo@gmail.com INFORME LCB1 EXPERIMENTO 8: PROPIEDADES COLIGATIVAS G-3165 ING. QUIM I RESUMEN Al terminar el experimento pudimos observar de manera experimental, cómo es que afecta la presencia de un soluto no volátil a la temperatura de congelación y la temperatura de ebullición de un disolvente, en este caso el agua. Se pudo apreciar con claridad que cuanto más soluto se agregue, la temperatura de congelación desciende más e inversamente la temperatura de ebullición aumenta. En términos generales se trató de cumplir con los objetivos del experimento, sin embargo, las circunstancias en las que estamos no permiten cumplir al 100% con lo establecido. / II INTRODUCCIÓN Las propiedades coligativas dependen de la concentración del soluto y no de la naturaleza de sus moléculas. No guardan ninguna relación con el tamaño ni con cualquier otra propiedad de los solutos. Son función sólo del número de partículas. Las propiedades coligativas juegan un importante rol en muchos campos de la Química, porque por su dependencia con el número de moles del soluto, aportan un camino para determinar la concentración por medida de dichas propiedades, estos datos permitirán a su vez, conocer masas moleculares. Las soluciones que con más frecuencia se usan en la práctica, y que son las más sencillas de estudiar, son aquellas en que el soluto es no volátil. En estas soluciones su vapor estará conformado con moléculas de solvente por lo tanto la presión de vapor de la solución es sólo presión de vapor del solvente. Nuestro estudio se referirá exclusivamente a estos sistemas. Las propiedades coligativas no guardan ninguna relación con el tamaño ni con cualquier otra propiedad de los solutos. Son función sólo del número de partículas y son resultado del mismo fenómeno: el efecto de las partículas de soluto sobre la presión de vapor del disolvente. Existen cuatro propiedades coligativas de las soluciones que, para un dado solvente, dependen del número de partículas de soluto, pero no de la naturaleza de éste: • descenso de la presión de vapor • elevación del punto de ebullición • descenso del punto de congelación • presión osmótica Descenso de la presión de vapor INFORME LCB1 EXPERIMENTO 8: PROPIEDADES COLIGATIVAS G-3165 ING. QUIM Cuando se disuelve una sustancia en un disolvente líquido, el punto de congelación de la disolución es menor que el del disolvente puro. El descenso en la temperatura de congelación depende del número de moles de soluto disueltos en una cantidad dada de disolvente. La presión de vapor de un disolvente desciende cuando se le añade un soluto no volátil. Este efecto es el resultado de dos factores: 1. La disminución del número de moléculas del disolvente en la superficie libre. 2. La aparición de fuerzas atractivas entre las moléculas del soluto y las moléculas del disolvente, dificultando su paso a vapor. Si un soluto es no volátil la presión de vapor de su disolución es menor que la del disolvente puro. Así que la relación entre la presión de vapor y presión de vapor del disolvente depende de la concentración del soluto en la disolución. Esta relación está dada por la ley de Raoult, que establece que la presión parcial de un disolvente sobre una disolución está dada por la presión de vapor del disolvente puro, multiplicada por la fracción molar del disolvente en la disolución. Una fuerza motora en los procesos físicos y químicos es el incremento del desorden: a mayor desorden creado, más favorable es el proceso. La vaporización aumenta el desorden de un sistema porque las moléculas en el vapor no están tan cercanamente empacadas y por lo tanto tienen menos orden que las del líquido. Como en una disolución está más desordenada que el disolvente puro, la diferencia en el desorden entre una disolución y un vapor es menor que la que se da entre un disolvente puro y un vapor. Así las moléculas del líquido tienen menor tendencia a abandonar el disolvente para transformarse en vapor. Elevación del punto de ebullición Las disoluciones que contienen solutos no-volátiles presentan puntos de ebullición más elevados que el disolvente puro. La diferencia entre el punto de ebullición de la solución y el disolvente puro para una presión constante establecida se conoce como elevación del punto de ebullición que depende de la naturaleza del disolvente y la concentración del soluto, pero es independiente, por lo menos en soluciones diluidas, de la naturaleza del soluto en tanto este no se disocie. La temperatura de ebullición de un líquido es aquélla a la cual su presión de vapor iguala a la atmosférica. Cualquier disminución en la presión de vapor (como al añadir un soluto no volátil) producirá un aumento en la temperatura de ebullición. La elevación de la temperatura de ebullición es proporcional a la fracción molar del soluto. Este aumento en la temperatura de ebullición (DTe) es proporcional a la concentración molal del soluto: DTe = Ke m INFORME LCB1 EXPERIMENTO 8: PROPIEDADES COLIGATIVAS G-3165 ING. QUIM La constante ebulloscópica (Ke) es característica de cada disolvente (no depende de la naturaleza del soluto) y para el agua su valor es 0,52 ºC/mol/Kg. Esto significa que una disolución molal de cualquier soluto no volátil en agua manifiesta una elevación ebulloscópica de 0,52 º C. Descenso del punto de congelación La presión de vapor más baja de una solución con relación al agua pura, también afecta la temperatura de congelamiento de la solución, esto se explica porque cuando una solución se congela, los cristales del solvente puro generalmente se separan; las moléculas de soluto normalmente no son solubles en la fase sólida del solvente. Por ejemplo, cuando soluciones acuosas se congelan parcialmente, el sólido que se separa casi siempre es hielo puro, como resultado la presión de vapor del sólido es la misma que para el agua líquida pura. La temperatura de congelación de congelación de una solución es la temperatura a la cual comienzan a formarse los cristales de solvente puro en equilibrio con la solución. Debido a que el punto triple de la temperatura de la solución es más bajo que el del líquido puro, la temperatura de congelamiento de la solución también será más bajo que el del agua líquida pura. La congelación se produce cuando la presión de vapor del líquido iguala a la presión de vapor del sólido. Llamando Tc al descenso crioscópico y m a la concentración molal del soluto, se cumple que: DTc = Kc m Siendo Kc la constante crioscópica del disolvente. Para el agua, este valor es 1,86 ºC/mol/Kg. Esto significa que las disoluciones mólales (m=1) de cualquier soluto en agua congelan a -1,86 º C. Presión osmótica La presión osmótica es la propiedad coligativa más importante por sus aplicaciones biológicas. Se define la presión osmótica como la tendencia a diluirse de una disolución separada del disolvente puro por una membrana semipermeable. Un soluto ejerce presión osmótica al enfrentarse con el disolvente sólo cuando no es capaz de atravesar la membrana que los separa. La presión osmótica de una disolución equivale a la presión mecánica necesaria para evitar la entrada de agua cuando está separada del disolvente por una membrana semipermeable. Las leyes que regulan los valores de la presión osmótica para disoluciones muy diluidas (como las que se manejan en Biología) son análogas a las leyes de los gases. Se conocen con el nombre de su descubridor Jacobus H., y se expresan mediante la siguiente fórmula: p= m R T INFORME LCB1 EXPERIMENTO 8: PROPIEDADES COLIGATIVAS G-3165 ING. QUIM Donde p representa la presión osmótica, m es la molalidad de la disolución, R es la constante universal de los gases y T es la temperatura absoluta. De esta manera se puede resumir lo siguiente: ➢ La temperatura de fusión y la de congelación para una sustancia pura a una determinada presión, están a la misma temperatura. ➢ La temperatura de congelación de una sustancia pura desciende cuando a la sustancia se le adiciona un soluto. ➢ El descenso en la temperatura de congelación es muy utilizado actualmente en diferentes procesos industriales. ➢ El descenso en la temperatura de congelación es una consecuencia directa de la disminución de la presión de vapor por parte del solvente al agregarle un soluto. ➢ El proceso de congelación, al igual que el de fusión y el de evaporación son procesos isotérmicos. Esto debido a que el calor ganado o perdido por la sustancia es liberado en su transformación de un estado a otro. ➢ El cambio en la presión trae como consecuencia un cambio en la temperatura de ebullición, congelación y fusión. ➢ Las propiedades de una solución que depende de la concentración de las partículas de soluto y no de su identidad se conocen como propiedades coligativas. ➢ Las propiedades coligativas incluyen disminución de la presión de vapor, elevación de la temperatura de ebullición, descenso de la temperatura de congelación y de la presión osmótica. ➢ A partir de las propiedades coligativas se puede determinar el peso molecular de un soluto desconocido. Además, en la industria son utilizadas también para la crio génesis. ➢ La presencia de un soluto siempre disminuye la temperatura de congelación si éste es insoluble en la fase sólida. ➢ La disminución, o descenso de la temperatura de congelación, hace que la línea de equilibrio sólido - líquido se desplace a la izquierda en el diagrama de fase. ➢ Soluciones de solutos con pesos moleculares diferentes diluidos en un mismo solvente a una misma concentración tienen la misma constante crioscópica para el solvente. ➢ La temperatura de congelación de un líquido es la temperatura a la cual las fases sólida y líquida de una sustancia pueden coexistir entre sí. / INFORME LCB1 EXPERIMENTO 8: PROPIEDADES COLIGATIVAS G-3165 ING. QUIM III MÉTODO Material y equipo. • • • • • • • • • Termómetro digital o de mercurio Vasos de vidrio pequeños (Suficientes) Cuchara medidora Agitador Jarra medidora Balanza granataria Estufa Olla metálica Hielera Secuencia Preparación de soluciones de cloruro de sodio y sacarosa: Preparación de soluciones de sacarosa: 1. 2. 3. 4. 5. 6. 7. 8. 9. Pesar un vaso de vidrio en una balanza granataria Adicionar 150 g de agua, igualmente pesados sobre la balanza Con una cuchara medidora, adicionar 0.5 g de sacarosa Disolver con un agitador hasta homogenizar la disolución Para la segunda solución igualmente pesamos un vaso de vidrio sobre la balanza Agregar 150 g de agua destilada Ahora agregaremos no 0.5 g, sino, 1 g de sacarosa y disolvemos hasta homogenizar Para la tercera solución lo único que cambiará será la cantidad de sacarosa, conforme avance el número de solución se agregará la cantidad anterior + la cantidad inicial, es decir a la tercera solución le corresponden 1.5 g, a la cuarta, 2 g y así sucesivamente hasta la novena solución. Realizar por duplicado cada solución, una para el punto de congelación y otra para el punto de ebullición. Preparación de soluciones de Cloruro de Sodio: 1. 2. 3. 4. 5. 6. 7. 8. 9. Pesar un vaso de vidrio en una balanza granataria Adicionar 150 g de agua, igualmente pesados sobre la balanza Con una cuchara medidora, adicionar 0.5 g de NaCl Disolver con un agitador hasta homogenizar la disolución Para la segunda solución igualmente pesamos un vaso de vidrio sobre la balanza Agregar 150 g de agua destilada Ahora agregaremos no 0.5 g, sino, 1 g de NaCl y disolvemos hasta homogenizar Para la tercera solución lo único que cambiará será la cantidad de NaCl, conforme avance el número de solución se agregará la cantidad anterior + la cantidad inicial, es decir a la tercera solución le corresponden 1.5 g, a la cuarta, 2 g y así sucesivamente hasta la novena solución. Realizar por duplicado cada solución, una para el punto de congelación y otra para el punto de ebullición. Descenso del punto de congelación: 1. 2. Pesar un vaso de vidrio y registrar peso En el vaso, colocar 150 g de agua destilada mediados en una balanza granataria. INFORME 3. 4. 5. 6. 7. 8. 9. LCB1 EXPERIMENTO 8: PROPIEDADES COLIGATIVAS G-3165 ING. QUIM En una hielera colocar una cama de hielos lo suficientemente gruesa y adicionar sal de grano para prolongar la duración del hielo y disminuir altamente la temperatura de este. Colocar el vaso de vidrio con el agua dentro de la hielera, mantener a agitación constante y lenta Con un termómetro verificar la temperatura del agua, y observar cómo va descendiendo esta. Cuando en el vaso de vidrio veamos que el agua destilada comienza a tomar cuerpo en forma de nieve, o la formación de pequeños cristales, tomaremos esa temperatura como referencia. Registrar la temperatura de congelación del agua. Repetir dicho proceso, pero ahora en cada una de soluciones se agregará la cantidad de soluto según sea el caso (Sacarosa o Cloruro de Sodio) y la cantidad correspondiente de agua destilada. Repetir el proceso de operaciones desde el paso 1 hasta el paso 7 con cada una de las 9 disoluciones de sacarosa y con las 9 disoluciones de cloruro de sodio. Elevación del punto de ebullición: 1. 2. 3. 4. 5. 6. 7. 8. 9. Pesar un pocillo u olla metálica en una balanza granataria y registrar peso. Añadir 150 g de agua destilada con una jarra medidora Colocar pocillo u olla en la estufa y poner a calentar Mantener a agitación constante Con un termómetro ir corroborando la temperatura del agua Cuando veamos que del seno del agua comienza a burbujear y emitir vapor, o en otras palabras comience a ebullir, debemos registrar esa temperatura Registrar temperatura de ebullición. Repetir dicho proceso, pero ahora en cada una de soluciones se agregará la cantidad de soluto según sea el caso (Sacarosa o Cloruro de Sodio) y la cantidad correspondiente de agua destilada. Repetir el proceso de operaciones desde el paso 1 hasta el paso 7 con cada una de las 9 disoluciones de sacarosa y con las 9 disoluciones de cloruro de sodio. Diagrama de flujo Hacer cálculos para las soluciones de Sacarosa y de Cloruro de sodio Preparar las 18 disoluciones a utilizar de Sacarosa Preparar las 18 disoluciones a utilizar de Cloruro de sodio INFORME LCB1 EXPERIMENTO 8: PROPIEDADES COLIGATIVAS G-3165 ING. QUIM Preparar mezcla frigorífica para descenso de la temperatura Realizar muestreo con vaso de agua destilada y registrar temperatura de congelación Realizar proceso con cada una de la soluciones de los dos reactivos Realizar muestreo para conocer la temperatura de ebullición del agua Realizar proceso con cada una de la soluciones de los dos reactivos Registro de datos obtenidos durante la práctica / INFORME LCB1 EXPERIMENTO 8: PROPIEDADES COLIGATIVAS G-3165 ING. QUIM IV RESULTADOS Para NaCl se obtuvieron los siguientes datos: Molalidad g de NaCl Kg mL de Agua Agua Temp. Ebullición (°C) Temp. Congelación (°C) 1 0.057038558 0.5 150.2704869 0.15 100 -2 2 2 0.114077116 1 150.2704869 0.15 101 3 3 0.171115674 1.5 150.2704869 0.15 101 -4 -5 4 4 0.228154232 2 150.2704869 0.15 103 -5 5 6 5 6 0.28519279 0.342231348 2.5 3 150.2704869 0.15 150.2704869 0.15 104 104 -5 -7 7 7 0.399269906 3.5 150.2704869 0.15 105 -7 8 8 0.456308465 4 150.2704869 0.15 106 -8 9 9 0.513347023 4.5 150.2704869 0.15 106 -8 Agua 98 0 No. DETERMINACIÓN No. Porciones 1 Densidad Agua: 0.9982 g/ml Para Sacarosa se obtuvieron los siguientes datos: No. No. DETERMINACIÓN Porciones Molalidad g de Kg Sacarosa mL de Agua Agua Temp. Ebullición (°C) Temp. Congelación (°C) 1 1 0.009738047 0.5 150.2704869 0.15 99 -1 2 2 0.019476093 1 150.2704869 0.15 99 -1 3 3 0.02921414 1.5 150.2704869 0.15 100 -3 4 4 0.038952186 2 150.2704869 0.15 100 -4 5 5 0.048690233 2.5 150.2704869 0.15 100 -4 6 6 0.058428279 3 150.2704869 0.15 102 -4 7 7 0.068166326 3.5 150.2704869 0.15 102 -5 8 8 0.077904372 4 150.2704869 0.15 103 -6 9 9 0.087642419 4.5 150.2704869 0.15 104 -6 Agua 97 0 Densidad Agua: 0.9982 g/ml / INFORME LCB1 EXPERIMENTO 8: PROPIEDADES COLIGATIVAS G-3165 ING. QUIM V CONCLUSIONES Al terminar la práctica se obtuvieron distintos resultados para cada una de las soluciones de sacarosa, así como las de cloruro de sodio. Lo primero lo que podemos observar es que como conforme aumenta la cantidad de soluto presente en el disolvente, la temperatura de congelación disminuye cada vez más y viceversa, conforme aumenta la cantidad de soluto, la temperatura de ebullición aumenta. También podemos notar que también existe una diferencia entre un electrolito y un no electrolito, puesto que las temperaturas a las que congeló el agua con el cloruro de sodio fueron menores y a su vez las temperaturas de ebullición fueron mayores que las de la sacarosa respectivamente. Las mediciones obtenidas pueden o no estar cerca de la realidad, pues considerando que no se utilizaron los métodos adecuados, los insumos en estado puro y el material correspondiente, la práctica no puede resultar 100% efectiva, pero se trató de comprender el concepto de las propiedades coligativas y como varían en función de la presencia de un soluto no volátil. / VI BIBLIOGRAFÍA • UNAM. (s. f.). Departamento de Fisicoquímica. Propiedades Coligativas. Recuperado 7 de diciembre de 2020, de http://depa.fquim.unam.mx/amyd/archivero/PROPIEDADESCOLIGATIVAS_30492 • Zapata, M. (2020, 20 noviembre). Propiedades Coligativas: Disminución en el Punto de Congelación. Química en casa.com. https://quimicaencasa.com/propiedades-coligativas-disminucion-puntocongelacion/ • agugarrone.16mb.com. (s. f.). Descenso CrioscÃ3pico | Instituto Superior Albert Sabin. Instituto SABIN. Recuperado 7 de diciembre de 2020, de https://www.albertsabin.edu.ar/comunidadpracticos-descenso-crioscopico.php • Aumento ebulloscópico y punto de ebullición - Propiedades coligativas - Disoluciones - Química -. (s. f.). beUnicoos. Recuperado 7 de diciembre de 2020, de https://www.beunicoos.com/quimica/estados-de-la-materia/propiedades-coligativas/quimicaaumento-ebulloscopico-y-punto-de-ebullicion-propiedades-coligativas /