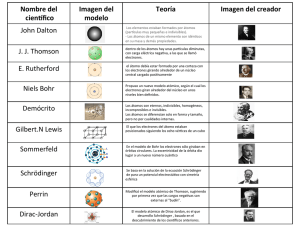
INSTITUTO EDUCATIVO DISTRITAL CIUDADELA 20 DE JULIO (ANTIGUO CEB 120) GUÍA DIDÁCTICA Grado 10 TEMA CIENCIAS NATURALES UNIDAD: 1 ¿De qué está hecho todo lo que nos rodea? ¿Cómo es la microestructura de los materiales? GRADO: Décimo AREA O ASIGNATURA: CIENCIAS NATURALES (QUÍMICA) PERIODO: Segundo FECHA: Julio/2020 DOCENTE: NINFA REYES M CORREO ELECTRÓNICO: laninamorena@hotmail.com WHATSAPP: 3168102629 (comunicación sólo para asesorías y aclaración de dudas) HORARIO DE ASESORIAS Y ACLARACIONES DE DUDAS: según el horario eje temático: lunes a viernes de 8 a 3 p.m. TOPICO: UNIDOS PARA FORMAR UNO SOLO META DE COMPRENSION: El estudiante comprenderá y analizará la estructura del átomo en términos de orbitales, subniveles y niveles de energía, la relacionará con el número atómico del elemento correspondiente. TOPICOS: DISCONTINUIDAD DE LA MATERIA ACTIVIDADES DE APRENDIZAJE: (Para los padres y niños). Jóvenes antes de comenzar lee con cuidado la guía didáctica y organiza todos los recursos que vas a necesitar como libreta o bitácora, tabla periódica consulta las referencias bibliográficas que estarán en esta guía, así como los distintos simuladores. INSTITUTO EDUCATIVO DISTRITAL CIUDADELA 20 DE JULIO (ANTIGUO CEB 120) Actividades de exploración 1. Lee atentamente y subraye las ideas que le permitan identificar las propiedades macroscópicas y microscópicas de la materia Macroscópico y microscópico Hemos establecido que la química estudia las propiedades de la materia o los materiales. Los materiales exhiben una amplia variedad de propiedades, dentro de las que podemos nombrar las diferentes texturas, colores, tamaños, reactividades, entre otras muchas que caracterizan y diferencian todo cuanto existe en el universo. Esta variedad de propiedades que podemos estudiar a través de nuestros sentidos, corresponde a las propiedades macroscópicas. La química busca entender y explicar estas propiedades a partir de la estructura y las propiedades microscópicas, es decir, a nivel de los átomos y las moléculas. La diversidad del comportamiento químico es el resultado de la existencia de unos cuantos cientos de átomos, organizados en elementos. En cierto sentido, los átomos son como las 27 letras del alfabeto, que se unen en diferentes combinaciones para formar la infinita cantidad de palabras de nuestro idioma. Así entonces, toda la materia está formada por átomos. Estos son la unidad básica y estructural y están conformados por partículas más pequeñas que, gracias a su configuración y energía, se mantienen unidas logrando dar paso a estos agregados estables, que terminan siendo los 2. Mediante un dibujo, represente gráficamente la estructura componentes de todo. macroscópica y microscópica de un objeto. Estructura macroscópica Estructura microscópica INSTITUTO EDUCATIVO DISTRITAL CIUDADELA 20 DE JULIO (ANTIGUO CEB 120) Actividad de investigación guiada Cuando observamos el firmamento, el sol, el agua en sus diferentes estados, el suelo, el aire, la atmósfera, los diferentes ecosistemas, los fenómenos naturales, la diversidad de los seres vivos, etc., comprendemos que todo lo que nos rodea está hecho de materia y que toda la materia que nos rodea está constituida por átomos. http://recursostic.educacion.es/secundaria/edad/4esofisicaquimica/impresos/quincen a8.pdf INSTITUTO EDUCATIVO DISTRITAL CIUDADELA 20 DE JULIO (ANTIGUO CEB 120) Temas: MODELOS DE BOHR En la primera mitad del siglo XX se realizaron unos descubrimientos que no podían ser explicados con el modelo de Rutherford. El físico N. Bohr propone un modelo en el que los electrones sólo pueden ocupar ciertas órbitas circulares. Los electrones se organizan en capas y, en cada capa tendrán una cierta energía, llenando siempre las capas inferiores (de menor energía) y después las superiores. La distribución de los electrones en las capas se denomina configuración electrónica y se realiza de la siguiente manera: La 1ª capa puede contener, como máximo, 2 electrones. La 2ª capa puede contener, como máximo, 8 electrones. Comienza a llenarse una vez que la 1ª ya está completa. La 3ªcapa puede contener, como máximo, 18 electrones. Comienza a llenarse una vez que la 2ª capa ya está completa. El número de electrones en cada capa se representa entre paréntesis y separados por comas. Por ejemplo, un átomo que tenga 11 electrones los distribuye así: (2,8,1). Es decir, 2 electrones en la capa 1, 8 electrones en la capa 2 y 1 electrón en la capa 3. Niels Bohr (1885 - 1962). Físico danés. Tras doctorarse en la Universidad de Copenhague en 1911, completó sus estudios en Manchester, Inglaterra a las órdenes de Ernest Rutherford. Basándose en las teorías de Rutherford, publicó su modelo atómico en 1913, introduciendo la teoría de las órbitas cuantificadas, que consiste en que, en torno al núcleo atómico, el número de electrones en cada órbita aumenta desde el interior hacia el exterior. En su modelo, además, los electrones podían caer (pasar de una órbita a otra) desde una órbita exterior a otra interior, emitiendo energía, hecho sobre el que se sustenta la Mecánica Cuántica. En 1916, Bohr comenzó a ejercer de profesor en la Universidad de Copenhague, accediendo en 1920 a la dirección del recientemente creado Instituto de Física Teórica. En 1922 recibió el Premio Nobel de Física por sus trabajos sobre la estructura atómica y la radiación. Abogando por los usos pacíficos de la energía nuclear, retornó a Copenhague, ciudad en la que residió hasta su fallecimiento en1962. De aquí en adelante le envío un curso completo de química para que no salgan de casa. CURSO COMPLETO DE QUIMICA SE ESTUDIAN LOS SIGUIENTES TEMAS 1. IDENTIFICACIÓN DE ATOMOS) PAGINAS 135 – 137 2. PARA PRACTICAR. PAG. 141 3. RECUERDA LO MÁS IMPORTANTE (PAG.144-146) INSTITUTO EDUCATIVO DISTRITAL CIUDADELA 20 DE JULIO (ANTIGUO CEB 120) TODO ESTO ME LO ENVIÁN POR CORREO O POR WHATSAPP Tiempo de ejecución. 1. Actividad Final o síntesis / Evaluación (describir que será continua, formativa, permanente y cómo se llevará a cabo). Observe la siguiente historieta . Introducción.html conceptual Preguntas sobre la historieta en familia: responda todas las preguntas que están en la historieta en libreta le toman fotos y me la envían. INSTITUTO EDUCATIVO DISTRITAL CIUDADELA 20 DE JULIO (ANTIGUO CEB 120) TALLER SOBRE EVALUACION DE CONOCIMIENTOS PREVIO 1. Dibuja un átomo de sodio con 11 protones, 12 neutrones y 11 electrones. 2. Dibuja un átomo de berilio con 4 protones, 5 neutrones y 4 electrones. 3. Un elemento tiene número atómico 1 y número másico 3. Indica cuántos protones, neutrones y electrones tiene uno de sus átomos. 4. Un átomo de un elemento tiene 92 protones, 135 neutrones y 90 electrones. Indica su número atómico, su número másico y su carga. 5. Un elemento tiene 3 isótopos: uno de masa atómica 111 una y 30,57 % en 6. abundancia, otro de masa 113 una y 17,26 % en abundancia y otro de masa 114 una y 52,17 % en abundancia. ¿Cuál es la masa atómica de este elemento 7. ¿Qué diferencia existe entre el Modelo de Bohr y el de Rutherford? OTRAS HERRAMIENTAS.SIMULADOR DE ISOTOPOS. isotopes-and-atomic-mass_es_PE (1).html ETAPA DE SINTESIS: La evaluación es de forma continua, formativa y permanente se tendrán en cuenta las actividades realizadas en la guía, los cuales serán calificados desde lo cognitivo, personal y social, la organización de sus trabajos y la ortografía INSTITUTO EDUCATIVO DISTRITAL CIUDADELA 20 DE JULIO (ANTIGUO CEB 120)