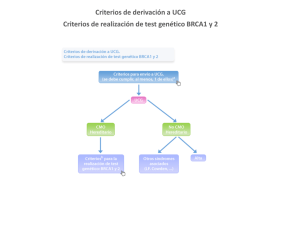
Relevancia de los antecedentes familiares Aunque no está muy claro el uso de los términos mutación y polimorfismo, el término mutación se suele atribuir a situaciones poco frecuentes y que están asociadas una patología, mientras que el término polimorfismo se asocia a una variación común en una población más o menos estable y no es causa directa de ninguna patología. Los polimorfismos patológicos son de interés en el mundo de la medicina para el diagnóstico presintomático y prenatal de enfermedades génicas, para la detección de individuos portadores o para determinar la compatibilidad en trasplantes. También son de interés para definir riesgos a presentar determinadas enfermedades como Alzheimer o diabetes, y condicionar la respuesta a fármacos. Los polimorfismos que generan variaciones fenotípicas pueden influir de forma leve en la susceptibilidad a presentar distintas enfermedades Los polimorfismos pueden tener distinta trascendencia desde el punto de vista funcional, dependiendo de si afectan a una región codificante del genoma, a una región reguladora o a una región no codificante. Pero cuando un polimorfismo génico (es decir, que afecta a una región del ADN codificante) da como resultado una alteración fenotípica, en la mayoría de los casos es perjudicial, ya que puede modificar las características bioquímicas, fisiológicas e incluso morfológicas de la célula, pudiendo originar procesos patológicos. Sólo en casos excepcionales, esta variación o mutación puede ser beneficiosa, dando lugar a una ventaja adaptativa al individuo, siendo éste el motor de la evolución de las especies. Los polimorfismos que generan variaciones fenotípicas pueden influir de forma leve en la susceptibilidad a presentan distintas enfermedades. Existen polimorfismos con alteraciones fenotípicas que dan origen a la aparición de un proceso patológico, originando lo que conocemos como enfermedades genéticas. Asimismo, se utilizan con finalidades clínicas como la identificación de biopsias, la posibilidad de transplantes, la inestabilidad genética de tumores, etc. También se pueden utilizar médicamente para la detección de la susceptibilidad frente a procesos patológicos, especialmente en la prevención de enfermedades complejas. Finalmente, en el caso de los polimorfismos que tienen un papel directo con la aparición de un fenotipo patológico, son de interés para realizar un diagnóstico o el estudio de los mecanismos moleculares de la enfermedad. Los antecedentes de enfermedades familiares son únicos para cada persona. Los factores clave en los antecedentes familiares que pueden aumentar el riesgo son: Enfermedades que hayan ocurrido a una edad más temprana de lo común (10 a 20 años antes de la edad en que esta enfermedad suele afectar a otras personas). Enfermedades que aparecen en más de un familiar cercano. Enfermedades que por lo general no afectan a uno de los sexos en particular (por ejemplo, el cáncer de mama en un varón). Ciertas combinaciones de enfermedades dentro de una familia (por ejemplo, cáncer de mama y de ovarios o afecciones cardíacas y diabetes). Es posible que los antecedentes familiares contengan información importante sobre los riesgos de ciertas enfermedades. Las personas con antecedentes familiares de cierta enfermedad pueden obtener incalculables beneficios si cambian su estilo de vida y se someten a pruebas de detección sistemática. Si bien no se pueden modicicar los genes, sí se pueden cambiar costumbres poco saludables como fumar, el sedentarismo o la mala alimentación. En muchos casos, adoptar un estilo de vida más saludable puede reducir el riesgo de enfermedades presentes en la familia. Las pruebas de detección sistemática (como las mamografías y las pruebas de detección de cáncer colorrectal) pueden detectar enfermedades en etapas incipientes, cuando es más fácil tratarlas. Las pruebas de detección sistemática también pueden detectar factores de riesgo como el colesterol alto o la presión arterial alta para reducir la probabilidad de sufrir una enfermedad. Es muy relevante reunir informacion sobre sus abuelos, padres, tías, tíos, sobrinos, hermanos e hijos. El tipo de información que se debe reunir incluye: Afecciones médicas principales y causas de muerte. Edad a la aparición de la enfermedad y edad de muerte. Orígenes étnicos. Las pruebas genéticas también pueden ayudar a determinar si el paciente o algún miembro de la familia también corre ese riesgo. Aunque una persona tenga una enfermedad en forma hereditaria, se pueden tomar medidas para reducir el riesgo. Debido a que estas variaciones de secuencias se relacionan sólo con un limitado incremento en el riesgo de desarrollar la enfermedad, deben ser consideradas variantes de susceptibilidad, pero no factores causales que inequívocamente determinan la enfermedad y por tanto los hallazgos de asociación deben ser analizados con cautela. Tomando estos datos en conjunto, podemos afirmar con certeza que las intervenciones en los estilos de vida están íntimamente relacionados con la aparición y el curso tempora Enfermedades con carga genetica hereditaria: Cancer: - Cancer de vejiga - Cancer de mama - Cancer de tiroides - Cancer colorectal - Cancer de riñon - Cancer de pulmon - Cancer de utero (endometrio) - Cancer de higado - Cancer de prostata - Linfoma No Hodgkin - Cancer pancreatico - Melanoma Enfermedades cronicas: - Diabetes mellitus - HTA - Enfermedad coronaria - Gota - Cuadros alergicos - Alzheimer - Esquizofrenia - Retinitis pigmentosa - Asma - Arterioesclerosis - Obesidad - Fibrosis Quistica - Corea de Huntington - Enfermedades tiroideas Mutaciones Geneticas mas estudiadas: Las mutaciónes perjudiciales en gen BRCA1 y el BRCA2 aumentan el riesgo de varios cánceres además del cáncer de mama y de ovario. Estos incluyen el cáncer de las trompas de Falopio y el cáncer de peritoneo . Los hombres con mutaciones en el BRCA2 y, en un grado menor, con mutaciones en el BRCA1, tienen también un riesgo mayor de cáncer de mama y de cáncer de próstata. Tanto los hombres como las mujeres con mutaciones dañinas en el BRCA1 o con mutaciones en el BRCA2 pueden tener un riesgo mayor de cáncer de páncreas. Algunas mutaciones en el BRCA2 (también conocidas como FANCD1), si se heredan de ambos padres, pueden causar una forma rara de anemia de Fanconi (subtipo FA-D1), un síndrome asociado con tumores sólidos en la infancia y que se presente la leucemia mieloide aguda. De la misma manera, algunas mutaciones en el BRCA1 (también conocidas como FANCS), si se heredan de ambos padres, pueden causar otro subtipo de anemia de Fanconi. Hay disponibles varios instrumentos como exámenes de detección que se pueden practicar en los pacientes con sospecha. Estos instrumentos evalúan los factores de antecedentes personales o familiares que están asociados con una mayor probabilidad de tener una mutación dañina en el BRCA1 o en el BRCA2, incluso: Cáncer de mama diagnosticado antes de los 50 años de edad Cáncer en ambas mamas en la misma mujer Tanto cánceres de mama como de ovario ya sea en la misma mujer o en la misma familia Múltiples cánceres de mama en la familia Dos o más tipos primarios de cánceres relacionados con BRCA1 o BRCA2 en un solo miembro de la familia Casos de cáncer de mama en hombres Etnicidad judía askenazí Cuando un individuo tiene antecedentes familiares que sugieren la presencia de una mutación en el BRCA1 o en el BRCA2, es posible que se obtenga más información si se examina primero a un miembro de la familia que tiene cáncer, si esa persona vive todavía y acepta examinarse. Si se encuentra que esa persona tiene una mutación dañina en el BRCA1 o en el BRCA2, entonces otros miembros de la familia pueden pensar en tener asesoramiento genético para saber más acerca de sus riesgos posibles y si las pruebas genéticas de mutaciones en el BRCA1 y en el BRCA2 podrían ser apropiadas para esos otros miembros. Si no se puede determinar si el miembro de la familia que tiene cáncer tiene también una mutación dañina en el BRCA1 o en el BRCA2, los miembros de una familia cuyos antecedentes sugieren la presencia de una mutación en el gen BRCA1 o BRCA2 pueden querer todavía pensar en tener asesoramiento genético para hacerse las pruebas genéticas. Algunos individuos, por ejemplo, quienes fueron adoptados desde su nacimiento, pueden no conocer sus antecedentes familiares. Si una mujer que no conoce sus antecedentes familiares tiene un brote temprano de cáncer de mama o de cáncer de ovario, o un hombre con antecedentes familiares desconocidos es diagnosticado con cáncer de mama, ese individuo puede querer pensar en el asesoramiento genético y en hacerse las pruebas genéticas para la mutación en el BRCA1 o en el BRCA2. Las asociaciones profesionales no recomiendan que los niños menores de 18 años, aun aquellos con antecedentes familiares que sugieren una mutación dañina en el BRCA1 o en el BRCA2, se sometan a pruebas genéticas del BRCA1 o del BRCA2. Esto se debe a que no hay estrategias de reducción de riesgos que se consideran específicamente para niños, y los riesgos de los niños de padecer un tipo de cáncer asociado con una mutación en el BRCA1 o en el BRCA2 son extremadamente bajos.