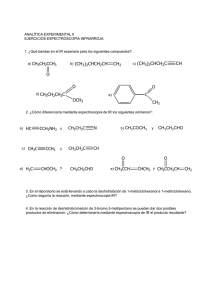
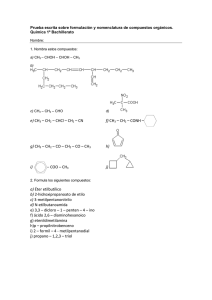
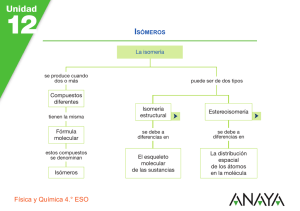
Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3er piso, Edificio 5P “Dr. Manuel Sánchez Lucero” E-mail: mplascencia@guayacan.uson.mx Capítulo 3: Nomenclatura y estructura de hidrocarburos Estructura del carbono Fórmulas Nomenclatura alifáticos Isomería Isómeros geométricos Nomenclatura aromáticos Benceno Resonancia Estructura del carbono, fórmulas, nomenclatura alifáticos colesterol Generalidades Alcanos: Son hidrocarburos que contienen enlaces carbono-carbono sencillos (una ligadura). Cicloalcanos: Son alcanos en dónde todos o algunos de los átomos de carbono están distribuidos en un anillo. Estructura y fórmula general Estructuras de cicloalcanos Alcanos y cicloalcanos son tan similares que muchas de sus propiedades se pueden considerar en forma paralela. Algunas diferencias y ciertas características estructurales se deben a los anillos de los cicloalcanos. Fuentes de alcanos Petróleo: mezcla compleja de compuestos orgánicos, la mayoría de los cuales son alcanos e hidrocarburos aromáticos. También contiene pequeñas cantidades de compuestos que tienen O, N y S. Refinación del petróleo: destilación, separación de fracciones en base a volatilidad de compuestos. Separación catalítica: Descomposición y reordenamiento de moléculas en alcanos más pequeños y más ramificados (5-10 átomos de carbono), en presencia de catalizadores. Ejemplo, obtención de gasolina. El compuesto 2,2,4-trimetilpentano (isooctano), altamente ramificado, se quema con mucha uniformidad (sin detonaciones) en las máquinas de combustión interna y se utiliza como uno de los estándares para establecer el índice de octano en las gasolinas. Tiene un índice de octano de 100. El heptano produce muchas detonaciones al quemarse y tiene un índice de octano de 0. CH3 CH3 CH3–C–CH2–CH–CH3 CH3 2,2,4-trimetilpentano (“Isooctano”) CH3–(CH2)5–CH3 Heptano Alcano lineal Punto de ebullición: 98°C Alcano ramificado Punto de ebullición: 99°C El n-octano tiene un punto de ebullición de 126°C Nomenclatura. Nomenclatura IUPAC International Union of Pure and Applied Chemistry: Sistema formal de nomenclatura creado por primera vez en 1892 y que se sigue utilizando actualmente. El sistema IUPAC para compuestos orgánicos se basa en un principio fundamental: cada compuesto diferente debe tener un nombre diferente (el número de compuestos orgánicos conocidos supera los 7 millones). Es posible deducir la estructura de un compuesto determinado a partir de su nombre IUPAC: los nombres de los alcanos terminan en –ano. Tipos de carbono e hidrógeno. H 1° H 3° H 2° Grupos alquilo Si se elimina un átomo de H de un alcano, se obtiene lo que se llama un grupo alquilo. Estos grupos tienen nombres que terminan en –ilo. Cuando el alcano es NO RAMIFICADO y el átomo de H que se elimina es terminal, los nombres son directos: Alcano Abreviatura Grupo alquilo Metano CH3-H Etano CH3CH2-H Propano CH3CH2CH2-H Butano CH3(CH2)3-H Metilo CH3Etilo CH3CH2Propilo CH3CH2CH2Butilo CH3(CH2)3- MeEtPrBu- Uso de los prefijos: n-, iso-, neo-, sec- y ter En alcanos con tres átomos de Carbono, es posible obtener más de un grupo: CH3CH2CH2- Grupo Propilo CH3CH2CH3 Propano (n-propilo) CH3-CHCH3 Grupo 1-metileno (iso-propilo) Existe un grupo de cinco átomos de carbono con un nombre común aprobado por la IUPAC que se debe reconocer: el grupo 2,2-dimetilpropilo, llamado comúnmente grupo neopentilo. pentilo CH3 CH3-C-CH2CH3 Grupo 2,2-dimetilpropilo ó neopentilo Nomenclatura común 1. Localizar la cadena continua más larga de átomos de carbono; ésta cadena determina el nombre básico del alcano. CH3CH2CH2CH2CHCH3 hexano CH3 CH3CH2CH2CH2CH CH3 heptano CH2 CH3 2. Numerar la cadena más larga empezando por el extremo más cercano al sustituyente. 6 5 4 3 2 1 CH3CH2CH2CH2CHCH3 CH3 7 6 5 4 3 CH3CH2CH2CH2CH CH3 2 CH2 1 CH3 sustituyentes 3. Utilizar los números obtenidos al aplicar la regla 2 para identificar la posición del grupo sustituyente. 6 5 4 3 2 1 CH3CH2CH2CH2CHCH3 2- metil hexano CH3 7 6 5 4 3 CH3CH2CH2CH2CH CH3 2 CH2 1 CH3 3- metil heptano 4. Cuando se encuentran presentes 2 o más sustituyentes, a cada sustituyente se le dará un número correspondiente a su posición en la cadena más larga. CH3 CH CH2 CH CH2 CH3 CH3 CH2 CH3 4-etil-2-metil hexano 5. Cuando se encuentran 2 sustituyentes presentes en el mismo átomo de carbono, se utiliza ese número dos veces. CH3 CH3 CH2 C CH2 CH2 CH3 CH2 CH3 3-etil-3-metil hexano 6. Cuando 2 o más sustituyentes son idénticos, esto se indica por el uso de prefijos di-, tri-, tetra-, etc. Los números se separan por comas. CH3 CH3 CH CH CH3 CH3 CH CH CH CH3 CH3 CH3 CH3 2,3-dimetil butano CH3 CH3 2,3,4-trimetil pentano CH3 CH3 C CH2 C CH3 CH3 CH3 2,2,4,4-tetrametil pentano 7. Cuando 2 cadenas de igual longitud compitan por la selección como cadena base, escoger la cadena que tiene el mayor número de sustituyentes. CH3 CH3 CH3 CH3 CH2 CH CH CH CH CH3 CH2 CH2 CH3 2,3,5-trimetil-4-propil heptano (4 sustituyentes) NO 4-sec-butil-2,3-dimetil heptano (3 sustituyentes) 8. Cuando la primera ramificación aparezca a una distancia igual de cada extremo de la cadena más larga, escoger el nombre que dé el menor número al primer punto de diferencia. 6 5 4 3 2 1 CH3 CH CH2 CH CH CH3 CH3 CH3 CH3 2,3,5-trimetil hexano NO 2,4,5-trimetil hexano **Ejercicios: De nombre a C C C–C–C–C–C–C–C C–C C C C C C C–C–C–C–C–C–C–C C C C C C Nomenclatura de cicloalcanos Los cicloalcanos que contiene un solo anillo se construyen agregando el prefijo ciclo a los nombres de los alcanos que tienen el mismo número de átomos de carbono: Si solo esta presente un sustituyente, no es necesario indicar su posición. Cuando están presentes 2 sustituyentes, el anillo se numera empezando por el sustituyente que se encuentre primero en el alfabeto, y la numeración sigue la dirección que da el menor número posible al siguiente sustituyente. CH3 CH CH3 CH3 CH2CH3 Isopropil ciclo hexano 1-etil-3-metil ciclo hexano NO 1-etil-5-metil ciclo hexano CH3 Cuando están presentes tres o más sustituyentes, se empieza por el sustituyente que lleva a dar a los localizadores los números más bajos. CH2CH3 1 2 3 4 Cl 4-cloro-2-etil-1-metil ciclo hexano NO 1-cloro-3-etil-4-metil ciclo hexano Cuando un anillo contiene menos átomos de C que un grupo alquilo unido a él, el compuesto se nombra como un alcano y el anillo se trata como un sustituyente cicloalquilo. CH3CH2CHCH2CH3 3-ciclobutil pentano **Ejercicio: Nombre a cada uno de los siguientes compuestos CH3 b) a) C(CH3)3 CH3CH C(CH3)3 c) CH3CH2CH(CH2)2CH3 CH3CH CH3CH2CH(CH2)2CH3 d) H3C CH3CH CH3 H3C CH3 Representación de las moléculas orgánicas: fórmula estructural desarrollada, semidesarrollada y molecular. Ejemplo: Propano (3 carbonos) Fórmula molecular: C3H8 Fórmula estructural semidesarrollada: CH3 - CH2 - CH3 Fórmula estructural desarrollada: H H H H-C–C–C-H H H H **Ejercicios: Dibuje la fórmula estructural semidesarrollada de: 4-etil-3-metil octano 4-etil-3,5-dimetil octano 5-etil-2,4,6-trimetil octano Modelos de esferas y barras para tres alcanos simples Propano CH3CH2CH3 Butano CH3CH2CH2CH3 Pentano CH3CH2CH2CH2CH3 Isobutano CH3- CH- CH3 CH3 Isopentano CH3- CH- CH2- CH3 CH3 CH3 Neopentano CH3- C- CH3 CH3 Conceptos básicos Hidrocarburo: compuesto formado sólo por C e H. Alcano: compuesto formado sólo por C, H y enlaces sencillos. Cicloalcano: compuesto cíclico que contiene sólo C e H. Grupo alquilo: cadena de hidrocarburo con un punto de unión abierto. Fórmula molecular: fórmula que proporciona el número exacto de cada clase de átomo en un compuesto. Fórmula condensada (estructural semidesarrollada): fórmula estructural en la cual NO se muestran individualmente todos los enlaces o átomos. Fórmula estructural (desarrollada): fórmula que proporciona la disposición de los enlaces de los átomos de una molécula. Compuesto saturado: compuesto sólo con enlaces sencillos. Compuesto no saturado: compuesto con al menos un doble o triple enlace. Isómeros: compuestos con la misma fórmula molecular pero diferentes fórmulas estructurales. Conformación tridimensional estable del colesterol. Ninguno de los anillos es plano, sino que están plegados para formar ángulos de enlace más estables. Isomería, isómeros geométricos Existen 6 clases de isomería Isomería estructural (isomería de constitución) Estereoisomería 1. De esqueleto. 2. De posición. En los isómeros estructurales, diferentes átomos están unidos unos con otros. 3. Funcional. 4. Geométrica. 5. De conformación. 6. Óptica. Los mismos átomos están enlazados unos con otros pero su configuración en el espacio es diferente. Isomería estructural Isómeros estructurales: isómeros que varían en las uniones de los átomos a través de enlaces. A mayor número de átomos en una fórmula molecular, mayor será el número de compuestos posibles para ella. Muy pocos de los isómeros de C20H42 o C40H82 se han sintetizado, aislado de fuentes naturales o caracterizado. Sin embargo, la posibilidad de su existencia ilustra muy bien el enorme alcance de la química orgánica. Isomería de esqueleto en alcanos (Isomería estructural) Isómeros de esqueleto: aquellos que difieren en la disposición de la cadena de carbono. Isomería de esqueleto en cicloalcanos (Isomería estructural) Tienen la fórmula molecular CnH2n (dos hidrógenos menos que los alcanos correspondientes). El cicloalcano más sencillo es el C3H6. Hay una sola fórmula estructural posible. El siguiente cicloalcano, el C4H8, muestra dos isómeros de esqueleto: C3H6 C4H8 Existen 5 posibles isómeros del C5H10 (no se incluyen los isómeros que tienen dobles enlaces) Representaciones de fórmulas estructurales Al aumentar el número de átomos en una molécula, se requieren de métodos más breves para representar compuestos. Esto es posible con las fórmulas condensadas, las cuales varían desde agrupar los H de un C dado, hasta usar diagramas de varillas. Ejemplo: CH3 (CH3)2-CH-(CH2)2CH3 CH3-CH-CH2CH2CH3 Todas son representaciones del compuesto: C C–C–C–C–C Isomería de posición (Isomería estructural) Isómeros de posición: isómeros que difieren en la ubicación de un grupo SIN carbono o un doble o triple enlace. El esqueleto de carbono NO se modifica. Ejemplo: los cuatro isómeros de C4H9Br CH3CH2CH2CH2Br CH3CH2CHCH3 Br Isómeros de esqueleto Isómeros de posición CH3CHCH2Br CH3 CH3 CH3CCH3 Br Estereoisomería Estereoisomería: se refiere a variaciones isoméricas en cuanto a la orientación espacial o tridimensional de los átomos. La disposición de enlazamiento de los átomos permanece constante, pero la relación de los átomos en el espacio difiere a consecuencia de una rotación en torno a enlaces C-C sencillos. Escalonada Conformación Representaciones Eclipsada Diagrama de caballete Proyección de Newman Isómeros conformacionales (confórmeros) Isómeros que difieren como resultado del grado de rotación en torno a un enlace C-C sencillo. Esta rotación ocurre sin dificultad, con fácil interconversión de los isómeros. Por lo tanto, estas variantes no se pueden aislar. Ejemplo: etano En la conformación eclipsada, la proyección muestra que los H están tan próximos unos a otros, lo cual conduce a una repulsión máxima entre los pares de e- enlazantes y explica la inestabilidad de esta conformación. Un giro de 60° alrededor del eje del enlace C-C coloca los H y los pares enlazantes a una distancia máxima entre sí, con lo que la repulsión se reduce al mínimo. Esta es la conformación escalonada, más estable. Proyecciones de Newman de las conformaciones del 1,2-dibromo etano (BrCH2CH2Br): eclipsada escalonada gauche eclipsada escalonada gauche anti (la más estable) Ejemplo: Isómeros de conformación escalonada y eclipsada del butano, CH3CH2CH2CH3, mirando a lo largo del enlace C1-C2 y utilizando proyecciones de Newman. 1. Determinar primero cuáles átomos están unidos a C1 y C2. 2. Dibujar la proyección de Newman en ángulos de 120° y colocar el resto de los átomos en C1 (H,H,H) y C2 (H, H, CH2CH3). Por último, girar 60° uno de los átomos de C para obtener la conformación eclipsada. **Ejercicio: Dibuje los isómeros de conformación escalonada y eclipsada del hexano CH3(CH2)4CH3, formados por giros de 60° alrededor del enlace sencillo entre los C2 y C3. Use proyecciones de Newman, identificando al isómero más estable. **Ejercicio: Identifique los alcanos correspondientes a cada una de las siguientes representaciones y escriba la fórmula condensada correspondiente. a) b) c) d) Isomería geométrica y de conformación de cicloalcanos El ciclopropano y el ciclobutano son menos estables que los cicloalcanos de anillo más grande. El origen de esta relativa inestabilidad son los ángulos internos de cada anillo. Cada C de un anillo tiene 4 átomos enlazados, tiene hibridación sp3 y debe ser tetraédrico, con ángulos de enlace de 109.5° Isomería geométrica en compuestos cíclicos Isómeros geométricos: isómeros cis y trans; es un tipo de estereoisomería en la cual los átomos o grupos exhiben diferencias de orientación en torno a un doble enlace o anillo. Isómero trans: isómero geométrico en el cual los grupos están en lados opuestos del anillo o doble enlace. Isómero cis: isómero geométrico en la cual los grupos están en el mismo lado de un anillo o doble enlace. Ejemplo: el 1,2-dibromo ciclopropano presenta dos isómeros, uno cis y otro trans, ya que los átomos de Br pueden estar del mismo lado, o bien en lados opuestos. **Ejercicio: Dibuje los isómeros geométricos del 1,2-dimetil ciclobutano y del 1,3-dimetil ciclobutano. Isomería de conformación en el ciclohexano Conformación de bote: una conformación inestable del ciclohexano con ángulos de enlace de 109.5°, pero en la cual casi todos los enlaces están eclipsados. Conformación de silla: conformación más estable del ciclohexano en la cual todos los enlaces están escalonados y los ángulos de enlace son de 109.5°. Forma de bote Forma de silla Las conformaciones de silla y de bote están libres de tensión angular Factores que afectan la estabilidad de una conformación. Primer factor de desestabilización: en la forma de bote, los C de extremos opuestos (C1 y C4) se acercan uno al otro, lo que causa interacciones estéricas entre los hidrógenos de “asta de bandera” a causa de su proximidad. En la forma de silla, éstos dos mismos C se doblan alejándose uno del otro (uno hacia arriba y otro hacia abajo) y por tanto no están sujetos a repulsión mutua. Segundo factor de desestabilización: Conformación Al observar de frente los enlaces C2-C3 y C5-C6 usando proyecciones de Newman: Bote Silla Forma de bote: los átomos enlazados están en la conformación eclipsada menos estable. Forma de silla: los átomos enlazados se encuentran escalonados, por lo que esta forma es la conformación predominante más estable. Tercer factor de desestabilización: Tensión anular. Una diferencia significativa con respecto al ángulo tetraédrico preferido (<109.5°) causa una disminución en el traslape de orbitales en los enlaces sigma y tensión en los ángulos internos El ángulo interno de un pentágono es muy cercano al ángulo tetraédrico de 109.5°, por lo que el ciclopentano se dobla fuera del plano y es energéticamente muy estable. Conformaciones del ciclopentano Envelope Media silla En los cicloalcanos más grandes, como el ciclohexano y el ciclooctano, los anillos son lo bastante grandes y tienen suficiente flexibilidad a través de la rotación de enlaces para doblarse, torcerse y plegarse fuera del plano hasta que cada C tiene el ángulo tetraédrico estable. Fullereno Molécula compuesta totalmente de átomos de carbono, de forma esférica, elipsoidal o de tubo (nanotubos de carbono). Su estructura es similar a la del grafito, pudiendo contener anillos penta o heptagonales. El primer fullereno (C60) se descrubrió en 1985 por R. Curl, H. Kroto y R. Smalley. Su descubimiento incrementó enormemente el número de formas conocidas de alótropos de carbono, los cuales se limitaban al grafito, diamante y formas amorfas como carbón y hollín. Desde entonces han sido sujeto de intensa investigación debido a sus propiedades químicas únicas y aplicaciones tecnológicas, especialmente en la ciencia de materiales, electrónica y nanotecnología. Nomenclatura aromáticos, benceno, resonancia Compuestos alifáticos y aromáticos Compuestos alifáticos y aromáticos Los compuestos orgánicos se dividen en dos grandes clases: alifáticos (graso) y aromáticos (fragante). Compuestos alifáticos: son de cadena abierta y los cíclicos que se les asemejan. Los hidrocarburos alifáticos alcanos, alquenos, alquinos y sus análogos cíclicos reaccionan principalmente por adición y sustitución por radicales libres: la primera ocurre en los enlaces múltiples; la segunda, en otros puntos de la cadena alifática. Compuestos aromáticos: son el benceno y los compuestos de comportamiento químico similar. Se caracterizan por su tendencia a la sustitución heterolítica. Además, estas mismas reacciones de sustitución son características de anillos aromáticos dondequiera que aparezcan, independientemente de los otros grupos funcionales que la molécula pudiera contener. Estos últimos afectan a la reactividad de los anillos aromáticos, y viceversa. Hidrocarburos aromáticos ESTIMULANTES DEL SISTEMA NERVIOSO CENTRAL: ANFETAMINAS Nombre Genérico Nombre Comercial Sulfato de Anfetamina Benzedrina Dextro-anfetamina Dexedrina Metilfenidato Ritalina Fenproporex Fenisec Clobenzorex Asenlix Metilendioximetanfetamina (MDMA) Extasis Clorhidrato de clobenzorex (Asenlix) Inhibidor del apetito cocaína Estructura del benceno El benceno se conoce desde 1825, y sus propiedades químicas y físicas son mejor conocidas que las de ningún otro compuesto orgánico. A pesar de ello, hasta el año 1931 no se había logrado proponer una estructura satisfactoria para esta sustancia, y tuvieron que pasar de 10 a 15 años para que fuera de uso general entre los químicos orgánicos. La dificultad no residía en la complejidad de la molécula, sino más bien en las limitaciones del desarrollo que había alcanzado por entonces la teoría estructural. Benceno y aromaticidad 1900’s: los químicos se rompieron la cabeza para poder establecer la estructura de un líquido con fórmula molecular C6H6 Este debía de ser insaturado pero sin sufrir recciones de adición. En 1861 A. Kekulé y J. Loschmidt propusieron independientemente una forma cíclica. Los compuestos cíclicos con 4n+2 electrones poseen características únicas y elevada estabilidad. Modelo de Kekulé or Resonance structures for benzene Representation of hybrid Estabilidad del anillo bencénico. Reacciones del benceno Tabla 13.1 CICLOHEXENO CONTRA BENCENO Reactivo Ciclohexeno da KMnO4 Oxidación rápida (acuoso, frío, diluido) Adición rápida Br2/CCI4 (en la oscuridad) Adición rápida HI Hidrogenación rápida H2 + Ni a 25ºC, 1.3 atm Benceno da No hay reacción No hay reacción No hay reacción Hidrogenación lenta a 100-200ºC, 100 atm El benceno resiste la adición, que destruiría su sistema anular. En cambio, se sustituye con facilidad, conservando el sistema anular. La adición convertiría al benceno en un producto menos estable debido a la destrucción del anillo bencénico estabilizado por resonancia. (HNO3) (H2SO4) Descripción orbital del benceno Cada carbono está enlazado a tres átomos, utiliza orbitales sp2 (como en el etileno), que se encuentran en un mismo plano, el del núcleo del carbono, y se dirigen hacia los vértices de un triángulo equilátero. Si se disponen seis carbonos y seis hidrógenos de modo que se permita el solapamiento máximo de estos orbitales, se obtiene la siguiente estructura: H o C C H C 120º H 120º C 120º (a) o H C H La molécula es plana, con todos los C e H ubicados en el mismo plano. Es simétrica, con todos los C en los vértices de un hexágono regular. de enlace HCada ángulo C mide 120º. C C H C Esta planaridadHpermite el solapamiento de los orbitales p en H ambas direcciones, con la deslocalización y estabilización (b) resultante. H Cada átomo de carbono dispone de un cuarto orbital p que tiene dos lóbulos: uno encima y otro debajo del plano del anillo. Ese orbital está ocupado por un solo electrón. El orbital p de un C puede solapar al correspondiente de un C adyacente, lo que permite el apareamiento de los electrones y la formación de un enlace pi adicional. El orbital p de cualquiera de los átomos de C solapa igualmente a los orbitales de ambos C unidos a él. El resultado son dos nubes electrónicas pi continuas con forma de rosca, una encima y otra abajo del plano. H C C H C H C H H H (b) C C H C H H C H Resonancia del benceno Nomenclatura de derivados del benceno Nomenclatura de bencenos monosustituídos. Se usan dos sistemas: 1. Se utiliza benceno como nombre base y se agrega el del sustituyente como prefijo. Ejemplo: Br F Fluorobenceno NO2 Cl Clorobenceno Bromobenceno Nitrobenceno 2. Para otros compuestos, el sustituyente y el anillo forman un nombre nuevo base. Ejemplo: NH2 CH3 Tolueno (metilbenceno) OH Fenol (hidroxibenceno) Anilina (aminobenceno) O COOH Ácido benzoico SO3H O-CH3 C-CH3 Acetofenona Anisol Ácido bencensulfónico Nomenclatura de bencenos disustituídos. 1. Las posiciones relativas se indican por los prefijos orto, meta y para (o-, m-, p-). Ejemplo: Br Br Br Br Br 1,2-dibromobenceno (o-dibromobenceno) 1,3-dibromobenceno (m-dibromobenceno) Br 1,4-dibromobenceno (p-dibromobenceno) • Nunca se usan los términos o-, m- y p- si hay más de dos sustituyentes. • Para 2 o más sustituyentes de usan números. Para los ácidos nitrobenzoicos: COOH COOH COOH NO2 NO2 Ácido 2-nitrobenzoico (ác. o-nitrobenzoico) Ácido 3-nitrobenzoico (ác. m-nitrobenzoico) NO2 Ácido 4-nitrobenzoico (ác. p-nitrobenzoico) Los dimetilbencenos se llaman xilenos. CH3 CH3 CH3 CH3 CH3 1,2-dimetilbenceno (o-xileno) 1,3-dimetilbenceno (m-xileno) CH3 1,4-dimetilbenceno (p-xileno) Si hay más de dos grupos en el anillo, sus posiciones se ubican con números. Ejemplo: Br Cl Cl Br Cl 1,2,3-triclorobenceno Br 1,2,4-tribromobenceno Cuando se asigna un nombre al benceno para identificarlo como sustituyente, se le llama grupo fenilo. Ejemplo: CH3CH(CH2)4CH3 2-fenilheptano CH3C=CHCH3 2-fenil-2-buteno El nombre bencilo se presenta al grupo derivado del tolueno, al eliminar un átomo de hidrógeno del grupo metilo. CH2- Grupo bencilo (fenilmetilo) CH2- Cl Cloruro de bencilo (ó cloruro de fenilmetilo) Fuente de hidrocarburos aromáticos En 1825, Michael Faraday aisló un nuevo hidrocarburo a partir de gas, al que llamó “bicarburo de hidrógeno”. Nueve años más tarde, Eilhardt Mitscherlich de la Universidad de Berlin preparó la misma sustancia mediante calentamiento de ácido benzoico con lima, encontrando un hidrocarburo con la fórmula empírica CnHn. Debido a su relación con el ácido benzoico, a este hidrocarburo se le nombró Benzina, y más tarde Benceno, nombre con el que se le conoce en la actualidad. Exudado de árboles: materiales resinosos (bálsamos), algunos muy fragantes, de elevado valor comercial, en especial cuando los árboles que los producen crecen solo en lugares exóticos. Ejemplo: La goma benzoina, bálsamo obtenido de un árbol que crece en Java y Sumatra. Benzoina es una palabra francesa equivalente a Benjoina, la cual significa “incienso de Java”. El ácido benzoico es inoloro, aunque puede aislarse de la goma benzoina. Los compuestos relacionados con el benceno se obtienen se extractos vegetales similares. Ejemplos: el bálsamo tolu se obtiene del árbol del tule que crece en Sudamérica. La destilación de éste bálsamo permite la obtención del tolueno. Incienso de Java Bálsamo de Tolú OBTENCIÓN DE HIDROCARBUROS AROMATICOS USOS DE HIDROCARBUROS AROMATICOS COMPUESTOS ORGANICOS USADOS A GRAN ESCALA Preguntas generadoras ¿Qué es un hidrocarburo? ¿Dónde podemos encontrar alcanos? ¿Por qué es tan importante el petróleo? ¿Por qué es importante seguir reglas para nombrar los compuestos?