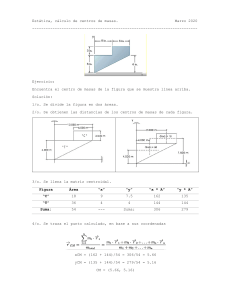
Estequiometria. Nava Rios Alexa Guadalupe La estequiometría es el cálculo para una ecuación química balanceada que determinará las proporciones entre reactivos y productos en una reacción química. Las leyes estequiométricas son aquellas que expresan relaciones de masa de elementos en un compuesto químico o de reactivos y productos en una reacción química. Ley de Lavoisier o de conservación de la masa: En toda reacción química o física se conserva la masa, es decir, la masa total de los reactivos es igual a la masa total de los productos. Ley de Proust o de las proporciones constantes: para generar un compuesto determinado, dos o más elementos químicos se unen entre sí, siempre en la misma proporción ponderal. Ley de Dalton o de las proporciones múltiples: Puede ocurrir que varias masas de un elemento se puedan combinar con una misma masa de otro elemento; Dalton concluyó que las masas variables guardan una relación sencilla, es decir, expresable mediante un cociente de números enteros pequeños. Ley de Richter o de las proporciones equivalentes o reciprocas: Richter concluyó que, si dos elementos se combinan con una cierta masa fija de un tercero, la relación entre sus masas al combinarse con este será idéntica a la relación de sus masas al combinarse entre sí Ley de Gay-Lussac o de los volúmenes de combinación: a diferencia de las anteriores, esta ley relaciona los volúmenes de los gases intervinientes en una reacción química. La ley de los volúmenes de combinación establece que, en una reacción en la que la temperatura y la presión son constantes, los volúmenes de todos los gases que participan en ella guardan entre sí una relación sencilla Bibliografía: 1. 2. Estequiometría [Internet]. Quimica.es. [citado el 7 de septiembre de 2021]. Disponible en: https://www.quimica.es/enciclopedia/Estequiometr%C3%ADa.html Significados. Significado de Estequiometría [Internet]. Significados.com. Significados; 2019 [citado el 7 de septiembre de 2021]. Disponible en: https://www.significados.com/estequiometria/