Cuadernillo de actividades 3° QUIMICA 2T - ALUMNO
Anuncio

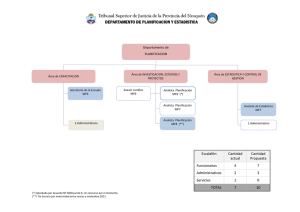
CIENCIAS Y TECNOLOGÍA. QUÍMICA SEGUNDO TRIMESTRE MANUAL DEL ALUMNO MDT 2° TRIMESTRE M.A. ÍNDICE NO. SECUENCIA 7 TEMA LAS SUSTANCIAS Y SUS REPRESENTACIONES SECUENCIA 8 LA REACCIÓN QUÍMICA Y LA CONSERVACIÓN DE LA MATERIA SECUENCIA 9 LA RAPIDEZ DE LAS REACCIONES QUÍMICAS SECUENCIA 10 UTILIDAD DE MODIFICAR LA RAPIDEZ QUÍMICA SECUENCIA 11 LA ENERGÍA Y LAS REACCIONES QUÍMICAS SECUENCIA 12 LA TABLA PERIÓDICA DE LOS ELEMENTOS MDT 2° TRIMESTRE M.A. SEGUNDO TRIMESTRE 7. LAS SUSTANCIAS Y SUS REPRESENTACIONES Eje Tema Aprendizaje esperado MATERIA, ENERGÍA E INTERACCIONES Naturaleza macro, micro y submicro. • Representa y diferencia mediante esquemas, modelos y simbología química, elementos y compuestos, así como átomos y moléculas. Para empezar ACTIVIDAD: En base a tus conocimientos previos, completa el siguiente mapa conceptual. Clasificación de Materia Elemento MDT Compuesto 2° TRIMESTRE Mezcla Molécula M.A. Manos a la obra Fórmulas químicas ACTIVIDAD: Lee y contesta las siguientes preguntas. Utiliza la información de tu libro de texto. • ¿Qué es una formula química? Al conjunto de números y símbolos químicos para representar compuestos se le conoce como fórmula química • ¿Qué reglas debe cumplir una fórmula química ¿ 1. Indica el tipo de átomos que forman al compuesto usando símbolos químicos. 2. Especifica la cantidad de cada átomo en un compuesto. Para ello se usan números como subíndices, colocados junto al símbolo químico. En el caso de que haya sólo un átomo, el símbolo del elemento es suficiente y, por lo tanto, no se coloca subíndice. • ¿Qué es un símbolo químico? Es una abreviación del nombre de un elemento químico. • Escribe el símbolo químico de las sustancias: H2 O2 H4C Co2 Nota: Imprime o adquiere una tabla periódica, te servirá para tus próximas sesiones. Las sustancias y sus interacciones Enlaces químicos ACTIVIDAD: Completa los siguientes enunciados. 1. Un enlace químico es: ___________________________________________________ ________________________________________________________________________ 2. ____________________________________________________son los responsables de dichas interacciones y forman los enlaces químicos. 3. Existen tres tipos de enlaces : __________, __________ y _______________ MDT 2° TRIMESTRE M.A. Sustancias con enlaces covalentes ACTIVIDAD: Completa la tabla con ayuda de tu libro de texto. Tipo de enlace: Se forma, por lo general, entre: ¿Qué pasa con los electrones de valencia? COVALENTE Temperaturas de fusión / ebullición Conductividad térmica / eléctrica Ejemplos El modelo de Lewis ¿Qué son los electrones de valencia? ¿Qué es el modelo de Lewis? ACTIVIDAD: Elabora los modelos de Lewis de los compuestos químicos. H2 MDT O2 H4C 2° TRIMESTRE Co2 M.A. Moléculas polares y no polares ACTIVIDAD: Completa el esquema. Polar Enlace covalente No polar Representación geométrica de las moléculas ¿Qué es la geometría molecular ? Menciona las distintas formas. ACTIVIDAD: Elabora una predicción de la geometría de las siguientes sustancias: SUSTANCIA GEOMETRÍA MOLECULAR a) Metano (CH4) MDT 2° TRIMESTRE M.A. b) Metanol (CH4O) c ) Benceno (C6H6) Compuestos iónicos y redes cristalinas ACTIVIDAD: Completa la tabla con ayuda de tu libro de texto. Tipo de enlace: Se forma, por lo general, entre: ¿Qué pasa con los electrones de valencia? METÁLICO Temperaturas de fusión / ebullición Conductividad térmica / eléctrica Ejemplos Compuestos metálicos ACTIVIDAD: Completa la tabla con ayuda de tu libro de texto. Tipo de enlace: Se forma, por lo general, entre: MDT IÓNICO ¿Qué pasa con los Temperaturas electrones de de fusión / valencia? ebullición 2° TRIMESTRE Conductividad térmica / eléctrica Ejemplos M.A. Las representaciones de las sustancias ACTIVIDAD: Identifica las diversas representaciones para los compuestos químicos. Fórmula química Estructuras de Lewis Representación de esferas Representación de esferas y barras Para terminar ACTIVIDAD: Completa la tabla sobre la estructura química del Agua. Formula química Estructura de Lewis Geometría molecular: Representación de Representación de esferas y esferas barras Autoevaluación MDT 2° TRIMESTRE M.A. 8. LA REACCIÓN QUÍMICA Y LA CONSERVACIÓN DE LA MATERIA Eje Tema Aprendizaje esperado MATERIA, ENERGÍA E INTERACCIONES Energía •Reconoce intercambios de energía entre el sistema y sus alrededores durante procesos físicos y químicos. •Explica, predice y representa intercambios de energía en el transcurso de las reacciones químicas con base en la separación y unión de átomos o iones involucrados. Para empezar ACTIVIDAD: Observa la imagen y contesta las preguntas. ¿Qué es una reacción química? MDT ¿Cómo es la reacción química de la combustión? 2° TRIMESTRE M.A. Manos a la obra Reacciones y ecuaciones químicas ACTIVIDAD: Analiza y completa el esquema, utiliza la información de tu libro de texto o puedes investigar en otras fuentes, Reacción quimica • Una reacción química se produce cuando dos o más sustancias se combinan transformando su composición y obteniendo una nueva sustancia. Ecuación quimica •Es la forma abreviada de escribir qué es lo que sucede en una reacción química. A las sustancias iniciales se les denomina «reactantes» o «reactivos» y a las que se obtiene, «productos o resultantes» Ejemplos de reacciones químicas •La fotosíntesis • La respiración •La digestión • La lluvia ácida • La oxidación de los metales • La combustión (quemar un papel) Evidencias de una Reacción Química •Cambio de color, sabor u olor •Cambio de temperatura •Desprendimiento de un gas •Formación de precipitado al fondo del recipiente Tipos de Reacciones Químicas •Reacción de composición, adición o síntesis . Se combinan dos o más sustancias para formar un solo compuesto. •Reacción de descomposición. Un compuesto por efecto de energía se descompone en dos o más sustancias. •Reacción de combustión. Se refiere a las reacciones que realizan los compuestos orgánicos con el oxígeno. 1.Combustión completa: Se presenta cuando hay suficiente cantidad de oxígeno gaseoso; el color de la llama es azul. 2.Combustión incompleta: Se presenta cuando hay poca cantidad de oxígeno gaseoso; el color de la llama es amarillo. MDT 2° TRIMESTRE M.A. ACTIVIDAD: Identifica las partes de una ecuación química. PARTES DE UNA ECUACIÓN QUÍMICA . Conservación de la materia ACTIVIDAD: Lee y contesta las siguientes preguntas. • ¿Qué es la estequiometría? Es la rama de la química dedicada a determinar tanto la proporción de las sustancias en las reacciones químicas, como sus correspondientes coeficientes estequiométricos. • ¿Qué postula la ley de conservación de la masa de Lavoisier? “En una reacción química la materia no se crea ni se destruye, solo se transforma” • Considerando las Ley de conservación ¿Qué ocurre con los átomos en una química? De dicha ley se puede concluir que, durante las reacciones químicas, los átomos no dejan de existir ni surgen de la nada. Antes y después de la reacción química hay la misma cantidad de átomos de cada elemento, es decir, el número de átomos que hay en los reactivos debe ser el mismo que hay en los productos. MDT 2° TRIMESTRE M.A. Balanceo de ecuaciones químicas Si conoces la fórmula química de las sustancias que participan en una reacción, puedes determinar sus coeficientes estequiométricos; a este procedimiento se le conoce como balanceo de ecuaciones químicas. ACTIVIDAD: Enumera y escribe los pasos para balancear una ecuación química. 1. 2. 3. 4. 5. Realiza el balanceo de la ecuación: Al2O3 + H2O ⎯→ Al(OH)3 MDT 2° TRIMESTRE M.A. Cantidad de sustancia: mol y masa molar ¿Cuál es la ley de los gases en reacciones químicas ? ¿Qué es un mol? ¿ Cuál es el valor de un mol? . MDT 2° TRIMESTRE M.A. Para terminar ACTIVIDAD: Redacta un texto de divulgación científica acerca de la información que proporciona una ecuación química balanceada, por ejemplo, la obtención de metales o la combustión de metano. Texto de divulgación :_______________________________________ MDT 2° TRIMESTRE M.A. 9. LA RAPIDEZ DE LAS REACCIONES QUÍMICAS Eje Tema Aprendizaje esperado DIVERSIDAD, CONTINUIDAD Y CAMBIO Tiempo y cambio •Argumenta sobre los factores que afectan la rapidez de las reacciones químicas (temperatura, concentración de los reactivos) con base en datos experimentales •Explica y predice el efecto de la temperatura y la concentración de los reactivos en la rapidez de las reacciones químicas, a partir del modelo corpuscular de la materia Para empezar ACTIVIDAD: Lee y contesta las preguntas. a) Explica por qué la comida se conserva por más tiempo dentro de un refrigerador que al estar expuesta a condiciones ambientales. Respuesta libre b) A partir de lo que sabes de concentración, ¿qué se descompone más rápido, un caldo concentrado, como el pozole, o uno diluido? Respuesta libre MDT 2° TRIMESTRE M.A. Manos a la obra Rapidez de las reacciones químicas ACTIVIDAD: Identifica las formulas para medir la rapidez de una reacción química. En química es posible medir la rapidez de una reacción como el cambio en la cantidad de sustancia que reacciona por unidad de tiempo. FORMULA DE CONCENTRACIÓN FORMULA DE RAPIDEZ Aplica las formulas resolviendo el problema de tu libro de texto. MDT 2° TRIMESTRE M.A. Efecto de la concentración en la rapidez de las reacciones químicas Rapidez de reacción y temperatura MDT 2° TRIMESTRE M.A. ACTIVIDAD: En base a las imágenes y tu libro de texto completa el esquema. Factores que afectan a la velocidad de reacción Naturaleza de los reactivos Concentración de los reactivos. . . MDT Estado físico de los reactivos Temperatura: Catalizadores: . . 2° TRIMESTRE M.A. Las reacciones químicas y el modelo de partículas Explica la teoría de colisiones Las colisiones y las reacciones en los diferentes estados de agregación ¿Cuáles son las características de las colisiones de acuerdo a los estados de agregación de la materia? Solido MDT Liquido 2° TRIMESTRE Gaseoso M.A. Para terminar ACTIVIDAD: En base a lo analizado en la secuencia, responde lo siguiente. 1. Una vela encendida se consume poco a poco hasta desaparecer. ¿Se ha cumplido la ley de Lavoisier? La ley de Lavoisier se cumple siempre, lo que sucede es que en la combustión de la vela se originan gases que se escapan a la atmósfera; si se pudiera hacer la experiencia en un recipiente cerrado se comprobaría que la masa permanece constante. 2. La cocina de nuestra casa es un verdadero laboratorio donde se producen muchos fenómenos físicos y químicos; entre otros podemos citar: a. Preparar una ensalada. d. Tostar pan. b. Cocer un huevo. e. Calentar leche. c. Hacer un cocido. f. Preparar café. De todos estos procesos, ¿cuáles son físicos y cuáles son químicos? ¿Por qué? Los procesos físicos son los que no llevan asociado un cambio en la naturaleza de la sustancia; son: a), e) y f). Los procesos químicos son los que producen un cambio en la naturaleza de la sustancia; son: b), c) y d). 3. Al añadir limaduras de hierro sobre azufre y moverlo, se observa un conjunto con una distribución no uniforme de su aspecto. Al calentar el conjunto anterior aparece un sólido negro de propiedades distintas al azufre y al hierro. ¿Qué se ha producido en cada caso? En el primer caso se ha producido una mezcla heterogénea y en el segundo una reacción química. 4. Cuando reaccionan 20 g de hidrógeno (H2) se forman 180 g de agua (H2O). ¿Qué cantidad de oxígeno (O2) habrá reaccionado? Como se cumple la ley de conservación de la masa, reaccionarán 160 g de oxígeno. 5. El oxígeno (O2) y el hidrógeno (H2) reaccionan en proporción de 8:1, para formar agua (H2O). a. ¿Qué cantidad de hidrógeno reaccionará con 32 g de oxígeno? a. 4 g de hidrógeno b. Si disponemos de 6 g de hidrógeno y 32 g de oxígeno, ¿qué masa de agua se obtendrá? b. Con 32 g de oxígeno reaccionan 4 g de hidrógeno, luego 2 g de hidrógeno quedan sin reaccionar. La masa que se obtiene de agua es: m (H2 O) = 32 + 4 = 36 g de agua c. ¿Cuántos gramos de oxígeno reaccionarán 8 g de hidrógeno? c. masa de oxígeno = 8 · masa de hidrógeno = 8 · 8 = 64 g de oxígeno d. ¿Qué masa de agua se obtendrá? d. m (H2 O) = 64 + 8 = 72 g de agua MDT 2° TRIMESTRE M.A. 10. UTILIDAD DE MODIFICAR LA RAPIDEZ QUÍMICA Eje Tema Aprendizaje esperado DIVERSIDAD, CONTINUIDAD Y CAMBIO Tiempo y cambio •Identifica la utilidad de modificar la rapidez de las reacciones químicas •Reconoce la utilidad de las reacciones químicas en el mundo actual Para empezar ACTIVIDAD: Lee y contesta las preguntas. ¿Cómo se alteran los procesos al aumentar la rapidez de la reacción química de la combustión? Aumentando la cantidad de oxigeno para que la reacción sea más rápida o viceversa. ¿Se puede obtener algún beneficio de ello? Aumentar la temperatura, la rapidez en que se prepara algo , etc. En las películas, habrás visto que para apagar el fuego arrojan una manta por encima. ¿Es eficaz este método? ¿Por qué crees que se hace? Sí es eficaz, porque se evita la presencia de oxígeno que es uno de los reactivos de la combustión MDT 2° TRIMESTRE M.A. Manos a la obra Conservación de alimentos ACTIVIDAD: Completa el cuadro y agrega imágenes con ejemplos. MÉTODO CARACTERÍSTICAS EJEMPLO Enfriamiento Los alimentos se almacenan a bajas temperaturas. Alimentos congelados Encurtidos Los alimentos se sumergen en una disolución de vinagre, sal y especias que incrementa su acidez y, además, les da sabor. Chiles en escabeche Conservadores Se adicionan sustancias naturales o producidas por el ser humano para frenar el deterioro del alimento. Carne y pescado ahumados, El alimento es esterilizado después de ponerlo dentro de una lata herméticamente sellada. Verduras, atún, frutas, sopas y Se extrae el aire del envase que contiene el alimento y se sella herméticamente Embutidos, carne y pescado Deshidratación Se elimina la mayor parte del agua del alimento para evitar reacciones químicas no deseadas. Carne seca, frutas deshidratadas Escaldado El alimento se somete a altas temperaturas por un periodo corto de tiempo y así también se detiene su proceso de envejecimiento. Cocción rápida de algunas Enlatado Envasado al vacío MDT 2° TRIMESTRE mermeladas y frutas cristalizadas productos lácteos enlatados empacados al vacío verduras M.A. Otra manera de aumentar la rapidez de reacción ACTIVIDAD: Completa el siguiente esquema. Catalizador • Son sustancias que modifican la rapidez de una reacción química sin ser un reactivo o un producto de la misma Catalizador biologico • Existen proteínas que actúan como catalizadores naturales, las cuales se llaman enzimas. Catalizador negativo • Son compuestos químicos que impiden o retardan una reacción química conocidos como linhibidores La industria petroquímica Transformaciones químicas Craqueo Hidrodesulfuración (hds) . MDT 2° TRIMESTRE M.A. Cuidado del medio ambiente ACTIVIDAD: Relaciona los términos con su definición correcta. Lluvia ácida La mayor parte de las radiaciones que llegan a la Tierra procedentes del Sol se reflejan y regresan al espacio, pero una pequeña parte queda retenida y sirve para mantener la temperatura media de la Tierra; de no existir la atmósfera, la temperatura de nuestro planeta sería de unos – 18ºC. Efecto invernadero Disminución de la capa de ozono Se denomina capa de ozono a la zona de la estratosfera donde el ozono es más abundante de lo normal, y agujero de la capa de ozono a la zona donde la concentración de ozono es menor de lo normal. La lluvia ácida se debe principalmente a dos sustancias que, al reaccionar con el agua de lluvia, la vuelven ácida, porque originan ácido sulfúrico y ácido nítrico. • ¿Cómo ayuda el uso de un convertidor catalítico? MDT 2° TRIMESTRE M.A. Cuidado de la salud ACTIVIDAD: Lee y contesta las siguientes preguntas. Revisa tu libro de texto. 1. ¿Cómo actúan los medicamentos en el organismo para aumentar la rapidez de su reacción química? Al actuar sobre un tejido, un medicamento se une a moléculas de la membrana celular, llamadas receptores, y así modifica la rapidez de algunas reacciones químicas dentro de la célula. Esto provoca un efecto determinado en el organismo, como disminuir la temperatura corporal 2. ¿Cuáles son los medicamentos estimulantes? Algunos medicamentos aumentan la rapidez de reacciones en el organismo, por lo que reciben el nombre de estimulantes. 3. ¿Cuáles son los medicamentos estimulantes? Medicamentos que hacen más lentas algunas reacciones, por lo que reciben el nombre de inhibidores 4. ¿Cuáles son las características de los antibióticos ? Interfieren con los catalizadores que permiten el desarrollo de la pared celular de las bacterias, lo que impide su proliferación. 5. ¿Qué es un analgésico? Medicamento que disminuye el dolor. 6. ¿Qué es un antipirético? Medicamento que hace disminuir la fiebre. 7. ¿Qué es un antiinflamatorio Medicamento que reduce la inflamación. MDT 2° TRIMESTRE M.A. Para terminar ACTIVIDAD: Lee es problema y contesta las preguntas. “Algunas familias de tu comunidad van a comprar directamente a agricultores y granjeros de la localidad alimentos frescos, como verduras, frutas, leche, huevos y pollo. ¿Qué técnicas de conservación de alimentos les propondrías para mantenerlos en buen estado antes de su venta y consumo? • ¿Qué factores influyen en la descomposición de los alimentos? Principalmente, las temperaturas altas, la elevada humedad, la presencia de microorganismos y hongos, el contacto con el oxigeno del aire y el tipo de empaque, etc. • ¿Qué relación hay entre las reacciones químicas y la descomposición de los alimentos? La descomposición de los alimentos se produce como consecuencia de una serie de reacciones químicas, incluso cuando hay microorganismos presentes, pues su acción también implica que se efectúa reacciones químicas • 3. ¿Qué impacto tienen los métodos de conservación físicos y químicos en la velocidad de descomposición de los alimentos? Todos los métodos de conservación de alimentos se enfocan finamente a retardar las reacciones químicas que producen la descomposición MDT 2° TRIMESTRE M.A. 11. LA ENERGÍA Y LAS REACCIONES QUÍMICAS Eje Tema Aprendizaje esperado MATERIA, ENERGÍA E INTERACCIONES Energía •Reconoce intercambios de energía entre el sistema y sus alrededores durante procesos físicos y químicos. •Explica, predice y representa intercambios de energía en el transcurso de las reacciones químicas con base en la separación y unión de átomos o iones involucrados. Para empezar ACTIVIDAD: Lee y contesta las preguntas y el esquema. Define con tus propias palabras qué es la energía química: Respuesta libre • Define con tus propias palabras qué es una reacción química: Respuesta libre Reacciones quimicas y la energia • MDT En general los procesos fisicos y quimicos van acompañados de cambios de energia que pueden manifestarde de diferentes formas : 2° TRIMESTRE M.A. Manos a la obra La energía y las reacciones químicas ACTIVIDAD: Analiza y contesta lo que se pide. Utiliza tu libro de texto. Se define como: Exotérmicas Representación: Energicamente las reacciones pueden ser: Se definen como: Endotérmicas Representación: CALORÍMETRO ¿Qué es la calorimetría? MDT 2° TRIMESTRE M.A. Conservación de la energía ACTIVIDAD: Define los siguientes términos. LEY DE LA CONSERVACIÓN DE LA ENERGÍA En los procesos físicos, químicos y biológicos, la energía no se crea ni se destruye, pero puede transformarse, o bien transferirse entre el sistema y sus alrededores ENERGÍA QUÍMICA La energía química de una sustancia equivale a la suma de la energía necesaria para romper cada uno de los enlaces entre sus átomos. En una reacción química se deben romper enlaces en los compuestos de los reactivos para que se formen enlaces nuevos en los productos. ENERGÍA DE ENLACE Es la energía total promedio que se desprendería por la formación de un mol de enlaces químicos, a partir de sus fragmentos constituyentes (todos en estado gaseoso). Suele reportarse en kilojulios por cada mol de enlaces (kJ/mol). MDT 2° TRIMESTRE M.A. ACTIVIDAD: Encuentra la energía quimia en las reacciones químicas y completa la tabla. Considera lo siguiente: REACCIÓN QUÍMICA ENERGÍA QUÍMICA a) H2 + F2 ⎯→ 2 HF b) 2 HI ⎯→ H2 + I2 Tipos de energía asociados a las reacciones químicas ACTIVIDAD: • Menciona los tipos de energía que se pueden liberar en una reacción química Térmica Luminosa Eléctrica Calórica • ¿A qué se refiere el proceso Redox? En el interior de una batería se realizan dos procesos, en n uno de ellos, los átomos pierden electrones, lo cual es un proceso de oxidación, y en el otro los ganan, es decir, pasan por un proceso de reducción; al fenómeno total se le conoce como proceso redox. MDT 2° TRIMESTRE M.A. ACTIVIDAD: Elabora una pila casera (utiliza el procedimiento de tu libro de texto) y contesta. ¿Cómo funciona una batería eléctrica? MDT 2° TRIMESTRE M.A. Absorción de luz en las reacciones químicas ACTIVIDAD: Explica el proceso químico de la fotosíntesis. Algunas reacciones absorben energía en forma de luz. Tal es el caso de la fotosíntesis, proceso a través del cual las plantas verdes y otros organismos, como algunas bacterias, transforman la energía de la luz solar en energía química que se almacena en compuestos llamados carbohidratos. Las plantas utilizan la energía de la luz para producir, a partir de agua y dióxido de carbono, el carbohidrato más importante en la naturaleza, la glucosa (C6H12O6), ya que es la principal fuente de energía para la mayoría de los seres vivos. El proceso para la obtención de la glucosa en las plantas, partiendo del dióxido de carbono y agua, se puede representar de la siguiente forma. 6 CO2 + 6 H2O ⎯→ C6H12O6 + 6 O2 Una consecuencia de la fotosíntesis es que retira el dióxido de carbono del ambiente, un gas de efecto invernadero producto de la respiración y de la combustión, y, además, libera oxígeno al ambiente, prácticamente todo el oxígeno presente en nuestra atmósfera proviene de este proceso biológico MDT 2° TRIMESTRE M.A. Emisión de luz en las reacciones químicas LUMINISCENCIA. Existen reacciones que liberan energía en forma de luz y una cantidad pequeña de calor, fenómeno conocido como luminiscencia. Esta luz se genera de manera muy distinta a la de las bombillas eléctricas o de la combustión. BIOLUMINISCENCIA Algunos seres vivos también son capaces de llevar a cabo reacciones químicas que emiten luz. El ejemplo más conocido es el de la luciérnaga, aunque los científicos calculan que 90% de los seres vivos que habitan a más de 500 m de profundidad en los océanos también realizan este tipo de reacciones Para terminar ACTIVIDAD: En la siguiente hoja, elabora un mapa mental sobre energía química. Evaluación INSTRUMENTO PARA EVALUAR EL MAPA CONCEPTUALE SI CUMPLE CRITERIOS DE EVALUACIÓN NO CUMPLE Representa los conceptos principales a través de un esquema. Utiliza palabras claves y la muestra dentro de óvalos o rectángulos y limpieza total. El mapa conceptual se encuentra presentado de manera original, ordenada de manera jerárquica, lógica y secuencial Clasificación de conceptos presentados de manera lógica. Estos se encuentran relacionados unos con otros a través de las palabras clave o conectores. La presentación fue hecha en tiempo y forma, además se entregó de forma limpia en el formato pre establecido (papel o digital) No presenta errores ortográficos. MDT 2° TRIMESTRE M.A. ENERGÍA QUÍMICA MDT 2° TRIMESTRE M.A. 12. LA TABLA PERIÓDICA DE LOS ELEMENTOS Eje Tema Aprendizaje esperado DIVERSIDAD, CONTINUIDAD Y CAMBIO Continuidad y ciclos • Deduce información acerca de la estructura atómica a partir de datos experimentales sobre propiedades atómicas periódicas. Para empezar ACTIVIDAD: Lee y responde las preguntas: • ¿Por qué está formada la materia? La materia está formada por átomos Los elementos están formados por diminutas partículas llamadas átomos. ... Un grupo de átomos unidos entre sí forman una molécula. Cuando una molécula contiene átomos de más de un elemento, recibe el nombre de compuesto • ¿Cómo se puede clasificar la materia? Ejemplos clasificación de la materia: sustancias, elementos, compuestos y mezclas homogéneas y heterogéneas. Para que algo se considere materia debe poseer masa y volumen Además, se encuentra en tres estados: líquido, sólido y gaseoso. • ¿Cuál es la importancia de la clasificación de la materia? La clasificación de la materia es importante para poder distinguir el elemento, compuesto o mezcla con el que se está trabajando. Por ejemplo, sirve para distinguir que el H2O es agua y no confundir este compuesto con una mezcla de agua y sal (NaCl + H2O) la cual es una mezcla heterogénea. MDT 2° TRIMESTRE M.A. Manos a la obra La historia de la tabla periódica ACTIVIDAD: Identifica la cronología de la tabla periódica. ¿Qué es la tabla periódica? Antoine Lavoisier (1789) Johann Döbereiner (1830) John Newlands, Alexandre-Émile Béguyer de Chancourtois Dmitri Mendeléiev (1869) . Tabla periódica moderna MDT 2° TRIMESTRE M.A. Un catálogo de elementos: la tabla periódica ACTIVIDAD: Colorea la tabla periódica de acuerdo a sus propiedades e identifica su estructura. METALES MDT NO METALES METALOIDES 2° TRIMESTRE GASES NOBLES M.A. ACTIVIDAD: Completa los enunciados. Utiliza tu libro de texto o investiga en otras fuentes, • Los elementos químicos están ordenados _____________________________________ __________________________________________________________________________ • Según sus propiedades físicas y químicos, existen tres tipos de elementos: ________ _______________________________________________ • Los __________________en su mayoría son sólidos a temperatura ambiente, tienen brillo, son maleables y dúctiles, y son buenos conductores de electricidad. • Los _____________ se presentan como sólidos, líquidos o gases a temperatura ambiente, son opacos,. son frágiles y quebradizos y malos conductores de electricidad. • Los _____________ poseen propiedades intermedias; por ejemplo, son sólidos a temperatura ambiente, frágiles y quebradizos, pero pueden conducir la electricidad. • A los elementos del grupo IA se les conoce como _______________. • En la tabla periódica de los elementos existen __________ periodos • En la tabla periódica existen 18 columnas llamadas _______________ • Completa el nombre de las familias y sus principales elementos: Grupo A: elementos representativos 1. IA: ________________ 2. II A : _________________ 3. III A : _________________ 4. IV A : _______________ 5. VA : _______________ 6. VI A : ___________________________ 7. VIII A : _______________ Grupo B: elementos de transición Presenta _______________ B (desde IB hasta el VIII B) • Partes de un elemento químico en la tabla periódica MDT 2° TRIMESTRE M.A. Temperaturas de fusión y de ebullición ACTIVIDAD: Realiza una gráfica de las temperaturas de fusión y ebullición (en el eje vertical) en función del número atómico (en el eje horizontal) de los siguientes elementos químicos elementos químicos MDT C Na Be Mg 2° TRIMESTRE M.A. El número atómico y la masa de los átomos • ¿Cuáles son las partículas que forman un átomo? Los protones, Los neutrones Los electrones • ¿ Que define el número atómico ( Z ), El número de protones • Explica como se calcula la masa atómica de un elemento Respuesta libre Las capas electrónicas de los átomos ACTIVIDAD: Los electrones se mueven alrededor del núcleo dependiendo de ciertos valores de energía. Éstos son característicos para cada elemento y se conocen como niveles de energía o capas electrónicas ACTIVIDAD: Utiliza tu tabla periódica y completa la información de los 10 principales elementos químicos. Elemento Símbolo del elemento: Número atómico: Cantidad de electrones de valencia: Cantidad de electrones internos Masa atómica 1. Oxígeno 2. Carbono 3. Hidrógeno 4. Nitrógeno 5. Calcio 6. Fósforo 7. Azufre 8. Potasio 9. Sodio 10. Cloro MDT 2° TRIMESTRE M.A. Propiedades atómicas de los elementos ACTIVIDAD: Completa las características de las propiedades de atómicas de los elementos Tamaño de los átomos Energía de ionización Carácter metálico Afinidad electrónica Electronegatividad MDT 2° TRIMESTRE M.A. Para terminar Evaluación MDT 2° TRIMESTRE M.A.