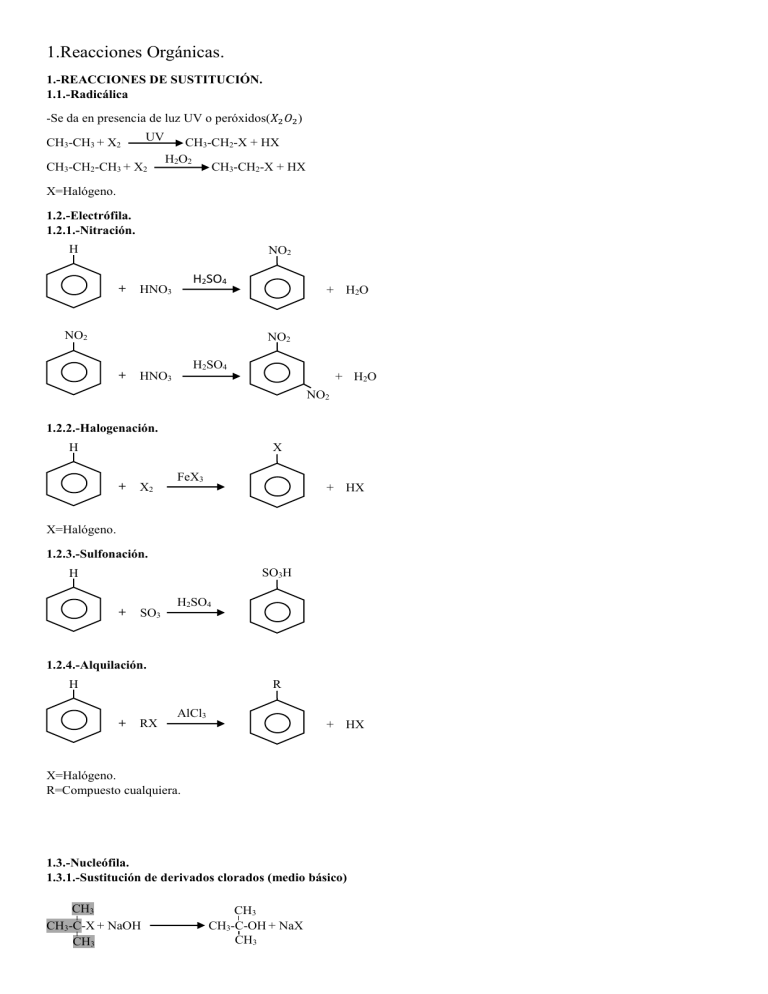
1.Reacciones Orgánicas. 1.-REACCIONES DE SUSTITUCIÓN. 1.1.-Radicálica -Se da en presencia de luz UV o peróxidos(𝑋2 𝑂2 ) UV CH3-CH3 + X2 CH3-CH2-CH3 + X2 CH3-CH2-X + HX H 2O 2 CH3-CH2-X + HX X=Halógeno. 1.2.-Electrófila. 1.2.1.-Nitración. H NO2 + H2SO4 HNO3 NO2 + H2O NO2 H2SO4 + HNO3 + H2O NO2 1.2.2.-Halogenación. H X + X2 FeX3 + HX X=Halógeno. 1.2.3.-Sulfonación. SO3H H + SO3 H2SO4 1.2.4.-Alquilación. H R + RX AlCl3 + HX X=Halógeno. R=Compuesto cualquiera. 1.3.-Nucleófila. 1.3.1.-Sustitución de derivados clorados (medio básico) CH3 CH3-C-X + NaOH CH3 CH3 CH3-C-OH + NaX CH3 Importante: Esta reacción compite con la de eliminación, pero cuando se trata de un carbocatión estable(terciario) se utiliza la sustitución. CH3-CH2-CH2-Cl + 2NH3 CH3-CH2-Cl2-NH2 + NH4Cl 1.3.2.-Sustitución en alcoholes (medio ácido) CH3-CH2-CH2-OH + HCl CH3-CH2-Cl2-Cl + H2O 2.-REACCIONES DE ADICIÓN. 2.1.-Electrofila. 2.1.1.-Hidrógeno con catalizadores como: Ni/Pt/Pd CH3-CH2-CH=CH2 + H2 CH3-CH2-CH2-CH3 2.1.2.-Halógenos. Cl Cl CH3-CH2-CH-CH2 CH3-CH2-CH=CH2 + Cl2 2.1.3.-Agua. Regla de Markovnikov: El H se une donde hay más H. CH3-CH2-CH=CH2 + H2O CH3-CH2-CH2-CH2 (Minoritario) OH CH3-CH2-CH-CH3 (Mayoritario) [se elige este por regla] OH 2.1.4.-Acidos hidrácidos. Regla de Markovnikov CH3-CH2-CH=CH2 + HCl CH3-CH2-CH2-CH2 (Minoritario) Cl CH3-CH2-CH-CH3 (Mayoritario) [se elige este por regla] Cl 2.2.-Nucleofila. CH3-CH2-CO-CH3 + HCN CN CH3-CH2-C-CH 3 n OH 2.3.-Radicalica. -En presencia de luz UV o peróxidos la adición de HX es radicalaria y anti-Markovnikov CH3-CH2-CH=CH2 + HX CH3-CH2-CH2-CH2 (Minoritario)[se elige este por regla] X CH3-CH2-CH-CH3 (Mayoritario) X 3.-REACCIONES DE ELIMINACIÓN. 3.1.-Deshidratación de alcoholes(medio ácido). Regla de Saytzeff: El H se une al carbono con menor número de H. H2SO4 CH3-CH2-CH2OH CH3-CH=CH2 + H2O CH2=CH-CH2-CH3 (minoritario) CH3-CHOH-CH2-CH3 H2SO4 Calor CH3-CH=CH-CH3 (mayoritario) 3.2.-Deshidrogenación de halógenuros (medio básico). Regla de Saytzeff. CH2=CH-CH2-CH3 + KX + H2O (minoritario) CH3-CH-CH2-CH3 X CH3-CH2-CONH2 KOH EtOH CH3-CH=CH-CH3 + KX + H2O (mayoritario) CH3-CH2-C≡N + H2O 3.3.-Deshidrohalogenación de dihalógenos KOH CH3-CH-CH-CH3 CH3-C≡C-CH3 + 2KX + H2O EtOH X X 3.4.-Saponificación (hidrólisis básica de ésteres) R-COOR’ + NaOH R-COONa + R’OH 4.-REACCIONES DE CONDENSACIÓN 4.1.-Esterificación (en medio básico) CH3-COOH + CH3-CH2OH CH3-COO-CH2-CH3 + H2O Ácido + Alcohol Éster + Agua 4.2.-Hidrólisis de ésteres en medio ácido (proceso inverso) CH3-COO-CH2-CH3 + H2O(H+) CH3-COOH + CH3-CH2-OH 4.3.-Amidificación CH3-COOH + CH3-NH2 Ácido + Amina CH3-CONH-CH3 + H2O Amida + Agua CH3-CO-X + CH3-NH2 Haluro de acilo + Amina CH3-CONH-CH3 + HX Amida + Haluro de H 4.4.-Síntesis de éteres CH3OH + CH3OH Alcohol + Alcohol CH3-O-CH3 + H2O Éter + Agua (Esta condensación ocurre a temperaturas inferiores a 150ºC. A temperaturas por encima, se produce la deshidratación, con la formación del alqueno correspondiente) CH3-CH2OH H2SO4 CH2=CH2 + H2O T>150ºC 5.-OXIDACIÓN-REDUCCIÓN 5.1.-Combustión CxHy + O2 CO2 + H2O 5.2.-Reacciones redox (oxidación) menos intensas en alcoholes. 5.2.1.-Primarios CH3-CH2-CH2OH K2Cr2O7/H+ CH3-CH2-CHO K2Cr2O7/H+ CH3-CH2-COOH KMnO4 5.2.2.-Secundarios K2Cr2O7/H+ CH3-CHOH-CH3 CH3-CO-CH3 5.2.3.-Terciarios -En presencia de (K2Cr2O7/H+) no se oxidan CH3 KMnO 4 CH3-C-OH HCOOH + CH3-CO-CH3 (Condiciones más fuertes) CH3 5.3.-Reacciones de oxidación de alquenos KMnO4 (diluido) CH3-CHOH-CHOH-CH3 (Condiciones suaves) CH3CH=CHCH3 KMnO4 concentrado y caliente CH3COOH + CH3COOH (Condiciones más fuertes) 5.4.-Reacciones de reducción R-CHO LiAlH4 R-CO-R´ R-COOH LiAlH4 R-CHOH-R´ LiAlH4 R-COO-R´ R-CO-X R-CH2-OH R-CH2-OH LiAlH4 H2/Pt R-CH2-OH + R´-OH R-CHO + HX






