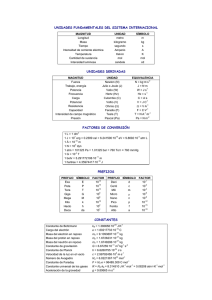
INDICE INTRODUCCION ................................................................................................................................. - 1 - PROBLEMAS DE APLICACIÓN, GASES REALES E IDEALES ............................................... - 2 FISICOQUIMICA FARRINGTON DANIELS .............................................................................. - 2 FISICOQUIMICA GILBERT CASTELLAN ................................................................................................. - 48 GASES REALES ................................................................................................................................- 76 - PROBLEMAS DE APLICACIÓN PRIMERA LEY DE LA TERMODINÁMICA .............................................. - 89 FISICOQUIMICA FARRINGTON DANIELS ............................................................................................. - 89 FISICO QUIMICA GILBERT CASTELLAN .............................................................................................. - 131 - TERMOQUÍMICA ............................................................................................................................ - 157 FISICOQUIMICA GILBERT CASTELLAN ............................................................................................... - 157 FISICOQUIMICA FARRINGTON DANIELS ........................................................................................... - 180 - SEGUNDA LEY DE LA TERMODINÁMICA ........................................................................... - 218 FISICOQUIMICA FARRINGTON DANIELS ........................................................................... - 218 FISICOQUIMICA GILBERT CASTELLAN ............................................................................................... - 252 - ENERGIAS LIBRES ........................................................................................................................... - 282 FISICOQUIMICA FARRINGTON DANIELS ........................................................................................... - 282 TRATADO DE FISICOQUIMICA LUIS ROMO ....................................................................................... - 307 - ESPONTANIEDAD Y EQUILIBRIO ..................................................................................................... - 316 FISICOQUIMICA GILBERT CASTELLAN ............................................................................................... - 316 - ANEXOS ......................................................................................................................................... - 333 - INTEGRANTES ................................................................................................................................ - 335 - INTRODUCCION Con el fin de entender de manera fenomenológica y teórica los procesos de la Fisicoquímica se realizó este compendio de ejercicios resueltos analizando su comportamiento. Desde la antigüedad se ha estudiado los gases ideales y reales, que hoy con ese conocimiento hemos aplicado en el desarrollo de los ejercicios ya que en la mayoría de las aplicaciones de la ingeniería están inversos. La primera ley de la termodinámica tiene una importancia trascendental en el desarrollo de la humanidad, ya que esta expresó que al igual que con la masa, la energía no se crea ni se destruye, solo se transforma. En el campo de la fisicoquímica esto es de vital importancia, debido a que para tener un claro entendimiento de lo que pasa en un proceso, se debe entender que para que algo realice un trabajo sobre el mismo, se debe ganar o perder energía. La termoquímica hemos aplicado conocimientos previos de química lo cual es fundamental en la fisicoquímica para el entendimiento del fenómeno relacionado en las reacciones químicas para saber si es que una reacción química es espontánea o inverosímil. La segunda ley de igual manera trata que una reacción química espontánea hace que la entropía aumente, se procedió a aplicar los conocimientos y se trató la entropía y el comportamiento empírico del funcionamiento de una máquina desde el punto de vista fisicoquímico. Por esta razón fue necesaria otra función termodinámica, las Energías libres, es capaz de realizar trabajo a medida que el sistema tiende al equilibrio. De esta forma se puede explicar mejor los fenómenos que suceden en la naturaleza, en el laboratorio y en la industria. Como en el caso de nuestro estudio, compresiones, expansiones de gases, reacciones químicas, máquinas, que pueden ser ideales o reales, licuefacción de gases, que es un proceso de mucha utilidad en la industria moderna, entre otros procesos, lo cual indica la gran valía de estos postulados y la necesidad del estudiante de aprender estos conceptos. -1- PROBLEMAS DE APLICACIÓN, GASES REALES E IDEALES FISICOQUIMICA FARRINGTON DANIELS 1.1. Calcular el volumen ocupado por 20g de bióxido de carbono a una presión de 740 mm Hg y a 30 0C, tomando en cuenta que se obedece la ley de los gases ideales. Datos: P= 740 mm Hg Solución: Fig: 1.1-1 Al ser gas ideal tenemos: V= 11, 65 L 1.2. En un aparato de Víctor Meyer la evaporación de 0,110 g de un hidrocarburo puro, H-(CH2) n-H, desplaza 27ml de aire medidos en una bureta de mercurio a 26,1 0C y 743 mm Hg ¿Cuál es el peso molecular del hidrocarburo y el valor de n? Datos: -2- Solución: Fig: 1.3.2-1 Volumen será igual al volumen del aire que ha desplazado Calculo del peso molecular del hidrocarburo. Calculo del número de moles, mediante la ecuación de Víctor Meyer Respuesta: M= 102, 27 n = 7 mol -3- 1.3. Calcular el peso molecular promedio del aire saturado con vapor de agua, a 25 0C y a una presión total de 1 atm. La presión de vapor del agua a esta temperatura es de 23,7 mm Hg. Considérese al aire como formado por 80% de nitrógeno y 20% de oxígeno en volumen. Datos: Aire: N2= 80% O2= 20% Solución: Fig: 1.3.3-1 Peso molecular del aire: ∑ Análisis del aire Húmedo: Al ser aire saturado la presión que aporta el agua será el mismo valor de la presión de vapor de agua a 250C, ya que tenemos una humedad del 100% Calculo de la presión del aire -4- Tabla: 1.3.3-1 Componentes de la mezcla Componente Pi, atm Xi Mi, g/mol Xi*Mi Aire 0,969 0,969 28,8 27,9 Agua(v) 0,031 0,031 18 0,558 ∑ 1.4. Calcular el número de toneladas de bióxido de carbono, sobre una superficie de una milla cuadrada, si la presión atmosférica es de 760 mm Hg y el aire contiene 0,046 % en peso de CO2. Datos: P = 760 mm Hg % Aire = 0,046 Solución: Conociendo la altura desde el nivel del mar hasta la tropósfera, lugar en donde se encuentra el aire podemos calcular el volumen ocupado por este. Considerando la temperatura ambiente: -5- 1.5. Se llenan los matraces A y B con oxígeno y nitrógeno, respectivamente, a 25 0C y se conectan por medio de una llave. Tabla: 1.3.5-1 Datos Gas Gas Volumen, Presión, atm ml A O2 500 1 B N2 1500 ½ Calcular (a) la presión total, (b) la presión parcial de cada gas y (c) la fracción molar del oxígeno en la mezcla final. Fig: 1.3.5-1 -6- Solución: Al no existir variación de temperatura, el proceso es isotérmico. Calculo de la presión final del O2 Presión final del N2 Presión total del sistema Fracción molar en la mezcla final -7- 1.6. A 550C y 1 atm el N2O4 se disocia un 50,3% en NO2 de acuerdo con la reacción N2O4 =NO2 ¿Cuál es la densidad del gas? (b) ¿Cuál es el peso molecular promedio del gas? Fig: 1.3.6-1 Solución: El gas se refiere a la mezcla de N2O4 + NO2, luego de la disociación Peso molecular del gas Base de cálculo 100g de la mezcla Tabla: 1.3.6-1 Datos Gas Mi, g/mol masa, g ni=m/M Xi XiMi NO2 46 50,3 1,09 0,67 30,82 N2O4 92 49,7 0,54 0,33 30,36 ∑ Si se asume como un gas ideal se tiene: Respuesta: -8- 1.7. La densidad del amoniaco, fue determinada a distintas presiones pesando el gas contenido en grandes bulbos de vidrio. Los valores obtenidos a 0 0C, en gramos por litro, fueron los siguientes: 0,77159 a 1 atm, 0,51185 a 2/3 de atm, 0,38293 a ½ de atm, 0,25461 a 1/3 de atm. (a) ¿Cuál es el peso molecular del amoniaco? (b) considerando que el peso atómico del hidrógeno es igual a 1,008, ¿Cuál será el peso atómico del nitrógeno? Tabla: 1.3.7-1 Datos δ,( g/L) 0,77169 0,51185 0,38293 0,25461 P, (atm) 1 2/3 1/2 1/3 0,76777 0,76586 0,76383 δ/P, (g/atmL) 0,77169 Diagrama: δ/P=f(P) δ/P, g/atm-L P, atm 1/3 1/2 2/3 1 Fig: 1.3.7-1 (a) ( ) -9- ( ) ( ) (b) 1.8. La temperatura crítica del tetracloruro de carbono es de 283,1 0C. Las densidades en gramo por mililitro, del líquido ρl y del vapor ρv a diferentes temperaturas son las siguientes. Tabla: 1.3.8-1 Datos t (0C) 100 150 200 250 270 280 Ρl (g/ml) 1,4343 1,3215 1,1888 0,9980 0,8666 0,7634 Ρv (g/ml) 0,0103 0,0304 0,0742 0,1754 0,2710 0,3597 ¿Cuál será el volumen molar crítico del CCl4? ρl ρv Fig: 1.3.8-1 Mediante extrapolación del grafico se obtiene la densidad crítica. - 10 - Peso molecular tetracloruro de carbono: Por lo tanto: 1.9. Utilizando la ecuación de Van der Waals, calcular la presión ejercida por una mol de bióxido de carbono a 00C en un volumen de (a) 1 litro, (b) 0,05 litros, (c) Repetir los cálculos a 100 0C, en 0,05 litros. Fig: 1.3.9-1 Datos: Constantes de Van der Waals para el CO2 son: Fuente: Tratado de fisicoquímica, Luis A. Romo - 11 - Solución: (a) V1= 1 litro (b) V2=0,05 litros (c) V3=0,05 litros y T3=373,15 - 12 - 1.10. Calcular el volumen que ocupa una mol de metano a 00C y 50 atm utilizando (a) la ley de los gases ideales y (b) la ecuación de Van der Waals. En los cálculos de la parte (b) la solución cúbica se puede evitar usando el método de aproximaciones sucesivas. La ecuación de Van der Waals se puede escribir del método siguiente. V El valor de V obtenido con le ecuación de los gases ideales, se sustituye en el lado derecho de esta ecuación, calculando un valor aproximado de V. Este valor se sustituye nuevamente en el lado derecho de la ecuación para obtener un valor de V aun más exacto. Este proceso se continúa hasta que el valor calculado de V sea esencialmente el mismo que el utilizado en la sustitución en el lado derecho de la ecuación. Solución: (a) (b) Primera sustitución: V - 13 - Segunda sustitución: 1.11. Calcular el volumen ocupado por un kilogramo de bióxido de carbono a 100 0 C y 50 atm empleando (a) la ecuación de los gases ideales y (b) la gráfica de Hougen-Watson-Ragatz Fig: 1.3.11-1 Solución: (a) (b) Factor de compresibilidad y las respectivas constantes críticas. - 14 - - 15 - 1.12. Calcular el segundo coeficiente virial para el hidrógeno a 00C partiendo del hecho que los volúmenes molares a 50, 100, 200 y 300 atm son 0,4624; 0,2386; 0,1271 y 0,09004 litro mol-1. Respectivamente. Solución: Conociendo que el segundo coeficiente virial es la extrapolación hasta de la gráfica V ((PV/RT)-1) = f ( ), entonces: Datos: Tabla: 1.12-1 Datos [( Diagrama: ) 50 100 200 300 0,4624 0,2386 0,1271 0,09004 0,01516 0,01571 0,01723 0,01861 ] 2,16 4,19 7.86 11,11 =f ( ) Fig: 1.3.12-1 - 16 - Calculo de la pendiente: Ecuación de tendencia: [( ) ] [( ) ] 1.13. Se hizo el vacío en un bulbo de vidrio provisto de una llave y se encuentra que su peso era 46,8542 g sin tomar en cuenta el empuje del aire. Al abrir la llave y llenar el bulbo con aire, el peso aumentó a 47,0465 g. La presión barométrica fue de 745 mm y la temperatura de 27 º. (a) Calcular el volumen total del bulbo sabiendo que el peso molecular promedio del aire es de 28,8. (b) Calcular el peso del bulbo si se llenara con hidrógeno seco a las mismas condiciones de temperatura y presión. Datos: m1 sin aire = 46,8542 g m2 con aire = 47,0465 t= 27 ºC = 300 ºK P = 745 mm Hg= 0.98atm Solución: - 17 - Maire = 28,8 g mol-1 maire = m2-m1 maire = 0,1923g a) b) Calculo de la masa del bulbo total: - 18 - 1.14. ¿Qué masa puede soportar un globo que contenga 1000 litros de helio a 25º y presión de 1 atm? Puede tomarse el peso molecular promedio de aire como 28,8. Datos: V He = 1000 L M He = 4 gmol-1 M aire = 28,8 gmol-1 T= 298 ºK 1000L He P= 1 atm Solución: Fig: 1.3.14-1 1.15. El coeficiente de expansión térmica α se define como Y el de compresibilidad κ se define como ( ) Calcular estas cantidades para el gas ideal. - 19 - Solución: Para α (1) GAS IDEAL PV = nRT (2) (3) (1) y (3) en (1) Para β (1’) GAS IDEAL PV = nRT (2’) (3’) (2’) y (3’) en (1’) - 20 - 1.16. La temperatura puede definirse como una función lineal de alguna propiedad M. Si esta propiedad tiene el valor Mi en el punto de congelación y la propiedad Ms en el punto de evaporación, derívese la ecuación para expresar la temperatura en la escala centígrada. El astrónomo sueco Anders CELSIUS, habiendo verificado la constancia de la temperatura de fusión y ebullición del agua a una presión dada, decide emplear estas temperaturas como puntos fijos de referencia, para la construcción de una escala termométrica fácilmente reproducible. Diagrama V = f(t) Diagrama, Punto triple del agua Fig: 1.3.16-2 Solución: ΔT (ºK) = Δt (ºC) - 21 - (T –T0) ºK = (t- t0) ºC T = t + 273.15 T0 = t0 + 273.15 (t + 273.15 – (t0 + 273.15)) ºK = (t- t0) ºC (t – t0)ºK = (t – t0) ºC 1 ºK = 1 ºC t,°C= T,°K – 273,15 1.17. Suponiendo que el aire se comporta como un gas ideal, calcular la densidad del aire de 25º y 1 atm si la humedad relativa del aire es de 70%. La presión del vapor del agua a 25º es de 23.7 mm. La composición del aire seco, en volumen es de 80% de nitrógeno y 20% de oxígeno. Datos: T= 25 ºC PV° aire = 23.7 mm Hg P = 1 atm HR = 70% Fig: 1.3.17-1 Solución: T= 25 ºC 273.15 ºK T= 298.15 ºK - 22 - Tabla 1.3.17-1 Datos MEZCLA PM , gmol-1 Xi aire seco Xi, mezcla Pi, mm Hg a nivel del mar N2 28 0.80 0.78 594.73 O2 32 0.20 0.20 148.68 H2O 18 ------- 0.02 16.59 TOTAL M= ΣXiMi= 1.00 1.00 760 28,60 HR = PVaire = (PV°aire) PVaire = 25ºC, 1atm PVaire = 16.59 mm Hg PV = nRT PM = ρ mezcla RT ρ mezcla = ρ mezcla = ρ mezcla = 1.69 - 23 - 1.18. (a) ¿Cuántos gramos de aire habrá en la atmósfera que rodea a la tierra suponiendo que es una esfera con un diámetro de 12 millones de metros y la presión atmosférica es de 760 mm sobre cualquier punto? (b) ¿Cuántas moles de aire habrá en la atmósfera suponiendo que el peso molecular promedio del aire es de 28.8? (c) ¿Cuántas moléculas de oxígeno habrá en la atmósfera terrestre si un quinto del volumen total del aire está formado por oxígeno? Datos: D = 12 × 106 m P = 760 mm Hg T ideal = 273 ºK Fig: 1.3.18-1 M aire= 28.84 g/mol Solución: P= P= 1 atm Solución: Vesfera = 3 Vesfera = Vesfera = Vesfera = 9.0477 a) 1023 L PV = nRT PV = g aire = - 24 - 1026 g g aire f(T) = 3.180 b) n aire = n aire f(T)= 1.103×1025 c) V aire = V O2 V aire = (9.0477 V O2 1.809 1023 L) 1023 L de O2 PV = nRT n= n O2 f(T)= 2,204 1024 Moléculas de O2 = n O2 f(T) × N0 Moléculas de O2 = 2,204 1024 × 6.023 × 1023 Moléculas de O2 = 1.328 1048 - 25 - 1.19. Una mezcla compuesta por 0.1 g de hidrógeno y 0.2 g de nitrógeno se va a almacenar a 760 mm de presión y a 26º. (a) ¿Cuál será el volumen del recipiente? (b) ¿Cuál será la fracción molar del hidrógeno en la mezcla? (c) ¿Cuál será la presión parcial del H2? Datos: P = 760 mm Hg T = 26 ºC Solución: T= 26 ºC 273.15 ºK T= 299.15 ºK P= P= 1 atm Fig: 1.3.19-1 Tabla 1.3.19-1 Datos MEZCLA gi Mi , ni = , mol Xi = Pi = Xi × P, atm H2 0.1 2 0.05 0.88 0.88 N2 0.2 28 0.0071 0.12 0.12 TOTAL 0.3 M = ΣXiMi = 0.0571 1.00 1 5.12 a) PV = nRT - 26 - V= V= V= 1.401 L b) PT = XH2 PH2 + XN2 PN2 PH2 = XH2 PT PH2= 0,88 atm 1.20. La relación entre la densidad del cloruro de etilo y la presión en atmósferas, a diferentes presiones, a 0º, es la siguiente: 2.9002 g litro -1 atm-1 a 760 mm, 2.8919 a 475 mm, 2.8863 a 285 mm. Calcular el peso molecular del cloruro de etilo y el peso atómico del cloro usando el método de la fig. 1.3 conociendo los pesos atómicos del carbono y del hidrógeno. Tabla 1.3.20-1 Datos ρ/P , P ,atm 2.9002 1.000 2.8919 0.601 2.8863 0.375 Datos: T = 0 ºC Desarrollo: T = 0 ºC 273.15 ºK T = 273.15 - 27 - Diagrama: ρ/P =f(P) Fig. 1.3.20-1: Densidad limite del cloruro de etilo PV = nRT Si P = 0 atm ⇒ (ρ/P)0 = 2.878 M = 2.878 (0.08205 )(273.15 ºK) M = 64,47 - 28 - 1.21. Las densidades en gramos por centímetro cúbico del éter metílico líquido y gaseoso, a distintas temperaturas, son las siguientes: Tabla 1.3.21-1 Densidad del éter metílico líquido y gaseoso a diferentes temperaturas ºC 30 50 70 100 120 ρl 0,6455 0,6116 0,5735 0,4950 0,4040 ρv 0,0142 0,0241 0,0385 0,0810 0,1465 Calcular la densidad y la temperatura crítica. Solución: Las constantes críticas Tc y Pc, se pueden evaluar partiendo en principio de la isoterma crítica o mediante la aplicación de la Regla de Cailletet y Mathias que se las conoce con el nombre de la ―Ley de los diámetros rectilíneos‖. La bisectriz del área comprendida dentro de la curva ρ – T del líquido y vapor es una recta que indica que densidad media del gas disminuye linealmente con la temperatura, esta línea por extrapolación permite obtener tanto la temperatura crítica, como la densidad crítica. Diagrama: ρ =f(t) Fig: 1.3.21-1 - 29 - 6,30 cm | 120 ºC = 126 ºC | 6 cm 1,75 cm | 0,4 g/cm3 = 0,175 g/cm3 | 4 cm Tc = 126 °C ρc= 0,175g/cm3 1.22. Basándose en las constantes críticas del helio expresadas en la tabla 1.1, calcular las constantes de Van der Waals. Datos: Tabla 1.3.22-1 Constantes críticas del Helio GAS Tc, ºK Helio (He) 5,3 c, L mol-1 0,0578 Pc, atm PcVc / RTc 2,26 0,300 Solución: b= 1 c 3 b = 1 0,0578 3 b = 1,927 .10-2 L mol-1 a = 3 Pc 2 c a = 3 (2,26)( 0,0578)2 a = 0,0227 atm L2 mol-2 - 30 - 1.23. La corrección tomando en cuentas las imperfecciones de los gases, mediante la ecuación de Berthelot Permite calcular pesos moleculares más exactos que los obtenidos con la ecuación de los gases ideales. Calcular el peso atómico del nitrógeno considerando que la densidad del óxido de nítrico, NO, a 0º y 760 mm es de 1,3402 g litro-1. Las constantes críticas del NO son: 177,1 ºK y 64 atm. El peso atómico aceptado del nitrógeno es de 14,007. Datos: T = 273ºK P = 760 mm = 1 atm Tc = 177,1 ºK Pc = 64 atm ρ = 1,3402 g litro-1 Solución: M = 29,9874 g-mol-1 Peso Molecular de NO: - 31 - Tabla 1.3.23-1 Peso atómico de la mezcla No PA , gmol-1 Xi PA calculado, gmol-1 Oxigeno, O2 32 0,53 15,8933 Nitrógeno, N2 28 0,47 14,0941 TOTAL M= 30 1,00 M= 29,9874 Peso atómico del NITRÓGENO = 14,0941 g 1.24. Calcular el número de gramos de hidrógeno contenidos en un recipiente de 500 ml de capacidad cuando se introduce hidrógeno a 200º y 100 atm, utilizando (a) la ecuación general de los gases, (b) la ecuación de Van der Waals, (c) la gráfica de Hougen-Watson –Ragatz. Datos: V = 500 ml M H2 = 2 gmol-1 T = 200 ºC = 473 ºK P = 100 atm Solución: a) Ecuación general de los gases: PV = nRT PV = g RT M g = PVM H2 RT g= g = 2,577 g de Hidrógeno - 32 - b) Van der Waals : P = V–b nRT _ n2a V2 a = 0,2444 atm L2 mol-2 b = 0,02661 L mol-1 g= 2,476 g de hidrogeno c) Hougen-Watson – Ragatz Tabla 1.3.24-1 Datos GAS Pc, Tc, ºK π = P / Pc Θ = T / Tc Z g 33,3 7,813 14,204 1,05 2,100 atm H2 12,8 - 33 - g = 2,100 g de hidrógeno 1.25. Las bombas de difusión de aceite pueden usarse para obtener presiones de 10-6 mm de mercurio, bastante rápidamente. Si el gas presente es nitrógeno y la temperatura 25°, calcular la densidad en gramos por litro. Datos: Solución: N2=28 g/mol T=298 K P= 1.32 x 10-8 atm ρ 1.26. Un matraz de cristal de 200 ml se llena con una mezcla de oxígeno y nitrógeno a 25° y 1 atm. Si la mezcla pesa 0.244 g ¿cuál es el porcentaje de oxígeno en peso? Tabla 1.3.26-1 Datos Gas M(g/mol) n(moles) m(g) Xm=mi/mT %m O2 32 0.00374 0.120 0.492 49.2 N2 28 0.00444 0.124 0.508 50.8 0.00818 0.244 1.000 100.0 Total - 34 - Datos: P= 1atm mT= 0,244 g V=0,2L Fig: 1.3.26-1 Solución: (1) Pero m=M*n (2) Despejando nO2 en 2 Reemplazando nO2 en 1 - 35 - Reemplazando nN2 en 1 m=M*n 1.27. A partir de las leyes de Boyle y de Gay-Lussac, dedúzcase la forma de la ecuación de los gases ideales utilizando la ecuación fundamental de cálculo diferencial ( Ec. A.39; Pág. 754). Diagrama: P=f(V) V=f(T) Fig: 1.3.27-1 - 36 - (1) Ecuación de estado de la Ley de Boyle ( ) Ecuación de estado de la Ley de Gay-Lussac ( ) Entonces en (1): ( ∫ ∫ ) ∫ - 37 - 1.28. Calcular la densidad del aire a 30 ° C, 735 mm de presión, y una humedad relativa de 70%: Puede suponerse que el aire seco contiene 20% de oxígeno y 80% de nitrógeno por volumen. La presión de vapor del agua a 30° es 31.8 mm. Fig: 1.3.28-1 Datos: T=30oC = 303,15oK P=735mmHg = 0,967atm HR=70% Aire seco (O2=20% ; N2=80%) P H2O(v)= 31,8mmHg = 0,0418atm Formulas y Solución: Tabla1.3.28-1 Datos Aire %V Xi M(g/mol) Mi*Xi O2 20 0.20 32 6.4 N2 80 0.80 28 22.4 Total 100 1.00 --------- M=28.8 Seco - 38 - Tabla: 1.3.28-2 Resultados ̅ Composición Pi(mmHg) Xi=Pi/P M(g/mol) Xi*Mi Aire Seco 712.74 0.97 28.8 27.93 Agua (v) 22.26 0.03 18 0.55 ΣPi= 735 1.00 -------- ̅ ∑ ̅ ̅ ̅ ̅ ̅ 1.29. Si la presión atmosférica es de 740 mm, ¿cuántos kilogramos de oxígeno hay sobre un metro cuadrado de tierra? El porcentaje en peso de oxígeno en el aire es de 22.8. Datos: Patm= 740mmHg = 0,974atm m O2 = Kg? A= 1m2 - 39 - Tabla: 1.3.29-1 Datos Aire %m m(g) M(g/mol) n(mol) Xi Pi=Xi*P (atm) O2 22.8 22.8 32 0.7125 0.2054 0,200 N2 77.2 77.2 28 2.7571 0.7946 0,774 100.0 100.0 -------- 3.4696 1.0000 O,974 B.C.=100 g Aire m= 2067, 33 Kg 1.30. Calcular la temperatura crítica y el volumen de hidrógeno partiendo de las siguientes densidades (en gramos por centímetro cúbico) del líquido ρl y del vapor ρv: Datos: Tc=? V H2=? - 40 - Tabla: 1.3.30-1 Datos °C -246 -244 -242 -241 ρl 0,061 0,057 0,051 0,047 ρv 0,0065 0,0095 0,014 0,017 Diagrama: ρ= f(T) Fig: 1.3.30-1 ρ= 0.03214 g/cm3 Tc= -240,4 °K ̃ ̃ ̃ - 41 - 1.31. Calcular la presión ejercida por 1 mol de bióxido de carbono en ½ litro a 25 °, utilizando (a) la ley de los gases ideales y (b) la ecuación de Van der Waals. Datos: P=? n= 1mol CO2 V=0,5L T=25oC = 298,15oK a=3,592 b=0,04267 Desarrollo: a) b) ̃ ̃ - 42 - Esta ecuación de estado propuesta por Van der Waals relaciona la presión, el volumen y la temperatura de un gas real de tal modo que a presiones moderadas concuerda con los datos experimentales. Este logro se debe al hecho de que además de la corrección aplicada para el volumen se reconoce que la existencia de energía de atracción entre las moléculas impone la necesidad de introducir una corrección para presión. 1.32. (a) Utilizando la gráfica de Hougen-Watson-Ragatz, calcular el volumen que debe tener un recipiente para contener 1000 g de n-octano, C8H18 a 354° a una presión de 50 atm. (b) ¿Cómo debería interpretarse esta gráfica si se colocaran 1000 g de octano en este recipiente a una presión de 50 atm a 183°? Datos: m n-octano = 1000g T= 354oC 627,15oK P= 50 atm M= 114 Tc= 570oK Pc= 24,7 atm V=? Formulas y Solución: a) Para demostrar la aplicación de este principio, se parte del corolario que firma que todos los gases el factor de compresibilidad, Zv es una función singular de variables correspondientes. - 43 - Fig.1.3.32: Diagrama de Hougen-Watson-Ragatz Mediante la gráfica de Hougen-Watson-Ragatz, Zc=0,4 b) T=183oC = 456,15oK - 44 - 1.33. Demuestre que la ecuación de Van der Waals se puede escribir en función de la temperatura reducida Tr, de la presión reducida Pr, y del volumen reducido Vr, como: ̃ ( ̃ ) Si a, b y R también se expresan en función de las constantes críticas. Se puede observar que todas las constantes relacionadas con la naturaleza individual del gas, no se han tomado en cuenta. ̃ ̃ Pero si: ̃ ̃ ̃ Entonces: ̃ ̃ ̃ ( ̃ [ ( ̃ ̃ ̃ ̃ ̃ ̃ ̃) ̃ ̃ ̃ ̃ ̃ ̃ ̃) ̃ ̃ ] - 45 - ̃ ̃ SI: ̃ ̃ ̃ ̃ Entonces: ̃ ̃ ̃ ̃ Despejando: ̃ ( ̃ ) 1.34. La ecuación de Van der Waals puede ordenarse en forma de series como la ecuación virial. Demostrar que el segundo coeficiente virial para un gas de Van der Waals lo da: (1) A partir de la ecuación cúbica de Van der Waals ̃ ( ) ̃ ̃ ( ) ̃ ̃ ̃ - 46 - ̃ ̃ ̃ ( [̃ ) ( ) ̃ ( ) ̃ ( ) Pero si: ̃ ̃ ) ̃ ( ̃ ̃ ] ̃ ̃ Entonces ̃ ̃ ̃ ̃ - 47 - PROPIEDADES EMPÍRICAS DE LOS GASES. FISICOQUIMICA GILBERT CASTELLAN 2.1. Cinco gramos de etano se encuentran dentro de un bulbo de un litro de capacidad. El bulbo es tan débil que se romperá si la presión sobrepasa las 10 atmósferas. ¿A qué temperatura alcanzará la presión del gas el valor de rompimiento? Datos: Masa Etano = 5g Si P > 10 atm. El bulbo se romperá Solución: PV = nRT Ec.2.1- 1 Ec.2.1-2 Despejamos n de la Ec.2.1-2, sustituimos en la Ec.2.1-1 y despejamos T 2.2. Un gran cilindro para almacenar gases comprimidos tiene un volumen aproximado de 1.5 pies3. Si el gas se almacena a un presión de 150 atm a 300°K, ¿cuántos moles de gas contiene el cilindro? ¿Cuál sería el peso del oxígeno en un cilindro de esta naturaleza? Datos: V = 1.5 pies3 P = 150 atm T = 300 K Solución: a) ¿Cuántos moles de gas contiene el cilindro? - 48 - b) ¿Cuál sería el peso del oxígeno en un cilindro de esta naturaleza? Despejamos m de la Ec.2.1-2que representa la masa del gas oxígeno. m = nM m = (258.84 moles) × (32 g/mol) m= (258.84 moles) × (32 g/mol) m= 8282.88g 2.3. En el sistema ilustrado en la fig. 2-13 se halla contenido helio a 30.2°C. El bulbo de nivelación L se puede levantar para llenar el bulbo inferior con mercurio y forzar la entrada del gas a la parte superior del dispositivo. El volumen del bulbo 1 hasta la marca b es de 100.5 cm3 y el del bulbo 2 entre las marcas a y b es de 110.0 cm3. La presión del helio se mide por la diferencia entre los niveles del mercurio en el dispositivo y en el brazo evacuado del manómetro. Cuando el nivel del mercurio está en a la presión es 20.14 mm de Hg. ¿Cuál es la masa de helio en el recipiente? Datos: mHe = 4g/mol T = 30.2°C = 303.35°K V1 = 100.5 cm3 V2 = 110.0 cm3 Pa = 20.14mm Hg = 0.0265 atm Figura 2.13: Equipo de Bulbos combinados de Helio y Mercurio Fuente: Fisicoquímica de Castellán, capítulo 2 ―Propiedades Empíricas de los gases‖, pág. 24 - 49 - Solución: VT =Volumen total de He VT =V1+ V2 VT =(100.5 + 110.0) cm3 VT = 210.5 cm3 = 0.2105L Despejamos m de la Ec.2.1-2 y reemplazamos en la Ec.2.1-1 que representa la masa total del sistema. 2.4. Se emplea el mismo tipo de aparato usado en el problema anterior. En este caso no se conoce el volumen V1, el volumen en el bulbo 2, V2, es 110.0 cm3. Cuando el nivel del mercurio está en a la presión es 15.42 mm de Hg. Cuando el nivel del mercurio se eleva a b la presión del gas es 27.35 mm Hg. La temperatura es 30.2°C. a) ¿Cuál es la masa de helio en el sistema? b) ¿Cuál es el volumen del bulbo 1? Datos: V2 = 110.0 cm3 = 0,11 L Pa = 15.42 mm de Hg = 0,020 atm Pb = 27.35 mm de Hg = 0,036 atm T = 30.2 °C = 303,35 K Solución: a) Despejo m de la Ec.2.1-2 y sustituyo en la Ec.2.1-1 b) Volumen del bulbo 1 PaVa = nRT Ec.2.4 - 1 - 50 - Pa (V1 + V2) = PbV1 0,020 (V1 + 0,11 L) 0,020 V1 + 2,23 = 0,036 V1 103 = 0,036 V1 V1 = 0,142 L 2.5. Supongamos que al establecer las escalas de los pesos atómicos las condiciones de referencia escogidas hayan sido Po. = 1 atm, Vo. = 30.000 litros y To = 300.00 K. Calcular la "constante del gas", el "número de Avogadro" y las masas de un "número de Avogadro" de átomos de hidrógeno y de oxígeno. Datos: P0 = 1 atm Vo = 30.000 L To = 300.00 K Solución: Hallamos el valor de R con los valores dados en el ejercicio. R Ec.2.5-1 R P0V0 T0 R 0.100 (1 atm) (30 lt/mol) 300º K lt atm molº K Determinamos el número de moles y lo relacionamos con el valor de la constante Rg de los gases. n R P0V0 0.100 Ec.2.5-2 n 0.082057 Rg T0 Rg n 1.2187 Determinamos el número de moléculas por mol con el número de Avogadro y el número de moles hallados anteriormente. N1= N (avo) * n Ec.2.5-3 N1= (6.023 1023)(1.2187) N1= 7.34 1023 moléculas/mol Determinamos el peso molecular del Hidrógeno 6.023 1023 — M H0 = 1 g/mol - 51 - = (1/V)( V/ T)P 2.6. El coeficiente de expansión térmica está definido por Aplicando la ecuación de estado calcular el valor de para un gas ideal. Partimos de la ecuación general de los gases Ec.2.1-1y despejamos el volumen V V nRT p Ec.2.6-1 Derivamos la Ec.2.6-1 con respecto a la temperatura Pa presión constante. Ec.2.6-2 Ec.2.6-3 Reemplazamos la derivada de la Ec.2.6-2 y remplazamos en la ecuación de compresión isobárica Ec.2.6-3. 1 nR V p Ec.2.6-4 De la ecuación general de los gases despejamos n R y T para relacionar con la Ec.2.6-4 y determinar el valor final de α nR V p T Ec.2.6- 5 1 T 2.7. El coeficiente de compresibilidad Ec.2.6 - 6 está definido por 1 / V V / P T Calcular el valor de para un gas ideal. Partimos de la ecuación general de los gases Ec.2.1-1y despejamos el volumen V V nRT p Ec.2.7-1 Derivamos la Ec.2.7-1 con respecto a la presión P a temperatura constante. Ec.2.7-2 Ec.2.7-3 - 52 - Reemplazamos la derivada de la Ec.2.7-2 y remplazamos en la ecuación de expansión isotérmica Ec.2.7-3. 1 nRT ( 2 ) V p Ec.2.7-4 De la ecuación general de los gases despejamos n R y P para relacionar con la Ec.2.7-4 y determinar el valor final de nRT 1 pV Ec.2.7-5 1 P Ec.2.7 - 6 2.8. Expresar la derivada ( p/ T)Vde un gas en función de y . V=V(P,T)Ec.2.8-1 V V V dP dT P T T P Ec.2.8-2 V=cte. dV=0 V V 0 dP dT P T T P ( ) ( Ec.2.8-3 ) 0 VdP VdT V P T V V P T V 2.9. Un gramo de N2y 1 g de O2se colocan en un frasco de 2 litros a 27°C. Calcular la presión parcial de cada gas, la presión total y la composición de la mezcla en moles por ciento. Datos: mN2 = 1 g mO2 = 1 g V=2L - 53 - T = 27°C = 300,15 K Partimos de la ecuación general de los gases Ec.2.1-1y despejamos el volumen P pi ni xi RT V Ec.2.9-1 pi xi pr Ec.2.9-2 ni nr Ec.2.9-3 De la Ec.2.9-1 hallamos la presión del N2 PN2 lt atm 1 gr 0.082057 mol º K (300,15)º K 2 lt 28 gr/mol PN2 0,4398 atm De la Ec.2.9-1 hallamos la presión del O2 1 (0.082057 )( 27 300 ,15 ) pO2 2 32 p O2 0,3848 atm Determinamos la presión total P T= P N2 + Po2 P T= 0,4398 + 0,3848 P T= 0,8246 atm Determinamos el moles totales nT 1 1 28 32 nT 0,06696 De acuerdo con el valor total realizamos un balance y las fracciones molares con 1 / 32 relación a la presión. xo2 0.06696 0.466 xN2 1 / 28 0.06696 0.533 Por lo tanto se tiene la composición molar del oxígeno y nitrógeno. % no2 100 xo2 46 .6% % n N2 100 xN2 53 .3% - 54 - 2.10. Un gramo de H2 y 1 g de 02 se colocan en una botella de dos litros a 27°C. Calcular la presión parcial de cada gas y la presión total al igual que la composición de la mezcla en moles por ciento. Comparar estos resultados con los del problema 2-9. Datos: mN2 = 1 g mO2 = 1 g V=2L T = 27°C = 300.15 K Realizamos el mismo procedimiento que el ejercicio anterior determinando las presiones parciales, la presión total, número de moles totales y las fracciones molares de la mezcla. p N2 p o2 (0.082054)(300.15) 6.15atm 2 (0.082054)(300.15) 0.3848atm 2 pT p N2 p o2 6.534 atm nr 1 1 0.5313 2 32 xH 2 (1 / 2) 0.941 0.5313 % n H 2 100 xH 2 94 .1% xo2 (1 / 2) 0.0588 0.5313 %no2 100 xo2 5.88 % Comparación: La diferencia con los resultados del problema anterior se debe a que tenemos las mismas masas pero diferentes pesos moleculares, lo que hace que haya muchas más moles de H2 que de O2 ya que es bastante más ligero. Entre N2 y O2 la diferencia no es tan fuerte. 2.11. Se agrega una mezcla de nitrógeno y vapor de agua a un recipiente que contiene un agente secante sólido. Inmediatamente después, la presión en el recipiente es de 760 mm Hg. Luego de algunas horas, la presión alcanza un valor constante de 745 mm Hg. - 55 - a) Calcular la composición de la mezcla original en moles por ciento. b) Si el experimento se realiza a 20 oC y el agente secante aumenta su peso en 0.150 g, ¿Cuál es el volumen del frasco? (Se puede despreciar el volumen ocupado por el agente secante). Datos: Pi = 760 mm Hg. Pf = 745 mm Hg. t = 20 oC. T = 293.15 K. m = 0.150 g. Solución: a) El agente secante absorbe el vapor de agua y por eso es que, al cabo de un tiempo, la presión total disminuye pues la presión del agua desaparece. Así, la presión total inicial es: Pi = PN2 + PH2O Ec.2.11-1 Por lo tanto la presión final es: Pf = PN2Ec.2.11-2 xN2 xH 2O p H 2O pT pi p f p N2 pT pi pf pi 745 0.98 760 760 745 0.02 760 Por lo tanto la composición en moles por ciento es: %n N2 xN2 100 % n N2 0.98 100 98 % %n N2 98 % % n H 2O xH 2O 100 %n H 2O 0.02 100 2% %n H 2O 2% b) El aumento en peso del agente se debe al agua absorbida, por lo tanto, la masa de vapor de agua es 0.150 g y así, el volumen del frasco será: V mH 2O RT 0.150 (0.082054 )( 293 .15 ) 10 .156 L M H 2O p H 2O 18 (15 / 760 ) V 10.156L - 56 - 2.12. Se analiza una mezcla de oxígeno e hidrógeno pasándola sobre óxido de cobre caliente y por un tubo secante. El hidrógeno reduce el CuO según la ecuación: CuO + H2 → Cu + H2OEc.2.12-1 El oxígeno reoxidiza el cobre formando: Cu + ½O2 → CuOEc.2.12-2 100 cm3 de la mezcla, medidos a 25 oC y 750 mm Hg producen 84.5 cm3 de oxígeno seco, medidos a una temperatura de 25 oC y 750 mm Hg después de su paso sobre el CuO y el agente secante. ¿Cuál es la composición original de la mezcla? Datos: VT = 100 cm3. VT = 0.1 L. tT = 25 oC. TT = 298.15 K. PT = 750 mm Hg. PT = 0.9868 atm. VO2(SECO) = 84.5 cm3. VO2(SECO) = 0.0845 L. o tO2(SECO) = 25 C. T = 298.15 K. PO2(SECO) = 750 mm Hg. PO2(SECO) = 0.9868 atm. Solución: Según la Ley de Hess tenemos que: CuO + H2 → Cu + H2O Cu + ½O2 → CuO H2 + ½O2 → H2O Los moles totales nT y nO2 f los podemos evaluar a partir de la ecuación de PT VT 0.9868 0.1 4.034 10 3 moles nT RTT Ec.2.12-3 0.082054 298 .15 estado ya que: nT nO2 f nO2 f PO2 VO2 f f RTO2 f 0.9868 0.0845 3.408 10 3 moles 0.082054 298 .15 El número total de moles en la mezcla está dado por la relación: nT ni Ec.2.12-4 nT nO2 nH2 i - 57 - Donde nO2 es el número de moles de oxígeno antes de la reacción y está dado por la relación: nO2 nO2 nO2 f i reaccionan Ec.2.12-5 nO2 nO2 nO2 i nO2 Donde reaccionan f reaccionan Ec.2.12-6 son las moles de O2 que reaccionan y nO2 f son las moles de O2 que quedan sin reaccionar. Si todo el H2 reaccionó, tendremos, a partir de la reacción química, que: nH2 2nO2 nO2 reaccionan reaccionan Ec.2.12-7 1 nH Ec.2.12-8 2 2 Combinando estas tres ecuaciones encontramos que: nT nO2 nO2 f reaccionan nH2 Ec.2.12-9 1 nT nO2 nH 2 nH 2 f 2 3 nT nO2 nH 2 f 2 nH 2 2 nT nO2 f 3 nH 2 2 4.034 103 3.408 103 4.173 104 moles 3 nO2 nT nH2 i Ec.2.12-10 nO2i 4.034 103 4.173 104 3.617 103 moles La composición en moles por ciento de la mezcla original es: %nH2 %nH 2 nH 2 100 4.173 10 100 10 .34 % 4.034 10 nT 4 3 %n H 2 10 .34 % %nO2 nO2 nT 100 - 58 - %nO2 3.617 10 100 89 .66 % 4.034 10 3 3 %nO2 89 .66 % 2.13. Demostrar que xi = (yi/Mi) / [(y1/M1) + (y2/M2) + …], en donde xi, yi y Mi son la fracción molar, el porcentaje del peso y el peso molecular del componente i respectivamente. El número de moles, la fracción molar y el porcentaje en peso están dados por las relaciones: ni xi mi Mi ni nT yi mi 100 mT Combinando estas relaciones tendremos: nT = n1 + n2 + … nT ni mT yi 100 M i mT y1 m y T 2 ... 100 M i 100 M 2 mT yi mT yi yi n Mi 100M i 100M i xi i mT y1 mT y2 y1 y nT ... mT y1 y2 ... 2 ... M1 M 2 100M1 100M 2 100 M1 M 2 2.14. Una mezcla de gases está compuesta de etano y butano. Se llena un bulbo de 200 cm3 de capacidad con la mezcla a una presión de 750 mm Hg y 20 oC. Si el peso del gas en el bulbo es 0.3846 g, ¿Cuál es el porcentaje molar de butano en la mezcla? Datos: V = 200 cm3. V = 0.2 L. P = 750 mm Hg. P = 0.9868 atm. t = 20 oC. T = 293.15 K. mT = 0.3846 g. - 59 - MC2H6 = 30 g/mol. MC4H10 = 58 g/mol. Solución: La masa total en el tubo es: mT = ∑mi Ec.2.14-1 mT = ∑niMi mT = nETANOMETANO + nBUTANOMBUTANO mT = 30nETANO + 58nBUTANO Ec.2.14-2 El número total de moles en el tubo es: nT = ∑niEc.2.14-3 nT = nETANO + nBUTANO nETANO = nT - nBUTANO Ec.2.14-4 Reemplazamos la ecuación 2.14-4 en la ecuación 2.14-2, así obtenemos: mT = 30(nT - nBUTANO) + 58nBUTANO 0.3846 = 30nT - 30nBUTANO + 58nBUTANO 0.3846 = 30nT + 28nBUTANO n BUTANO 0.3846 30nT 28 Ec.2.14-5 El número total de moles lo podemos calcular a partir de la relación: nT nT PV RT (0.9868 )( 0.2) 8.2 10 3 moles (0.082054 )( 293 .15 ) nT 8.2 10 3 moles Reemplazamos el valor de nT en la ecuación 2.14 - 5, así se obtiene: n BUTANO 0.3846 30 (8.2 10 3 ) 4.95 10 3 moles 28 Reemplazamos el valor de nT y nBUTANO en la ecuación 2.14 - 4, así obtenemos: n ETANO 8.2 10 3 4.95 10 3 3.25 10 3 moles El porcentaje %n ETANO molar del etano y del butano respectivamente son: n ETANO 100 nT - 60 - %n ETANO 3.25 10 100 39.63% 8.2 10 3 3 %n ETANO 39 .63 % %n BUTANO n BUTANO 100 nT 4.9510 100 60.37% 8.2 10 3 %n BUTANO %n BUTANO 60 .37 % 3 2.15. Un bulbo de 138.2 ml contiene 0.6946 g de gas a 756,2 mm Hg y 100 oC. ¿Cuál es el peso molecular del gas? Datos: V = 138.2 ml. V = 0.1382 L. m = 0.6946 g. P = 756.2 mm Hg. P = 0.995 atm. t = 100 oC. T = 373.15 K. Solución: El número total de moles está dado por la relación: n PV RT Ec.2.15-1 Y por la relación: n m M Ec.2.15-2 Igualando estas dos expresiones y despejando el peso molecular obtenemos: M M mRT PV 0.6946 0.082054 373 .15 154 .66 g / mol 0.995 0.1382 M 154.66g / mol - 61 - 2.16. Suponiendo que el aire tiene un peso molecular promedio de 28.8 y que la atmósfera es isotérmica a 25 o C, calcular la presión barométrica en Guadalajara (México), ciudad que se encuentra a 1567 m sobre el nivel del mar; calcular la presión barométrica en Cerro de Pasco (Perú), 4259 m sobre el nivel del mar. La presión a nivel del mar es de 760 mm Hg. Datos: MAIRE = 28.8 g/mol. t = 25 oC. T = 298.15 K. zGuadalajara = 1567 m. zCerro de Pasco = 4259 m. Po(NIVEL DEL MAR) = 760 mm Hg. Solución: Haciendo uso de la ley de distribución barométrica, tendremos: p p o e Mgz / RT (po Presión a Nivel del Suelo) Así: pGuadalajara 760e ( 28.8)(980)(156710 ) /(8.314410 298.15) 635.81mmHg 2 7 pGuadalajara 635 .81mmHg pCerrodePasco 760e ( 28.8)(980)(425910 ) /(8.314410 298.15) 467.97mmHg 2 7 pCerrodePasco 467 .97 mmHg - 62 - 2.17. La composición aproximada de la atmósfera a nivel del mar está dada por la siguiente tabla. Tabla 2.17-1 Composición aproximada de la Atmósfera a Nivel del Mar GAS PORCENTAJE EN MOLES Nitrógeno 78.09 Oxígeno 20.93 Argón 0.93 Dióxido de Carbono 0.03 Neón 0.0018 Helio 0.0005 Criptón 0.0001 Hidrógeno 5 × 10-5 Xenón 8 × 10-6 Ozono 5 × 10-5 Fuente: Fisicoquímica de Castellán, capítulo 2 ―Propiedades Empíricas de los Gases‖, pág. 25 Despreciando los cuatro últimos componentes, calcular las presiones parciales del resto, la presión total y la composición de la atmósfera en moles por ciento a alturas de 50 y 100 Km (t = 25 oC). Datos: z = 50 Km. z = 100 Km. t = 25oC. T = 298.15 K. Solución: La presión parcial de cada componente la podemos calcular a partir de la siguiente ecuación: p i p io e Mgz / RT Ec.2.17-1 p i xio p o Ec.2.17-2 Donde: La composición en por ciento la podemos determinar por la relación: xi z p i z pT z - 63 - %ni 100 xi z Así: 50 Km Tabla 2.17-2 Valores y Cálculos a 50Km Mi xio pio N2 28 0.7809 0.7809 3.1 × 10-3 89.08 O2 32 0.2093 0.2093 3.74 × 10-4 10.75 Ar 40 0.0093 0.0093 3.42 × 10-6 0.10 CO2 44 0.0003 0.0003 5.0 × 10-8 0.0014 Ne 20 0.000018 0.000018 3.45 × 10-7 0.0099 0.000005 -6 He 4 0.000005 pi xi 2.27 × 10 0.652 pT = 3.1 × 10-3 100 Km Tabla 2.17-3 Valores y Cálculos a 100Km Mi xio pio pi N2 28 0.7809 0.7809 1.22 × 10-5 87.71 O2 32 0.2093 0.2093 6.71 × 10-7 4.82 Ar 40 0.0093 0.0093 1.26 × 10-9 0.0091 CO2 44 0.0003 0.0003 8.38 × 10-12 0.0001 Ne 20 0.000018 0.000018 6.63 × 10-9 0.0477 He 4 0.000005 0.000005 1.03 × 10-6 7.4047 pT = 1.391 xi 10-5 2.18. ¿Cuál debe ser el peso molecular de un gas para que la presión del gas disminuya la mitad de su valor en una distancia vertical de un metro? (t = 25 o C). ¿Qué tipos de moléculas tienen pesos moleculares de esta magnitud? Datos: z = 1 m. t = 25 oC. T = 298.15 K. - 64 - Solución: A partir de la ley de distribución barométrica tenemos que: ln p Mgz / RT po Ec.2.18-1 Por lo tanto: M RT po ln gz p Ec.2.18-2 Que la presión del gas disminuye a la mitad, significa que: p po 2 ó po 2 p De esta manera se llega a tener que: M M RT ln 2 gz 8.3144 10 298 .15 ln 2 175333 .59 g / mol 980 100 7 M 175333.59g / mol El peso molecular tan alto corresponde a las moléculas conocidas por el nombre de polímeros. 2.19. Considerar un ―gas ideal de papas‖ que tiene las siguientes propiedades: obedece la ley del gas ideal, las partículas individuales pesan 100 g pero no ocupan volumen; es decir, son masas puntuales. a) A 25 oC, calcular la altura a la cual el número de papas por centímetro cúbico disminuye a una millonésima parte de su valor a nivel del suelo. b) Sabiendo que las papas reales ocupan volumen, ¿hay alguna correlación entre el resultado del cálculo en (a) y la distribución espacial observable de las papas en una bolsa de papel? Datos: m = 100 g. t = 25 oC. T = 298.15 K. Solución: a) La ley de distribución barométrica establece que: - 65 - Nz e Mgz / RT No Si despejamos z de esta ecuación, obtenemos: z RT N o ln Mg N z Ec.2.19-1 Ec.2.19-2 Ya que: Nz 10 6 No Ec.2.19-3 Y el peso molecular de una papa es igual a su masa por el número de 8.314410 298.15 ln 10 1006.02310 980 Avogadro: z 7 23 6 5.8 10 18 cm z 5.8 10 18 cm b) Si existe correlación ya que la altura obtenida en a) [z = 5.8 × 10-18 cm] es despreciable, lo que implica que todas las papas están en el suelo y esto es lo que observamos. 2.20. Un globo de 10000 m3 de capacidad se llena con helio a 20 oC y a 1 atm de presión. Si el globo se carga con un 80 % de la carga que puede levantar a nivel del suelo, ¿a qué altura alcanzará el estado de reposo?. Supóngase que el volumen del globo es constante, la atmósfera isotérmica, 20 oC, el peso molecular del aire 28.8 y la presión a nivel del suelo 1 atm. La masa del globo es 1.3 × 106 g. Datos: V = 10000 m3. V = 10 × 106 L. t = 20 oC. T = 273.15 K. P = 1 atm. MCARGA = 80 %. t = 20 oC. T = 273.15 K. MAIRE = 28.8 g/mol. PNIVEL DEL SUELO = 1 atm. m = 1.3 × 106 g. Solución: - 66 - El globo asciende debido a que es más ligero que el aire. Sin embargo, en el momento en que el peso de la masa de aire que desaloja es igual al peso total del globo, éste permanecerá estático. Es decir, la condición de equilibrio está dada por la siguiente relación: M aire M H e M globo M c arga Ec.2.20-1 MAIRE es el peso de la masa de aire desalojado y variará con la altura de acuerdo a la ley de distribución barométrica. M aire maire g Vg oVo ge Mgz/ RT g Ya que la densidad es: maire poVo Mgz/ RT e RTo m Mp V RT Ec.2.20-2 En forma similar el peso del helio MAIRE está dado por la relación: M He Vg g M He poVo RTo e M H e gz / RT Ec.2.20-3 El peso del globo no varía con la altura. M globo mglobo g Ec.2.20-4 Para establecer el peso de la carga (MCARGA) sabemos que a nivel del suelo la carga máxima sería aquella que sumada al peso del globo y del helio igualará el peso del volumen de aire desalojado, es decir: McMax arga g M He poVo M aire poVo mglobo g g RTo RTo Como sólo se carga 80 % de este valor tenemos que: Mc arga 0.8McMax arga Por lo tanto, el globo alcanzará el estado de reposo cuando: g M He poVo M He poVo MH e gz / RT M pV M aire poVo Mairegz / RT g mglobo g 0.8 g aire o o mglobo g g e e RTo RTo RTo RTo Reordenando esta ecuación se obtiene que: M aire e M aire gz / RT M H e e M H e gz / RT RTo 0.2 M aire M H e 0.8 poVo - 67 - Como no podemos despejar z de esta ecuación, le damos diferentes valores hasta que el resultado del lado izquierdo de la ecuación sea igual al del lado derecho 28.8e 28.89801.41 /(8.314410 293.15) 4.0026e 4.00269801.41 /(8.314410 293.15) 7 7 (8.3144 10 7 293.15) 0.2 28.8 4.00260.8 1 10 106 Se encuentra que para z = 1.41 Km se cumple la igualdad. z = 1.41 Km 2.21. Expresar las presiones parciales en una mezcla de gases (a) en función de las concentraciones molares Ci (b) en función de las razones molares ri. Solución: a) Las concentraciones molares se definen como: Pi X i P ni P nT De la ecuación de estado se tiene: P RT nT V Ec. 2.21 - 1 Ec. 2.21-2 Reemplazo de la Ec. 2.21-2 en la Ec. 2.21-1 Pi ni RT V Ec. 2.21-3 La concentración se define como: Ci ni V Reemplazo de la Ec. 2.21-4 en la Ec. 2.21-3 Ec.2.21 - 4 Pi C i RT b) Las razones molares se definen como: ri ni n1 Se tiene 1 ri Ec. 2.21 - 5 n n1 n T ri 1 ri ni i nT n1 Ec. 2.21 - 6 - 68 - 1 r ri i ni Xi nT Pri 1 ri Pi Xi P 2.22. Si a una altura h dada, la presión de un gas es Ph y la presión a z=0 es Po, demostrar que a cualquier altura, z, P=Po f h/Z donde f=Pz / Po Datos: z=0 f Pz P0 Demostrar: P Po f h z Solución: De acuerdo con la ley de distribución barométrica, Ph P0 e Mgh RT P0 (e Mg RT )h Ec. 2.22-1 o bien a una altura Z dada Pz P0 (e Mg RT )Z De esta ecuación tenemos que e Mg RT P z P0 1 Z Reemplazo la Ec. 2.22-3 en la Ec. 2.22-2 P Pz P0 z P0 Ec. 2.22-2 h Ec. 2.22-3 Z - 69 - 2.23. Al morir Julio César, su última exhalación tenía un volumen de 500 cm3aproximadamente. Esta cantidad tenía 1 mol % de argón. Supóngase que la temperatura era de 300oK y que la presión a nivel del suelo era 1 atm. Supóngase que la temperatura y la presión son uniformes sobre la superficie y aún tienen esos valores. Si las moléculas exhaladas por César han permanecido todas en la atmosfera terráquea y se han esparcido completamente a través de ella, cuántas inhalaciones de 500 cm3 cada una debemos realizar en promedio para inhalar una de las moléculas de argón de César? Datos: V = 500 cm3 T = 300K P = 1atm nJ C = 0.01 Solución: Vatm= área de la superficie terrestre x altura = 4r 2 z n J C n J0C e Mgz RT 4r 2 dz Ec. 2.23-1 Ec. 2.23-2 0 n J C n J0C RT 4r 2 Mg Ec. 2.23-3 Despejando nJ0C tenemos n J0C Mgn J C RT 4r 2 n J C 0.01 n J C 0.01 PV RT Ec. 2.23-4 Ec. 2.23-5 (1)( 0.5) 2.031 *10 4 (0.082 )(300 ) N J0C n J0C N 0 Sustituyo la Ec.2.23-6 en la Ec.2.23-5 Ec. 2.23-6 - 70 - N J0C N 0 JC N J0C Mgn J C RT 4r 2 N0 Ec.2.23-7 (39.948)(980)(6.023 * 10 23 ) 4 (6.37 * 108 )(8.314 * 10 7 )(300) moléculas cm3 moleculas * 500 0.0188 3 inhalación inhalación cm Número de inhalaciones necesarias para aspirar una molécula de Julio Cesar, es decir 1 inhalaciones 53.31 moleculas molécula 0.0188 inhalación 2.24. a) Demostrar que si calculamos el número total de moléculas de un gas en la atmosfera aplicandola formula barométrica obtendríamos el mismo resultado que al suponer que el gas tiene una presión a nivel del suelo hasta una altura z=RT/Mg y que la presión es cero por encima de este nivel. b) Demostrar que la masa total de la atmosfera terrestre está dada por Ap 0/g, donde po es la presión total a nivel del suelo y A es el área de la superficie terrestre. Nótese que este resultado no depende de la composición de la atmósfera. (Resolver este problema calculando primero la masa de cada constituyente, fracción molar Xi, peso molecular Mi, y sumar. Luego, examinando el resultado, resolverlo de la manera más fácil.) c) Si el radio promedio de la tierra es 6.37 108cm, g=980 cm/seg2, y Po = 1atm, calcular la masa de la atmosfera en gramos. Datos: a) Z = RT/Mg b) MT = AP0/g c) r = 6.37*108cm g = 980 cm/seg2 Po = 1atm Solución: - 71 - a) dn n01 Adz n n01 Adz n01 Az n01 A Z 0 dn n01 Ae MgZ RT Ec.2.24-1 RT Mg dz El número total de moléculas en la atmósfera será n n A e 1 0 Ec.2.24-2 MgZ RT Ec.2.24-3 dz 0 Ec.2.24-4 n n 01 A RT Mg b) De acuerdo con la ley de distribución barométrica, la masa del componente i de la atmosfera en una fracción diferencial será dmi oi e mi oi e Mgz RT Adz Ec.2.24-5 Mgz RT Adz oi A 0 RT Mi g De la ecuación de estado sabemos que oi M i Poi RT Ec.2.24-7 Poi A g Ec.2.24-8 Reemplazo la Ec.2.24-7 en la Ec.2.24-6 mi Ec.2.24-6 mT mi Poi A A A Poi Po g g g Ec.2.24-9 c) La superficie de la tierra es 4πr2, por lo tanto, mT dinas 4 (6.37 *108 ) 2 cm2 cm2 5.27 *10 21 g 980cm / seg 2 (1.01325 *10 6 ) - 72 - 2.25. Puesto que los gases atmosféricos se distribuyen diferentemente según sus pesos moleculares, el porcentaje promedio de cada gas es diferente del porcentaje a nivel del suelo; los valores, Xi, de las fracciones molares a nivel del suelo se suministran a continuación. a) Deducir una relación entre la fracción molar promedio del gas en la atmosfera y las fracciones molares a nivel del suelo b) Si las fracciones molares de N2, O2 y Ar a nivel del suelo son 0.78 ; 0.21 y 0.01 respectivamente, calcular las fracciones molares promedio de N2, O2 y A en la atmosfera. c) Demostrar que la fracción de peso promedio de cualquier gas en la atmosfera es igual a su fracción molar a nivel del suelo. Datos: b) XN2 = 0.78 XO2 = 0.21 XAr = 0.01 Solución: a) Xi ni nT dni n e 0 i ni ni0 Ec.2.25-1 MgZ RT Adz Ec.2.25-2 RTA Mi g Ec.2.25-3 ni0 RTA ART ni n n M Mi g g i 0 i 0 i Ec.2.25-4 Reemplazo la Ec2.25-3 y Ec.2.25.4 en la Ec.2.25.1 ni ART Mi g Xi n ART Mi g i Ec.2.25-5 - 73 - Xi Xi X i0 nT0 Mi X i0 nT0 Mi X i0 Mi X i0 M i ni0 nT0 c) Aplicando la Ec.2.25-7 Xi0 0.78 0.21 0.01 M 28 32 40 0.03468 i XN 2 XO 2 X Ar 0.78 28 0.804 0.03468 0.21 32 0.189 0.03468 0.01 40 0.007 0.03468 c) La fracción de peso promedio fi WiT Masa total de i en la atmosfera/ masa total en la atmosfera WT De los resultados obtenidos en el inciso a), tenemos que, WiT niT Mi ART 0 ART 0 ni M ni gMi g WT WiT ART 0 ART ni g g Por lo tanto: n Ec.2.25-8 0 i ART 0 nT g Ec.2.25-9 ART 0 ni g fi X i0 ART 0 nT g Ec.2.25–10 - 74 - 2.26. Considérese una columna de gas en un campo gravitatorio. Calcular la altura Z determinada por la condición de que la masa de la columna está situada debajo de Z. Solución: Consideremos un área transversal de 1cm2. La masa total en la sección diferencial dz será dm m0 e MgZ RT dz Integrando hasta una altura Z, tenemos m(Z)= -m0 RT MgZ / RT Z e Mg 0 RT 1 e MgZ / RT m(Z) = -m0 Mg 0 La masa total la obtendremos integrando hasta infinito, Ec.2.26-1 Ec. 2.26 - 2 Ec. 2.26 - 3 RT mT= m(Z=∞) = m0 Mg m(Z ) 1 e MgZ / RT mT Ec. 2.26 - 4 Ec. 2.26 - 5 M(Z) = mT/2 Ec. 2.26 - 6 1 1 e MgZ / RT 2 Z= Ec. 2.26 - 7 RT ln 2 Mg - 75 - GASES REALES 3.1. Para la disociación N2O4 = 2NO2, la constante de equilibrio a 25 ºC e K = 0.115, está relacionada con el grado de disociación α y la presión en atmósferas según la ecuación K = 4α2p=/(1-α2). Si n es el número de moléculas de N2O4 que estarían presentes si no se produjo disociación, calcular V/n.a.p = 2 atm y 0.5 atm, suponiendo que la mezcla en equilibrio se comporta idealmente. Comparar los resultados con los volúmenes en caso de que no se produjese disociación. Datos: T = 25 ºC = 298 k K = 0.115 K = 4α2p=/(1-α2) P1 = 2atm P2 = 0.5atm Solución: Ec.3.1-1 Ec.3.1-2 Para P1 = 2atm Ec.3.1-3 Ec.3.1-4 Para P2 = 0.5atm - 76 - 3.2. Para la mezcla descrita en el problema 3-1 demostrar que en la medida que p se aproxima a cero el factor de compresibilidad Z = pV/nRT se aproxima a 2 en lugar de a su valor normal, la unidad. ¿Por qué acontece este fenómeno? Solución: Ec.3.2-1 Ec.3.2-2 Ec.3.2-3 P 0K(1-α ) 0 1 –α α 1 2 Ec.3.2-4 2 Z 2 p 0 Ec.3.2-5 Ec.3.2-6 El hecho de que tengamos el doble de moléculas que al principio hace que Z2 en lugar de hacerlo a su valor normal que es la unidad. - 77 - 3.3. Cierto gas a 0 ºC y a 1 atm de presión tiene un valor de Z =1.00054. Calcular el valor de b para este gas. Datos: T = 0 ºC = 273.15 K Z =1.00054 Solución: Ec.3.3-1 3.4. Si Z =1.00054 a 0 ºC y 1 atm y la temperatura de Boyle del gas es 107 K, calcular los valores de a y b (solo se necesitan los dos primeros términos de la expresión de Z). Datos: Z =1.00054 T = 0 C = 273.15 K P = 1 atm TBoyle = 107 K Solución: Ec.3.4-1 Ec.3.4-2 ( a = 8.774b ( ) ) - 78 - 3.5. Las constantes críticas para el agua son 374 ºC, 218 atm y 0.0566 litros/mol. Calcular los valores de a, b y R; comparar el valor de R con el valor correcto y observar la discrepancia. Valorar solo las constantes a y b a partir de p, y Tc Empleando estos valores y el valor correcto de R calcular el volumen crítico. Comparando con el valor correcto. Datos: T = 374 C P = 218 atm 0.0566 litros/mol Solución: ̅ 3.6. Determinar la relación de las constantes a y b de la ecuación de Berthelot con las constantes críticas. Solución: Ec.3.6-1 ̅̅̅ ̅ ̅ Ec.3.6-2 - 79 - ̅ =b+ Ec.3.6-3 ̅ Ec.3.6-4 ̅̅̅̅̅ Ec.3.6-5 ̅ ̅ Ec.3.6-6 ̅ Ec.3.6-7 ̅ ̅ 3.7. Determinar la relación de las constantes a y b de la ecuación de Dieterici con las constantes críticas (Nótese que esto no se puede resolver igualando unas con otras las tres raíces de la ecuación). Solución: ̅ ( ̅ ) ̅ ̅̅̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ Ec.3.7-1 ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ - 80 - ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ 3.8. La temperatura crítica del etano es 32.3°C, la presión crítica es 48.2 atm. Calcular el volumen crítico empleando: a) La ley del gas ideal, b) La ecuación de Van der Waals, comprobando que para el gas de Van der Waals. ̅ c) La ecuación modificada de Berthelot. d) Comparar los resultados con el valor experimental 0.139 litros/mol. Datos: T = 32.3°C = 305.3 K P = 48.2 atm Solución: a) Ley del gas ideal ̅ b) Ecuación de Van der Waals ̅ Ec. 3.8 - 1 ̅ Ec. 3.8 - 2 ̅ c) Ecuación modificada de Berthelot Ec. 3.8 - 3 - 81 - Ec. 3.8 –4 ̅ d) Comparar los resultados con el valor experimental 0.139 litros/mol 3.9. La presión de vapor de agua en estado líquido a 25°C es 23.8 mmHg y a 100°C es de 760 mmHg. Aplicando la ecuación de Van der Waals como guía, en una forma u otra, demostrar que el vapor de agua saturado se asemeja más al comportamiento de un gas ideal a 25°C que a 100°C. Datos: T1 = 25°C = P1 = 23.8 mmHg T2 = 100°C = 373.15 K P2 = 760 mmHg = 1 atm Solución: ̅ ̅ Ec.3.9-1 ̅ ̅ ̅ - 82 - ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ ̅ Ec.3.9-2 ̅ ̅ ̅ ̅ ̃ 3.10. El factor de compresibilidad para el metano está dado por Z= 1 + Bp + Cp2 +Dp3.Si pestá dada en atm los valores de las constantes son los siguientes: Datos: Tabla 3.10-1 Valores de las Constantes T(K) B C D 200 1000 Fuente: Fisicoquímica de Castellán, capítulo 2 ―Propiedades Empíricas de los Gases‖, pág. 47. Representar gráficamente los valores de Z en función de p a estas dos tem- peraturas en un intervalo de 0 a 1000 atm. y(30.44) = —8.18 x 10-5 = 0 Solución: — Ec. 3.10 - 1 - 83 - Para: 1000 K Figura 3.10-1 Representación Gráfica de los Valores de Z en función de p a estas dos temperaturas en un intervalo de 0 a 1000 atm - 84 - 3.11. Si el factor de compresibilidad de un gas es Z(P,T), la ecuación de estado puede expresarse p̅/RT = Z. Demostrar cómo afecta esto a la ecuación para la distribución del gas en un campo gravitatorio. A partir de la ecuación diferencial para la distribución demostrar que si Z es mayor que la unidad la distribución es más amplia para un gas real que para uno ideal y que lo contrario es verdadero si Z es menor que la unidad. Si Z = 1 + Bp, donde B es una función de la temperatura, integrar la ecuación para obtener la forma explícita de la función de distribución. Solución: Ec. 3.11 - 1 ̅ ̅ ̅ Figura: 3.11-1 Factor de Compresibilidad - 85 - ( ) 3.12. A Presiones altas (volúmenes pequeños) la ecuación de Van der Waals, ̅ ecuación ̅ ( )̅ ̅ ̅ , puede reordenarse en la siguiente forma: ̅ Si se eliminan los términos cuadráticos y cúbicos ̅ = b como una primera aproximación de la raíz más pequeña de la ecuación. Esto representa el volumen del líquido. Empleando este valor aproximado de ̅e n los términos mayores demostrar que la siguiente aproximación para el volumen del líquido es A partir de esta expresión, demostrar que la primera aproximación para el coeficiente de expansión térmica de un líquido de Van der Walls es a = bR/a Solución: ̅ Ec. 3.12 - 1 ̅ ̅ ̅ ̅ - 86 - 3.13. Empleando el mismo método que se empleó para obtener la ecuación demostrar la relación dada en la Tabla 3-4 entre ̅̅̅̅ ̅ para la ecuación de Beatti-Bridgeman, a saber: ' (RT)2 = - B2/RT. De la Tabla 3-4 para la ecuación de Beatti-Bridgeman puede expresarse Z como: Solución: ̅ ) ( ̅ ̅ ̅ ( ̅ ̅ Ec. 3.13 - 1 ) ( Ec. 3.13 - 2 ( ( ) ̅ )( ( ) ̅ ) ) ( ) ) ( ( ( ( ( ) ) ( ( ( ) ) ( ) ) ) ) ̅ - 87 - 3.14. ¿A qué temperatura tiene la pendiente de la curva Z contra p (p = 0) un máximo valor para el gas de Van Der Waals? ¿Cuál es el valor de la pendiente máxima? Datos: p=0 Solución: Ec.3.14-1 [ ( ] ) - 88 - PROBLEMAS DE APLICACIÓN PRIMERA LEY DE LA TERMODINÁMICA FISICOQUIMICA FARRINGTON DANIELS 4.1. Se producen treinta y cinco litros de hidrogeno por la acción de un ácido sobre un metal a una presión total de 1 atm. Calcular el trabajo efectuado por el gas al hacer retroceder la atmósfera, expresado en (a) atmósferas-litro, (b) en calorías, (c) en julios y (d) en ergios. SOLUCIÓN: Aplicamos la fórmula: L=P L=1atm (35-0)l L= 35 atm-l Conversión de Unidades: L= 35 atm-l * L= L= * . L= * L= 4.2. Un peso de 900 gramos cae desde una altura de 120 metros, (a) ¿Cuántos ergios de calor se liberan cuando golpea el suelo? (b) ¿Cuántos julios? (c) ¿Cuántas calorías? (d) ¿Cuántas atmosferas-litro? SOLUCIÓN: 900g =Q . - 89 - 1059,5 J Conversión de unidades: 1059,5 J 1059,5 J . 1059,5 J . 4.3. Un calentador eléctrico de 500 vatios, ¿Cuántos grados de temperatura podrá elevar a 10 litros de agua durante 1 hora, suponiendo que no haya pérdida de calor? El calor específico del agua puede tomarse como 1 cal/grad g y la densidad como 1g/cm3, independientemente de la temperatura. SOLUCIÓN: P= 500w Aplicamos la definición de potencia . . . . . . . . 43.0 - 90 - 4.4. Cien gramos de benceno se vaporizan en su punto de ebullición de 80.2° y a 760 mmHg. El calor de vaporización es de 94.4 cal/g. Calcular (a) L Rev (b) Q, (c) ∆H, (d) ∆E. SOLUCIÓN: T =353.35°K P= 1 atm Calculamos las moles de benceno . = 1.28 mol de PARTE A: P Proceso P1 P2 V1 V2 V A presión constante, Lrev = P∆V = P(Vlíquido– V vapor) Despreciando el volumen del líquido en comparación con el volumen del vapor: . . . PARTE B: . . *100g 94.4 . 9440 cal PARTE C: . - 91 - . PARTE D: . E2 – E1 .E2 .E2 9440 cal .E2 cal 4.5. Cien gramos de nitrógeno a 25° y 760mmHg, se expanden reversiblemente e isotérmicamente a una presión de 100mmHg. (a) ¿Cuál el trabajo máximo en calorías que se puede obtener de esta expansión? ¿Cuál es el trabajo máximo que se puede obtener si la temperatura es de 100°? SOLUCIÓN: PARTE A: Utilizamos la fórmula del gas ideal y calculamos V1 y V2 . . .V1= .V1= 87.305 L - 92 - . .V2= .V2= 666.401L Utilizamos la fórmula : . ln 4230 cal P Diagrama P – V 1 T=373.15°K 2 V PARTE B: Utilizamos la fórmula del gas ideal y calculamos V1 y V2 . . .V1= V1= 109,267 L . .V2= - 93 - V2= 827,777 L . ln . 5361,466 4.6. (a) Calcular el trabajo realizado en calorías, cuando una mol de bióxido de azufre se expande isotérmicamente y reversiblemente a 27° de 2.46 a 24.6 litros, suponiendo que el gas es ideal. (b) ¿Tendría una fuerza de atracción entre las moléculas del gas facultad para hacer el trabajo fuera más grande o más pequeño? SOLUCIÓN: °K= 27°C +273.15= 300.15°K PARTE A: Utilizamos la fórmula : . . ln . PARTE B: - 94 - Más pequeño pues se podría expandir menos. 4.7. (a) Demuestre que para una expansión reversible isotérmica de V1 a V2 de una mol de gas que obedece a la ecuación de van der Waals, el trabajo efectuado por el gas está dado por: = RT ln ( )+a( ) SOLUCIÓN: PARTE A: Ec. de van der Waals : (1) P= ∫ (2) (1)en (2) . ∫ RT ln ( 4.8. ∫ )+a( ) Calcular el trabajo que se puede obtener de una expansión reversible isotérmica de un mol de cloro de 1 a 50 litros a 0 °. (b) Suponiendo que se comportar como un gas ideal y (c) suponiendo que se siguiera la ecuación de van der Waals. PARTE B: °K= 0°C +273.15= 273.15°K Diagrama P – V - 95 - . ln 87,62 atm- l/ mol PARTE C: a= 6.493 b= 0.05622 Diagrama P – V RT ln ( )+a( ) ln ( ) + 6.493 ( ) . - 96 - 4.9. Calcular la capacidad de calor molar del glicol, (CH2OH)2 a 2°, con los siguientes datos. Se pesaron cien gramos de glicol dentro de un recipiente de cobre equipado con un calentador eléctrico y un termómetro resistente sensible. El recipiente de cobre o calorímetro se suspendió por medio de finas cuerdas dentro de otro recipiente exterior, al cual se le podía extraer el aire. El recipiente protector llevaba calentador y pilas termoeléctricas por medio de los cuales su temperatura se conservaba muy cercana a la del calorímetro, de modo que el calor desprendido por este era despreciable. El aparato fue sometido en un baño de hielo; y después de que se enfrió cerca de 0°, se extrajo el aire del recipiente exterior. Con el recipiente protector mantenido a la misma temperatura que el calorímetro se necesitaron 955 julios para calentar el calorímetro de 0.500 a 3.500°. La capacidad de calor del calorímetro se encontró ser de 20.00 cal/grad a 2°. SOLUCIÓN: QGANADO = QPERDIDO nglicol ̃ T + ̃ T = 228.15 cal .̃= = 33.57 ̃ = 33.57 4.9. ¿Cuánto calor se necesita para aumentar la temperatura de 10 gramos de argón (un gas monoatómico) de 0° hasta 10° (a) a volumen constante, (b) a presión constante? SOLUCIÓN: Calculamos las moles de argón = 0.25 moles de Ar Realizamos las conversiones de unidades °K= 0° +273.15= 273.15°K °K= 10° +273.15= 283.15°K - 97 - P 2 P=kT 1 T PARTE A Por ser un gas monoatómico . . . PARTE B: V 2 V=kT 1 T Por ser un gas monoatómico - 98 - . . . 4.10.A un mol de argón a 25 ° y 1 atm de presión, se le hace expandirse reversiblemente hasta un volumen de 50 litros (a) isotérmicamente y (b) adiabáticamente. Calcular la presión final en cada caso, suponiendo que el gas es ideal. SOLUCIÓN: T = 298,15 PARTE A: Diagrama P – V P(atm) 1 T=298.15°K 2 V(L) . = V1= 24.45 L Por ser un proceso isotérmico se puede aplicar la Ley de Boyle: P1V1= P2V2 . - 99 - . 89 L PARTE B: Diagrama P – V P(atm) (L) . . . . . . 4.11. Diez litros de nitrógeno a 1atm y 25° se les hace expandirse reversible y adiabáticamente hasta 20 litros. ¿Cuáles son la temperatura y presión finales? SOLUCIÓN: °K= 25° +273.15= 298.15°K - 100 - Diagrama P – V P(atm) =298.15°K (L) Aplicamos las relaciones de Poisson Por ser un gas diatómico . . . . . . . . . . - 101 - 4.12. (a) Calcular el trabajo máximo de la expansión isotérmica de 10 gramos de helio de un volumen de 10 litros a otro de 50 litros a 25°. (b) Calcular el trabajo máximo de una expansión adiabática, partiendo de las mismas condiciones y permitiendo al gas expandirse hasta 50 litros. SOLUCIÓN: Calculamos las moles de helio = 2.5 moles de He Realizamos las conversiones de unidades °K= 25°C +273.15= 298.15°K PARTE A Diagrama P – V P(atm) 1 T=298.15°K 2 V(L) . ln 2383.67 cal - 102 - PARTE B: Por ser un gas monoatómico . . Aplicamos las relaciones de Poisson: . . . . . . 1454.6 cal - 103 - 4.13. Por el análisis se ha encontrado que el cloruro de plomo contiene 74.5% de plomo y 25.5% de cloro por peso. El peso atómico del cloro es 35.45 .El calor especifico del plomo es aproximadamente de 0.0309 cal/g. Utilizando estos datos ¿Cuáles de las siguientes fórmulas son posibles: Pb2Cl, PbCl, PbCl2, PbCl3, PB2Cl2, Pb2Cl4? Calcular el peso atómico posible del plomo. SOLUCION Base de cálculo: 100g de cloruro de plomo MCl2= 35.45 g .̅ .̅ .̅ ELEMENTO m(g) M(g/mol) Xi Cl2 25.5 35.45 0.72 0.67 Pb 74.5 207.12 0.36 0.33 = 1 1.08 1.00 Fórmula del cloruro de plomo: PbCl2 4.15. De la relación de Dulog y Petit, deducir el calor específico del hierro a la temperatura ambiente. SOLUCIÓN: Peso atómico del hierro = Aplicando la relación de Dulog y Petit Peso atómico* Cp = - 104 - Cp = Cp = 4.15. Una bala de 50 gramos, se desplaza a una velocidad de 2000 pies-seg-1. Calcular su energía cinética en (a) julios y (b) en calorías. SOLUCIÓN: PARTE A PARTE B 4.16. La tensión superficial del agua es de 72 dinas cm-1(72 ergios cm-2) a 25°C; calcular la energía superficial en calorías de una mol de agua dispersada en forma de rocío, teniendo las gotitas 1 micra ( 10-4cm) de radio. La densidad del agua puede tomarse como 1g. cm-3. T=25°C= 298°K r= 10-4cm - 105 - 4.17. ¿Qué corriente debe pasar a través de un calentador de 100 ohmios para calentar un termostato de agua de 10 litros 0.1 grad-1 min-1? El calor específico del agua puede tomarse como de 1 cal grad-1 g-1 y la densidad como de 1g. cm-3 V=10L=10000 cm3 R= 100Ω √ 4.18. Una mol de gas monoatómico es condensado en su punto de ebullición estándar de -33.4°C, sometiéndola a una presión infinitesimal mayor que una 1 atm. Para evaporar un gramo de amoniaco en su punto de ebullición se requiere la absorción de 327 cal. Calcular (a) Lrev, (b) q, (c) ∆H, (d) ∆E. T = - 33.4°C = 239.60°K P = 1 atm ∆Hvap = 327 cal/g - 106 - P Proceso P1 P2 V1 V2 V SOLUCIÓN PARTE A A presión constante, Lrev = P∆V = P(Vlíquido– V vapor) Despreciando el volumen del líquido en comparación con el volumen del vapor: PARTE B y C A P= constante ; Qp=∆H. El proceso también ocurre a T=constante pero ∆U no es cero, porque hay un cambio de fase de gas(vapor) a líquido. Por dato: ∆H = - ∆Hvap = - 327 cal/g PARTE D - 107 - 4.19. Un mol de gas ideal a 25 ° C y 100 atm, se hace expandir reversiblemente e isotérmicamente hasta 5 atm. Calcular (a) el trabajo efectuado por el gas en atmósferas-litro, (b) el calor absorbido en calorías, (c) ∆ E y (d) ∆ H. n= 1 P T= 25°C= 298°K P1 Po= 100 atm Pf= 5atm T= cte= 298°K SOLUCIÓN V1 V2 V Cálculo de los volúmenes PARTE A ( ) PARTE C ∆U= 0, debido a que es un proceso a temperatura constante PARTE B U= Q-L Q=Lrev= 73.24 atm.L - 108 - PARTE D ∆H=∆U+ ∆PV ∆H=∆PV= PfVf – PoVo= 100(0.244) -5(4.887) 4.20. Calcular el trabajo máximo obtenido en una expansión isotérmica de 10 gramos de helio, de 10 a 50 litros a 25°C, suponiendo un comportamiento de gas ideal. Exprese la respuesta en (a) calorías, (b) ergios y (c) atmosferaslitro. m= 10g ̅ P 4 g/mol Vo= 10 L P1 Vf= 50 L P2 T= cte= 298°K T= 25°C= 298°K V1 V2 V SOLUCIÓN ̅ PARTE C ( ) - 109 - PARTE B PARTE A 4.21. Diez moles de bióxido de carbono contenidas en un volumen de 20 litros, se las expande a un volumen de 200 litros a 25°C. Calcular el trabajo máximo que se puede efectuar si (a) se supone que el gas es ideal y (b) si se utiliza la ecuación de van der Waals. n= 10 P Vo= 20 L P1 Vf= 200 L P2 T= 25°C= 298°K T= cte= 298°K V1 V2 V SOLUCIÓN PARTE A ( ) L=57011.52 J - 110 - PARTE B P P1 P2 T= cte= 298°K b V1 V2 V ) Para el helio b=0.02370 L.mol-1 a= 0.03412 atm.L2.mol-2 ) 4.22. Cien litros de helio a 0°C y 1 atm, se calientan en un vaso cerrado a 800°C. (a) Calcular el cambio de la energía interna en kilocalorías (b) ¿Qué tanto más calor se requeriría si el gas fuera calentado a una presión constante de 1 atm? Vo= 100 L To= 0°C= 273°K Po = atm Tf=800°C=1073°K SOLUCIÓN - 111 - Como el helio es un gas monoatómico: ̃ PARTE A ̃ ( y ̃ ) PARTE B ̃ ( ) - 112 - 4.23. Diez pies cúbicos de oxigeno bajo presión y a 25°C se hacen expandir reversiblemente y adiabáticamente hasta un volumen de 30 pies3. Considerando al oxígeno a un gas ideal con la capacidad de calor dada en la tabla II, calcular la temperatura final. To=25°C= 298°K SOLUCIÓN 4.24. Un mol de hidrógeno a 25°Cy a 1 atm, se comprime adiabáticamente y reversiblemente a un volumen de 5 litros. Calcular (a) la temperatura final, (b) la presión final, y (c) el trabajo efectuado por el gas. n= 1 To=25°C= 298°K Po= 1 atm Vf=5L SOLUCIÓN - 113 - PARTE A Como el hidrogeno es un gas diatómico ̃ ̃ ỹ ̃ - 114 - PARTE B PARTE C 4.25. Derivar la ecuación para la expansión adiabática de un gas que obedece la ecuación de estado P( ̃ – b) = RT. dQ=0 Derivamos la relación de Poisson Ec. 1 Ec.2 Ec. 3 Derivamos la ecuación de estado dada ̃ Ec. 4 ̃ Ec. 5 Despejando VdP de la Ec .5, ̃ Ec. 6 Introducimos la ec. 6 en la ec. 3 ̃ ̃ Ec. 7 Ec. 8 - 115 - Despejando PdV de la ec. 8, ∫ ∫ Integrando, 26. Derivar la relación para Čp - Čv para un gas que obedece la ecuación de van der Waals. ̃ ̃ ̃ para Gas que obedece la ecuación de van der Waals. ̃ Ec. 1 Derivando, Ec. 2 Ec. 3 Según la primera y segunda ley de la Termodinámica, Ec. 24 Ec. 5 - 116 - Mediante las relaciones de Maxwell, Ec. 6 Ec. 6 en Ec. 5 Ec. 7 Ec. 7 en Ec. 3 Ec. 8 ̃ Si, Ec. 9 Derivando, 0 Ec. 10 Ec. 11 Ec. 12 ̃ Ec. 13 Igualando la Ec. 9 con la Ec. 13 ̃ ̃ ( ( ̃ ̃ ̃ ̃ ̃ ) )( ( ( ( ) ) [ ( ) ̃ ( ) )( ) ( ) ) Al operando la ec. 13 se tiene ] Ec. 14 Coeficientes termoelásticos y su relación - 117 - Ec.15 Ec. 16 Ec. 15 y Ec. 16 en Ec. 14 ̃ ̃ ̃ ̃ ̃ [ ( )] ̃ 4.27. El calor específico del cinc es de 0.0978 cal grad-1 g-1, y se ha establecido que 10.00gramos de este metal se combinan con 10.85 gramos de cloro para formar el cloruro de cinc estable. ¿Cuál es el peso atómico del cinc y cuál es la fórmula para el cloruro de cinc, si la valencia del cloro es 1 y su peso atómico es 35.45? mZn= 10 g mCl= 10.85 g SOLUCION ̅ ̅ ̅ ELEM ENTO Zn Cl ̅( m(g) n(moles) Xmol 65.44 10 0.15 0.33 35.45 10.85 0.31 0.67 0.46 1 0.33\0.33= 1 0.67\0.33= 2 Fórmula del cloruro de cinc: ZnCl2 - 118 - 4.28. ¿Cuánto trabajo desarrolla un hombre que pesa 75 kg (165 lb) cuando sube el monumento Washington de 555 pies de alto? ¿Cuántas kilocalorías debe suministrar para hacer este trabajo muscular, suponiendo que el 25% de la energía producida por la oxidación de los alimentos en el cuerpo, pueden convertirse en trabajo mecánico muscular? w=75 kg. h=555ft * * = 164.28 m SOLUCIÓN PARTE A: Hay un cambio de altura por ende tenemos una energía potencial, expresada por la siguiente ecuación: *(169.28m) = 124.42x103 J L=mgh= 75Kg* L= 124.4x103 J* * = 29.72 Kcal L= 29.72 Kcal PARTE B: Como se transforma solo el 25% de los alimentos en energía tenemos la siguiente relación 29, 72 Kcal* = 118.9 Kcal Se debe consumir 118.9 Kcal de energía producida por los alimentos para realizar dicho trabajo. 4.29. ¿A que distancia llegará una pelota de 100 gramos con una velocidad de 100 pies seg-1, subiendo verticalmente y haciendo caso omiso de la fricción de aire? m= 100g* v= 100 = 0.1 Kg * = 3.05 g= 9.8 SOLUCIÓN - 119 - Debido a que es un problema de caída libre aplicamos v= √ h= = = 0.47 m h= 0.47 m 4.30. La perdida de calor de un horno es de 100 cal min-1 ¿Qué corriente debe pasar a través de un calentador de 50 ohmios, para compensar esta perdida de calor? P= 100 * * = 6.98 W R= 50 Ω SOLUCIÓN Aplicando las ecuaciones de la electricidad P= I2R I=√ = √ = 0.37 A I= 0.37 4.31. Cien litros de vapor de agua a 100 oC y 0.5 atm, se comprimen isotérmicamente y reversiblemente a 1 atm y aun mas, hasta que el volumen es de 10 litros. Despreciando el volumen de agua condensada en comparación con el volumen del vapor y suponiendo la conducta de este es como la de un gas ideal, calcular el trabajo requerido para la compresión y el calor producido. V1=100 L P T= 100 oC = 373.15 K P1= 0.5 atm V2= 10 L SOLUCIÓN P2 P1 T= 373.15°K L V2 V1 V Como el vapor se comporta como gas ideal: - 120 - Aplicando Ley de Boyle P1V1=P2V2 P2= = = 50 atm P2= 50 atm. Calculo de las moles de vapor PV= nRT n= =1.63x10-4 moles = n=1.63x10-4 moles Aplicando la ecuación del trabajo isotérmico reversible ) = (1.63x10-4 moles)*(8.31 L= nRT ln )*(373.15 K)*(-2.30) = -1.16 J L= -1.16 J Como no hay variación de temperatura tenemos que U=0 Aplicando la primera ley de la termodinámica U = Q-L 0 = Q-L Q = L = -1.16 J 4.32. Demuestre que para una expansión isotérmica de un gas ideal H = 0 SOLUCIÓN P 1 P1 2 P2 T= cte V1 V2 V - 121 - Para calcular la entalpia en el estado 2 H= n ̃ T Como es un proceso isotérmico T= 0 así tenemos que H es igual a cero para la expansión isotérmica de un gas ideal. 4.33. ¿Cuál es la cantidad mínima de calorías de trabajo necesaria para comprimir isotérmicamente 1 mol de amoniaco a 1 atm y 150 oC, a un volumen de 10 litros: (a) suponiendo q obedece la ley de los gases ideales, (b) suponiendo que también obedece la ecuación de Van der Waals con a= 4.170 atmosferas-litro2 y b= 0.03707 litros mol-1? SOLUCION P PARTE A n= 1 mol NH3 P1 = 1 atm P1 P2 o T= 150 C = 323.15 K V1 V2 V Aplicando la ecuación del gas ideal tenemos P1V1 =nRT V1 = = = 26.5 L V1 = 26.1 L P2V2 =nRT P2 = = = 2.65 atm P2 = 2.64 atm L=nRT ln( ) = (1 mol)*(1,98 )*(323.15 K)*(-0.98) L= -632.35 cal - 122 - PARTE B Si es un gas de van der Waals podemos aplicar la siguiente expresión: P= Despejando el volumen tenemos V3 – ( - - =0 Resolviendo para encontrar el volumen 1 tenemos V3– (( - ) ( =0 V1= 26.7 L Realizamos el calculo del trabajo de expansión isotérmico para un gas de van der Waals – L= L= L = -629.7 cal 4.34. Un mol de gas ideal se expande isotérmicamente y reversiblemente de un estado de P1 y V1 a otro estado de P2 y V2. Calcular el trabajo efectuado por el gas. Un gas verdadero obedece a la relación P ( ̃ -b)=RT, donde b es una constante, se expande isotérmicamente y reversiblemente de un estado P1 y ̃ 1 a otro estado de P2 y ̃ 2. Calcular el trabajo efectuado por el gas. ¿Qué conclusiones generales se pueden deducir de estos resultados? SOLUCIÓN P P1 P2 T= cte V1 V2 V - 123 - PARTE A Para la expansión de un gas ideal: ∫ ∫ L= nRT ln PARTE B P P1 P2 T= cteT= cte V1P2 V2 V Para la expansión de un gas verdadero: ∫ ∫ L = nRT Ln ( ) 4.35. (a) Calcular el cambio en la energía interna del oxigeno cuando se calienta de 0 a 100 oC a volumen constante. (b) Calcular el cambio de la entalpia en este proceso. SOLUCIÓN PARTE A U = n ̃ T = (1mol)*(7.05 )*(373.15-273.15) = 22.56 Kcal U =22.56 Kcal PARTE B - 124 - Debido a que es un proceso a volumen constante, U = H H = 22.56 Kcal 4.36. Un mol de oxigeno a 5 atm y contenido en un volumen de 4 litros se hace expandir reversible y adiabáticamente hasta una presión final hasta una presión final de 1 atm ¿Cuál es (a) el volumen final y (b) la temperatura final? P1= 5 atm V1= 4 L P2= 1 atm ̃ R ̃ SOLUCIÓN PARTE A Utilizando la relación de Poisson que relaciona la presión y el volumen, encontramos V2: = P1 ̃ ̃ = = 1.4 = P2 - 125 - ⁄ V2 = ⁄ = = 12.67 L V2 = 12.67 PARTE B Utilizando la ecuación del gas ideal obtenemos T1: P1V1= nRT1 = T1 = = 243.9 K T1 = 243.9 K Utilizando la relación de Poisson que relaciona la temperatura con el volumen encontramos T2: T1 = T2 T2 = ⁄ ⁄ = = 153.8 K T2 = 153.8 K 4.37. Un tanque contiene 20 litros de nitrógeno comprimido a 10 atm y 25 oC. Calcular el trabajo máximo (en calorías) que se puede obtener cuando el gas se hace expandir a 1 atm de presión (a) isotérmicamente (b) adiabáticamente. P1= 10 atm P T1= 25 oC = 298.15 K V1= 20 L P2= 1 atm SOLUCIÓN P1 P2 T= 298.15 K V1 V2 V PARTE A Para realizar los cálculos asumimos que se trata de un gas ideal por lo cual podemos aplicar: P1V1= nRT - 126 - = n= = 8.18 moles N2 P2V2= nRT V2 = = = 200 L Aplicando la ecuación del trabajo de expansiónisotérmico tenemos: L= nRT ln( ) = (8.18 moles)*(1.98 )*(298.15 K)*(2.30) =11.10 Kcal L= 11.10 Kcal PARTE B Como es un gas diatómico ̃ ̃ Como es un proceso adiabático podemos aplicar la relación de Poisson que relaciona presión y volumen: = ̃ ̃ P1 = = 1.4 = P2 ⁄ V2 = ⁄ = = 103. 6L V2 = 103.6 L Utilizando la relación de Poisson que relaciona la temperatura con el volumen encontramos T2: T1 = T2 T2 = ⁄ = ⁄ = 281 K T2 = 281 K - 127 - Con esto podemos aplicar la ecuación del trabajo de expansión para un proceso adiabático, dada por: =- L= - = 694.42 cal L = 694.42 cal 4.38. Una molécula de un gas ideal se comprime en un cilindro por medio de un pistón. La presión es P, el volumen V y el cilindro esta sumergido en un termostato a una temperatura T. El siguiente ciclo se lleva a cabo (1) la temperatura del termostato se eleva 1 oC, conservándose la presión constante; (2) la presión se eleva gradualmente hasta que el volumen decrece a su valor original V, sin modificar la temperatura; y la (3) la temperatura del termostato se disminuye en 1 oC, conservándose el volumen constante. Haga una tabla mostrando las presiones inicial y final, las temperaturas y q, w y E, para cada paso. Etapa 1-2: Expansión Isobárica P Etapa 2-3: Compresión Isotérmica 3 P1 Etapa 3-1: Expansión Isométrica 2 P2 V1 V2 V SOLUCION ESTADO 1 2 3 P, atm P1 P2= P1 P3 T, K T1 T2 T3 = T2 V, L V1 V2 V3 = V1 PARTE A Etapa 1-2 Q= n ̃ (T2 - T1) L= P1 (V2 - V1) U= n ̃ (T2 - T1) PARTE B Etapa 2-3 U= 0 - 128 - L =Q= nRT ln( ) PARTE C ETAPA 3-1 L=0 U=Q= n ̃ (T1 – T3) ETAPA 1-2 2-3 U ̃ n (T2 - T1) 0 n ̃ (T1 – T3) 3-1 Q n ̃ (T2 - T1) L P1 (V2 - V1) nRT ln( ) nRT ln( ) n ̃ (T1 – T3) 0 4.39. Calcule la elevación máxima de temperatura de una pieza de hierro de 500 kg cuando la superficie al caer de una altura de 500 metros (despreciar la resistencia del aire y suponer que la mitad del calor va adentro de la pieza de hierro). El peso atómico del hierro es 55.85 g mol-1. Cp hierro = SOLUCION En este caso, tenemos una variación de altura por tanto tenemos una energía potencial, expresada por: E= mgh= (500kg)*(9.8 *(500 m) = 2.45x106 J Asumiendo que la presión es constante en dicho proceso tenemos que la ecuación del calor esta expresada por: Q= = = ( ) = 5.47 K T= 5.47 K 4.40. Calcular cuantas calorías mas se requerían para calentar 100 gramos de aluminio de 25 a 300 oC que se necesitan para calentar el mismo peso de plata y al mismo intervalo de temperatura. Cp aluminio = 0.897 Cp plata= 0.237 - 129 - SOLUCION Calculamos la cantidad de calor requerida para calentar los 100 g de aluminio QAl = mCp T QAl = (100g)*(0.897 )*(300 oC-25 oC) =24,66x103 J * = 5.9 Kcal QAl = 5.9 Kcal Calculamos la cantidad de calor requerida para calendar los 100 g de plata QAg = mCp T QAg = (100g)*(0.237 )*(300 oC-25 oC) =6.52x103 J * = 1.55Kcal QAg = 1.55Kcal Se necesitan 4.35 Kcal mas el calor utilizado en calendar 100g de plata para poder calendar 100g de aluminio. 4.41. Se calientan diez moles de helio 25 a 125 oC a una presión constante introduciendo algo de metal plata a 200 oC y dejando que el sistema recobre su equilibrio térmico. ¿Cuántos gramos de plata se necesitarían emplear? Cp helio = 5.193 Cp plata= 0.237 SOLUCION Se aplica el principio de conservación del calor que propone: Q ganado = Q perdido nMCP T = m CP T (10 moles He)*(4 *(5.193 *(125 oC-25 oC) = m* 200 oC -125 oC) m= 1168,27 g Se necesitan 1168,27 g de plata para poder calentar helio de 25 oC a 125 oC Se necesitan 1168,27 g de plata para poder calentar helio de 25 oC a 125 oC - 130 - ENERGÍA Y PRIMERA LEY DE LA TERMODINÁMICA FISICO QUIMICA GILBERT CASTELLAN 5.1. Un gas experimenta una expansión en una sola etapa, contra una presión opuesta constante, desde T, P1, V1 hasta T, P2, V2. ¿Cuál es la masa máxima M que se puede levantar hasta una altura h en esta expansión? b) El sistema de a) vuelve a su estado inicial mediante una compresión en una etapa: ¿Cuál es la mínima masa M´ que debe caer desde una altura h para restablecer el sistema a su estado inicial? c) ¿Cuál es la masa neta que baja a través de la altura h con la transformación cíclica (a) y (b)? d) si h = 10cm, P1 = 10 atm, P2 = 5 atm y T = 300°K, y se trata de un mol de gas, calcular los valores numéricos pedidos en (a) y (b) Solución: P P1=10 atm Pop=P2=5 atm T=300 K V1 V2 V a) W = Mgh De donde: Lexp = Pop (V2 – V1) Pop = P2 Lexp = P2 (V2 – V1) - 131 - )= ( ) ) b) Lcomp = P1 (V2 – V1) Pop = P1 ( ( ) ( ) ) c) ( [ ) ( ) ] d) P= ( ) ( ) - 132 - ( ) 5.2. Un mol de un gas ideal se expande de T, P1, V1 a T, P2, V2 en dos etapas Presión de oposición Variación de volumen Primera etapa P´(constante) V1 a V´ Segunda etapa P2 (constante) V´ a V2 Especificamos que el punto P´, V´, está sobre la isoterma a la temperatura T. a) Formular la expresión para el trabajo producido en esta expansión en términos de T, P1, P2 y P´. b) ¿Para qué valor de P´ tiene el trabajo un valor máximo en esta expansión en dos etapas? ¿Cuál es el valor máximo del trabajo producido? Solución: P P1=10 atm Pop=P2=5 atm T=300 K V1 V2 V L = L1a etapa + L2a etapa - 133 - L = Pop (V´- V1) + Pop (V2 – V1) + Pop (V2 – V´) L = P´(V´- V1) + P2 (V2 – V´) PV=nRT ) ( [ ( ) ( ) ( )] b) P´ = (P1P2)1/2 [ ] ( ) - 134 - 5.3. Tres moles de un gas ideal se expanden isotérmicamente contra una presión constante de oposición de 1 atm desde 20 hasta 60 litros. Calcular L, Q, ∆U y ∆H. Solución: P P1 Pop=P2=1 atm T=cte. V1=20 L V2=60 L V T = cte ∆H = 0 ∆U = 0 L = P ∆V L = P (V2 – V1) L = 1atm (60L – 20L) L = 40 atmL Q=L Q = 40 atmL 4. Tres moles de un gas ideal a 27°C se expanden isotérmicamente y reversiblemente desde 20 hasta 60 litros. Calcular L, Q, ∆U y ∆H P Solución: T=300,15 K V1=20L V2=60 L V - 135 - T = cte ∆U = 0 ∆H = 0 PV=nRT ∫ ∫ ∫ ( ) ( ) Q = ∆U + L Q=L 5.5. Un mol de gas de Van der Waals a 27°C se expande isotérmicamente y reversiblemente desde 10 hasta 30 litros. Calcular el trabajo producido: a = 5.49 litros2. Atm. Mol-1, b = 0.064 litros/mol Solución: P(Ṽ-b)=RT ∫ ∫ ̃ ̃ ( ̃ ̃ ) ̃ - 136 - ∫ ̃ ̃ ̃ ̃ ̃ ∫ ̃ ̃ ̃ ̃ ̃ ̃ L = 26.944 atmL 5. 6. Un mol de un gas ideal está encerrado a una presión constante Pop= p=2 atm. La temperatura varía desde 100 °C hasta 25 °C a) ¿Cuál es el valor de W? b) Si Cv= 3 cal/ °k mol, calcular Q, E, y H Solución DATOS: P1= 2atm y T1=373,15 °K P2= 2 atm y T2= 298,15 °K P Pop=P=2 atm T1=300,15 K T2=298,15 K V2 V1 V1 V n R T1 P1 - 137 - V1 1 mol (0,082l atm/ mol K) (373,15K) 2 atm V1=15.3921L V2 V2 n R T2 P2 1 mol (0,082 l atm/ mol K) (298,15 K) 2 atm V2=12.29L L P V L 2 atm (12,298l - 15,392 l) - 6,188 l - atm 24,218 cal 1 l - atm L= -149.86 cal b) U CV T cal U 3 (1 mol ) (298,15 - 373,15) K k mol ∆U= -225 cal Q U L - 225 cal - 149,86 cal Q= -374.86 cal Proceso a presión constante H Q ∆H= -374.86 cal - 138 - 5.7. Si un gas ideal se somete a una expansión politrópica reversible, se cumple que p v n C , donde C y n son constantes y n>1. a) Calcular el trabajo para esta expansión, si un mol de gas se expande de V1 a V2 y si T1= 300 °C, t2= 200°C y n=2 b) Si Cv 5cal/ K mol calcular Q, E, H Solución: P T1=300°C= 573.15 K T2=200°C= 473,15 K a) V1 politrópica V 2 El trabajo para una expansión reversible es: V L p dV V2 V1 Sustituyendo en esta expresión la condición pVn= C con n=2, tenemos: L V2 V1 V2 dV C dV C 2 V1 V 2 V p1 V12 p 2 V22 L V1 V2 L p1V1 p2V2 p1V1 nRT1 l - atm p1V1 (1 mol) 0,082 (573,15K) mol K p2V2 nRT2 P1V1= 46.991 atmL l - atm p2V2 (1 mol) 0,082 (473,15K) mol K P2V2= 38.79 atmL - 139 - L (46,99l atm - 38,79 l atm) 24,218cal l atm L= 198.59 cal b) U nCV T cal U (1 mol) 5 (473,15 - 573,15) K K mol L= -500 cal Q U L Q - 500 cal 198,59 cal Q= -301.41 cal H CpT C p Cv R C p 5 cal/ K mol 1,987 cal / K mol ̅̅̅̅= 6.987 cal/molK ΔH 6,987 cal/Kmol(473,15 513,15)K ∆H= -698.7 cal - 140 - 5.8. a) El coeficiente de expansión térmica del agua líquida es 2,1 x 10-4 grad-1 y la densidad es 1 g/cm3. Si se calientan 200 cm3 de agua, de 25°C a 50 °C bajo presión constante de 1 atmósfera, calcular W. b) Si C p = 18 cal7°K mol, calcular Q y H Solución: a) El coeficiente de expansión térmica está definido con la expresión como: 1 V p V T Que puede escribirse en la forma: dV VdT Sustituyendo esta expresión para la diferencial del volumen dV en la ecuación de trabajo: L pdV L p dV L p VdT L pV T2 dT L pV (T2 T1 ) T1 L (1 atm)(0,2 l) (2,1 10 -4 L 1,05 10 -3 1 )(50 25 )C C l - atm L 1,05 10-3 l atm 24,218 cal 1 l atm L=0.0254 cal Conociendo la densidad y el volumen, la masa es: m V m 1 g/cm3 200 cm3 m=200g 200 g 11,11 moles 18 g/mol - 141 - H n C P T H 11,11mol 18 cal (323,15- 298,15) K mol K ∆H=5000cal Q= H Q=5000cal 5.9. Un mol de gas ideal se comprime adiabáticamente en una sola etapa con una presión constante de oposición igual a 10 atm. Inicialmente el gas está a 27°C y 1 atm de presión; la presión final es de 10 atm. Calcular la temperatua final del gas, W, Q . Resolver esto para dos casos: Caso I: Gas monotómico, Cv 3R / 2. Caso II: gas diatómico Cv 5R / 2. ¿Cómo se afectaría los resultados si se utilizan n moles en vez de un mol? La compresión adiabática a la cual se somete el gas queda descrita esquemáticamente por la figura: P (atm) P2 = 10 T2 P1 = 1 T1= 300 °K V V2 V1 Solución: Caso I: como el gas es ideal, el volumen es el estado 1 es: V1 V1 nRT P1 (1 mol) ( 0,082 l - atm/mol K) (300,15 K) 1 atm - 142 - V1=24.61 L Proceso es adibático Q=0 U L U n C v (T2 T1 ) L - Pop ( V2 - V1 ) n Cv (T2 T1 ) - Pop ( V2 - V1 ) cal 3 (1 mol) (1,987 cal/mol K)(T 2 - 300,15) K - 10 atm (V2 - 24,61) l 24,218 l - atm 2 2,98 (T2 - 300,15) 242,18 (V2 - 24,61) p2V2 nRT2 10 V2 0,082 T2 2,98 T2 - 894,45 - 242,18 (0,0082T2 ) 596,05 4.966 T2 6854,5 T2=1380.32°K V2=11.32 L L p v L (10 atm) (11,32 - 24,61) L (24,218 cal ) l - atm L=3218.6 cal U - L L= -3218.6 cal El H para un gas monoatómico - 143 - H C p T Cp R C v Cp 5 R 2 5 cal H 1,987 (1380,32- 300,15) K 2 mol K ∆H= 5365.74 cal 4,97 ( T2 - 300,15) - 242,18 V2 5960,05 10 V2 0,082 T2 6,95 T2 7451,79 T2= 1071.29°K V2= 8.78 L L 10 (8,78- 24,61) 24,218 ∆U=L=3833.71 cal 7 H (1,987)(1071,29 - 300,15) 2 ∆H=5362.89 cal - 144 - 5.10. Una mol de gas ideal a 27˚C y 1 atm de presión se comprime adiabáticamente y reversiblemente hasta una presión final de 10 atm. Calcular la temperatura final, Q, L, ΔU y ΔH para los mismos casos del problema 7-9. Datos: n= 1mol t= 27˚C=300˚K P1= 1atm P2= 10atm P(atm) 2 P2 1 P1 T2 1 P1 T(˚K) 1 T1 1P Para gas ideal monoatómico V2 V1 1a 1a = T2= = = T2= ⁄ ⁄ T2= 753.94˚K U=Q-L Q=0 U=-L ΔU= nCVΔT ΔU=(1mol)(3/2)(8.31J/mol˚K)(753.94-300.15˚K) ΔU=5656.49 J ΔU=-ΔL - 145 - L=-5656.49 J ΔH= nCPΔT ΔH=(1mol)(5/2)(8.31J/mol˚K)(753.94-300.15˚K) ΔH=9427.48 J Para gas ideal diatómico = T2= = = ⁄ T2= ⁄ T2= 579.21˚K U=Q-L Q=0 U=-L ΔU= nCVΔT ΔU=(1mol)(5/2)(8.31J/mol˚K)(579.21-300.15˚K) ΔU=5797.47 J ΔU=-ΔL L=-5797.47 J ΔH= nCPΔT - 146 - ΔH= (1mol)(7/2)(8.31J/mol˚K)(579.21-300.15˚K) ΔH=8116.46 J 5.11. Un mol de gas ideal a 27˚C y 10 atm de presión se expande adiabáticamente hasta una presión constante opositora de 1atm. Calcular la temperatura final, Q, L, ΔU y ΔH para los dos casos del problema Cv=3R/2 y Cp=5R/2. Datos: n= 1mol P(atm) t= 27˚C=300˚K P1= 10atm P2= 1atm 1 P1 1 P1 T1 P2 2 1 1 T2 2P Para gas monoatómico U=Q-L V1 V2 1a 1a Q=0 U=-L ΔU= nCVΔT L=-PopΔV P1V1=nRT1 V1= V1= V1=2.46 L - 147 - nCVΔT= -Pop(V2-V1) (1mol)(3/2)(1.987cal)(T2-300.15)=(-1atm)(V2-2.46L)(24.218cal/atmL) 2.98T2 - 894.59=-24.218 V2 + 59.58 P2V2=nRT2 V2= V2= V2=0.08205 T2 Reemplazando V2 2.98T2 - 894.59=-24.218 (0.08205 T2)+ 59.58 4.96 T2=954.17 T2=192.14˚K Reemplazando T2 en V2 V2=0.08205 (192.14) V2=15.75L U=-L L=(-1amt)(15.75-2.46)L L=-13.29atmL(24.218cal/atmL) L=-321.8 cal ΔU=321.8 cal ΔH= nCPΔT ΔH=(1mol)(5/2)(1.987cal/molK)(192.14-300.15) ΔH= -536.5 cal - 148 - Para gas diatómico U=Q-L Q=0 U=-L ΔU= nCVΔT L=-PopΔV P1V1=nRT1 V1= V1= V1=2.46 L nCVΔT= -Pop(V2-V1) (1mol)(5/2)(1.987cal)(T2-300.15)=(-1atm)(V2-2.46L)(24.218cal/atmL) 4.97T2 – 1491.75=-24.218 V2 + 59.58 P2V2=nRT2 V2= V2= V2=0.08205 T2 Reemplazando V2 4.97T2 – 1491.75=-24.218 (0.08205 T2)+ 59.58 6.96 T2=1551.33 T2=223.02˚K Reemplazando T2 en V2 - 149 - V2=0.08205 (223.02) V2=18.3L U=-L L=(-1amt)(18.3-2.46)L L=-15.84atmL(24.218cal/atmL) L= -383.6 cal ΔU= . cal ΔH= nCPΔT ΔH=(1mol)(7/2)(1.987cal/molK)(223.03-300.15) ΔH= -536.40 cal 5.12. Repetir el problema 11 suponiendo que la expansión es reversible. Datos: n= 1mol P(atm) t= 27˚C=300˚K P1= 10atm P2= 1atm 1 P1 1 P1 T1 P2 2 1 1 T2 P1 Para gas ideal monoatómico = T2= = - 150 - = ⁄ T2= T = ⁄ . ˚K U=Q-L Q=0 U=-L ΔU= nCVΔT ΔU=(1mol)(3/2)(1.987cal/mol˚K)(119.5-300.15˚K) ΔU= -538.4 cal ΔU=-ΔL L=538.4 cal ΔH= nCPΔT ΔH=(1mol)(5/2)(1.987cal/mol˚K)(119.5-300.15˚K) ΔH=-897.4 cal Para gas ideal diatómico = T2= = = - 151 - ⁄ T2= ⁄ T = 55.5˚K U=Q-L Q=0 U=-L ΔU= nCVΔT ΔU=(1mol)(5/2)(1.987cal/mol˚K)(155.5-300.15˚K) ΔU=-718.5 cal ΔU=-ΔL L=718.5 cal ΔH= nCPΔT ΔH=(1mol)(7/2)(1.987cal/mol˚K)(155.5-300.15˚K) ΔH=-1005.9 cal 5.13. El coeficiente de Joule-Thomson para un gas de Van de Waals está dado por: µJT=[ Calcular ΔH (calorías) para la compresión isotérmica a 300˚K de 1 mol de nitrógeno desde 1 hasta 500 atm; a=1.34 L2atm/mol2 y b= 0.039L/mol Solución: ( ∫ ) (H2-H1)= ( ∫ ) ∫ - 152 - ΔH= ΔH=[ ( ) ][(500atm)(24.218cal/molK)] ΔH=846.94cal 5.14. La temperatura de ebullición del nitrógeno es de -196˚C y Cp=5cal/˚K. Las constantes de Van der Waals y µJT se dan en el problema 13.¿Cuál será la presión inicial si la temperatura del nitrógeno desciende desde 25˚C hasta la temperatura de ebullición en una expansión Joule-Thomson de una sola etapa?(La presión final debe ser 1atm). Solución: ( ) ( ) – 0.1888 – 0.1888 – ∫ =∫ P= .33atm - 153 - 5.15. Repetir el cálculo del problema anterior para el amoniaco: la temperatura de ebullición=-34˚C, Cp=8.5cal/molK, a=4.17 L2atm/mol2 y b= 0.037L/mol. Solución: ( ) ( ) – 0.1053 – 0.1053 – ∫ =∫ P= atm 5.16. A partir del valor de Cp dado en la tabla 7-2 para el oxígeno, Calcular Q, L, ΔU y ΔH para el cambio de estado: a) p= constante, 100˚C a 300˚C b) v= constante, 100˚C a 300˚C Solución: ̅̅̅̅ p= QP=nCpdT ΔH=Q - 154 - ∫ ∫ ΔH= 6.0954(T2-T1) + ΔH= 6.0954(573.15 - 373.15) + ΔH=1480.12 cal=Q ΔH=6192.82 J Suponiendo que el oxígeno es gas ideal a estas condiciones de temperatura y presión: ΔH=ΔU-PΔV ΔH=ΔU-P(V2-V1) PV=nRT V1= V2= ΔH=ΔU + R(T2-T1) ΔU=ΔH - R(T2-T1) ΔU=(1480.72) - (1.987cal/molK)(573.15-373.15K) ΔU= 8 . cal L=Q – ΔU L=1480.72 – 1083.32 L=397.4 cal - 155 - b) Si el volumen permanece constante el trabajo L=0, y por la primera ley ΔU=Q. Como el cambio de la temperatura es el mismo que en inicio (a) el valor de ΔH será para este caso el mismo que calculamos antes, es decir ΔH= 1480.72cal. ̅̅̅̅ p= QP=nCpdT ΔH=Q ∫ ∫ ΔH= 6.0954(T2-T1) + ΔH= 6.0954(573.15 - 373.15) + ΔH= . cal H=U + PV dH=dU + pdV + VdP ΔH=ΔU + pΔV ΔU=ΔH - pΔV ΔU=ΔH + R(T2 – T1) ΔU=(1480.72) - (1.987)(573.15 – 373.15) ΔU=1083.32cal ΔU= . cal = Q - 156 - TERMOQUÍMICA FISICOQUIMICA GILBERT CASTELLAN 6.1. Según los datos de la tabla 7-1, calcular los valores de ΔH˚268 para las siguientes reacciones: a) 2O2(g) 3O2g) b) H2S(g) + 3/2O2g) H2O(L) + SO2g) c) TiO2(S) + 2Cl2g) TiCl4(l) + O2g) d) C(grafito) + CO2(g) 2COg) e) CO(g) + 2H2(g) CH3OH(l) f) FeO3(S) + 2Al(s Al2O3(S) + 2Fe(s) g) NaOH(s) + HClg) NaCl(s) + H2O(L) h) CaC2(S) + H2O(l) Ca(OH)2(g) i) CaCO3(g) Δ Δ a) 2O2(g) Δ + C2H2(g) CaO(s) + CO2(g) ∑ ̅̅̅̅ Δ Δ ̅̅̅̅ 3O2g) Δ Δ Δ b) H2S(g) + 3/2O2g) Δ Δ H2O(l) + SO2g) Δ - 157 - c) TiO2(S) + 2Cl2g) TiCl4(l) + O2g) Δ Δ Δ Δ d) C(grafito) + CO2(g) 2COg) Δ Δ Δ Δ e) CO(g) + 2H2(g) Δ Δ CH3OH(L) Δ Δ f) FeO3(S) + 2Al(s) Al2O3(S) + 2Fe(s) Δ Δ Δ Δ g) NaOH(s) + HClg) NaCl(s) + H2O(l) Δ Δ Δ - 158 - Δ h) CaC2(S) + H2O(L) Δ Ca(OH)2(g) + C2H2(g) Δ Δ Δ i) CaCO3(g) Δ CaO(s) + CO2(g) Δ Δ Δ 6.2. Suponiendo que los gases son ideales, calcular reacciones del problema anterior. para cada una de las ΔH=ΔU + ΔnRT ΔU=ΔH - ΔnRT Δn= a) 2O2(g) 3O2g) =ΔH - ΔnRT Δn= Δn= =(-68Kcal) – (1)(1.987cal/mol˚k)(298˚k)(1Kcal/1000cal) =-68.59 Kcal - 159 - b) H2S(g) + 3/2O2g) H2O(l) + SO2g) =ΔH - ΔnRT Δn= Δn= =(-134.4624Kcal) – (- 3/2)(1.987cal/mol˚k)(298˚k)(1Kcal/1000cal) = - 133.57 Kcal c) TiO2(S) + 2Cl2g) TiCl4(l) + O2g) =ΔH - ΔnRT Δn= Δn= =(38.7Kcal) – (-1)(1.987cal/mol˚k)(298˚k)(1Kcal/1000cal) = 39.29 Kcal d) C(grafito) + CO2(g) 2COg) =ΔH - ΔnRT Δn= Δn= =(41.22Kcal) – (1)(1.987cal/mol˚k)(298˚k)(1Kcal/1000cal) = 40.62 Kcal e) CO(g) + 2H2(g) CH3OH(L) =ΔH - ΔnRT Δn= Δn= - 160 - =(- 30.6043Kcal) – (-3)(1.987cal/mol˚k)(298˚k)(1Kcal/1000cal) =-28.82 Kcal f) FeO3(S) + 2Al(s) Al2O3(S) + 2Fe(s) =ΔH - ΔnRT Δn= Δn= =(-202.59Kcal) – (0)(1.987cal/mol˚k)(298˚k)(1Kcal/1000cal) =-202.59 Kcal g) NaOH(s) + HClg) NaCl(s) + H2O(l) =ΔH - ΔnRT Δn= Δn= =(-42.496Kcal) – (-1)(1.987cal/mol˚k)(298˚k)(1Kcal/1000cal) =-41.9 Kcal h) CaC2(S) + H2O(l) Ca(OH)2(g) + C2H2(g) =ΔH - ΔnRT Δn= Δn= =(-29.9712Kcal) – (1)(1.987cal/mol˚k)(298˚k)(1Kcal/1000cal) =-30.56 Kcal i) CaCO3(g) CaO(s) + CO2(g) =ΔH - ΔnRT Δn= - 161 - Δn= =(42.498Kcal) – (1)(1.987cal/mol˚k)(298˚k)(1Kcal/1000cal) = 41.9 Kcal 6.3.Para la reacción ΔHº298=31.3822Kcal. Los valores de Cp (cal/mol ºK) son: grafito, 2.066; H2O(g), 8.025; CO(g), 6.965; y H2(g) 6.892. Calcular el valor de ΔHºa 125ºC DATOS: Cp C(grafito)= 2.066 cal/molºK Cp H2O(g)= 8.025 cal/molºK Cp CO(g)= 6.892 cal/molºK Cp H2(g)= 6.892cal/molºK ΔHº298=31.3822Kcal T=125ºC+273= 398ºK Δ Δ Δ ∑ Δ ∫ Δ Δ ∑ /ºK ∫ 6.4 Con base en los datos a 25ºC: EC. (1) EC. (3) - 162 - 6.5 Calcular los calores estándar de formación de del y del a) Parael (3) (7) (6) + (7) (7) -37.3 131.35 = (6) + (7) = -63.72 = -63.72 b) Parael - 163 - = (10) + (11) = -196.56 = -196.56 6.6 Con base en los datos a 25ºC: EC. (1) EC. (2) El calor de formación del a) Calcular es -63.kcal/mol ºC para la reacción: b) Suponiendo que los gases son ideales, calcular ΔE para esta reacción (el negativo de esta cantidad, +218.4 kcal, es la energía cohesiva del cristal). a) ( ) - 164 - b) 6.7 Con base en los datos a 25ºC: Ec.(1) Calcular ΔHº para: a) b) c) d) Suponiendo que los gases son ideales, calcular ΔE para estas tres reacciones Solución: a) - 165 - b) c) d) Para a) = 100.6kcal Para b) = 219.95kcal Para c) = 119.35kcal - 166 - 6.8 a) Según los datos de la tabla 7.1, calcular el calor de vaporización del agua a 25ºC b) Calcular el trabajo producido en la vaporización de 1 mol de H 2O a 25ºC bajo una presión constante de 1 atm. c) Calcular ΔE de vaporización del AGUA A 25ºC d) Los valores de Cp(cal/ºKmol): vapor de agua 8.025; agua líquida, 17.996. Calcular el calor de vaporización a 100 ºC Solución: a) TABLA 7.1 Calores estándar a 25ºC Compuesto ΔfHº Kcal/mol H2O(g) -57.7979 H2O(l) -68.3174 L a P=cte ⁄ ( b) Δ ∫ ) Δ Δ - 167 - ∫ 6.9 Según los valores dados en la tabla 7.2para Cp como función de la temperatura, y a base de los datos: Calcular para la reacción: Solución: = (1) + (3) = -12.33kcal = -12.33 ̂ ( ̂ ̂ ̂ ̂ TABLA 7.2 Capacidad calorífica de gases en función de la temperatura ̂ GAS a H2 6.9496 -0.1999 4.808 Br2 8.4228 0.9739 -3.555 HBr 6.5776 0.9549 1.581 ̂ ) - 168 - ̂ Δ ] ̂ Δ Δ ∫ Δ ∫ Δ ∫ Δ ∫ Δ Δ 6.10 Según los datos de las tabla 7.1 y 7.2 calcular Δ para la reacción TABLA 7.2 Capacidad calorífica de gases en función de la temperatura ̂ GAS O2 C(grafito) CO2 ̂ Δ ̂ ̂ a 6.0954 -1.265 6.369 ̂ 3.2533 14.008 10.10 -10.171 -103.31 -34.05 2.751 ̂ - 169 - 6.11Una muestra de sacarosa C12H22O11 que pesa 0.1265g se quema en una bomba calorimétrica. Luego de efectuarse la reacción se encuentra que para producir eléctricamente un aumento igual de temperatura se necesitan 2082.3 joule. a) Calcular el calor de combustión de la sacarosa b) Con base en el calor de combustión y los datos apropiados de la tabla 7.1, calcular el calor de formación de sacarosa. c) Si el aumento de temperatura en el experimento es 1.743ºC, ¿Cuál es la capacidad calorífica del calorímetro y su contenido? a) 1cal = 4.184 J = 497.681cal =0.497681 Kcal b) La reacción de combustión de la sacarosa es: c) Para el calorímetro - 170 - 6.12 A partir de los calores de solución a 25°C: Reacción 1: HCl (g) + 100Aq HCl. 100 Aq Reacción 2: NaOH(s) + 100Aq NaOH. 100 Aq Reacción 3: NaCl (s) + 200Aq NaCl.200 Aq H= -17.65 Kcal H= -10.12 Kcal H= 1.106 Kcal Y de los calores de formación de HCl (g), NaOH (s), NaCl formación de la tabla 7-1, calcular H para la reacción: (s) y H2O de la (l) HCl .100Aq + NaOH.100Aq NaCl .200Aq + H2O (l) Tabla 7-1: Calores estándar de formación a 25 °C Compuesto H°f , Kcal / mol HCl (g) - 22,063 NaOH (s) -101,99 NaCl (s) - 98,232 H2O (l) - 68,3174 Utilizando las reacciones 1. y 2. Establecidas en el enunciado: HCl. 100Aq HCl (g)+ 100Aq + NaOH.100Aq NaOH (s) + 100Aq H= 17.65 Kcal H= 10.12 Kcal HCl.100Aq + NaOH .100Aq 200Aq + HCl (g) + NaOH (s)H= 27.77 Kcal Si a esta nueva reacción le agregamos la reacción 3 obtenemos: HCl.100Aq + NaOH .100Aq 200Aq + HCl (g) + NaOH (s) H= 27.77 Kcal + 200Aq + NaCl (s) NaCl.200Aq H= 1.106 Kcal Reacción 4: NaCl (s) + HCl.100Aq + NaOH.100Aq NaCl. 200Aq + HCl (g) + NaOH (s) H= 8.76 Kcal - 171 - De la tabla 7-1, el H° para la reacción: Reacción 5: H2O (l) + NaCl(s)HCl (g) + NaOH (s) Es igual a: H= -22.063 – 101.99-(-68.3174 – 98.232)= 42.4964 Kcal Multiplicando la reacción5 por -1 y sumándole la reacción 4 obtenemos: HCl (g) + NaOH (s) H2O(l) + NaCl(s) H= -42.4964 Kcal + NaCl (s) + HCl.100Aq + NaOH .100Aq NaCl.200Aq + HCl (g) + NaOH (s) H= 28.786 Kcal HCl .100Aq + NaOH.100Aq NaCl .200Aq + H2O (l)H= -13.71 Kcal 6.13 A partir de los calores de formación a 25°C: Solución H2SO4.600Aq KOH.200Aq KHSO4.800Aq K2SO4.1000Aq H, Kcal -212.35 -114.82 -274.3 -336.75 Calcular H para las reacciones: H2SO4.600Aq + KOH.200Aq KHSO4.800Aq + H2O (l) KHSO4.800Aq + KOH.200Aq K2SO4.1000Aq + H2O (l) Tabla 7-1: Calor estándar de formación a 25 °C Compuesto H2O (l) H°f , Kcal / mol - 68,3174 Solución: Para la primera reacción, usando los datos de tabla del enunciado: Hreacción= -274.3-68.3174-(-212.35 – 114.82) Hreacción= -15.44 kcal - 172 - Para la segunda reacción: Hreacción= -336.75-68.3174-(274.3-114.82) Hreacción= -15.94 kcal 6.14 A partir de los calores de formación a 25°C: Solución H, Kcal H2SO4(l) H2SO4 .1Aq H2SO4 .2Aq H2SO4 .4Aq -193.91 -200.62 -203.93 -206.83 Solución H2SO4.10Aq H2SO4 .20Aq H, Kcal H2SO4 .100Aq H2SO4 . Aq -209.93 -211.00 -211.59 -216.90 Calcular el calor de solución del ácido sulfúrico para estas soluciones y representar gráficamente H, contra la fracción molar del agua en la solución El calor de solución es la variación de entalpía relacionada con la adición de una cantidad determinada de soluto a una cantidad determinada de solvente a T y P constantes. Así el primer calor de solución para el ácido sulfúrico que podemos calcular es el de la ecuación: H2SO4 (l) + 1Aq H2SO4.1Aq Que usando los datos de la tabla es: Hs= -200.62+193.91= -6.71 Kcal Ya que Haq= 0 De igual forma, los demás calores de solución serán: H2SO4 (l) + 2Aq H2SO4. 2Aq H2SO4 (l) + 4Aq H2SO4. 4Aq H2SO4 (l) + 10Aq H2SO4. 10Aq H2SO4 (l) + 20Aq H2SO4. 20Aq H2SO4 (l) + 100Aq H2SO4. 100Aq H2SO4 (l) + Aq H2SO4. Aq Hs= -203.93 + 193.91= - 10.12 kcal Hs= -206.83 + 193.91=-12.92 kcal Hs= -16.02 kcal Hs= -17.09 kcal Hs= -17.68 kcal Hs= -22.69 kcal - 173 - Si graficamos los calores de solución HS, contra la fracción molar del agua XH2O, obtenemos la figura: Hs -6.71 -10.12 -12.92 -16.02 -17.09 -17.68 XH2O 0.5 0.66 0.8 0.909 0.952 0.99 ∆Hs= f(XH2O) 0 0 0,2 0,4 0,6 0,8 1 1,2 -5 ∆Hs -10 -15 -20 -25 XH2 O 6.15 Utilizando la ecuación (7-45) y la ley de Joule, demostrar que para un gas ideal (H/P)T=0 La ecuación (7-45) del texto de Castellan es: E V H P V V T P T P T Ec: 7-45 Si el gas es ideal, entonces: nRT V P2 P T Y la ecuación 7-45 puede escribirse como: E nRT H P V 2 V T P P T - 174 - La ley de Joule establece que: (E/V)T=0 entonces tenemos: nRT nRT H nRT 0 V P P P T P 6.16 A partir de la ley del gas ideal y la ecuación (7-57) deducir las ecuaciones (7-58) y (7-59) La ecuación (7-45) del texto de Castellan es: T1V1 T2V2 1 1 Mientras que las ecuaciones (7-58) y (7-59) son: T1 P1 1 T2 P2 1 y P1V1 P2V2 Si el gas es ideal toma la forma: nRT1 T1 P1 1 nRT2 T2 P2 1 De donde: T1 nR 1 T1 P1 1 T1 P1 1 T1 1 P1 T2 P2 1 T2 nR 1 T2 P2 1 1 1 T2 P2 1 Si en lugar de sustituir en la ecuación (7-45) el volumen por su expresión para un gas ideal, lo hacemos con la temperatura T tenemos que: P1V1 1 P2V2 1 V2 V1 nR nR P1V1V1 1 P2V2V2 1 De donde: P1V1 P2V2 - 175 - 6.17 Aplicando la ecuación (7-44) para una transformación a volumen constante, demostrar que: H P C P CV V P T T V E H CP dT CV dt P dV Vdp P T V T Si el volumen es constante entonces dV=0, entonces tenemos: H C P dT CV dt Vdp P T H P P CP CV V P T T V T V De donde: H P C P CV V P T T V 6.18 Según los datos de la tabla 7-3 y los calores de formación (kcal/mol) de los compuestos gaseosos: Compuesto SiF4 H°f -370 SiCl4 CF4 NF3 OF2 HF -145.7 -162.5 -27.2 5.5 -64.2 Calcular la energías de enlace simple: Si-F; Si-Cl; C-F; N-F; O-F, H-F Tabla 7-3: Calores de formación de átomos a 25 °C (kcal/mol) Compuesto Si F Cl C N O H H°f , Kcal / mol 88,04 18,3 29,012 171,698 85,565 59,159 52,089 - 176 - Para el enlace Si-F, podemos utilizar la reacción: SiF4 Si + 4F Cuyo H es usando la tabla 7-3 del texto: Hreacción= 88.04 + 4(18.3) - (-370) = 531.24 kcal Como el SiF4 tiene cuatro enlaces Si-F, la energía del enlace simple Si-F será 531.24 (kcal)/4= 132.81 kcal De igual forma para el enlace SiCl: SiCl4 Si + 4Cl Hreacción= 88.04 + 4(29.012) - (-145.7) = 349.788 kcal Y como el SiCl4 tiene cuatro enlaces Si-Cl, la cantidad 349.788/4=87.447 kcal es la energía del enlace simple Si-Cl Para el enlace C-F CF4 C + 4F Hreacción= 171.698 + 4(18.3) – (-162.5) = 407.398 kcal 407.398 kcal /4 = 101.84 kcal (enlace C-F) Para el enlace N-F NF3 N + 3F Hreacción= 85.565 + 3(18.3) – (-27.2) = 167.6665 kcal 167.6665 kcal / 3 =55.88 kcal (enlace N-F) Para el enlace O-F OF2 O + 2F Hreacción= 59.159 + 2(18.3) – 5.5 = 90.259 kcal 90.259 kcal / 2 =45.129 kcal (enlace O-F) - 177 - Para el enlace H-F HF H + F Hreacción= 52.089 + 18.3 – (-64.2)= 134.58 kcal (enlace H-F) 6.19 Con los datos de la tabla 7-3 y los calores de formación (kcal/mol) a 25° C de los compuestos gaseosos: Compuesto H°f CH4 -17.889 C2H6 -20.236 C2H4 12.496 C2H2 54.194 Calcular la energía de enlace de: a) el enlace simple C-C en C2H6 b) en enlace doble C=C en C2H4 c) el enlace triple CC en C2H2 Tabla 7-3: Calores de formación de átomos a 25 °C (kcal/mol) Compuesto C H H°f , Kcal / mol 171,698 52,089 a) El H de la reacción: C2H62C +6H Es utilizando la tabla 7-3 y los datos del enunciado: Hreacción= 2(171.698) + 6(52.089) - (-20.236) = 676.166 kcal Por otra parte, el H de la reacción: CH4 C +4H Es con la tabla 7-3 y los datos del enunciado: Hreacción= 171.698 + 4(52.089) – (-17.889) = 397.943 kcal La energía 397.943 kcal es la energía que poseen los cuatro enlaces C-H del CH4; de aquí que 397.943 / 4 =99.485 kcal es la energía de un enlace C-H. Como el C2H6 tiene seis enlaces C-H y un solo enlace C-C, si restamos a 676.166 kcal, que es la energía de seis enlaces C-H y uno C-C, la cantidad 6(99.485) tendremos la energía de un enlace C-C en el C2H6. Realizando las operaciones encontramos: - 178 - HC2H6 - 6HC-H = 676.166 – 6(99.485) = 79.25 kcal (enlace C –C en C2H6 ) a. En la reacción C2H42C +4H Hreacción= 2(171.698) + 4(52.089) – 12.496 = 539.256 kcal Como el C2H4 tiene cuatro enlaces C–H, si restamos a 539.256 kcal la energía que esto representa tendremos: 539.256 – 4(99.485) = 141.316 kcal Que es la energía de un enlace doble C=C en el C2H4 b) De igual manera en la reacción: C2H22C +2H Hreacción= 2(171.698) + 2(52.089) – 54.194 = 393.38 kcal 393.38 – 2(99.485) = 194.41 kcal (enlace CC en C2H2) - 179 - TERMOQUIMICA FISICOQUIMICA FARRINGTON DANIELS 7.1. En un calorímetro adiabático la oxidación de 0.4362 gramos de naftalina produce un aumento de temperatura de 1.707 0. La capacidad calorífica del calorímetro y del agua fue de 2460 cal gra-1. Despreciando las correcciones de oxidación del cable y por el nitrógeno residual. ¿cual cera la entalpia por mol de la combustión del naftaleno?. DATOS m=0.4362 gramos M= 128gra/mol SOLUCION. 7.2. Las siguientes reacciones se pueden utilizar para impulsar cohete: - 180 - (a) calcular los cambios de entalpia a 25opara cada una de las reacciones por kilogramo de combustible más la cantidad necesaria del agente oxidante. (Para el HF ∆Hof=64.2kcal). (b) puesto que el impulso es mayor cuando la fuerza molecular de los gases de salida es menor, divisase el calor por kilogramo entre el peso molecular del producto y ordénese las reacciones según su efectividad basándose en el impulso inicial. Datos. HF ∆Hof=64.2kcal H2O(l)∆Hof=-68.3174kcal/mol CO2(g)∆Hof=-94.0518kcal/mol CH3OH(l)∆Hof=-57.02kcal SOLUCION (a) ∑ ∑ ∑ ∑ - 181 - ∑ ∑ b) (1) (3) Orden de las reacciones según su efectividad. (1)>(2)>(3) 7.3. calcular el calcular desprendido durante la explosión de un gramo de etileno (a) a presión constante a 25 grados con exceso de aire. (b) con exceso de oxigeno puro a 20 atm de presión en una bomba cerrada. Datos H2O(l)∆Hof=-68.3174kcal/mol CO2(g)∆Hof=-94.0518kcal/mol C2H4(l)∆Hof=12.496kcal SOLUCION - 182 - A 100% de exceso de aire ∑ ∑ (b) con exceso de oxigeno puro ∑ ∑ 7.4. Calcular la entalpia de formación del PCl5(s) basándose en los calores delas siguientes reacciones. SOLUCION EC.4.1 divido para 2 - 183 - 7.5. Usando los valores de las entalpias de formación que aparecen en la tabla II, calcular las entalpias de combustión a 25 grados de las siguientes sustancias obteniendo CO 2 (G) yH2O(L) : a) n-butano, b)metanol, c) acido acético. Datos. H2O(l)∆Hof=-68.3174kcal/mol CO2(g)∆Hof=-94.0518kcal/mol C4H10(g)∆Hof=-29.812kcal/mol CH3OH(l)∆Hof=-57.02kcal CH 3COOH(L))∆Hof=-116.4kcal SOLUCION. ∑ ∑ ∑ ∑ ∑ ∑ - 184 - es de -61.4kcal /mol a 25o. (a) calcular el calor de 7.6. Para la acetona (CH3)2CO combustión dela (CH3)2CO a presión constante.(b) calcular el calor desprendido al quemar dos gramos de (CH3)2CO a presión en una bomba cerrada a 25o. Datos. H2O(l)∆Hof=-68.3174kcal/mol CO2(g)∆Hof=-94.0518kcal/mol (CH3)2 CO(l)∆Hof=-61.4kcal/mol SOLUCION. ∑ b) ∑ 1mol--------------------- -425.70 kcal 0.03448mol------------ X= -14.68kcal 7.7. Calcular ∆H298para la siguiente reacción: Sabiendo que: - 185 - SOLUCION. A la Ec 7-3 la multiplicamos por (-1) 7.8. Usando los valores de la tabla III calcular los cambios de entalpia al diluir una solución de 1 mol de acido clorhídrico en 5 moles de agua con un gran exceso de agua. SOLUCION. 7.9. Calcular las entalpias de reacción a 25o de las siguientes reacciones en soluciones acuosas. Las siguientes reacciones se pueden utilizar para impulsar cohete: Datos. ∆Hof=-66.544kcal/mol ∆Hof=-40.0233kcal/mol - 186 - SOLUCION. Al tratarse de un acido fuerte con una base fuerte la reacción se disocia en sus respectivos iones con un ∆H=0 ya que aparentemente no se produce ninguna reacción. ∑ ∑ 7.10. El calor de la reacción. Se va a determinar (a) basándose en las energías de enlace de la tabla VI suponiendo que el benceno C6H6tiene tres C=C, tres C-C y seis C-H. (b) a partir de los calores de formación del C6H6 (G) ,C (G)y H (G) de la tabla II. Datos. C=C = -145kcal/mol C-C = -80.5 kcal/mol C-H = -92.2kcal/mol C6H6(g)∆Hof=19.820kcal/mol SOLUCION. (a) basándose en las energías de enlace. - 187 - (b) a partir de los calores de formación. ∑ ∑ 7.11. La ecuación de la capacidad calorífica molar del n-butano es: Cp=4.64+0.0558T Calcular el calor necesario para elevar la temperatura de una mol desde 25 hasta 300°, a presión constante. DATOS: n=1 mol T1 =25°C=298°K T2 =300°C=573°K P= cte SOLUCIÓN: ∫ ∫ ) - 188 - 7.12. Calcular ∆H a 1000 K para la reacción. CH4 (g) + 2O2 (g) CO2 (g) +2H2O (g) DATOS: ̅ ̅ ̅ ̅ Tabulados a 298.15 +17.845×10-3T-41.65×10-7T2 ̅ CH4=3.422 O2=2(6.0954+3.2533×10 -3 CO2 =6.3957+10.1933×10 H2O= T-10.171×10-7T2 ) -3 T-35.333×10-7T2 2(7.1873+2.3733×10-3T+2.084×10-7T2) SOLUCIÓN: ̅ = ̅ ̅ ̅ =5.1568-9.4117×10-3T+4.0827×10-6T2 ∫ ̅ ∫ - 189 - 7.13. Aproximadamente la capacidad calorífica molar de un sólido es igual a la suma de las capacidades caloríficas atómicas de los elementos sólidos que forman el compuesto. ¿Qué relación general expresara la influencia de la temperatura sobre el calor de la reacción entre sólidos, dando productos sólidos; como por ejemplo, la reacción Fe(s) +S(s) →FeS(s) ? DATOS: ̅ ̅ ̅ ̅ ̅ P= Como P= P= ̅ ̅ ̅ ̅ ̅ ̅ ̅ P ̅ P= 7.14. En una bomba calorimétrica, la combustión de 1.753 gramos de sacarosa produce un aumento de temperatura de 2.907°. el cambio de entalpia para la combustión de la sacarosa es de 1349.7 kcal/mol (a) ¿Cuál será la capacidad calorífica total del agua y del calorímetro? (b) si el calorímetro contiene 1850 gramos de agua (calor especifico igual 1.0 cal/grad g), ¿Cuál será la capacidad calorífica del calorímetro ? en este problema no se toman en cuenta las correcciones por la oxidación del alambre ni el nitrógeno residual. DATOS: m=1.753 g C12H22O11 - 190 - ∆T=2.907° ∆H=1349.7 kcal/mol SOLUCIÓN: M=342 g/mol C12H22O11 C12H22O11 a) b) - 191 - 5.15. Cuantos gramos de azúcar de caña C12H22O11, se deben oxidar para obtener el mismo número de calorías de calor, que en el trabajo efectuado por un hombre de 160 lb.(72.7 kg) al escalar una montaña de 1 milla (1.609km) de alto. El calor de combustión del determinado empíricamente C12H22O11 es de 1349.7 kcal/mol. Se a que solo se aprovecha el 25% del valor calorífico de los alimentos para convertirlo en trabajo aprovechable por el hombre o por los animales, y, por consiguiente, los gramos calculados de C12H22O11 se deben multiplicar por 4 aproximadamente para obtener la cantidad oxidada realmente. DATOS: m=? g C12H22O11 d=1.609km M=342 g/mol C12H22O11 SOLUCIÓN: Calculo de la fuerza del hombre F=712.46 kg.m/ Calculo del trabajo del hombre 1146.348J - 192 - C12H22O11 7.16. La combustión del acido oxálico en una bomba calorimétrica proporciona 673 cal/g a 25 C. Calcular (a) ∆E y (b) ∆H para la combustión de una mol de acido oxálico HO2CCO2H (M-90). DATOS: Q=673 cal/g T=25°C M=90 g/mol SOLUCIÓN: 0 a) ∆E= ∆E=Q=673 cal/g b) Q - 193 - 7.17. El cambio de entalpia en la combustión del tolueno para formar H 2O (l) y CO2 (g) es de -934.50 kcal/mol a 25°. Calcular la entalpia de formación del tolueno. DATOS: T=25°C SOLUCIÓN: ̅ ̅ ̅ ̅ ̅ 7.18. A 25°, el cambio de entalpia para la combustión del bisulfuro de carbono, CS2, liquido en CO2 Y SO2 es de -256.97 kcal/mol. Calcular la entalpia de formación DATOS: ̅ del CS2 líquido. T=25°C SOLUCIÓN: - 194 - ̅ ̅ ̅ ̅ ̅ 88.57 7.19. Calcular el calor desprendido a 25° durante la reacción. ̅ La entalpia de formación del MgO (s) es SOLUCIÓN: ̅ ̅ ̅ ̅ ̅ ( ̅ ̅ ) ( ̅ ) 7.20. Los siguientes calores de solución se obtienen a 18° cuando se utiliza un gran exceso de agua. Calcular el calor de hidratación del CaCl2 hasta dar CaCl2.6H2O por a) H2O(l) y b)H2O(v). El calor de vaporización del agua a esta temperatura es de 586 cal/g. SOLUCIÓN: - 195 - a) = -22.5 kcal. Procesoexotérmico b) MH2O =18g/mol = 63.288kcal 7.21. Usando estos valores para el calor integral de la solución de nitrato de cadmio en agua, dibujar una grafica de ∆H con respecto a la molalidad m y determinar el calor diferencial de la solución del nitrato de cadmio en solución 4 molal: m(molalidad) 1,063 1,799 4,251 6,372 ∆H (J/mol) -34,2 -65.7 -126,0 -174,4 9,949 -228,5 - 196 - ∆H=f m 0 Entalpia(J/mol) escala: 1cm=-50(J/mol9 0 2 4 6 8 10 12 -50 y = -21.608x - 24.49 R² = 0.9782 -100 -150 -200 -250 -300 molalidad (m) escala: 1cm=2(m) Figura5.21: Diagrama de entalpia en función de la molalidad SOLUCIÓN: Utilizando una regresión lineal 7.22. Usando las entalpias de formación del y del solución a dilución infinita (Tabla IV) y los valores de Δ cómo se obtuvo el valor Δ en demostrar de la tabla (II) DATOS: - 197 - SOLUCIÓN: ∑ ∑ ( ) ) ( 7.23. (a) Calcular, basándose en las entalpias de formación y en las energías de enlace, el calor de disociación del en átomos. (b) Calcular los valores de reacción a presión constante de las siguientes reacciones DATOS: Δ Δ SOLUCIÓN: Ec (1)+ (ec (2.a)*(-1)) - 198 - ∑ Δ Δ ( Δ ∑ Δ Δ Δ Δ ) 7.24. Una mol de metano (considérese como gas ideal), inicialmente a 25⁰C y una atm de presión, se calienta a presión constante hasta duplicar su volumen. La variación de la capacidad calorífica molar con la temperatura absoluta esta .Calcular (a) ∆H y (b) ∆E dad por DATOS: T= 25 C P= 1atm V2= 2V1 SOLUCIÓN: Diagrama 5.24: Presión en función del volumen - 199 - ∫ (a) ∫ (b) 7.25. Calcular el calor molar de combustión del monóxido de carbono a presión constante y a 1327⁰ DATOS: P= 1atm T=1327 C - 200 - Δ SOLUCIÓN: Δ ∫ ∫ º º 7.26. Conociéndose la entalpia de formación del la entalpia de formación del a 298° como -31.8 kcal y a 298 como 8 kcal, calcular ΔH para la reacción: DATOS: T=298°C - 201 - Δ Δ SOLUCIÓN: ∑ ∑ 7.27. (a) Calcular el cambio en la energía interna del oxígeno cuando se calienta de 0° a 100°a volumen constante. (b) Calcular el cambio de entalpia en este proceso. DATOS: T1= 0°C T2=100°C SOLUCIÓN: ∫ º º - 202 - 7.28. Calcular la entalpia de combustión del n-nonano, basándose en los datos de la tabla I sobre el n-heptano, el n-hexano y el n-octano. DATOS: Δ SOLUCIÓN: ∑ ( Δ ( Δ Δ Δ ∑ ) ) ( ( Δ Δ Δ Δ ) ) 7.29. Calcular la cantidad de calor requerido para elevar la temperatura de una mol de oxigeno de 300 a 1000°K a presión constante. DATOS: n= 1mol de O2 - 203 - T1= 300 C T2 = 1000 C SOLUCIÓN: ∫ ∫ ( 7.30. Calcular la entalpia de formación para una mol de ) según los valores siguientes (a) (b) (c) (d) (e) (f) SOLUCIÓN: Aplicamos la ley de Hess para la solución de este problema: Ec (b)+ (ec(c)*(-1)) - 204 - Ec (d)+ (ec (e)*(-1)) Ec (1)+ec (2) Ec (a)*(1/2)+ (ec(f)*(-1/2)) Ec (3)+ec (4) - 205 - 7.31. Utilizando las entalpias de formación de la tabla 2.3 calcular los calores de combustión, a presión constante, a 25°C de (a) CO, (b) , (c) y (d) . DATOS: Entalpias de formación tomadas de la Tabla II. (Ver en anexos) SOLUCION: (a) CO ∑ ∑ ∑ ∑ (b) ( ) (c) - 206 - ∑ ∑ ( (d) ( ) ) ( ) ( ) . ∑ ∑ ( ( ) ) 7.32. El calor integral de solución de una mol en n moles de agua, en calorías, se obtiene según la ecuación Calcular para las siguientes reacciones: (a) solución de 1 mol de en 5 moles de agua; (b) solución de una mol de (c) solución de una mol de en 10 moles de agua; en un gran exceso de agua, 100000 moles por ejemplo; (d) adición de un gran exceso de agua a la solución en 10 moles - 207 - de agua; (e) adición de 5 moles mas de agua a la solución que contiene 5 moles de agua. DATOS: SOLUCION: (a) Solución de 1 mol de en 5 moles de agua (b) Solución de una mol de en 10 moles de agua (c) Solución de una mol de en un gran exceso de agua, 100000 moles por ejemplo - 208 - (d) Adición de un gran exceso de agua a la solución en 10 moles de agua (e) 5 moles de agua a la solución que contiene 5 moles de agua 7.33. Utilizando los valores de la tabla III, calcular el cambio de entalpia cuando se diluye una solución de 1 mol de NaOH en 5 moles de agua mediante la adición de 195 moles más de agua. DATOS: Calores integrales de solución acuosa tomados de la Tabla III (Ver en Anexos) SOLUCION: - 209 - 7.34. Calcular las entalpias de reacción a 25°C, en soluciones acuosas diluidas, de las siguientes reacciones: DATOS: Entalpias de reacción tomados de la Tabla I (Ver en Anexos) SOLUCION: (1) ∑ ∑ ( ) ( ) (2) ∑ ∑ ( ) 7.35. Calcular la cantidad de calor necesario para elevar la temperatura de una mol de desde 0°C hasta 300°C (a) a presión constante y (b) a volumen constante. ̅̅̅̅en calorías por gramo mol se obtiene mediante. ̅̅̅̅ - 210 - DATOS: Entalpias de formación tomados de la Tabla I (Ver en Anexos) Capacidades caloríficas a presión constante tomados de la Tabla VI (Ver en anexos) SOLUCION: (a) A presión constante ∫ ∫ ) ( ( ) (b) A volumen constante ( ) - 211 - ( ) 7.36. Calcular el calor desprendido durante la reacción a 1023°C y a presión constante. DATOS: Entalpias de formación tomados de la Tabla I (Ver en Anexos) Capacidades caloríficas a presión constante tomados de la Tabla VI (Ver en anexos) SOLUCION: ∑ ∑ ( ) CpHCl = 2 (6.7319 + 0.4325*10-3T +3.697*10-7T2) CpCl2 = - (7.5755 + 2.4244*10-3T – 9.650 *10-7T2) CpH2 = -(6.9469 - 0.1999*10-3T + 4.808*10-7T2) CpH2 = - 1.0586 - 1.3595*10-3T +12.236*10-7T2) - 212 - ∫ ∫ ( ) ( ) 7.37. Utilizando los datos de este capítulo y el ̅̅̅̅ del grafito ̅̅̅̅ Calcular para la siguiente reacción a 600 °K. DATOS: Entalpias de formación tomados de la Tabla I (Ver en Anexos) - 213 - Capacidades caloríficas a presión constante tomados de la Tabla VI (Ver en anexos) SOLUCION: ∑ ∑ ) ( ( ) CpCO = (6.3424 +1.8363*10-3T - 2.801*10-7T2) CpH2 = (6.9469 - 0.1999*10-3T + 4.808*10-7T2) CpH2O= (7.1873 + 2.3733*10-3T + 2.084 *10-7T2) Cp = 3.429+ 6.6197*10-3T +4.091*10-7T2 -1.169*105T-2 ∫ ∫ ( ) ( ) - 214 - 7.38. Calcular la temperatura teórica de la flama durante la combustión del etano con una cantidad estequiometria de oxígeno. El calor desprendido en la reacción, se utiliza para calentar productos, a la temperatura de la flama, suponiendo que la reacción es completa y no se pierde calor por radiación. La temperatura de la flama obtenida experimentalmente será menor que este valor teórico porque va temperaturas tan elevadas, la reacción es incompleta, efectuándose una disociación de los productos en átomos y radicales libres, con la absorción del calor subsiguiente. DATOS: Entalpias de formación tomados de la Tabla I (Ver en Anexos) Capacidades caloríficas a presión constante tomados de la Tabla VI (Ver en anexos) SOLUCION: ∑ [ ∑ ( ) ( )] ( ) 18.24 23.74 - 215 - 7.39. Calcular el cambio de entalpia para la disociación del (g) a 25°C utilizando los valores de la tabla II Explicar por que es diferente este resultado del indicado en la tabla V DATOS: De la Tabla II. Entalpia de formación a 25°C De la Tabla V. SOLUCION: A menudo, se encuentran discrepancias muy notables entre los valores de la Entalpia de formación a 25 C y ΔH de la disociación de enlaces, esto es debido a variaciones de configuración, geométrica y electrónica 7.40. Calcular el cambio de entalpia a 25°C para la reacción, en solución acuosa diluida, entre el y el NaCl. DATOS: Entalpias de formación tomados de la Tabla I (Ver en Anexos) SOLUCION: - 216 - ∑ [ ∑ ( )] ( ) - 217 - SEGUNDA LEY DE LA TERMODINÁMICA FISICOQUIMICA FARRINGTON DANIELS 8. 1. Calcular los cambios de entropía para los siguientes procesos: a) fusión de una mol de aluminio en su punto de fusión, 660 (∆Hfus= 191Kcal g mol-1); b) evaporación de 2 moles de oxígeno líquido en su punto de ebullición,-182,92 (∆Hevap=1,630 Kcal g mol-1); c) calentamiento de 10 gramos de sulfuro de hidrógeno de 50 a 100°.(Cp=7,15+0,00332T) a) b) c) ∫ [ ( ) ] - 218 - 8.2. Se condensa una mol de vapor estando a 100º, el agua se enfría a 0º y se convierte en hielo. ¿Cuál es el cambio de entropía del agua? Considerar que el promedio del calor especifico del agua es de 1.0 cal grad-1 g-1. El calor de vaporización en su punto de ebullición y el calor de fusión en su punto de congelación son de 539,7 y de 79.7cal g-1 respectivamente Se puede representar el proceso en las siguientes etapas: a) Entropía del cambio de estado mediante la variación de temperatura: b) Entropía de vaporización: - 219 - c) Entropía de fusión del agua: 8.3. Calcular el cambio de entropía si 350 gramos de agua a 5 ° se mezclan con 500 gramos de agua a 70 ° , suponiendo que el calor específico es de 1.00 cal/ g.grad Datos: m1 = 350 g T1 = 5 °C = 278,15 K m2 = 500 g T2 = 70 °C = 343,15 K C = 1 cal/ g.grad ∆S = ? Fig.3-1 Diagrama del problema ( ( )( ) ) ( )( ) - 220 - ) ( ( ( ) ) 8.4. Calcular el cambio de entropía de la céntupla expansión de una mol de gas ideal Datos: n = 1 mol V1 = V V2 = 100V T = cte ∆S = ? ⁄ Fig.4-1 Diagrama P-V 8.5. En la expansión isotérmica reversible de un gas ideal a 300 K de 1 a 10 litros, cuando tiene una presión inicial de 20 atm, calcular (a) cambio de entropía para el gas y (b) cambio de entropía para todos los procesos involucrados en la expansión Datos: Expansión reversible V1 = 1 L V2 = 10 L - 221 - P1 = 20 atm T = cte = 300 K (a) ∆S= ? para el gas (b) ∆S= ? para todos los procesos Fig. 5-1 Diagrama P-V (a) Para una mol ( ) Para 0,81 mol ( ) (b) ( ) ( ( ) ) ( ) ( ) - 222 - 8.6. Se conserva un termostato a una temperatura de 96,9 °. La temperatura del aire en el cuarto es de 26,9 °. Durante cierto tiempo, 1000 cal de calor se transmitieron a través del aislamiento del termostato al cuarto. (a) Cuál es el cambio de entropía del material del termostato? (b) cuál es el cambio de entropía del aire en el cuarto? Es el proceso reversible? Datos: T termostato = 96,9 ° = 370,05 K T aire en el cuarto = 26,9 ° = 300,05 K Q termostato = - 1000 cal Q cuarto = 1000 cal (a) ∆S termostato = ? (b) ∆S aire = ? Fig. 6-1 Diagrama Del Equipo (a) (b) Para determinar si el proceso es reversible se debe calcular el cambio de entropía total: Como se trata de una entropía positiva, se confirma que se trata de un proceso irreversible - 223 - 8.7. Calcular el cambio de entropía para la formación de una cantidad de aire conteniendo 1 mol de gas, mezclando nitrógeno y oxígeno. El aire puede tomarse como constituido del 80% de nitrógeno y 20% de oxígeno por volumen Datos: n aire = 1 mol 80% N2 20 % O2 ∆S = ? Fig. 7-1 Diagrama del Problema Tabla 7-1 Datos Obtenidos GAS N2 O2 ( ( V,L 0,8 0,2 n 0,8 0,2 ) ( ) ( ) X 0,8 0,2 ) ( ) ( ) - 224 - 8.8. Teóricamente, A qué altura puede levantar un galón de gasolina a un automóvil que pesa 2800 libras contra la fuerza de gravedad, si se supone que la temperatura del cilindro es de 2200 K y la temperatura que se desperdicia es de 1200 K (Densidad de la gasolina = 0,80 g/cm3; 1 lb = 0,2642 gal. Calor de combustión de la gasolina = 11200 cal/ g) Datos: h=? V = 1 gal mc = 2800 lb TH = 2200 K g= 9,8 m/s2 TL = 1200 K ρ gasolina = 0,8 g/cm3 PC gasolina = 11200 cal /Gb Fig. 8-1 Diagrama del Problema 1 lb = 453,6 g 1 pie = 30,8 cm 1 L = 0,2642 gal ( ) - 225 - ( ) - 226 - 8.9. Empleando las entropías atómica y molecular de la tabla II, calcular ∆S para las siguientes reacciones a 25°: a) Σ Σ Σ Σ Σ Σ Σ Σ b) c) d) - 227 - 8.10. Cuando se contrae el hule, el trabajo mecánico que se obtienen es igual a la fuerza q regula el desplazamiento en la dirección por la fuerza y esta dado por , en donde f es la fuerza y L es la longitud de la pieza de hule. Si la contracción se lleva a cabo reversiblemente, la primera ley puede escribirse Si se desprecia el trabajo volumen-presión. Demostrar que (b) (a) (a) ( ) ( ) Proceso L=cte y ( ) ( ) (b) ( ) [( ) ] 8.11. Un litro de un gas ideal a 300°K tiene una presión inicial de 15 atm y se le hace expandir isotérmicamente hasta un volumen de 10 litros. Calcular (a) el trabajo máximo que se puede obtener de esta expansión, (b) ΔU, (c) ΔH. - 228 - P,atm 1 15 (PV=K1)t 2 P2 Lmáx T=300K V,L 1 10 Fig. 11.1: Diagrama P-V V,L P,atm T,K 1 1 15 300 2 10 1.5 300 Estado Etapa L,cal 1a2 836 ΔU,cal 0 ΔH,cal 0 á á á - 229 - 8.12. Un mol de amoniaco (considerando que fuera un gas ideal) inicialmente a 25 ° C y 1 atm de presión, se calienta a una presión constante hasta que el volumen se ha triplicado. Calcular(a) Q, (b) ΔU, (c) ΔH, (d)L, (e) ΔS. Véase la Tabla VI Cap. 4. CpNH3=6.189+7.887×10-3T-7.28×10-7T2 (calmol-1grad-1) V,L P=cte 2 3V1 1 V1 T2 298.15 T, K Fig. 12.1: Diagrama V-T Estado V,L P,atm T,K 1 V1 1 298.15 2 3V1 1 894.45 ( Etapa ) Q,cal L,cal ΔU,cal ΔH,cal ΔΔS,calmol1 1a2 6323 1185 5138 6323 K-1 11.24 (a) - 230 - ∫ ∫ (b) ∫ ∫ ∫ ∫ ∫ ∫ (e) - 231 - ∫ ∫ 8.13. Calcular el aumento en la entropía del nitrógeno cuando se calienta de 25 a 1000º, (a) a una presión constante y (b) a un volumen constante a) a volumen constante ( b) ) a presión constante ( ) - 232 - 8.14. Calcular la diferencia de entropía entre un mol de agua líquida a 25 ° C y un mol de vapor de agua a 100 ° C y 1 atm. El calor especifico promedio del agua líquida puede tomarse como 1 cal grad-1g-1, y el calor de vaporización de 540 cal g-1. Δ Δ Δ Δ Δ 8.15. Se añaden 150 gramos de helio a un kilogramo de agua a 25° y en un sistema aislado. Calcular el cambio de entropía si el calor de fusión es de 1435 cal mol-1 y Cp= 18 cal mol-1 grad-1 para el agua líquida. - 233 - 8.16. Calcular el cambio de entropía de una mol de helio que experimenta una expansión adiabática reversible de 25º a 1 atm a una presión final de ½ atm a) Cálculo de b) Cálculo de la temperatura final: - 234 - c) Calculo de ̃ ( ) ( ) Con el valor de la variación de entropía se afirma que en un proceso adiabático reversible el valor de la misma es cero. 8.17. Un bulbo de 1 litro de capacidad que contiene nitrógeno a 1 atm de presión y a 25C, está conectado a otro bulbo de 3 litro que contiene bióxido de carbono a 2 atm de presión por medio de un tubo con una espita. Se abre ésta y los gases se mezclan hasta que se alcanza el equilibrio. Suponiendo que ambos gases son iguales, Cuál es el cambio de entropía para este cambio espontáneo? Datos: V1= 1 L P1= 1 atm T = cte = 298,15 K V2 = 3 L P2 = 2 atm Fig.17-1 Diagrama del Proceso - 235 - Tabla 17-1 Datos Obtenidos GAS N2 CO2 ( V,L 1 3 4 ) ( n 0,041 0,245 0,286 ( ) ( X 0,14 0,86 1,00 P 0,245 1,505 1,75 ) ) ( ) ( ) 8.18. Calcular la eficiencia teórica máxima con la cual el calor puede convertirse en trabajo en las siguientes turbinas hipotéticas: (a) vapor a 100º con salida a 140º; (b) vapor de mercurio a 360º con salida a 140º; (c) vapor a 400º y salida a 150º; (d) aire a 800º y salida a 400º; (e) aire a 1000º y salida a 400º, empleándose aleaciones especiales; (f) helio a 1500º y salida a 400º utilizándose el calor de la energía atómica - 236 - a) b) c) d) - 237 - e) f) 8.19. Calcular los cambios de entropía para las siguientes reacciones a 25°: a) Σ Σ Σ Σ Σ Σ b) c) - 238 - 8.20. Empleando las leyes primera y segunda combinadas, de la termodinámica, demostrar que ̅ implica a ( ̅ ̅ T= 0 (a) demostrar que para el proceso reversible a temperatura constante ̅ ̅ ̅ ̅ (b) Complete la prueba usando una de las relaciones de Maxwell ̅ ̅ (1) (2) Reemplazo (2) en (1) Dividimos para y tenemos: (3) (b) Por relación de Maxwell tenemos: ( ) ( ) ̃ ̃ Derivando tenemos: - 239 - ) ( ̅ Reemplazando en la Ecuación (3) tenemos: ̅ ̅ ( ) ̅ ̅ ̅ ̅ ̅ 8.21. La mitad de un mol de un gas ideal monoatómico inicialmente a 25ºC y ocupando un volumen de 2lt, se le hace expandir adiabáticamente y reversiblemente a una presión de 1 atm. El gas es luego comprimido isotérmicamente y reversiblemente hasta que su volumen es de 2lt a la más baja temperatura. Calcular: a)L b) Q, c) ΔH, d) ΔG, e) ΔS. P 1 P1 3 P2=1at m 2 V1= 2L V2= 5.93L T1=2 98ºK T V Fig. 21-1 Ciclo adiabático reversible - 240 - Tabla 21-1. Respectivas ecuaciones que intervienen en los procesos Etapas Proceso L(J) Q(J) 0 H(J) U(J) S(J/°K) Expansión 1- adiabática 2 reversible 0 Compresión 2- isotérmico 3 reversible ( ) L 0 0 Etapa 1-2 √ √ Trabajando con la ecuación del Ladrev tenemos: - 241 - Trabajando con las ecuaciones de la variación de entalpía y energía interna, ya conocidas tenemos que: Etapa 2-3 ( ) ( ) - 242 - 8.22. Si el volumen específico parcial V en mililitros por gramo es independiente de la concentración, entonces es igual al volumen de la solución menos el volumen del solvente puro que contiene, dividido por el soluto: Donde g es la cantidad del soluto en 100 ml de solución, la solución y es la densidad de es la densidad del solvente. La densidad de una solución de seroalbúmina conteniendo 1,54 gramos de proteínas por 100 ml, es de 1,0004 gcm-3 a 25°.( ). Calcular el volumen específico aparente ( ) 8.23. Una solución de cloruro de magnesio, MgCl2, en agua, conteniendo 41,24 g/L, tiene una densidad de 1,0311 g/cm3 a 20 °. La densidad del agua a esta temperatura es de 0,99823 g/cm3. Calcular (a) el volumen específico parcial, utilizando la ecuación del ejercicio anterior y (b) el volumen molal parcial del MgCl2 Datos: MgCl2 g = 41,24 g/L ρs = 1,031 g/cm3 T = 20 ° C ρo = 0,99823 g/cm3 (a) v = ? - 243 - (b) v molal parcial = ? ̂ ̂ ̂ 8.24. ¿Cuál es el cambio de la entropía cuando 1 mol de vapor de agua se calienta de 300°C a 600°C a presión constante? ΔS=? a P=cte CpH2O=7.1873+2.3733×10-3T+2.084×10-7T2 (calmol-1grad-1) Q= = Cp ΔS= ΔS= ; ΔS =∫ - 244 - ΔS=∫ 2.3733×10-3+2.084×10-7T) ΔS=7.1873 2.3733×10-3(873.15-573.15)+ 2.084×10-7(873.152-573.152) ΔS=3.025+0.712+0.0904 ΔS=3.82 calmol-1K-1 ( )] [ ( ) 8.25. Calcular el cambio en la entropía de un mol de aluminio que se calienta de 600 ° C a 700 ° C. El punto de fusión del aluminio es de 660°C, el calor de fusión es de 94 cal g-1 y las capacidades térmicas del aluminio sólido y del liquido pueden tomarse como 7.6 y 8.2 cal grad-1, respectivamente. Δ ó - 245 - Δ Δ Δ Δ Δ Δ Δ Δ Δ 8.26. Deduzca la expresión para el cambio de entropía de un gas que obedece la ecuación de van der Waals y que se expande de un volumen V1 A V2 a temperatura constante. ΔS=? , para Van der Waals V1────V2 a T=cte ( ) ( ) ( ) ∫ ( ) ∫ ∫ ( ) - 246 - 8.27. Dos bloques del mismo metal tienen igual tamaño pero se encuentran a diferentes temperaturas, T1 y T2. Estos bloques se juntan y se deja que adquieran la misma temperatura. Demostrar que el cambio de entropía esta dado por: T1 T 22 S m * Cp * ln 1 4T1T 2 Solución: Se considera: T1 > T2 Q i 0 (1) Q1 m1 * Cp1 (T 3 T1) (2) Q2 m2 * Cp 2 (T 3 T 2) (3) (2) y (3) en (1) m1 * Cp1 (T 3 T1) m2 * Cp 2 (T 3 T 2) 0 m1 * Cp1 m2 * Cp 2 (por tratarse del mismo metal) m * Cp(T 3 T 2 T 3 T1) 0 2T3 T1 T 2 T3 T1 T 2 (4) 2 dS dS1 dS2 (5) dT dT S m1 * Cp1 m2 * Cp 2 T T T1 T2 T3 T3 - 247 - S m1 * Cp1 * ln T3 T3 m2 * Cp 2 * ln T1 T2 S m1 * Cp1 * ln T1 T 2 T1 T 2 m2 * Cp 2 * ln 2T1 2T 2 T1 T 2 T1 T 2 S m * Cp * ln 2T1 2T 2 T1 T 22 S m * Cp * ln 4T1T 2 T1 T 2 2 2 S m * Cp * ln T1T 2 T1 T 22 4T1T 2 S m * Cp * ln 4T1T 2 T1 T 22 S m * Cp * ln 1 4T1T 2 T1 debe ser mayor a T2 para que el proceso sea espontaneo y exista una transferencia de calor en el sistema - 248 - 8.28. a) Calcular el menor trabajo que se tiene que hacer para extraer 100 cal de calor de un baño de hielo a 0°, cuando los alrededores se encuentran a 25°. b) ¿Qué cantidad de calor a 25° se podría obtener del baño de hielo al gastar 10 cal de trabajo en un proceso reversible? a) Asumimos una eficiencia del 100% Fig. 28-1 Diagrama del Proceso b) Fig. 28-2 Diagrama del Proceso Asumimos una eficiencia del 100% - 249 - 8.29. Calcular los cambios de entropía para las siguientes reacciones a 25°: a) Σ Σ Σ Σ Σ Σ b) c) - 250 - 8.30. Un recipiente de 2 litros a 0º contiene sulfuro de hidrógeno (suponiendo que es un gas de ideal) a 1 atm de presión. Se calienta el gas a 100º, permaneciendo la presión externa de 1 atm. Calcular a) el calor absorbido, b)el trabajo efectuado, c) ∆U, d) ∆H, e) ΔS Para el sulfuro de hidrogeno, Cp=7.15+0.00332T cal/( ºK) d) ∫ ∫ a) e) ∫ ∫ b) c) - 251 - INTRODUCCION A LA SEGUNDA LEY DE LA TERMODINAMICA FISICOQUIMICA GILBERT CASTELLAN 9-1. a) Considere una máquina imposible, que conectada a una única fuente de calor, produce trabajo neto en el medio ambiente. Acoplar esta máquina imposible a una ordinaria de Carnot para obtener el ―horno refrigerador‖. b) Acoplar el horno refrigerador a una de Carnot ordinaria de tal manera que se produzca trabajo en un ciclo isotérmico. SOLUCION: (KP) Kelvin-Plank; toda transformación cíclica, cuyo único resultado final sea el de absorber calor de una sola fuente térmica a una temperatura dada y convertirlo íntegramente en trabajo, es imposible. Clausius; toda transformación cíclica, cuyo único resultado final sea el de extraer calor de un cuerpo frio para transferirlo a uno caliente, es imposible. a) La maquina viola en principio de Kelvin-Plank, es posible y se pide acoplar a una de Carnot para crear el ―horno refrigerador‖, que viola el enunciado de Clausius. T1 Q1 ~K P W1 - 252 - Representamos el refrigerador de Carnot, con una entrada de trabajo igual a W1 T1 Q1 R W1 Q2 T2 Acoplando las dos maquinas tenemos: T1 Q*1 Q1 ~KP R W1 Q2 T2 Que se puede simplificar como: T1 Q1 ~C W=0 Q2 T2 - 253 - Donde se puede observar que el sistema con frontera puenteada tiene W=0 ―horno-refrigerador‖ b) Partiendo de la hipótesis de que una maquina que viola el principio de Clausius existe, se nos pide acoplarla a una maquina de Carnot (M) para obtener una maquina isotérmica que produzca trabajo. T1 Q1 Q1 ~C M W Q2 Q2 T2 La maquina rodeada por la frontera punteada es entonces una donde se toma calor (Q1-Q2) de una sola fuente a T1 para producir únicamente trabajo en un ciclo isotérmico. Se comprueba que: 9-2. ¿Cuál es la máxima eficiencia de una maquina térmica que tiene como fuente caliente agua bajo presión en ebullición a 125ºC y una fuente fría a 25ºC.? - 254 - Datos: TH=125ºC => (125 + 273.15) = 398.15 K TL=25ºC=> (25 +273.15) = 298.15 K Se sustituye las temperaturas absolutas. La eficiencia no depende del material utilizado en el ciclo sino solo de la diferencia de temperaturas de las fuentes. 9-3. Un refrigerador es acondicionado a un motor de ¼ de Hp (1Hp= 10.688 Kcal/min). Si el interior de la caja debe estar a -20C, encontrar de una temperatura exterior máxima de 35ºC ¿Cuál es la máxima perdida de calor en la caja (cal/min que se puede tolerar si el motor funciona continuamente? Supóngase que el coeficiente de rendimiento es el 75% del valor para una maquina reversible. Datos TH = 308.15K QH E=75 TH=35ºC = 308.15K R TL=-20ºC=253.15K W=2.67 QL=? TL=253.15 - 255 - 9-4. a) Supongamos que se escoge la eficiencia de una maquina reversible como propiedad termométrica para una escala termodinámica de temperatura. La - 256 - fuente fría tiene una temperatura fija. Medir la eficiencia de la maquina con la fuente caliente a 0ºC, temperatura de hielo, y con la fuente caliente a temperatura de vapor 100ºC ¿Cual es la relación entre las temperaturas, t en esta escala y las temperaturas termodinámicas comunes T? b) Supóngase que la fuente caliente tiene una temperatura fija y que definimos la escala de temperatura midiendo la eficiencia con la fuente fría a la temperatura de vapor y a la temperatura de hielo. Hallar la relación entre t y T para este caso. ( Escoge 100º entre temperaturas de vapor y hielo). a) [ ( ( ( )] ) ) b) Ahora la temperatura fija es la de la fuente caliente, que llamaremos t1(T1 en escala absoluta), y la variable será t, la de la fuente fría(T en escala absoluta). - 257 - La ecuación para la eficiencia será: 9-5. a) El helio liquido hierve a 4K y el hidrogeno liquido a 20K. ¿Cuál es la eficiencia de una maquina térmica reversible que opera entre fuentes de calor a estas temperaturas? b) Si queremos obtener la misma eficiencia de (a) para una maquina térmica con fuente fría a temperatura ambiente, 300 º, ¿Cuál debe ser la temperatura de la fuente caliente? SOLUCION a) Datos: TH= 20K TL=4K SOLUCION - 258 - b) 9-6 Considere el siguiente ciclo, utilizando un mol de gas ideal, inicialmente a 25ºC y 1atm de presión. Etapa 1. Expansión isotérmica contra la presión de cero hasta duplicar el volumen (expansión de Joule) Etapa2. Compresión isotérmica reversible a ½ atm a 1 atm. a) Calcular el valor de ∮ , obsérvese que el signo concuerda con (8-40). b) Calcular ΔS para la etapa 2 c) Sabiendo que en el siclo ΔSciclo = 0, hallar ΔS para la etapa 1. d) demostrar ΔS para la etapa 1 es igual a Que para la etapa 1 dividida por T. P, atm P1= 1 P3=1/ 2 P2= SOLUCION V 0 a) La integral ∮ V V2=2V 1 puede escribirse como: - 259 - ∫ ∮ ∫ Para la etapa 1, es un proceso isotérmico. Delate =0 Como es contra una presión de oposición de cero el trabajo W = 0 ∫ ∫ ∫ ∫ ∫ ∮ Es negativo por lo que el ciclo es ireversible. b) Usando la ecuación: En el literal (a) se comprueba: c) Si el ΔSciclo = 0, entonces: d) Sabemos que para la etapa 1: Y el cociente Q/T=0 ya que Q=0 entonces como: - 260 - Resulta que ΔS para la etapa 1 no es igual a Q (etapa 1)/T. 9-7. ¿Cuál es la variación de entropía si la temperatura de un mol de gas ideal aumenta de 100k a 300k, Cv= (3/2)R. a) Si el volumen es constante? b) Si la presión es constante? c) ¿Cuál sería la variación de entropía si se utiliza tres moles en vez de uno? SOLUCION. a) Utilizamos la ecuación de entropía para una mol de gas ideal. ( ) b) Para una mol de sustancia utilizamos la ecuación: Si la presión es constante la ecuación es: Para un gas ideal. - 261 - ( ) ( ) c) La entropía es una propiedad extensiva de los sistemas, así que si el número de moles se triplica esta debe triplicarse. Para los casos de los incisos (a) y (b) tendríamos entonces: V=cte. P=cte. 9-8. Un sólido monoatómico tiene una capacidad calorífica Cp=6.2 cal K-1mol1 .Calcular el aumento de entropía de un mol de este sólido si la temperatura aumente, a presión constante de 300 K a 500 K. ( ) 9-9. Un mol de un gas ideal, Cv=(3/2)R, se lleva desde 0ºC y 2atm a -40ºC y 0.4 atm. Calcular ΔS para este cambio de estado. - 262 - ( ) ( ) 9-10. Un mol de un gas ideal se expande isotérmicamente hasta duplicar su volumen inicial. a) Calcular ΔS. b) ¿Cuál sería el valor de ΔS si se duplicarían isotérmicamente cinco moles de un gas ideal? SOLUCION ( ) ( ) Para n= 5, puesto que S es una variable extensiva. 9-11 ¿Cuál es la variación de entropía si un mol de agua se calienta a presión constante desde 0°C hasta 100°C; Cp = 18 cal/K.mol? Datos: - 263 - n= 1mol; Cp=18 cal/Kmol P=cte. ; Qp=∆H T1=273K T2=373K Ec. 9.5-1 Si la presión es constante, entonces ( ) b) La temperatura de fusión es 0°C y el calor de fusión es 1,4363 kcal/mol. La temperatura de ebullición es 100°C y el calor de vaporización 9,7171 - 264 - kcal/mol. Calcular ∆S para la transformación hielo (0 C, 1 atm) →vapor (100°C, 1 atm). Se realiza en tres etapas que son: 1) Hielo(0°C)---líquido(0°C) Ec. 9.5-2 2) líquido(0°C)---líquido(100°C) Ec. 9.5-3 A presión constante, entonces ( ) 3) líquido(100°C)---vapor(100°C) Ec. 9.5-4 - 265 - Entonces la ∆S para toda la transformación es: ∆S= ∆S1 + ∆S2+ ∆S3 Ec. 9.5-5 ∆S= + ∆S= 36,92 9-12. Si en la temperatura de ebullición, 35°C, el calor de vaporización del MoF6 es 6 Kcal/mol, calcular ∆Svap. T= 35°C + 273 = 308K Ec. 9.6-1 9-13. a) A la temperatura de transición 95.4°C, el calor de transición de azufre rómbico a monoclínico es 0,09 kcal/mol. ¿Cuál es la entropía de transición? - 266 - S0 (rómbico-monoclínico) T= 95.4°C + 273.15 = 368.5K T=Te= 308K Ec. 9.7-1 b) En la temperatura de fusión, 119°C, el calor de fusión del azufre monoclínico es 0,293 kcal/mol. Calcular la entropía de fusión. Tf= 119°C= 392K ∆Hf= 0,293 kcal/mol Ec. 9.7-2 c) Los valores dados en a) y b) son para un mol de S, o sea para 32g; sin embargo la molécula en el azufre cristalino y líquido es S8. Calcular los valores correspondientes dados para S8. Los valores resultantes son más - 267 - representativos que las magnitudes comunes para las entropías de fusión y transición. ∆S Y ∆Sf para S8 , entonces: S=32g = 1mol S8= 8 mol de S 9-14. Un mol de hidrogeno gaseoso es calentado a presión constante desde 300°K hasta 500°K. Calcular la variación de entropía para esta transformación, basado en los datos de las capacidades caloríficas de la tabla. Cp= cal/mol.k n= 1mol H2 (g) P=cte. T1=300K T2=500K dS = ∫ ∫ Ec. 9.8-1 ∫ =∫ - 268 - ∫ =∫ ∆S= 6, 9469 ln ∆S= 6, 9469 ln ∆S= 3,547 cal/mol.K 9-15. Un mol de gas ideal, inicialmente a 25°C, se expande: Calcular ∆U, ∆S, Q Y L para a) y b). Obsérvese la relación entre ∆S y Q en a) y en b). a) Isotérmica y reversiblemente desde 20 a 40 l/mol b) T1= 25°C=298K ∆U=Q-L Ec.9.9- 1 Por ser una expansión isotérmica ∆U=0 Q=L L=nRT ln Ec.9.9- 2 - 269 - L=1mol (8, 314 ln L=1718 J L= Q=1718 J Ec. 9.9-3 Por ser una expansión isotérmica 5,76 c) Isotérmica e irreversiblemente, contra una presión de oposición cero (expansión de Joule), desde 20 a 40 l/mol. Pop= 0 (expansión Joule) Por ser una expansión isotérmica irreversible ∆U=0 - 270 - L=Pop. ∆V; donde Pop= 0 Ec.9.9- 3 Entonces, L= 0 ∆U=Q-L Por lo tanto, Q=0 ∆S Por ser proceso irreversible satisface la desigualdad de Clausius ∆S 9-16. a) Un mol de gas ideal, Cv=3/2R, se expande adiabática y reversiblemente; estado inicial 300K, 1 atm; estado final 0,5 atm. Calcular ∆U, ∆S, Q Y L. Para cálculo de T2 por proceso adiabático reversible-Relaciones de Poisson Ec.9.10-1 Donde ; entonces - 271 - T2=T1 T2=300K T2 = 227.7 K U =Q-L Por ser proceso adiabático Q=0 ∆U= -L ∆U= nCv∆T ∆U= 1mol*( )*(227,7-300)K ∆U= -901,65 J Por lo tanto L= 901,65J ∆S= Donde Q=0 por ser adiabático, entonces ∆S= 0 - 272 - b) El mismo gas, inicialmente a 300K y 1 atm. Se expande adiabáticamente contra una presión de oposición constante igual a la presión final, 0.5 atm. Calcular Q, L, ∆U Y ∆S. T1= 300K P1= 1atm Por ser un proceso adiabático irreversible T2= Ec.9.10-4 T2= T2= 240K ∆U= Q- L Si Q=0, entonces ∆U=-L L= Pop.∆V Ec.9.10-5 - 273 - L=P2 (V2-V1) L=P2nR L=0,5atm*1mol*8,314 * L=748,26 J Para un proceso adiabático donde dQ= 0 ∆U=-748,26 J ∆S= Ec.9.10-6 ∆S=0 9-17. Del os datos del grafito: S°298= 1, 3609 cal/mol.K Cp = -1,265 + 14,008*10-3 T – 103, 31*10-7 T2 + 2,751*10-9 T3. Cal/mol.K Calcular la entropía molar del grafito a 1500°K. ∆H a P constante=Qp Donde dQ= CpdT ∫ =∫ Ec.9.11-1 ∫ =∫ ∫ =∫ ( – ) - 274 - ∆S=-1,265ln + ( ) ∆S= -1,265 ln ( ) ∆S= 6,69 cal/mol.K + ∆S = Ec. 9.11-2 = 1,3609 cal/mol.K + 6,69 cal/mol.K = 8,06 cal/mol.K 9-18. En el límite, T= 0°K, se sabe empíricamente que el coeficiente de expansión térmica de los sólidos, α→0. Demostrar que, como consecuencia, la entropía es independiente de la presión a 0°K, de tal manera que no son necesarias las especificaciones relativas a la presión en la formulación de la tercera ley. α= ( α ) Mediante la relación de Maxwell tenemos: ( ) ( ) Entonces podemos demostrar que ( α ) Como α→0 cuando T→0 K, entonces ( ) - 275 - 9-19. Para agua líquida a 25 ºC, α=2.0 *10-4 grad-1 ,se puede tomar la densidad como un gramo/ cc. Se comprime isotérmicamente un mol de agua a 25 ºC desde 1 atm hasta 1000 atm, Calcular ΔS. a) Suponiendo que el agua es incompresible, esto es β=0. b) Suponiendo que β=4.53 *10 -5 atm-1. Resolución de a) α= si p α= T Vα= T Vα∫ T P = ∫ VαΔP=-ΔS ΔS=-Vα (P2-P1) Como: δH2O= V= y V= =18 cc/mol ΔS=-Vα (P2-P1) - 276 - ΔS=-(0.018L/mol)*(2.0 *10-4K-1)*(1000-1) atm =-3.59*10-3 =-0.3643 Resolución de b Si: V Y V= T T ∫ ΔV =ΔS ∫ ΔS= (V2-V1) =- T V= ∫ T = ∫ - ΔP=Ln Ln V2 =Ln V1 - ΔP Ln V2 =Ln V1 - (P2-P1) Ln V2 = Ln 18 – ((4.53*10-5) atm-1*(1000-1) atm) Ln V2=2.845 V2= V2 =17.20 - 277 - ΔS= (V2-V1) ΔS= (17.20-18) *(2.0*10-4/4.53*10-5) = -3.53*10-3 =-0.3578 =-0.0856 9-20.Para el cobre a 25 ºC,α=0.492 *10-4 grad-1 y β=0.78 *10 -6atm-1. La densidad es 8.92 g/cc. Calcular para la compresión isotérmica de un mol de cobre desde 1 atm hasta 1000atm bajo las dos mismas condiciones del problema anterior. Resolución a Como: δcu= y =7.123 cc/mol V= α= si p α= T Vα= p Vα∫ c=-ΔS V= T P = ∫ - 278 - ΔS=-Vα (P2-P1) ΔS=-(7.123*10-3L/mol)*(0.492 *10-4K-1)*(1000-1)atm =-0.35*10-3 =-0.3 =-8.48*10-3 Resolución de b =- T V= ∫ T = ∫ - ΔP=Ln Ln V2 =Ln V1 - ΔP Ln V2 =Ln V1 - (P2-P1) Ln V2 = Ln 7.12 – ((0.78*10-6) atm-1*(1000-1) atm) Ln V2=1.962 V2= V2 =7.117 Si: V Y V= T T ∫ ΔV =ΔS ∫ ΔS= (V2-V1) ΔS= (7.117-7.123) *(0.492*10-4/0.78*10-6) =-0.3784*10-3 =-0.038 =-9.1727*10-3 - 279 - 9-21. Demostrar que T= P α= Ecuación 1 p p= Ecuación 2 Ecuación 2 en Ecuación 1 α=T=-nR/P =- 2 V Ecuación 4 T T=- Ecuación 3 nRT/P2V Ecuación 5 Ecuación 5 en Ecuación 4 =nRT/VP2 P=nR/P 2 Ecuación 6 Igualando la ecuación 6 con la ecuación 3 tenemos que: T= P - 280 - 9-22. Considere la expresión dS = dT - VαdP Supóngase que para el agua β=4.53 *10 -5 atm-1, V=18cc /mol CP= 18 calorías/ k mol y α=2.0 *10-4 grad-1, calcular la disminución de temperatura que ocurre si el agua a 25ºC y 1000 atm de presión es llevada reversible y adiabáticamente a 1 atm de presión Por ser adiabático el dS es igual a cero dS = y Q= (CONSTANTE) dQ=0 Por lo que la expresión nos queda dT= VαdP Calculamos T2 =Vα∫ ∫ =VαΔP LnT2=VαΔP/ + LnT1 LnT2= LnT2=5.69K T2= T2=296, 56 K ΔT=T2–T1 ΔT= (298.15-296.56) K ΔT=1.588k - 281 - ENERGIAS LIBRES FISICOQUIMICA FARRINGTON DANIELS 10-1. Calcular los cambios de energía libre de Gibbs a 25°, para las reacciones del problema 10, cuando las sustancias reaccionantes se encuentran en su estado normal, usando los datos de formación de la entalpía de la tabla II Datos: (∆S, en ) Elementos y compuestos Fuente: Daniels (∆H, en ) Elementos y compuestos Fuente: Daniels (Ec. 1-1) - 282 - ΔS=-39.0025*10-3KcalK-1 (Ec. 1-2) ΔH= -68.317Kcal (Ec. 1-3) ΔG= -56.69 Kcal (Ec. 1-4) ΔS= 4.7373*10-3 KcalK-1 (Ec. 1-5) ΔG= -44.01Kcal (Ec. 1-6) ΔG= -45.425 Kcal (Ec. 1-7) - 283 - ΔS= -4.879*10-3 kcalk-1 (Ec. 1-8) ΔH= 10.05 Kcal (Ec. 1-9) ΔG= 11.51 Kcal d) (Ec. 1-10) ΔG= -38.7*10-3KcalK-1 (Ec. 1-11) ΔH= -39.131 Kcal (Ec. 1-12) - 284 - ΔG= -27.59 Kcal 10-2. Cuando se contrae hule, el trabajo mecánico que se obtiene es igual a la fuerza que regula el desplazamiento en la dirección de la fuerza y está dado por , donde P es la fuerza y es la longitud de la pieza de hule. Si la contracción se lleva a cabo reversiblemente, la primera ley puede escribirse: + T (Ec. 2-1) Si se desprecia el trabajo volumen – presión (a) demostrar que: (Ec. 2.2) + T T = cte (1) (2) (2) en (1) T (÷ ) T ( ) [( (3) (4) ) ] (b) Utilizando el principio de que el orden de diferenciación empleado para obtener es inmaterial, demostrar que -T (Ec. 2-3) T (1) Relación de Maxwell - (2) - 285 - (2) en (1) - T 10-3. Se hace expandir una mol de un gas ideal reversible e isotérmicamente (25°) de una presión de 1 atm a otra de 0.1 atm (a) ¿Cuál es el cambio en la energía libre de Gibbs? (b) ¿Cuál sería el cambio en energía libre de Gibbs si el proceso ocurriese irreversiblemente? Datos: P1= 1atm P2= 0.1 atm T= 298.15 °K P 1 1 2 0.1 T=cte. V V1 V2 Gráfico 3-1: Diagrama P-V 1) (Ec. 3- (1) PV= nR (Ec. 3-2) V= (nRT) / P (2) (2) en (1) ∫ ∫ - 286 - ( ) ΔG= -1363 cal (b) P 1 1 Irreversible 2 0.1 T=cte. V1 V V2 (Ec. 3-3) Gráfico 3-2: Diagrama P-V (1) -2 (2) (Ec. 3-4) (2) en (1) (3) ΔG= -1363 cal ( ) - 287 - 10-4. Las presiones de vapor del agua y del hielo a – 5° son de 3.163 y 3.013 mm , respectivamente. Calcular para la transformación del agua en hielo a -5°. Datos: P1= 3.163mm atm P2=3.013mm atm Gráfico 4- 1: Diagrama P-V (Ec. 4-1) (1) PV= nR V= (nRT) / P (2) (2) en (1) ∫ ∫ ( ) ΔG= -26.24 cal - 288 - 10-5. (a) Calcular el trabajo efectuado contra la atmósfera, cuando 1 mol de tolueno se evapora en su punto de ebullición, 111°. El calor de evaporización de 1 mol, calcule (b) q , (c) , (d) , (e) , (f) Datos: T= 384.15 n= 1mol (a) L= nRT L = 1 mol (1.986 cal (Ec. 5-1) ) (384.15) K L =763 cal (b) y (c) (Ec. 5-2) ΔH= 7958 cal (d) (Ec. 5-3) ΔU= 7196 calmol-1 (e) (Ec. 5-4) ΔG= 0 (f) (Ec. 5-5) ΔS= 20.7 calk-1mol-1 - 289 - 10-6. Un litro de un gas ideal a 300 K tiene una presión inicial de 15atm y se le hace expandir isotérmicamente hasta un volumen de 10 litros. Calcular (a) el trabajo máximo que se puede obtener de esta expansión, (b) ΔĒ, (c) Δ ̅ , (d) Δ ̅ , (e) Δ ̅ DatosProceso isotérmico m3 V1=1 L = 1 ΔU= Q – L T= 300 K (Ec. 6-1) P1=15 atm = 1519875 PaΔU= 0 V2=10 L = m3 R = 0.082 = 8.314 Q=L 1 2 Gráfico 6-1: Diagrama P-V expansión isoterma (a) PV = nRT (Ec. 6-2) n= n = 0.61mol L = nRT (Ec. 6-3) - 290 - L = 3502.9 J L = 836.61 cal. ΔU= ΔĒ = nCvΔT (b) (Ec. 6-4) ΔT= 0 ΔĒ = (c) Δ ̅ = nCpΔT (Ec. 6-5) ΔT= 0 Δ ̅ =0 (d) = Δ ̅ = nRT (Ec. 6-6) Δ ̅ = (0.61) (8.314) (300) Δ ̅ = - 3502.9 J Δ ̅ = - 836.61 cal. (e) Δ ̅ = - Lmax(Ec. 6-7) Δ ̅ = - 836.61 cal. - 291 - 10-7.- Un mol de amoniaco (considerando que fuera un gas ideal) inicialmente a 25 C y 1 atm de presión, se calienta hasta que el volumen se ha triplicado. Calcular (a) q, (b) L, (c) Δ ̅ , (d) ΔĒ, (e) Δ̅. DatosProceso isobárico n = 1mol NH3 V1= V1 ΔU= Q – L (Ec. 7-1) V2= 3 V1nCvΔT = nCpΔT - PΔV T1 = 298 K P1=1 atm = 101325 Pa Tabla 7-1: Cp= Ecuacion: :Cp = (a + b Sustancia a, J NH3 29,75 (X) T+c b )J ,J c J 25,10 , -1,55 Grafico 7-1: Diagrama P-V expansión isobárica (a) V1= (Ec. 7-2) V1= V1= 24.44 L V2= 73.32 L - 292 - T2 = (Ec. 7-3) T2 = T2 = 894 K Qp= nCp T NH3: Cp = 29.75 + 25.10 (Ec. 7-4) T - 1.55 Qp = ∫ Qp = 26300 J Qp = 6283 cal. (b) L = PΔV (Ec. 7-5) L = (101325) (73.32 - 24.44) L = 4952.77 J L = 1183.23 cal. (c) . Δ ̅ = Qp (Ec. 7-6) Δ ̅ = 6283 cal (d)ΔĒ = ΔU= Q – L (Ec. 7-7) ΔĒ = 6283 - 1183.23 ΔĒ = 5100 cal. (e) Δ ̅ = ∫ Δ ̅=∫ (Ec. 7-8) - 293 - Δ ̅ = 29.75∫ ∫ + 25.10 - 1.55 ∫ Δ̅ = 46.87 J Δ ̅ = 11.20 cal. 10-8.- Calcular la eficiencia teórica máxima con la cual el calor puede convertirse en trabajo en las siguientes turbinas hipotéticas: (a) vapor a 100 C con salida a 40 C; (b) vapor de mercurio a 360 C con salida a 140 C; (c) vapor a 400 C y salida a150 C; (d) aire a 800 C y salida a 400 C; (e) aire a 1000 C y salida a 400 C, empleándose aleaciones especiales; (f) helio a 1500 C y salida a 400 C utilizándose el calor de la energía atómica. Según el principio de Carnot “una máquina perfecta que trabaja reversiblemente dentro de los limites de temperatura T2 y T1 tiene la misma eficiencia termodinámica sin que importe la naturaleza de la sustancia que realice trabajo” % % (a) (Ec. 8-1) TH = 373 K TL = 313 K % (b) 16 % TH = 633 K TL = 413 K % 35 % (c) TH = 673 K TL = 423 K - 294 - % (d) 37 % TH = 1073 K TL = 673 K % (e) ( 37 % ) TH = 1273 K TL = 673 K % (f) 47 % TH = 1773 K TL = 673 K % 62 % 9.- Empleando las leyes de la primera y segunda combinadas, de la termodinámica, demostrar, P ̅ = RT implica a ( Ē⁄ ̅ )T = 0. (a) demostrar que para el proceso reversible a temperatura constante Ē ̅ T =T ̅ ̅ T –P (b) complete la prueba usando una de las relaciones de Maxwell ̅ V = ̅ ̅ T. - 295 - La derivada ( Ē⁄ ̅ )T se denomina presión interna que es de magnitud apreciable para los líquidos y sólidos porque la energía de cohesión entre las moléculas es alta. En cambio, para los gases tiene un valor ínfimo, entonces para un gas ideal que sus partículas tienen nula interacción, se sigue que ( ̅–P ̅ (a) Ē ̅ T =T ̅ – P ̅ )* ( ) ̅ ̅ ̅ T –P (b) P ̅ = RT ̅ V ̅ V (Ec. 9-1) ⁄ ̅ )T = 0. (Ec. 9-2) ̅ = ̅ T. ̅ ̅ T = = ̅ Sustituyendo tenemos ̅ T Pero; =T̅–P ̅ Entonces; Ē ̅ T =P–P=0 10.- Demostrar que (a) (b) (a) ̅ V ̅ S = = ̅ ̅ P T ̅–P ̅ (Ec. 10-1) - 296 - ( ̅ V =T ̅ – P ̅ )*( ̅+V ( ̅ = ̅ P ̅+V ̅ V (Ec. 10-2) )*( ̅ P T T=T ̅ V = ̅ ̅ P (a) ( ̅ S =V ̅+V )*( (Ec. 10-3) ̅ S +V ( +V T ̅+V =V (Ec. 10-4) )*( ̅ T V=V ̅ S = T - 297 - 10-11.- Dos moles de un gas ideal se comprime isotérmicamente de 1 a 5 atm a 100º. (a) ¿Cuál es el cambio de energía libre de Gibbs? (b) ¿Cuál hubiera sido el cambio de la energía libre de Gibbs si la compresión se hubiera efectuado a 0º? P P2 P1 T=cte. Datos V2 V1 V n= 2moles P1= 1 atm P2= 5 atm Grafico 11-1: Diagrama P-V de compresión isotérmica. a) T= 100ºC=373.15= cte. (Ec. 11-1) ΔG= 9986.14 J b) T=0ºC=273.15 (Ec. 11-2) ΔG= 7369.96 J - 298 - 10-12.- A 50º, la presión parcial de H2O (g) en e l CuSO4. H2O (s) es de 4.5 mmHg y en el CuSO4. 5H2O (s) es de 47 mmHg. Calcular el cambio de la energía libre de Gibbs para la reacción: CuSO4. 5H2O (s)= CuSO4. H2O (s) + 4H2O (g) Datos T= 50ºC = 323.15 K = cte. Pagua=4.5 mmHg P CuSO4. 5H2O= 47 mmHg Como t=cte. ( [ [ ] ] ) [ (Ec. 12-1) ] (Ec. 12-2) 10-13.- El calor de vaporización de oxigeno liquido a 1 atm es de 1630 cal .mol -1 en su punto de ebullición, -1831 C. para la evaporación reversible de 1 mol, de oxigeno liquido calcular (a) Q, (b) , (c) , y (d) . Datos P= 1 atm Hv= 1630 cal.mol-1 T eb= -183 ºC=90.15 K (Ec. 13-1) - 299 - Q= 1630 cal Como t= cte. ΔU=0 (Ec. 13-2) ΔS= 18.08 calK-1 (Ec. 13-3) Como T=cte. ΔG= -1630 cal 10-14.-Una mol de un gas ideal en 22.4 L, se hace expandir isotérmica y reversiblemente a 0º a un volumen de 224 L y 1/10 de atm. Calcular (a) L, (b) Q, (c) , (d) , (d) para él gas. Datos n= 1 mol V1= 22.4 L V2= 224 L T= 0ºC= 273.15 K P1= 1/10 atm= 0.1 atm P P1 P2 T=cte. V1 V2 V Grafico 14-1: Diagrama P-V de expansión isotérmica. - 300 - (Ec. 14-1) (Ec. 14-2) L= 5226J Como T= 273.15 K= cte. ΔH= 0 ΔU=0 9986.14 (Ec. 14-3) Como T= cte. [ ] [ ΔS= 19.14 JK-1 10-15. Calcular ] a 25º C para las siguientes reacciones: (a) SO3 (g) =SO2 (g) + ½ O2 (g) (Ec. 15-1) - 301 - (b) CaO(s) + CO2 (g) = CaCO3(s) ∑ ∑ (Ec. 15-2) 10-16. Puede derivarse fácilmente una ecuación para la presión P en función de la altura h en la atmosfera, si se supone que la temperatura T, la aceleración de la gravedad g y el peso molecular del aire M son constantes, la energía libre molar de Gibbs del gas es una función de la presión y de la altura y debe ser la misma en toda la atmósfera de modo que: G G dG dP dh 0 P h h P Demostrar que G Mg h P Entonces que: P P O e Mgh / RT - 302 - 10- 17. Calcular ΔGª para la siguiente reacción: H 2O( g ,25 º C ) H 2O(l ,25 º C ) Si la presión de vapor del agua a 25ºC es de 23,76mmHg Partimos : dG SdT VdP si T cte dT 0 dG S dT 0 VdP dG VdP Sabemos PV nRT V nRT P Re emplazo dG nRT dP P G º nRT ln PV G º 1* 8,31* 298* ln(3,13 10 2 ) G º 8578 J / mol.K - 303 - 10-18.Calcular L y ΔG cuando un mol de agua al estado líquido se evapora en su punto de ebullición de 100ºC a 1 atm y luego se expande en su estado de vapor hasta 50 litros a 100ºC. Grafica 18-1: Diagrama PV para la expansión del agua a las condiciones dadas P 1V1 nRT V1 nRT P1 1* 0,082 * 373 V1 1 V1 30.6 L P2 P 1 * V1 V2 1 * 30,6 P2 50 P 2 0.61a tm L nRT dV V V2 L nRT ln V1 V2 V1 50 L 1 * 8,31* 373* ln 30,6 L 1523J G nRT P2 P1 dP P 0,61 G 1 * 8,31* 373* ln 1 J G 1532 molK - 304 - 10-19. Diez gramos de helio se comprimen isotérmicamente y reversiblemente a 100ºC de una presión de 2 atm a 10 atm. Calcular: Q, L, ΔG, ΔA, ΔH, ΔU, ΔS. Grafico 19-1: Diagrama P-V para la compresión isotérmica del helio n m M 10 n 4 n 2.5moles nRT V P 2,5 * 0,082 * 373 V1 2 V1 38,2 L 2.5 0,082 373 V2 10 V 2 7, 6 L Para procesos isotermi cos U y H son cero 0 U Q L V2 Q L nRT ln V1 7 ,6 Q L 2,5 * 8,31* 373* ln 38,2 Q L 12467,6 J S Q T 12467,6 S 373 S 33,42 J .mol1 K 1 G H 0 TS - 305 - G 373 * ( 33,42) G 12467,6 J mol.K A U TS ; A TS A 12467,6 U 0 J mol.K 10-20. Calcular la presión de equilibrio para la conversión del grafito en diamante a 25 °C. Las densidades del grafito y del diamante pueden tomarse como 2.55 y 31.5 g/cm3, si la variación en la energía de Gibbs durante el cambio de grafito a diamante a 25 °C es de -126cal. C (grafito) G 128 cal * C (diamante) 4,186 J 527.436J 1 cal En el equilibrio : V1 V 2 VT T 1 2 T 2.55 31.5 g 1000cm3 T 534.05 3 * 5640g / L 1L cm G nRT ln P G nRT MG ln P mRT MG ln P VRT ln P P e P e n m M m V MG VRT 12*527.436 34050*8, 31*298 P 1 atm - 306 - ENERGIAS LIBRES TRATADO DE FISICOQUIMICA LUIS ROMO 11-1 mol de gas ideal se comprime isotérmicamente de 1 a 5 atmosferas a 360 K. Calcular ∆G. Datos n= 1 mol P1= 1atm P2= 5 atm T= 360 K R = 0.082 = 8.314 P P2 P1 T = cte. V Δ ̅ = nRT V2 V1 Grafico : Diagrama Δ ̅ = (1) (8.314) (360) P-V Compresión isoterma Δ ̅ = 4817.39 J Δ ̅ = 1150.88 cal. 11-2Asumiendo que el agua es un liquido incomprensible, calcular ∆G para 50 cm3 de agua a 25 °C cuando la presión varia de 1 atmosfera a 100 atmosferas. Datos V1=50 cm3 = 50 L = 50 T= 298 K P1=1 atm = 101325 Pa P2=100 atm = 10132500 Pa ΔG ΔT= 0 m3 +V +V - 307 - ΔG V ΔG = (50 )( 10132500 – 101325) ΔG = 501.56 J ΔG = 119.824 cal. 11-3 Para la reacción: H2O (l,-10°C) = H2O la presión del vapor del H2O (l) a -10°C es 286,5 Pa y la del H2O(s) es 260,0 Pa. Calcular ∆G. a) Una mol de agua se trnsforma a -10 C de liquido a vapor saturado (286,5 Pa). ΔG = 0 ya que las dos fases están en equilibrio. b) El vapor de agua puede expandirse desde 286,5 Pa hasta 260,0 Pa a -10 C ΔG = RT ΔG = (8.314) (263) Δ ̅ = -212.235 J Δ ̅ = - 51 cal. 11-3. La entropía del O2 A 25°C es 205.14 JK -1mol-1 siendo ΔG f= 0, Calcular ΔGf y ΔSf a 100 atmosferas. Datos ΔSfO2 = 205.14 Jmol-1 ΔGf = 0 P= 100 atm ΔGf= ? ΔSf=? (Ec. 4-1) ΔGf= 11415.38 Jmol-1 Δ Δ (Ec. 24-2) Δ - 308 - Δ Δ Δ Δ ΔSf= -3829 JK-1mol-1 11-4. Dada la reacción: 2SO2 (g) + O2 (g) = 2SO3 (g) calcular ΔG y ΔA y determinar la reacción espontánea. Tabla 25-1: Energías libres y entalpías de formación (KJmol-1) SO3 (g) O2 (g) SO2 (g ΔG f -370.4 0 -300.4 ΔH f -395.8 0 -296.8 (Ec. 25-1) Δ Δ Δ Δ ΔG = -140 KJmol-1 (Ec. 5-2) Δ Δ Δ ΔH = -1385.2 KJmol-1 (Ec. 5-3) Δ - 309 - ΔS= -165 KJ mol-1 (Ec. 25-4) ( Δ ) ΔU= 1093.6 KJmol-1 (Ec. 5-5) Δ ΔA= 2479.9 Kmol-1 11-5. Derivar las ecuaciones de Gibbs y Helmholtz a) Ecuación de Gibbs G= G (T, P); (G=G (T)) P G G TdG GdT 1 dG dT d 2 2 T T T T d G 1 G G dT T T T P T 2 G S T P GH siG H TS S T GH G T T P d G G H G dT T P T 2 T 2 T 2 (Ec.6-1) (Ec. 6-2) d G H 2 dT T T H d G 2 T dT T P - 310 - b) Ecuación de Helmholtz A TdA AdT 1 A dT dA T T V T2 T2 A d A 1 A dT T T T P T 2 d A S T V siA U TS S A U T A U A T T V A U A d A dT T P T 2 T 2 T 2 d A U dT T T2 U d A 2 T dT T P (Ec. 6-4) (Ec. 6-5) (Ec. 6-6) PODEMOS ESCRIBIR QUE: G d T H dT T2 dT 1 Si d d T 1 2 T T (Ec. 6-7) 1 d 1 2 dT T T G dT d H 2 T T 1 G d H d ( ) T T - 311 - G 1 d Hd T T G d T H 1 d t G d T H 1 d T Aná log a mente (Ec. 6-8) pa ra Helmholtz A d T U 1 d T (Ec. 6-9) 11-6. Para la reacción: Calcular: ∆H; ∆U; ∆A y ∆G Fuente: Tratado de Fisicoquímica Fuente: Tratado de Fisicoquímica (Ec. 7.1) ∆H= -635.1 (-693.5)-(-1206.9) ∆H=178.3 KJ (Ec. 7.2) - 312 - KJ mol-1 (Ec. 7.3) ( Ec. 7.4) (Ec. 7.5 (Ec. 7.6) 229.9 KJ ), se tienen los siguientes datos: 11-7. Para la reacción: T, °K 100 1000 3000 ∆G , K cal mol -1 27.53 15.55 -13.49 - 313 - Calcular ∆H y ∆S a cada temperatura ⁄ (Ec.8.1) 1∕T ∆G∕T 0.01 0.2753 0.001 0.0155 0.003 -4.496 ∆G∕T ∆H= 28.87 1∕T ∆H= 28.87 (Ec.8.2) ⁄ ⁄ ⁄ - 314 - , Calcular ∆G y ∆A a 11-8. Para la reacción: 25°C Fuente: Tratado de Fisicoquímica Fuente: Tratado de Fisicoquímica Ec 28.1 ) Ec 28.2 Ec 28.3 Ec 28.4 } Ec 28.5 - 315 - ESPONTANIEDAD Y EQUILIBRIO FISICOQUIMICA GILBERT CASTELLAN 12-1.Usando la ecuación de Van der Waals y la ecuación termodinámica de estado para un gas un Van der Waals. calcular Aplicando la ecuación termodinámica de estado: (1) Y la ecuación de Van der Waals: Si se deriva con respecto a la temperatura la ecuación (2) queda: ( ) Sustituyendo en (1) ( ) Y remplazando P según Van der Waals finalmente se obtiene ( ) ( ) 12-2. Por las propiedades puramente matemáticas de la diferencial exacta ( Demostrar que si ) es función solo de volumen, entonces Cv solo es función de la temperatura. - 316 - Tenemos la diferencial exacta: (1) Aplicando la regla de derivadas cruzadas en (1) (2) Dado que g(V) esta en función solamente del volumen tenemos que: ( ) Por lo tanto: ( ) Con lo cual se evidencia que Cv no es función del volumen, solo de la temperatura. 12-3. Mediante integración de la diferencial total dU para un gas de Van der Waals, demostrar que si C, es una constante , donde U´ es una constante de integración (es necesaria la respuesta del problema 10-1.) Sabemos que la diferencial de U es: dU= CdT + dV (1) Utilizando la ecuación: ( ) Remplazando la ecuación (2) en la ecuación (1) dU= CdT + dV Al integrar ∫ ∫ +∫ - 317 - U = CT - + U´ 12-4. Calcular ∆U para la expansión isotérmica de un mol de gas de Van der Waals desde 20 lt/mol hasta 80 lt/mol; si ―a‖ = 1,39 lt2 atm.mol-2 (heptano). Del ejercicio (10-1) obtenemos la ecuación: ∫ ∫ Sustituyendo datos para el Nitrógeno: [ ] 0,05212 Sustituyendo datos para el heptano: [ ] 1,1812 12-5. Integrando la ecuación = - P deducir una expresión para la función trabajo de un gas ideal. La ecuación =-P (1) - 318 - Sabiendo que la ecuación para el gas ideal es: Remplazando (2) en (1) =dV dA ∫ = ∫ = A- ∫ = - RT (ln V- ln RT) = - RT ln V + RT ln RT Sabemos que: A= - RT ln V + RT ln RT A = f (T) – RT ln V Tomando en la ecuación (10-23) el reciproco de ambos miembros, obtenemos ( v= -( s Con esta ecuación y la relación cíclica entre V, T y S demostrar que ( v 12-6. a)Hallar el valor de b) Deducir una expresión para la variación de entropía en la expansión isotérmico de un mol de gas de Van der Waals desde V1 hasta V2. a) De la ecuación fundamental ( ) ( ) - 319 - ( ) ( ) ( ) ( ) b) Para hallar la variación de entropía integrare la ecuación (4) ∫ ∫ Esta ecuación nos dará la variación de entropía para una expansión isotérmica de un gas de Van der Waals. 12-7. Tomando en la ecuación (10-23) el reciproco de ambos miembros, obtenemos . Con esta ecuación y la relación cíclica entre V,T y S demostrar que . Con la relación cíclica de V,T y S tenemos: ( ) ( ) ( Despejando ) tenemos: - 320 - ) ( Hallamos para poder sustituir: De la ecuación (9-44) hallamos ( ) ( ) : Por las relaciones de Maxwell tenemos: ( ) Reemplazando tenemos: ( ) Por las relaciones de Maxwell tenemos: ( ) 12-8. a) Expresar la ecuación termodinámica de estado para una sustancia que cumple con la ley de Joule. Para que una sustancia cumpla la ley de Joule tiene que cumplirse: ( ) Utilizando la ecuación (10-27) tenemos - 321 - ) ( ( ) ) ( Con las relaciones de Maxwell ( ) ( ) Reemplazando: 12-9 En una primera aproximación el factor de compresibilidad del gas de Van der Waals está dado por ( ) Calcular la fugacidad de Van der Waals ∫ ∫ ∫ ∫ ( ) - 322 - 12-10. Por la definición de fugacidad y la ecuación de Gibbs-Helmholtz, demostrar que la entalpia molar Ĥ para un gas real está relacionada con la entalpia molar de un gas ideal Ĥ mediante: Ĥ Ĥ ) ( La ecuación de Gibbs-Helmholtz es: ( ( ⁄ ) ) Para un gas real tenemos: =G (5) Hallando la derivada de G/T con respecto a T tenemos: ( ( ⁄ ) ) ( ) Reemplazando (2) en (8): ( ) Entalpia molar para un gas real. ( ) - 323 - Para un gas ideal tenemos: Derivando: ( ( ( ⁄ ) ) ( ) ) Sustituyendo (16) en (10) ( ) 12-11. Combinando los resultados de los problemas 10-9 y 10-10 demostrar que la entalpia de un gas de Van der Waals es: ( ) Del problema 10-9 tenemos: Derivamos con respecto a T es: - 324 - ) ( Sustituyendo esta expresión en el resultado del problema 10-10 alcanzamos: [ [ ] ] 12-12. a) Demostrar que la ecuación (10-28) Se puede expresar en la forma ) ( ( ) [ ( ( ] ( ) ) ) ( ) ( ) ( ) - 325 - b) Demostrar que la ecuación (10-30) Se puede expresar en la forma ( ) ( ) [ ( ) ( )] ( ( ) ) ( ) ( ) 12.15. Dado Demostrar que V=V(T,P) ( ) ( ) ( ( ) ) - 326 - 12-17. Usando los valores aproximados del factor de compresibilidad dados en el problema 10-9, demostrar que para un gas de van der Waals: a) [ [ ( ( ) ] ( ) ]( ( ) ) ) ( ) - 327 - ( ) ( ( ) ) b) A T=cte ( ( ) ( ) ) - 328 - c) (1a) A P=cte ) ( ( ) 12-18. Sabiendo que , demostrar que: a) T=T(V,P) ( ) ( ) (1) A V=cte - 329 - ( ) ( ) ( ) ( ) ) ( ) ( ( ( ) ) b) T=T(V,P) ( ) ( ) ( ) P=cte ( ( ) ( ) ) - 330 - ) ( ( ) ( ) ( ( ( ( ) ) ) ) c) S=cte. T=T (V, P) (2b) en (3) ( ) ( ( ( ) ) ) - 331 - ( ) ( (1)en (10) ( ( )( ) ) ) - 332 - ANEXOS CAPACIDADES CALORÍFICAS A PRESIÓN CONSTANTE EN FUNCIÓN DE TEMPERATURA Fuente: http://aplicaciones.virtual.unal.edu.co/drupal/files/capacidad.pdf BIBLIOGRAFÍA: - 333 - DANIELS F. ALBERTY R., Fisicoquímica, Traducción de la Segunda Edición en Inglés, Compañía Editorial Continental,S.A., México 22, D.F., 1965 - 334 - INTEGRANTES - 335 -