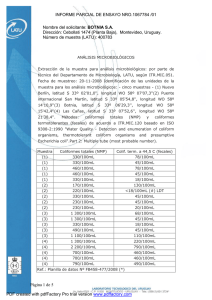
(100ml) (1g)
Anuncio
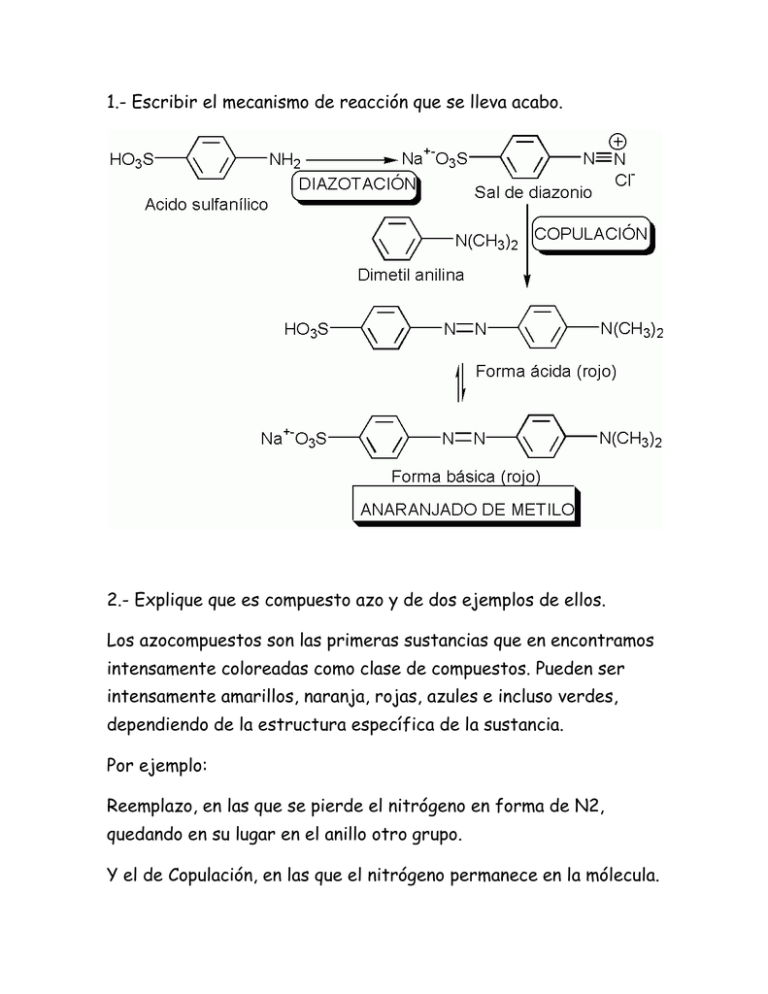
1.- Escribir el mecanismo de reacción que se lleva acabo. 2.- Explique que es compuesto azo y de dos ejemplos de ellos. Los azocompuestos son las primeras sustancias que en encontramos intensamente coloreadas como clase de compuestos. Pueden ser intensamente amarillos, naranja, rojas, azules e incluso verdes, dependiendo de la estructura específica de la sustancia. Por ejemplo: Reemplazo, en las que se pierde el nitrógeno en forma de N2, quedando en su lugar en el anillo otro grupo. Y el de Copulación, en las que el nitrógeno permanece en la mólecula. 3.- ¿Cuales son los usos y aplicaciones del producto obtenido? Por sus colorantes, los azocompuestos son de enorme importancia como colorantes: casi la mitad de los de uso industrial en la actualidad son colores azoicos, como también lo son algunos de los indicadores ácido-base. ANARANJADO DE METILO ROJO PARA UN INDICADOR ÁCIDO-BASE: UN COLORANTE ROJO ROJO EN ÁCIDO, AMARILLO EN BASE 4.- Escriba los cálculos necesarios para preparar las 6 soluciones estándar de NaOH y de HCL con un volumen de 100 ml, necesarias para realizar la síntesis del anaranjado de metilo. Al equipo #6 le toco hacer los cálculos de las soluciones 1 y 3: -solución 1: NaOH 2N 100ml. 1N-- Eq – 1000ml –solución 2: NaOH 1% 100ml 1g--- 100ml 1N—40g – 1000ml x--- 100ml 2N—2(40g)—1000ml x=(100ml) (1g) = 2N—80g—1000ml 1g 100ml x—100ml x=(100ml) (80g) = 8g 1000ml Entonces: -Para la solución 1 se necesitan 8g de NaOH en 2N y -Para la solución 3 se necesitan 1g en 1% 5.- Consultando la bibliografía, haga una lista de las propiedades fisicoquímicas, y el uso y precauciones que se deben tener con los reactivos que se utilizaron en la práctica. ÁCIDO SULFANILICO: para su manejo utilizar guantes protectores, gafas ajustadas de seguridad, no comer, beber ni fumar durante su manejo. Estado físico: cristales Peligros químicos: por combustión de gases tóxicos de carbono, óxidos de nitrógeno y azufre. La sustancia se descompone al calentarla intensamente. Reacciona con oxidantes. Punto de fusión: 288°C Olor: acre Densida relativa(agua=1): 1.5 pH: ácido Solubilidad en agua: escasa Punto de ebullición: 105.47°C AGUA DESTILADA: su descomposición se basa en la unidad de molécula H2O. es aquella molécula a la que se le han eliminado las impurezas e iones mediante destilación. Punto de ebullición: 100°C Punto de fusión: 0°C HIELO: es agua congelada. La forma mas fácil de reconocerlo es por su temperatura. ACIDO CLORHIDRICO: para su manejo usar siempre protección personal. Mantener estrictamente normas de higiene, no fumar ni comer en el sitio de trabajo. Estado físico: liquido humeante incoloro o amarillo claro Almacenamiento: lugares ventilados, frescos y secos, lejos de fuentes de calor, ignición directa de los rayos solares . Color: blanco níveo y frio al tacto Congelación a nivel del mar: 0°C Solubilidad: soluble en agua, alcoholes, éter y benceno. Insoluble en hidrocarburos. Olor: penetrante e irritante Punto de ebullición: 60-105°C Punto de fusión: -66 pH: 0.1 (1N); 2.01 (0.01N) HIDROXIDO DE SODIO:para el amnejo de NaOH es necesario el uso de lentes de seguridad, bata y guantes. Siempre manejarse en una campana y no utilizar lentes de contacto al trabajar con este compuesto. Estado físico: solido Apariencia: blanco en forma de escamas Almacenamiento: lugares ventilados, frescos y secos. Lejos de fuentes de calor. En recipientes no metálicos preferiblemente a nivel del piso. pH: 14( solución 5%) Solibilidad: soluble en agua, alcohol y glicerol Olor: inodoro Punto de fusión: 318°C Punto de ebulicion: 1390°C N,N-dimetilanilina: manejar bajo campana extractora. Almacenarlo en recipientes bien cerrados. En lugar Usos: para uso de laboratorio, análisis, investigación y química fina. fresco. Tiende a oxidarse, cambia ligeramente de color. Aspecto: liquido trasparente e incoloro. Olor: característico Punto de ebullición: 193°C Punto de fusión: 2°C Solubilidad: 1g/l en agua a 20°C Temperatura de auto ignición: 370°C