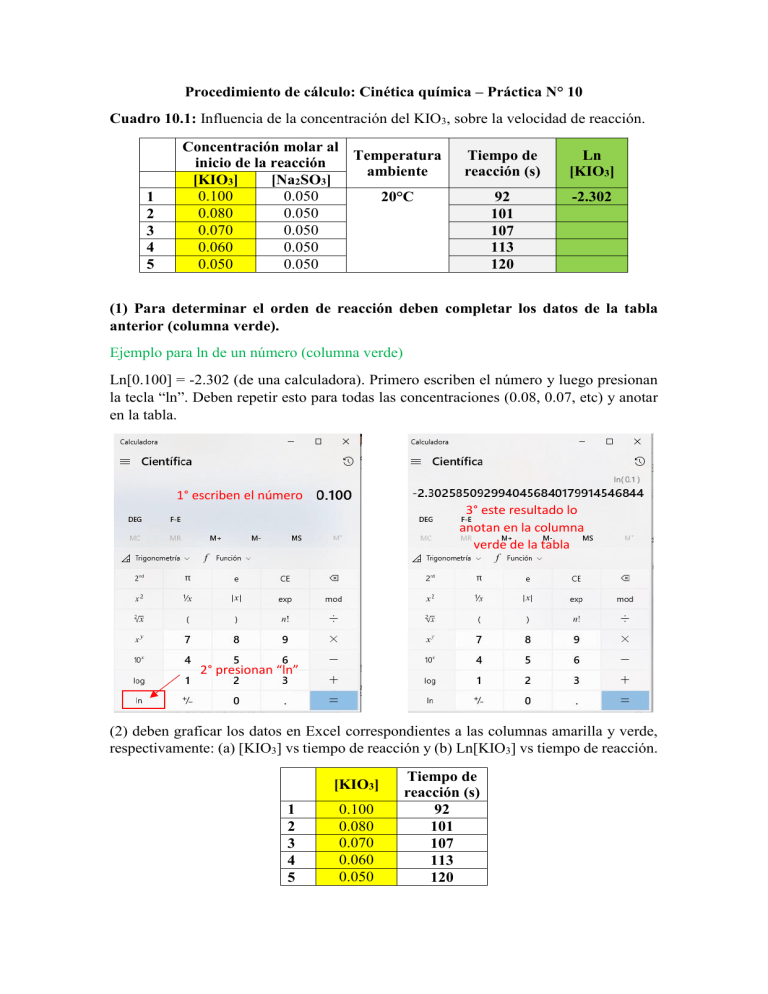
Procedimiento de cálculo: Cinética química – Práctica N° 10 Cuadro 10.1: Influencia de la concentración del KIO3, sobre la velocidad de reacción. 1 2 3 4 5 Concentración molar al Temperatura inicio de la reacción ambiente [KIO3] [Na2SO3] 0.100 0.050 20°C 0.080 0.050 0.070 0.050 0.060 0.050 0.050 0.050 Tiempo de reacción (s) Ln [KIO3] 92 101 107 113 120 -2.302 (1) Para determinar el orden de reacción deben completar los datos de la tabla anterior (columna verde). Ejemplo para ln de un número (columna verde) Ln[0.100] = -2.302 (de una calculadora). Primero escriben el número y luego presionan la tecla “ln”. Deben repetir esto para todas las concentraciones (0.08, 0.07, etc) y anotar en la tabla. 1° escriben el número 3° este resultado lo anotan en la columna verde de la tabla 2° presionan “ln” (2) deben graficar los datos en Excel correspondientes a las columnas amarilla y verde, respectivamente: (a) [KIO3] vs tiempo de reacción y (b) Ln[KIO3] vs tiempo de reacción. [KIO3] 1 2 3 4 5 0.100 0.080 0.070 0.060 0.050 Tiempo de reacción (s) 92 101 107 113 120 Ln [KIO3] 1 2 3 4 5 -2.302 Tiempo de reacción (s) 92 101 107 113 120 Para eso, deben copiar los datos en Excel y luego en la pestaña “INSERTAR”, deben hacer clic en el botón de “Insertar gráficos (X,Y) o burbujas”. 3° clic en la pestaña “INSERTAR” 2° Seleccionan los datos de las columnas que graficarán 4° clic en la pestaña de insertar gráfico de dispersión 1° copian sus datos en excel Les aparecerán los distintos tipos de gráficos. Deben escoger el que diga “Dispersión con líneas suavizadas y marcadores”. Luego hacer clic. 4° clic en la segunda casilla Les aparecerá el gráfico. Pueden manipular el gráfico con los ejes, asignarles nombres y ponerlos más estéticos. Pueden averiguar cómo en youtube (ajustar ejes de gráfico en Excel). DEBEN PEGAR EN SUS INFORMES LOS 2 GRÁFICOS OBTENIDOS EN EXCEL Deben repetir lo mismo para la tabla Ln[KIO3] vs tiempo de reacción. Además deben realizar la regresión lineal de esta última curva y obtener la ecuación de la recta y valor de R2 . Pueden averiguar el procedimiento en el enlace: https://www.youtube.com/watch?v=znzV1cyH5Gs Cuadro 10.2: Efecto de la temperatura sobre la velocidad de reacción del yodato (IO3)1- T 1 T 2 T 3 TEMPERATURA (°C) TEMPERATU RA (K) 30 303.15 CONCENTRACIÓN MOLAR AL INICIO DE LA REACCIÓN TIEMPO DE REACCIÓN (s) [KIO3] 0.100 [Na2SO3] 0.050 139 50 0.100 0.050 90 90 0.100 0.050 45 1° Realice la columna verde. Para transformar la temperatura a K, debe sumar 273.15. Ejemplo: T1 = 30 + 273.15 = 303.15 K 2° Grafique en Excel la temperatura (K) (columna verde) vs el tiempo de reacción (columna amarilla). Luego mostrar la ecuación de regresión exponencial con R2. Explique el comportamiento (puede usar la ecuación de Arrhenius). K = A × e(−E/(R × T))