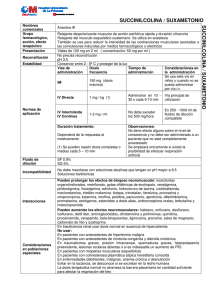
Traducido del inglés al español - www.onlinedoctranslator.com Farmacología de los fármacos bloqueadores neuromusculares y Anticolinesterasas Dr. Dominic O'Connor, Consultor, Royal Perth Hospital, Australia Dr. Carl Gwinnutt, Consultor, Hope Hospital, Salford, Reino Unido Envíe un correo electrónico a Dominic.O' Connor@health.wa.gov.au Preguntas del tutorial Después de leer el tutorial, debe intentar responder las siguientes preguntas 1. ¿Cómo se clasifican los fármacos bloqueadores neuromusculares? 2. ¿Cómo funcionan los fármacos bloqueadores neuromusculares? 3. ¿Cuáles son los efectos adversos del suxametonio? 4. ¿Qué fármacos bloqueantes neuromusculares no despolarizantes afectan al sistema cardiovascular? 5. ¿Cómo funciona la neostigmina? 6. ¿Cuáles son los efectos adversos de los anticolinesterásicos y cómo se previenen? Introducción Los fármacos bloqueantes neuromusculares (NMBD, por sus siglas en inglés) se utilizan en la anestesia para alterar la transmisión neuromuscular y proporcionar relajación del músculo esquelético. Estos fármacos permiten al anestesista realizar la intubación traqueal, facilitar la ventilación y proporcionar condiciones operativas quirúrgicas óptimas, por ejemplo, durante la laparotomía. Los NMBD son compuestos de amonio cuaternario estructuralmente similares a la acetilcolina (ACh); actúan principalmente en el receptor nicotínico postsináptico de la unión neuromuscular. Los NMBD pueden ser agonistas (NMBD "despolarizantes") o antagonistas (NMBD "no despolarizantes") en el receptor nicotínico. Los fármacos anticolinesterásicos (también conocidos como inhibidores de la acetilcolinesterasa) se utilizan para revertir los efectos de los NMBD no despolarizantes. Estos fármacos aumentan la concentración de ACh en la unión neuromuscular al inhibir la enzima acetilcolinesterasa. Si no está seguro de algunos de los términos utilizados hasta ahora, ahora es un buen momento para revisar el tutorial sobre "fisiología de la unión neuromuscular". NMBD despolarizantes El suxametonio (succinilcolina) es el único NMBD despolarizante en uso clínico. Estructuralmente son dos moléculas de ACh unidas y actúa como agonista del receptor nicotínico. El suxametonio se une a las dos subunidades alfa del receptor imitando a la ACh, lo que provoca la despolarización de la membrana. Cuando se produce la despolarización, provoca la contracción muscular, que se produce rápidamente y se observa clínicamente como fasciculación muscular. Después de la despolarización, el potencial de membrana debe restablecerse antes de que pueda ocurrir una mayor despolarización y el músculo esquelético permanece en un estado de relajación flácida hasta que esto ocurra. Una dosis intravenosa de suxametonio de 1,0-1,5 mg/kg produce un bloqueo neuromuscular profundo en 60 segundos, esto es más rápido que con cualquier otro NMBD. El bloqueo normalmente se resuelve espontáneamente después de aproximadamente 10 minutos. El suxametonio da como resultado un bloqueo de Fase I, caracterizado por la ausencia de desvanecimiento y facilitación posttetánica en la estimulación de los nervios periféricos. El suxametonio se hidroliza rápidamente por la colinesterasa plasmática a succinil monocolina y colina. Antes de su uso se almacena a 4 grados centígrados para evitar la hidrólisis. Aunque no se usa comúnmente, se puede usar una infusión de suxametonio para producir un bloqueo neuromuscular prolongado. Se ponen 500 mg de suxametonio en una bolsa de 500 ml de solución salina (solución al 0,1%). La velocidad de perfusión se ajusta para lograr el grado de relajación deseado, normalmente de 5 a 15 mg/kg/hora (5 a 15 ml/kg/hora). Si se utiliza esta técnica, se requiere un tratamiento previo con atropina. El suxametonio se puede administrar por vía intramuscular a una dosis de 3-5 mg/kg. El inicio es considerablemente más lento que cuando se administra por vía intravenosa. Esta vía generalmente se usa solo en bebés donde el acceso venoso no es posible. suxametonio; Indicaciones y efectos secundarios El suxametonio es el NMBD con el inicio de acción más rápido y predecible. Esto y el hecho de que tiene una acción de corta duración hacen que sea el fármaco de elección para la anestesia cuando se utiliza una inducción de secuencia rápida (RSI) para pacientes con riesgo de aspiración, o cuando se requiere una intubación traqueal rápida en una situación de emergencia. . También está indicado cuando se requiera una rápida recuperación de la función neuromuscular. El suxametonio tiene numerosos efectos secundarios no deseados: Bradicardia.Ocurre debido a la estimulación de los receptores muscarínicos en el nódulo sinoauricular. La bradicardia es más común en niños y después de dosis repetidas del fármaco. Aumento de la presión intraocular.Existe un riesgo teórico de expulsión del contenido vítreo con el uso de suxametonio en pacientes con lesión ocular penetrante. Este riesgo debe equilibrarse con el riesgo de aspiración de contenido gástrico en cirugía de urgencia. Dolor muscular.Ocurre comúnmente, especialmente en adultos jóvenes, en buena forma física y con deambulación temprana. Existen estrategias como la precurarización para reducir la incidencia, pero ninguna estrategia es completamente preventiva. Hiperpotasemia.Los niveles séricos medios de potasio aumentan en 0,5 mmol/l con la administración de suxametonio. Los pacientes con hiperpotasemia preexistente corren el riesgo de sufrir arritmias cardíacas y morir. La hiperpotasemia fatal puede ocurrir en pacientes quemados, pacientes con distrofias musculares y pacientes parapléjicos. Esto puede deberse a la proliferación de receptores extrasinápticos en estos pacientes. El riesgo máximo de hiperpotasemia en pacientes quemados ocurre durante los días 9 a 60 después de la quemadura. El uso de suxametonio dentro de los primeros 2-3 días después de una quemadura grave se considera seguro. Aumento de la presión intragástrica.Esto se compensa con un aumento en la presión de la barrera esofágica. Bloque fase II.Esto puede ocurrir después de dosis grandes o repetidas de suxametonio. El bloqueo neuromuscular se prolonga y la estimulación de los nervios periféricos provoca el desvanecimiento de la respuesta de altura de la contracción del tren de cuatro y la facilitación postetánica. Anafilaxia.El suxametonio es responsable de más del 50 % de las reacciones anafilácticas a los NMBD. Bloqueo prolongado debido a la reducción de la actividad de la colinesterasa plasmática.Esto puede deberse a causas congénitas o adquiridas. Las causas adquiridas incluyen la reducción de la síntesis de enzimas, que puede ocurrir en enfermedades hepáticas, carcinomatosis, embarazo o inanición (estados hipoproteinémicos), insuficiencia cardíaca, insuficiencia renal y quemaduras. La administración conjunta de otros fármacos como etomidato, anestésicos locales de éster, metotrexato, remifentanilo y esmolol puede provocar una reducción de la actividad de la colinesterasa plasmática. Las causas hereditarias de bloqueo prolongado después de suxametonio ocurren debido a la producción de colinesterasa plasmática atípica. La estructura de la enzima colinesterasa está determinada genéticamente por un gen en el cromosoma 3, este gen se describe como el gen habitual (94% de la población homocigota). Existen tres variantes del gen habitual y se conocen como genes atípicos, silenciosos y resistentes al fluoruro. Las personas con estos genes variantes tienen una enzima colinesterasa atípica y tienen un bloqueo neuromuscular prolongado después del suxametonio. La duración del bloqueo prolongado varía de 30 minutos (p. ej., personas heterocigotos para el gen atípico) a varias horas (por ejemplo, homocigotos para el gen silencioso). Hipertermia maligna.Esta condición puede ser desencadenada por suxametonio y por lo tanto su uso está absolutamente contraindicado en pacientes susceptibles. NMBD no despolarizantes Los fármacos no despolarizantes son antagonistas competitivos de la ACh en el receptor nicotínico postsináptico. Se unen a una o ambas subunidades alfa del receptor y evitan la despolarización debida a la ACh. La unión de los antagonistas al receptor es reversible y se produce una asociación y disociación repetidas. El bloqueo neuromuscular comienza a ocurrir cuando el 70-80% de los receptores están antagonizados, para producir un bloqueo completo se debe ocupar más del 90% de los receptores. También se cree que los NMBD no despolarizantes tienen una acción en los receptores presinápticos en la unión neuromuscular. La estimulación de los receptores presinápticos por la ACh normalmente da como resultado una mayor movilización de la ACh para hacer frente al aumento de la frecuencia de estimulación. Los NMBD no despolarizantes antagonizan estos receptores e inhiben este proceso. Al evaluar el bloqueo provocado por los NMBD no despolarizantes con un estimulador de nervios periféricos se observa una respuesta característica. El desvanecimiento de la respuesta de altura de la contracción ocurre durante un tren de cuatro o un patrón tetánico de estimulación. El desvanecimiento se debe a la acción de estos fármacos en el receptor presináptico, lo que reduce la disponibilidad de ACh con la estimulación nerviosa repetida. La facilitación post tetánica de la transmisión neuromuscular es otra característica del bloqueo neuromuscular no despolarizante y se debe al aumento de las cantidades de ACh en la sinapsis de la unión después de la estimulación tetánica. Los NMBD no despolarizantes no se metabolizan en la unión neuromuscular y la resolución del bloqueo se debe a un efecto de dilución del fármaco con el tiempo. Son fármacos altamente ionizados, solubles en agua y su volumen de distribución se aproxima al del plasma y líquido extracelular. Hay dos grupos de NMBD no despolarizantes, compuestos de bencilisoquinolinio y compuestos de aminoesteroides. Compuestos de bencilisoquinolinio Estos fármacos están formados por dos grupos de amonio cuaternario unidos por una cadena de grupos metilo. Son más propensos a descomponerse en el plasma y, a menudo, provocan la liberación de histamina; los ejemplos incluyen tubocurarina, atracurio, cisatracurio y mivacurio. Tubocurarina.Un fármaco con un inicio prolongado y una duración de acción prolongada (ver Tabla 1). Causa liberación marcada de histamina, con hipotensión y taquicardia. El bloqueo ganglionar puede ocurrir con dosis altas. La tubocurarina se excreta sin cambios principalmente en la orina pero también en la bilis. Sus efectos se prolongan en la insuficiencia renal. Ha sido reemplazado por agentes con mejores perfiles de efectos secundarios y ya no está disponible en el Reino Unido. atracurio.Una mezcla racémica de 10 estereoisómeros e isómeros geométricos. El atracurio tiene un inicio y una duración de acción intermedios. Provoca la liberación de histamina pero no tiene efectos cardiovasculares directos. El metabolismo es por degradación de Hofmann e hidrólisis de ésteres en el plasma, por lo que su duración de acción es independiente de la función renal y hepática. cisatracurio.El R-cis R′-isómero cis del atracurio. Constituye el 15% del compuesto original y es cuatro veces más potente con una acción de mayor duración. A diferencia del atracurio, no libera histamina. Se metaboliza por degradación de Hofmann y no se acumula en caso de insuficiencia renal. mivacurio.El mivacurio es un fármaco con una duración de acción corta de aproximadamente 15 minutos, lo que lo hace potencialmente útil para procedimientos cortos. Es una mezcla racémica de tres isómeros que es hidrolizada por la colinesterasa plasmática. El mivacurio se asocia con la liberación de histamina causando hipotensión significativa con dosis superiores a 0,2 mg/Kg. Al igual que el suxametonio, su duración de acción aumenta en pacientes con colinesterasa plasmática atípica. Compuestos de aminoesteroides Todos los NMBD de aminoesteroide poseen al menos un grupo de amonio cuaternario unido a un núcleo de esteroide. Tienden a no causar liberación de histamina y la mayoría se metaboliza en un órgano final antes de la excreción. Pancuronio.El primer esteroide NMBD en uso clínico tiene un inicio lento y una acción de larga duración. No provoca la liberación de histamina, pero tiene propiedades simpaticomiméticas débiles y provoca taquicardia. Es parcialmente desacilado en el hígado a un metabolito con propiedades bloqueantes neuromusculares y parcialmente excretado sin cambios en la orina. Su acción se prolonga en insuficiencia renal y hepática. vecuronio.El vecuronio es estructuralmente similar al pancuronio, pero tiene un inicio de acción ligeramente más rápido y una duración de acción más breve (intermedia). No libera histamina ni tiene efectos cardiovasculares. El metabolismo en el hígado ocurre a metabolitos activos antes de ser excretados en la bilis y la orina. El vecuronio es inestable en solución y se almacena como polvo y requiere mezclarse con agua antes de la administración. rocuronio.Esta amina monocuaternaria tiene el inicio de acción más rápido de los NMBD no despolarizantes clínicamente disponibles. Las condiciones de intubación se pueden lograr en 60-90 segundos después de una dosis de inducción de 0,6 mg/Kg. El rocuronio tiene una duración de acción intermedia y se metaboliza en el hígado y se excreta en la bilis. El rocuronio tiene efectos cardiovasculares mínimos y no libera histamina, sin embargo, tiene una mayor incidencia de reacciones anafilácticas que otros NMBD aminoesteroides. Tabla 1. Dosis, velocidad de inicio y duración de los bloqueadores neuromusculares succinilcolina tubocurarina atracurio cisatracurio mivacurio pancuronio vecuronio rocuronio Dosis (mg/Kg) Tiempo de inicio (min) Duración 1.0-1.5 <1 3-5 2-3 2-3 2-3 3-5 2-3 1-2 30-50 20-30 30-40 10-20 40-60 20-30 30-40 0.5 0.5 0.1 0,15-0,20 0.1 0.1 0.6 (min) 5-10 Anticolinesterasas Las anticolinesterasas (también conocidas como inhibidores de la acetilcolinesterasa) son agentes que inhiben la acción de la enzima acetilcolinesterasa en la unión neuromuscular. La inhibición enzimática conduce a una reducción en la degradación de ACh y potencia su acción. Las anticolinesterasas se utilizan en anestesia para revertir los efectos de los NMBD no despolarizantes. La reversión del bloqueo neuromuscular no despolarizante generalmente ocurre al final de la cirugía y no debe ocurrir antes de que ya haya ocurrido alguna resolución del bloqueo. La administración temprana de anticolinesterasa puede ser ineficaz debido a la alta ocupación del receptor por parte del NMBD. Inversión deintermediola acción de los NMBD con anticolinesterasa debe ser de al menos 20 minutos después de administrar el fármaco. Si se utiliza la estimulación de los nervios periféricos, se deben detectar al menos 3 espasmos en un tren de cuatro antes de intentar la reversión. La señal más confiable de que un bloque está completamente invertido por anticolinesterasa es una respuesta sostenida a la estimulación tetánica con un periférico estimulador nervioso (es decir, no se desvanece). Las pruebas clínicas de resolución adecuada del bloqueo neuromuscular incluyen la capacidad de levantar la cabeza de la cama durante 5 segundos, aunque esta es una evaluación mucho menos confiable. Las anticolinesterasas aumentarán el bloqueo de la Fase I debido a los NMBD despolarizantes y las anticolinesterasas no tienen ningún papel en la reversión de los efectos del suxametonio. Efectos secundarios de los agentes anticolinesterásicos Las anticolinesterasas provocan una acumulación de ACh que da como resultado la potenciación de sus efectos en los receptores muscarínicos. Esto puede causar bradicardia, miosis, molestias gastrointestinales, náuseas, broncoespasmo, aumento de las secreciones bronquiales, sudoración y salivación. Por esta razón, junto con la anticolinesterasa se debe administrar un antimuscarínico como el glicopirronio o la atropina para minimizar estos efectos. Fármacos anticolinesterásicos Neostigmina.Con mucho, la anticolinesterasa más utilizada en anestesia es la neostigmina. Este es un compuesto de amonio cuaternario soluble en agua que se combina de manera reversible con el sitio esterático de la enzima acetilcolinesterasa y lo vuelve inactivo durante aproximadamente 30 minutos. La neostigmina se administra como inyección intravenosa a una dosis de 0,05 mg/kg (máximo 5 mg) y debe administrarse con glicopirronio 0,01 mg/kg o atropina 0,02 mg/kg. La neostigmina comienza a hacer efecto después de aproximadamente 2 minutos, pero tiene su efecto máximo a los 5-7 minutos. Se excreta sin cambios por vía renal y tiene una vida media de unos 45 minutos. edrofonio.Esta anticolinesterasa forma un enlace iónico en el sitio aniónico de la enzima. La unión es reversible y de corta duración, del orden de unos pocos minutos. El edrofonio se utiliza como prueba de diagnóstico para la enfermedad neuromuscular miastenia gravis. La potenciación de ACh por el fármaco da como resultado un aumento transitorio de la fuerza muscular en el paciente miasténico. El edrofonio rara vez se usa para revertir los efectos de los NMBD, ya que sus efectos son de corta duración y el bloqueo neuromuscular puede aumentar después de una recuperación inicial. Piridostigmina.Este agente tiene un inicio más prolongado que la neostigmina y dura varias horas. Se usa con más frecuencia como terapia para la miastenia gravis. fisostigmina.Al igual que la neostigmina y la piridostigmina, la fisostigmina actúa de forma reversible en el sitio esterático de la enzima acetilcolinesterasa. Como es más soluble en lípidos que los otros agentes, puede ser absorbido desde el tracto gastrointestinal y atraviesa la barrera hematoencefálica. Compuestos organofosforados.Estas sustancias se encuentran en algunos pesticidas y agentes utilizados en la guerra química. Los compuestos organofosforados forman un enlace irreversible con la enzima y la recuperación solo ocurre después de la generación de una nueva enzima, lo que lleva semanas. El envenenamiento produce salivación, sudoración, bradicardia, broncoespasmo y debilidad muscular. El tratamiento es con atropina y medidas de soporte. Otras lecturas Appiah-Ankam J, Hunter J. Farmacología de los fármacos bloqueantes neuromusculares. Contin Educ Anaesth Crit Care Pain. 2004; 4:2-7 Ackroyd C, Gwinnutt C. Fisiología de la unión neuromuscular. Tutoría de la semana. www.anestesiamundial.org 13 de febrero de 2006 McGrath D, Hunter J. Monitoreo del bloqueo neuromuscular. Contin Educ Anaesth Crit Care Pain. 2006; 6:7-12