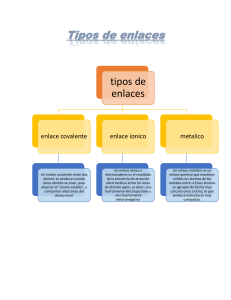
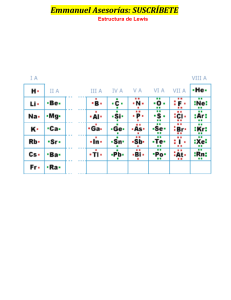
ENLACE COVALENTE QUÍMICA 3RO SECUNDARIA PROF. JUAN INTRODUCCIÓN - La regla del octeto explica la formación de compuestos iónicos y no iónicos (covalentes). - Para Lewis, dos átomos en un enlace llegan a cumplir con la regla del octeto transfiriendo electrones o al compartir uno o más pares de electrones. - Se considera que el par o pares de electrones compartidos pertenecen a la periferia de ambos átomos. - Al igual que en el enlace iónico, el enlace covalente conduce a que los átomos adopten la configuración de un gas noble. CONCEPTO EN(Br) = 2,8 EN(H) = 2,1 ∆ EN = 0,7 - Unión química entre dos o más átomos, donde se comparte electrones. - Generalmente se produce entre no metales de los grupos del IIIA hasta el VIIA. - No puede haber transferencia de e-, ya que ambos no metales tienden a ganar e-. - La diferencia de la electronegatividad (∆EN) es menor a 1,7. ∆𝑬𝑵 < 𝟏. 𝟕 CARACTERÍSTICAS Ejemplo: EN(Br) = 2,8 EN(H) = 2,1 ∆ EN = 0,7 - Se genera por superposición o solapamiento de orbitales atómicos moleculares. - Generalmente la compartición de e- es entre átomos de elementos no metálicos, pero también pueden intervenir átomos de elementos metálicos poco activos como Be, Al y Hg. - La diferencia de electronegatividad es relativamente baja. ∆𝑬𝑵 < 𝟏. 𝟕 PROPIEDADES - - A condiciones ambientales pueden ser sólidos, líquidos y gases. Generalmente tienen bajos puntos de fusión y de ebullición. Muchos son insolubles en solventes polares como el agua. La mayoría son solubles en solventes apolares como el n-hexano, benceno, CCl4, etc. Sus soluciones acuosas suelen ser malos conductores de la electricidad (no forman electrolitos). Generalmente son inflamables. Los átomos forman unidades discretas (moléculas). También llamados compuestos moleculares. CLASIFICACIÓN A) Según el tipo de traslape a. Traslape frontal o sigma (𝝈) b. Traslape lateral o pi (𝝅) CLASIFICACIÓN B) Según en número de electrones aportados para formar el enlace a. Enlace covalente normal cada átomo aporta un electrón para formar el par electrónico de enlace. Enlace covalente normal b. Enlace covalente coordenado o dativo En este tipo de enlace, solo un átomo aporta el par electrónico enlazante. Enlace dativo CLASIFICACIÓN C) Según polaridad a. Enlace covalente polar - Se genera entre átomos de diferentes elementos. - La densidad electrónica del enlace es compartida de forma desigual. - Se generan cargas aparentes o dipolos eléctricos (𝜹+; 𝜹–). - Se cumple: 𝟎 < ∆𝑬𝑵 < 𝟏. 𝟕 Ejemplo: EN(Cl) = 3,0 EN(H) = 2,1 ∆ EN = 0,9 CLASIFICACIÓN C) Según polaridad b. Enlace covalente apolar - Se da por lo general entre átomos del mismo elementos. - La densidad electrónica del enlace es compartida de forma equitativa. - Se cumple: ∆𝑬𝑵 = 𝟎 Ejemplo: EN(Br) = 2,8 EN(Br) = 2,8 ∆ EN = 0 Ejemplo: EN(P) = 2,1 EN(H) = 2,1 ∆ EN = 0 CLASIFICACIÓN D) Según la cantidad de pares enlazantes a. Enlace covalente simple - Constituido por un par de electrones compartidos. - Se genera un enlace tipo sigma (𝝈). NOTA: Un enlace dativo es también un enlace simple CLASIFICACIÓN D) Según la cantidad de pares enlazantes a. Enlace covalente múltiple ENLACE COVALENTE MÚLTIPLE DOBLE - Constituido por dos pares de electrones compartidos. - Contiene un enlace sigma (𝝈) y uno pi (𝝅) CLASIFICACIÓN D) Según la cantidad de pares enlazantes a. Enlace covalente múltiple ENLACE COVALENTE MÚLTIPLE TRIPLE - Constituido por tres pares de electrones compartidos. - Contiene un enlace sigma (𝝈) y dos enlaces pi (𝝅) DIAGRAMA DE LEWIS DE DIVERSAS SUSTANCIAS COVALENTE DIAGRAMA DE LEWIS DE DIVERSAS SUSTANCIAS COVALENTE ENLACE QUÍMICO Enlaces interatómicos Los átomos pueden conseguir la configuración electrónica de gas noble de dos formas: - Enlace iónico: Cediendo o aceptando e- de otros átomos ( transferencia de electrones). - Enlace covalente: compartiendo electrones.