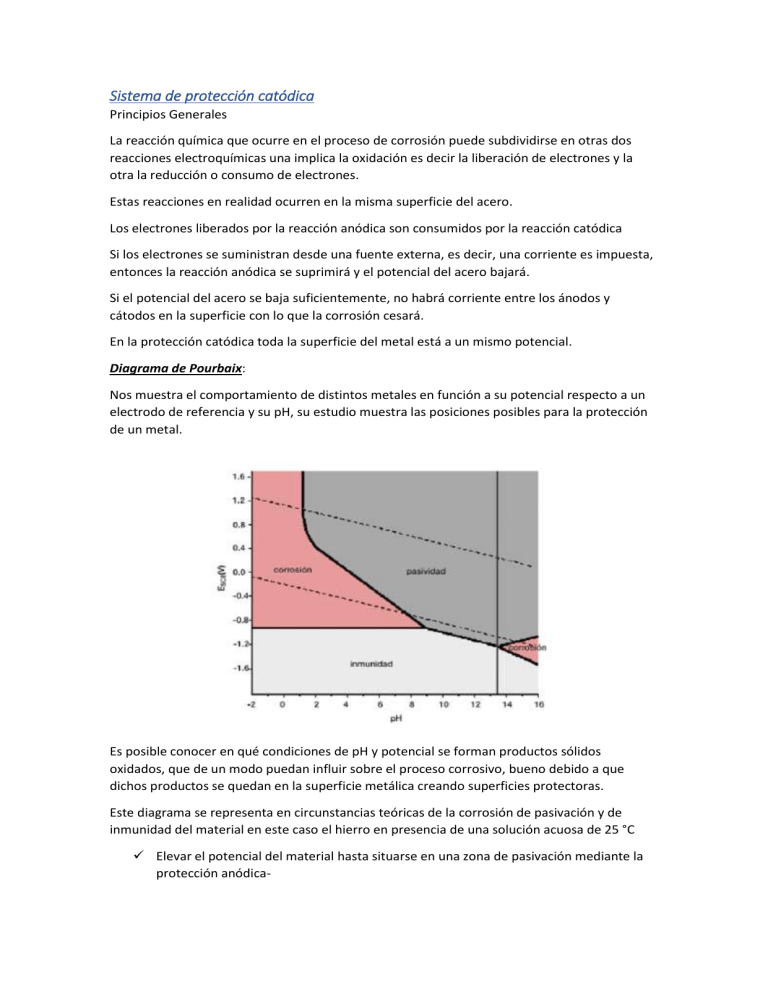
Sistema de protección catódica Principios Generales La reacción química que ocurre en el proceso de corrosión puede subdividirse en otras dos reacciones electroquímicas una implica la oxidación es decir la liberación de electrones y la otra la reducción o consumo de electrones. Estas reacciones en realidad ocurren en la misma superficie del acero. Los electrones liberados por la reacción anódica son consumidos por la reacción catódica Si los electrones se suministran desde una fuente externa, es decir, una corriente es impuesta, entonces la reacción anódica se suprimirá y el potencial del acero bajará. Si el potencial del acero se baja suficientemente, no habrá corriente entre los ánodos y cátodos en la superficie con lo que la corrosión cesará. En la protección catódica toda la superficie del metal está a un mismo potencial. Diagrama de Pourbaix: Nos muestra el comportamiento de distintos metales en función a su potencial respecto a un electrodo de referencia y su pH, su estudio muestra las posiciones posibles para la protección de un metal. Es posible conocer en qué condiciones de pH y potencial se forman productos sólidos oxidados, que de un modo puedan influir sobre el proceso corrosivo, bueno debido a que dichos productos se quedan en la superficie metálica creando superficies protectoras. Este diagrama se representa en circunstancias teóricas de la corrosión de pasivación y de inmunidad del material en este caso el hierro en presencia de una solución acuosa de 25 °C Elevar el potencial del material hasta situarse en una zona de pasivación mediante la protección anódica- Alcalinizar el medio hasta superar el pH frontera entre la zona de corrosión y la de pasivación. Por último, rebajar el potencial para situarse en una zona de inmunidad mediante protección catódica. Para poder entender esto tenemos que añadir un nuevo concepto el de pasivación la pasivación es una propiedad que tienen determinados materiales y aleaciones que debe permanecer totalmente inertes en determinados medios en los cuales y de acuerdo con la termodinámica deberían comportarse como metales activos y por lo tanto disolverse con velocidades altas a través de mecanismos corrosivos electroquímicos. La pasivación puede darse por dos mecanismos principalmente, uno es el de la formación de una capa de productos oxidados de un pequeño espesor, pero muy compacta, además de ser muy de muy baja porosidad por lo que el metal lo deja aislado del medio. La otra sería la presencia de capas monoatómicas, generalmente de oxígeno, absorbida por la capa metálica, siendo en este caso el menos común. La pasivación es una propiedad que poseen algunos metales y aleaciones que es de máxima importancia porque permite el uso de metales activos de precios más o menos moderados como el aluminio o el cromo en medios de alta agresividad, TT comportándose en ellos como materiales nobles. La cantidad de corriente que influye se ajusta de manera de vencer a la corriente de corrosión y descargándose desde todas las áreas anódica, existirá un flujo neto de ccorrientesobre la superficie, llegando a ser toda la superficie un cátodo. Por eso podemos decir que la protección catódica en síntesis consiste en convertir el cátodo de toda superficie metálica a proteger consiguiendo que por toda ella penetre corriente contínua. Si conectamos un trozo de hierro cuyo potencial electroquímico es de -0,44 voltios, con un trozo de zinc de potencial -0,76 voltios la diferencia de potencial existente establecerá una corriente eléctrica a través del electrolito de sin que actúa como ánodo al hierro que actúa como cátodo. Hemos protegido al hierro de la corrosión sacrificando en su beneficio una placa de zinc, este es el fundamento del método de protección por ánodos de sacrificio para proteger un metal lo haremos simplemente con otro que sea más electronegativo que él.











