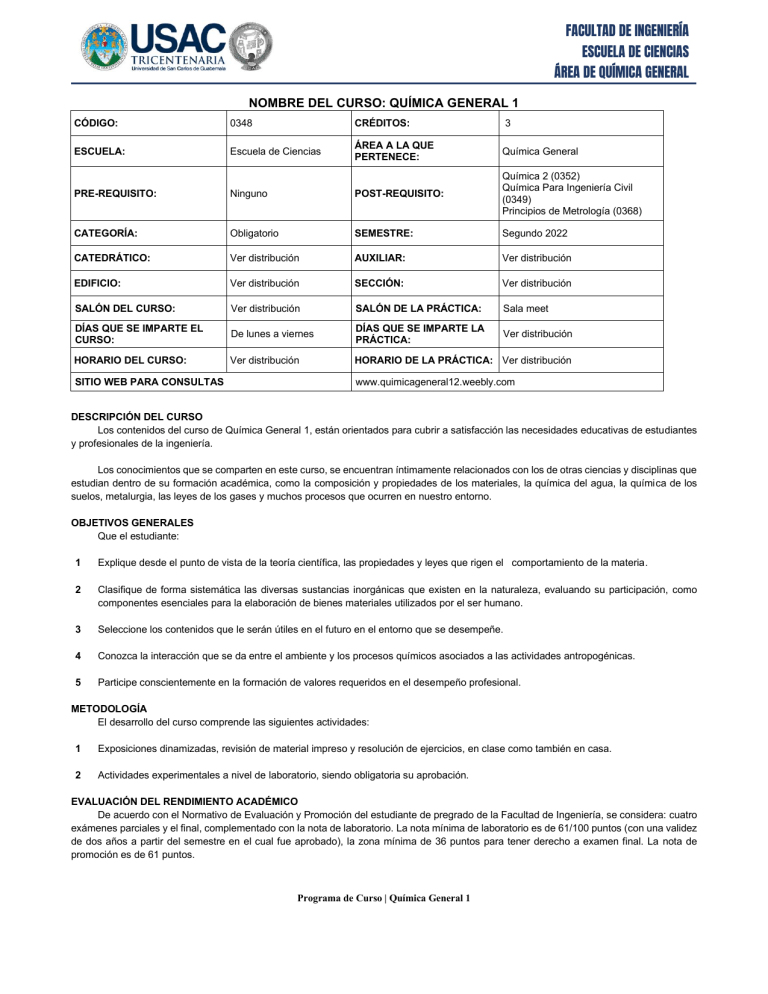
FACULTAD DE INGENIERÍA ESCUELA DE CIENCIAS ÁREA DE QUÍMICA GENERAL NOMBRE DEL CURSO: QUÍMICA GENERAL 1 CÓDIGO: 0348 CRÉDITOS: 3 ESCUELA: Escuela de Ciencias ÁREA A LA QUE PERTENECE: Química General PRE-REQUISITO: Ninguno POST-REQUISITO: Química 2 (0352) Química Para Ingeniería Civil (0349) Principios de Metrología (0368) CATEGORÍA: Obligatorio SEMESTRE: Segundo 2022 CATEDRÁTICO: Ver distribución AUXILIAR: Ver distribución EDIFICIO: Ver distribución SECCIÓN: Ver distribución SALÓN DEL CURSO: Ver distribución SALÓN DE LA PRÁCTICA: Sala meet DÍAS QUE SE IMPARTE EL CURSO: De lunes a viernes DÍAS QUE SE IMPARTE LA PRÁCTICA: Ver distribución HORARIO DEL CURSO: Ver distribución HORARIO DE LA PRÁCTICA: Ver distribución SITIO WEB PARA CONSULTAS www.quimicageneral12.weebly.com DESCRIPCIÓN DEL CURSO Los contenidos del curso de Química General 1, están orientados para cubrir a satisfacción las necesidades educativas de estudiantes y profesionales de la ingeniería. Los conocimientos que se comparten en este curso, se encuentran íntimamente relacionados con los de otras ciencias y disciplinas que estudian dentro de su formación académica, como la composición y propiedades de los materiales, la química del agua, la química de los suelos, metalurgia, las leyes de los gases y muchos procesos que ocurren en nuestro entorno. OBJETIVOS GENERALES Que el estudiante: 1 Explique desde el punto de vista de la teoría científica, las propiedades y leyes que rigen el comportamiento de la materia. 2 Clasifique de forma sistemática las diversas sustancias inorgánicas que existen en la naturaleza, evaluando su participación, como componentes esenciales para la elaboración de bienes materiales utilizados por el ser humano. 3 Seleccione los contenidos que le serán útiles en el futuro en el entorno que se desempeñe. 4 Conozca la interacción que se da entre el ambiente y los procesos químicos asociados a las actividades antropogénicas. 5 Participe conscientemente en la formación de valores requeridos en el desempeño profesional. METODOLOGÍA El desarrollo del curso comprende las siguientes actividades: 1 Exposiciones dinamizadas, revisión de material impreso y resolución de ejercicios, en clase como también en casa. 2 Actividades experimentales a nivel de laboratorio, siendo obligatoria su aprobación. EVALUACIÓN DEL RENDIMIENTO ACADÉMICO De acuerdo con el Normativo de Evaluación y Promoción del estudiante de pregrado de la Facultad de Ingeniería, se considera: cuatro exámenes parciales y el final, complementado con la nota de laboratorio. La nota mínima de laboratorio es de 61/100 puntos (con una validez de dos años a partir del semestre en el cual fue aprobado), la zona mínima de 36 puntos para tener derecho a examen final. La nota de promoción es de 61 puntos. Programa de Curso | Química General 1 FACULTAD DE INGENIERÍA ESCUELA DE CIENCIAS ÁREA DE QUÍMICA GENERAL ACTIVIDAD PONDERACIÓN 3 Exámenes parciales 36 puntos Laboratorio* 14 puntos Tareas preparatorias de examen 11 puntos Hojas de trabajo 11 puntos Presentación periodicidad química 03 puntos Zona 75 puntos Examen Final 25 puntos Nota Final 100 puntos *Es requisito indispensable aprobar el Laboratorio para poder aprobar el curso. CONTENIDO Unidad 1: Ciencia y Medición 1.1 Proceso Histórico 1.1.2 Método y objetivo de estudio. 1.1.3 Relación con otras ciencias y con el ser humano. 1.2 Materia 1.2.1 Medición de la materia. 1.2.2 Sistemas de medición. 1.2.3 Análisis dimensional. Unidad 2: Teoría atómica 2.1 Teoría atómica del núcleo 2.1.1 Clasificación de la materia 2.1.1.1 El átomo. 2.1.1.2 Sustancias elementales. 2.1.1.3 Compuestos. 2.1.1.4 Mezclas. 2.1.2 Partículas sub-atómicas 2.1.2.1 Protones, electrones y neutrones. 2.1.2.2 Localización, masa y carga de las partículas sub-atómicas fundamentales. 2.1.2.3 Modelos atómicos. 2.1.2.4 Isótopos. Número atómico, masa atómica, peso atómico. 2.2 Teoría atómica del electrón 2.2.1 Energía radiante 2.2.1.1 Teoría cuántica y ondulante. 2.2.1.2 Energía, longitud de onda y frecuencia. 2.2.2 Números cuánticos 2.2.2.1 Descripción de los números cuánticos. 2.2.3 Configuración electrónica 2.2.3.1 Regla de Hund. 2.2.3.2 Principio de exclusión de Pauli, distribuciones electrónicas. 2.2.3.3 Estructuras isoelectrónicas. Programa de Curso | Química General 1 FACULTAD DE INGENIERÍA ESCUELA DE CIENCIAS ÁREA DE QUÍMICA GENERAL Unidad 3: Clasificación periódica 3.1 Sistema periódico de los elementos. 3.1.1 Clasificación periódica de los elementos en grupos, períodos, elementos representativos y tierras raras. 3.1.2 Propiedades periódicas: 3.1.2.1 Estructura electrónica. 3.1.2.2. Potencial de ionización. 3.1.2.3 Electronegatividad. 3.1.2.4 Afinidad electrónica. 3.1.2.5 Carácter metálico. 3.1.2.6 Valencia iónica. 3.1.2.7 Radio iónico. 3.1.2.8 Peso atómico. 3.1.2.9 Radio atómico. Unidad 4: Conceptos fundamentales de enlace químico 4.1 Enlace 4.1.1 Naturaleza electrónica del enlace. 4.1.2 Tipos de enlace: 4.1.2.1 Enlace covalente. 4.1.2.2 Enlace iónico. 4.1.2.3 Enlace metálico. 4.1.3 Determinación teórica y práctica de sustancias iónicas y covalentes. Unidad 5: Nomenclatura 5.1 Número de oxidación 5.1.1 Determinación de los números de oxidación en sustancias elementales. 5.1.2 Nomenclatura de compuestos binarios: 5.1.2.1 Sales binarias. 5.1.2.2 Óxidos metálicos y no metálicos. 5.1.2.3 Compuestos hidrogenados. 5.1.3 Nomenclatura de compuestos ternarios: 5.1.3.1 Sales ternarias. 5.1.3.2 Oxácidos. 5.1.3.3 Hidróxidos. Unidad 6: Estequiometría de las reacciones químicas 6.1 Conceptos Fundamentales 6.1.1 El mol y número de Avogadro. 6.1.2 Peso fórmula gramo. 6.2 Leyes ponderales 6.2.1 Ley de la conservación de la masa. 6.2.2 Ley de las proporciones múltiples. 6.3 Ecuaciones químicas 6.3.1 Balanceo de ecuaciones. 6.3.2 Rendimiento porcentual. 6.3.3 Reactivo limitante. 6.3.4 Reactivo en exceso. Unidad 7: Gases 7.1 Propiedades de los gases 7.1.1 Unidades empleadas para expresar la presión, volumen, temperatura y la constante R. Programa de Curso | Química General 1 FACULTAD DE INGENIERÍA ESCUELA DE CIENCIAS ÁREA DE QUÍMICA GENERAL 7.2 Leyes de los gases 7.2.1 Ley de Boyle. 7.2.2 Ley de Charles-Gay Lussac. 7.2.3 Ley combinada. 7.2.4 Ley de los gases ideales. 7.2.5 Ley de las presiones parciales de Dalton. 7.3 Estequiometria de gases DOSIFICACIÓN DE CONTENIDOS Unidad Periodos 1 Ciencia y medición 07 2.1 Teoría atómica del núcleo 02 2.2 Teoría atómica del electrón 06 3 Clasificación periódica 04 4 Enlace químico 04 5 Nomenclatura 07 6 Estequiometria 09 7 Gases 06 CALENDARIZACIÓN Inicio de clases 18 de julio 2022 Primer parcial - Unidad 1 13 de agosto 2022 Segundo parcial - Unidad 2 y 3 17 de septiembre 2022 Tercer parcial - Unidad 4, 5 y 6.1 22 de octubre 2022 BIBLIOGRAFÍA Texto Ebbing, Darrell D.; Gammon, Steven D. Química General. Editorial Cengage. 9na Edición, 2010. Hein, M.; Arena, S. Fundamentos de Química. Editorial Cengage. 12va Edición, 2010. Kotz, John C.l.; Treichel, Paul M. Química y Reactividad Química. Editorial Thomson. 6ta Edición, 2005. Petrucci, Ralph. Química General. Editorial Pearson Education. 10ma Edición, 2010. Whitten, Kenneth W.; Davis, Raymond E. Química. Editorial Cengage. 8va Edición, 2008. Apoyo Para Laboratorio Alfaro, María del Rosario. Contaminación del Aire. Editorial EUNED. Alvarado Gámez, Ana; et. al. Análisis Químico Instrumental: Manual de Prácticas de Laboratorio. Editorial EUCR. 2008. Kotz, John C.l.; Treichel, Paul M. Química y Reactividad Química. Editorial Thomson. 6ta Edición, 2005. Phillips, John. Química: Conceptos y Aplicaciones. Editorial McGraw-Hill. 2da Edición, 2010. Rubinson, Judith F.; Rubinson, Keneth. Química Analítica Contemporánea. Editorial Pearson. Programa de Curso | Química General 1