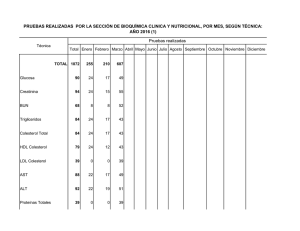
1 DEPARTAMENTO DE INGENIERIA QUIMICA Y BIOQUIMICA NOMBRE DEL PROYECTO “ELABORACION DE UN MANUAL DE PRACTICAS DE LA ASIGNATURA DE BIOQUIMICA” EMPRESA INSTITUTO TECNOLÓGICO DE MATAMOROS INFORME FINAL DE RESIDENCIAS PROFESIONALES PARA OBTENER EL TÍTULO DE INGENIERO QUIMICO PRESENTA: Petra Nataly Ortiz Septiembre 2020 - Febrero 2021 H. MATAMOROS, TAMAULIPAS, MÉXICO. 16260338 2 Preliminares 2. Agradecimientos Le doy gracias a mi padre por apoyarme en seguir estudiando, a mi familia por motivarme en los momentos difíciles y un agradecimiento especial a todos mis compañeros de trabajo de la Refaccionaria Potosí por otorgarme todo el apoyo necesario para poder estudiar y trabajar. A mis maestros y compañeros de escuela que siempre me enseñaron nuevas cosas y me motivaron más a estudiar esta carrera y aunque fue poco el tiempo que compartí quiero también agradecerles a mis compañeras y compañeros del área de saneamiento de la junta de aguas y drenajes liderados por el ingeniero Javier Treviño que me brindaron todo su apoyo y conocimiento. MARCO ANTONIO HERNANDEZ SANCHEZ Gracias a mi madre por ser mi guía y enseñarme lo bueno de las cosas, por toda su entrega para poder cumplir este logro en mi vida, gracias a ella y a su esfuerzo, es que ahora rinde frutos. Agradezco a mi familia por animarme a seguir adelante y nunca dejarme vencer por ninguna situación, por siempre creer en mí. También a mis compañeros y maestros que brindaron su apoyo ante alguna duda, ayudándome a seguir creciendo y mejorando. Y sobre todo gracias a Dios por acompañarme en cada paso a lo largo de mi carrera. PETRA NATALY ORTIZ 3 3. Resumen El ¨Manual de prácticas de la asignatura de bioquímica¨ se presenta avocando a los contenidos del mismo y está pensado como un apoyo didáctico para el estudiante, que garantiza y facilita aspectos importantes en la formación presente, y que puede auxiliarlo en sus tareas a futuro. El propósito de este manual es su uso constante en el laboratorio, para así familiarizar al estudiante con la metodología de trabajo de la Bioquímica, proporcionándole un ambiente donde tenga oportunidad de encontrarse con sustancias e instrumentos que lo motive a experimentar. El presente manual contiene 13 prácticas de laboratorio, que se pueden realizar en equipo o de manera individual. Ya que es considerado como un lugar donde el trabajo en equipo se facilita, da lugar a un proceso de constante integración, comunicación, investigación, construcción de ideas, surgimiento de nuevas preguntas, donde las actividades experimentales que mencionaremos más adelante, propicien la reorganización de conocimientos logrando alcanzar un aprendizaje significativo. Se propuso este manual para reforzar el proceso de enseñanza, requiriendo de la participación del estudiante y la guía del profesor en el laboratorio. Para que así futuras generaciones puedan llevarlo a cabo de la mejor manera. También se anexaron algunas normas de seguridad que se deben seguir dentro del laboratorio, estas incluyen normas generales y normas para manipular instrumentos y productos. Cada tema que se verá a continuación está 100% pensado para que el estudiante obtenga el mejor entendimiento. 4 4. INDICE DE CONTENIDO 5. Introducción ................................................................................................................. 6 6. Objetivo general .......................................................................................................... 7 6.1 Objetivos específicos ............................................................................................. 7 7. Justificación ................................................................................................................. 7 8. Marco teórico .............................................................................................................. 7 8.1 Cambios de energía ............................................................................................... 7 8.1.1 Reacciones exotérmicas.................................................................................. 8 8.1.2 Reacciones endotérmicas ............................................................................... 8 8.1.3 Transformación energética .............................................................................. 9 8.2 Aminoácidos .......................................................................................................... 9 8.2.1 Propiedades de los aminoácidos ................................................................... 10 8.2.2 Ninhidrina en aminoácidos............................................................................. 10 8.3 Cromatografía ...................................................................................................... 11 8.2.4 Clasificación de las técnicas cromatográficas................................................ 11 8.2.5 Etapas en la realización de una cromatografía .............................................. 13 8.3 Reacción de adamkiewicz.................................................................................... 14 8.4 Enzimas ............................................................................................................... 14 8.4.1 Cinética enzimática........................................................................................ 15 8.5 Carbohidratos ...................................................................................................... 17 8.5.1 Monosacáridos .............................................................................................. 17 8.5.2 Disacáridos .................................................................................................... 21 8.5.3 Polisacáridos ................................................................................................. 22 8.6 Calorimetría ......................................................................................................... 24 8.7 Glucolisis.............................................................................................................. 25 8.8 Ácido cítrico ......................................................................................................... 26 8.8.1 Producción y propiedades del ácido cítrico.................................................... 27 8.9 Electroforesis ....................................................................................................... 28 9. Resultados ................................................................................................................ 30 10. Conclusiones y recomendaciones ........................................................................... 30 11. Competencias desarrolladas ................................................................................... 31 5 12. FUENTES DE INFORMACION ............................................................................... 31 13. ANEXOS ................................................................................................................. 35 13.1 Normas de seguridad en el laboratorio ............................................................ 35 13.1.1 Normas generales ....................................................................................... 35 13.1.2 Normas para manipular instrumentos y productos ...................................... 35 13.2 Manual de prácticas de bioquímica................................................................. 36 6 5. Introducción Las prácticas de laboratorio en este manual corresponden a la necesidad de presentar demostraciones de los conocimientos revisados durante el curso de bioquímica en el programa educativo del Instituto Tecnológico de Matamoros. La bioquímica es una ciencia joven que alberga un conjunto de conocimientos sobre los componentes moleculares de la célula, sus interacciones y reacciones, de esta forma brinda un panorama general del funcionamiento celular. Dicho estudio es básico para el entendimiento de la vida a cualquier nivel y de cualquier especie. Las practicas son una forma sencilla de demostrar los fenómenos y características de las principales biomoléculas (glúcidos y proteínas) así como la ruta inicial del metabolismo energético. El estudio de la bioquímica es básico para integrar los conocimientos adquiridos en cada una de las áreas terminales de la carrera, y serán de gran utilidad en el desempeño profesional; debido a los avances vertiginosos en la tecnología a partir de la mitad del siglo pasado, que han acompañado y favorecido el mejor conocimiento. La clase teórica tiene como complemento la actividad práctica, obteniendo la ayuda necesaria para que los estudiantes adquieran destrezas para conocer y experimentar las propiedades físicas, químicas y biológicas de las moléculas. Debido a que se utilizan materiales provenientes de diversos seres vivos, es importante la seriedad y responsabilidad para el estudio detallado de los antecedentes académicos, la metodología a utilizar y para contar con reactivos y material limpio y suficiente, así como conocer y aplicar las normas oficiales vigentes y las buenas prácticas de laboratorio. Uno de los problemas a resolver son las técnicas y métodos, estos fueron actualizados con la finalidad de que cada grupo de alumnos pueda obtener resultados exactos, precisos y específicos. Esta asignatura aporta al perfil profesional del ingeniero bioquímico e ingeniero ambiental, los conocimientos que permiten su desarrollo y utilización en los diferentes procesos industriales necesarios para diseñar, seleccionar, adaptar, operar, controlar, simular, optimizar y escalar equipos y procesos en los que se aprovechen de manera sustentable los recursos bióticos relacionados con el campo de acción del ingeniero, así que en las siguientes practicas veremos experimentalmente un poco de lo mucho que puede realizar un futuro ingeniero ambiental. 7 6. Objetivo general Realizar un manual de prácticas de la asignatura de bioquímica para utilizarlo como complemento a la asignatura, cumpliendo con los requisitos dados en el temario impuestos por el Tecnológico Nacional de México. 6.1 Objetivos específicos -Complementar la materia de Bioquímica de la mejor manera, de forma que el alumnado, comprenda los temas de la asignatura. -Investigar las aplicaciones de la Bioquímica y llevarlas a cabo en el laboratorio. -Vincular la teoría aprendida en clase con la práctica. Promoviendo la participación activa en cada una de ellas, además, se pretende motivar al alumno a la investigación y al estudio de situaciones que relacionen hechos y fenómenos de la vida cotidiana en ellas, obteniendo conocimientos cada vez más precisos en el laboratorio. 7. Justificación La Práctica en el Instituto Tecnológico de Matamoros es el espacio de integración teóricopráctico, donde se da con mayor madurez, la construcción e integración de conocimientos en pro de la cualificación continua de la acción profesional, una construcción basada en vivencias que permite la articulación entre el pensar, el sentir y el actuar, con un ciclo continuo de "acción - reflexión - acción", frente al compromiso social que se adquiere, cuando se elige y ejerce la profesión. Lo anterior, hace necesaria la divulgación de un Manual de Práctica que proporcione estrategias académicas en la continua cualificación profesional de los estudiantes del ITM, que les permita enfrentarse al entorno, con seguridad y responsabilidad, lo cual, sólo será posible, si se posee el conocimiento, tanto de la profesión, como de las normas que rigen las acciones de ésta. 8. Marco teórico La Bioquímica es una ciencia que estudia la composición química de los seres vivos, especialmente las proteínas, carbohidratos, lípidos y ácidos nucleicos. Intenta comprender la base química de la vida: las moléculas que componen las células y los tejidos, que catalizan las reacciones químicas del metabolismo celular como la digestión, la fotosíntesis y la inmunidad, entre otras muchas cosas. También es empírica y, por tanto, su desarrollo está ligado a la observación y a la experimentación. Para generar conocimientos, la Bioquímica utiliza el denominado método científico. El método científico es un método o procedimiento que ha caracterizado a la ciencia natural, que consiste en la observación sistemática, medición, experimentación, la formulación, análisis y modificación de las hipótesis. 8 8.1 Cambios de energía En las reacciones químicas se producen transformaciones de energía, además de materia. La energía interna de una sustancia es la suma de todas las energías de esa sustancia, debida a las posiciones y los movimientos de las partículas subatómicas, de los átomos y de las moléculas que la constituyen, y a las uniones de los átomos. Las sustancias almacenan energía en sus átomos y moléculas. Estas partículas materiales pueden tener tres tipos de movimientos: de traslación, de rotación y de vibración. Según esto los átomos o moléculas poseen energía cinética debida a estos continuos movimientos. La energía aumentará con la temperatura, ya que un aumento de ésta supone una mayor agitación molecular. Pero los sistemas no sólo poseen energía por los movimientos de las partículas, sino también por la posición relativa de unas partículas respecto a otras, es decir, poseen energía potencial, que resulta menor en los gases que en los líquidos y en éstos menor que en los sólidos, pues sus moléculas se hayan más próximas. En las moléculas también hay energía debida a los enlaces entre sus átomos. Incluso en los propios átomos también hay energía, según las posiciones y los movimientos de sus partículas elementales. La suma de todas estas energías es la energía interna En todas las reacciones químicas se produce una variación en la energía interna de las sustancias que intervienen. En el estado inicial los reactivos tienen una energía interna y en el estado final los productos tienen otra. La diferencia de energía entre ambos estados se absorbe (reacciones endoenergéticas) o se desprende en la reacción (reacciones exoenergéticas), Si el sistema químico disminuye su energía, la comunica al medio ambiente, y si la aumenta, es porque la ha absorbido de él. Atendiendo al intercambio de energía en forma de calor con el exterior, las reacciones se clasifican en exotérmica y endotérmicas. 8.1.1 Reacciones exotérmicas La termoquímica es una parte de la química que estudia la relación del calor con las reacciones químicas. A las reacciones químicas que liberan calor se les llaman exotérmicas. A temperatura ambiente, el calor liberado por una reacción química es suficiente para producir un aumento de temperatura que percibes al tocar el tubo de ensayo o matraz y sentirlo “caliente”. Las moléculas excitadas del vidrio vibran tan intensamente que al tocarlas pueden lastimar o “quemar” tu piel dependiendo de la cantidad de calor generado. (Reacción exotérmica, s.f.) Una reacción exotérmica es aquella que al efectuarse libera (genera o produce) calor. 8.1.2 Reacciones endotérmicas Una reacción endotérmica es aquella que para efectuarse necesita calor. A temperatura ambiente, algunas reacciones endotérmicas toman el calor suficiente del medio en que se encuentran, para producir una disminución de temperatura observable. La reacción se siente “fría al tacto”. Para que observes un ejemplo, observa el siguiente video: Las reacciones exotérmicas y endotérmicas, de manera general, se llaman reacciones térmicas para resaltar el papel del calor en el cambio. (Reacción endotérmica, s.f.) 9 8.1.3 Transformación energética Una transformación de energía es el cambio de energía de una forma a otra. El Principio de conservación de la energía indica que la energía no se crea ni se destruye; sólo se transforma de unas formas en otras. En estas transformaciones, la energía total permanece constante; es decir, la energía total es la misma antes y después de cada transformación. En el caso de la energía mecánica se puede concluir que, en ausencia de rozamientos y sin intervención de ningún trabajo externo, la suma de las energías cinética y potencial permanece constante. Este fenómeno se conoce con el nombre de Principio de conservación de la energía mecánica. La bioenergética, o termodinámica bioquímica, es el estudio de los cambios de energía que acompañan a reacciones bioquímicas. (Transformaciones energéticas, s.f.) 8.2 Aminoácidos Los aminoácidos son compuestos orgánicos que contienen las funciones ácido carboxílico y amino. Dos aminoácidos se pueden unir en condiciones adecuadas, a través de un enlace amida, formando un dipéptido. El dipéptido puede incorporar un tercer aminoácido, formando un tripéptido. Cadenas con más de 50 aminoácidos se denominan proteínas. (Fernández, German, s.f. Aminoácidos) Figura 1 Enlace Peptídico. Se denomina enlace peptídico, al enlace que une los dos aminoácidos para formar el dipéptido (Fig. 1). Los aminoácidos se pueden clasificar en a, b o g-aminoácidos dependiendo de la posición del grupo amino en la cadena carbonada (Fig. 2). Figura 2 Clasificación de los aminoácidos. Son especialmente importantes los a-aminoácidos, puesto que pertenecen a esta familia los 20 aminoácidos que forman parte de las proteínas. Se observa que todos los aminoácidos obtenidos a partir de proteínas (naturales) pertenecen a la serie L (grupo amino a la izquierda en la proyección de Fischer, Fig. 3). 10 Figura 3 Proyección de Fisher 8.2.1 Propiedades de los aminoácidos Los aminoácidos son compuestos sólidos; incoloros; cristalizables; de elevado punto de fusión (habitualmente por encima de los 200ºC); solubles en agua; con actividad óptica y con un comportamiento anfótero. La actividad óptica se manifiesta por la capacidad de desviar el plano de luz polarizada que atraviesa una disolución de aminoácidos, y es debida a la asimetría del carbono α (alfa), ya que se halla unido (excepto en la glicina) a cuatro radicales diferentes. Esta propiedad hace clasificar a los aminoácidos en Dextrógiros (+) si desvían el plano de luz polarizada hacia la derecha, y Levógiros (-) si lo desvían hacia la izquierda. El comportamiento anfótero se refiere a que, en disolución acuosa, los aminoácidos son capaces de ionizarse, dependiendo del pH, como un ácido (cuando el pH es básico), como una base (cuando el pH es ácido) o como un ácido y una base a la vez (cuando el pH es neutro). En este último caso adoptan un estado dipolar iónico conocido como zwitterión. Figura 4 Estado dipolar iónico. El pH en el cual un aminoácido tiende a adoptar una forma dipolar neutra (igual número de cargas positivas que negativas) se denomina Punto Isoeléctrico. La solubilidad en agua de un aminoácido es mínima en su punto isoeléctrico. (Propiedades de los aminoácidos, s.f.) 8.2.2 Ninhidrina en aminoácidos Es un reactivo común para la detección de amoniaco, aminas primarias y secundarias, también es utilizada con fines cuantitativos para la determinación de aminoácidos. 11 Reacciona con todos los grupos amino para formar un producto colorido azul o púrpura (llamado púrpura de Ruhemann). La amina se condensa con una molécula de ninhidrina para dar una base de Schiff. En este paso, debe haber también un protón alfa para la transferencia de base de Schiff, por lo que una amina terciaria no puede ser detectada por la prueba de ninhidrina. La reacción de ninhidrina con aminas secundarias da una sal de iminio generalmente de color amarillo-anaranjado. Es una de las reacciones más sensibles para identificar aminoácidos en general, ya que detecta una parte de aminoácido en 1 500 000 partes de agua. Aminoácidos y muchas aminas primarias dan un color violeta característico. La prolina da coloración amarilla. Por su sensibilidad esta reacción se emplea para valoración cuantitativa de aminoácidos por colorimetría. 8.3 Cromatografía La Cromatografía es una técnica de separación en la que los componentes de una muestra se separan en dos fases: una fase estacionaria de gran área superficial, y una fase móvil. El objetivo de la fase estacionaria es retrasar el paso de los componentes de la muestra. Cuando los componentes pasan a través del sistema a diferentes velocidades, estos se separan en determinados tiempos. Cada componente tiene un tiempo de paso característico a través del sistema, llamado tiempo de retención. La separación cromatográfica se logra cuando el tiempo de retención del analito difiere del resto de componentes de la muestra. La cromatografía puede ser preparativa y analítica. • • La cromatografía preparativa se refiere a la separación de los componentes de una mezcla para su posterior procesamiento, y se puede considerar un método de purificación. En la cromatografía analítica generalmente se hace con una pequeña muestra permitiendo para cuantificar la proporción relativa de los componentes en la mezcla. La cromatografía es una de los principales métodos analíticos y permite la separación y cuantificación de sustancias muy similar en estructura y propiedades químicas. (TP Laboratorio químico, s.f. ¿Qué es la cromatografía?) 8.2.4 Clasificación de las técnicas cromatográficas De acuerdo con la forma del lecho cromatográfico: Cromatografía plana Se realiza sobre papel u otro material sólido. Suele llamarse “en capa fina” o “en capa delgada” porque la fase estacionaria recubre un soporte plano y rígido. (Cromatografía, s.f.) 12 Figura 5 Cromatografía plana Cromatografía ascendente en capa fina Cromatografía ascendente en capa fina: colocación de una muestra (con 3 componentes), desarrollo de la cromatografía y revelado del cromatograma. Rf es el factor de retardo o retraso, que mide la movilidad relativa de cada componente con respecto al máximo posible, la distancia recorrida por el frente de fase móvil. Componente 1: Rf = a / D Componente 2: Rf = b / D Componente 3: Rf = c / D Figura 6 Cromatografía ascendente. 1: aplicación de la muestra 2: se sumerge el extremo inferior en la fase móvil 3 a 5: la fase móvil asciende por capilaridad y se va produciendo la separación de los componentes 6: se marca el frente de avance del disolvente y se deja secar la placa 7: revelado de los componentes ya separados y medida de su avance. Cromatografía en columna F.M. líquida, F.E. sólida: columnas de varios mm de diámetro y varios cm de longitud. F.M. gas, F.E. sólida: columnas de unos 5 mm de diámetro y 1-20 m de longitud. 13 F.M. gas, F.E. líquida: columnas “capilares”, con menor diámetro y 30-100 m (incluso más) de longitud. Avance de las moléculas por la columna. Figura 7 Cromatografía en columna. Funcionamiento de una columna, mostrando la carga de la muestra y diversos momentos a lo largo de la elución: 1. 2. 3. 4. Muestra depositada sobre el lecho cromatográfico La muestra penetra en el lecho Se añade fase móvil Comienza la separación de los componentes de la muestra 7. Eluye el primer componente 9. Eluye el segundo componente De acuerdo con el estado físico de las fases Cromatografía de gases Con fase móvil gaseosa: • • Cromatografía gas-líquido Cromatografía gas-sólido Cromatografía líquida Con fase móvil líquida: • • Cromatografía líquido-líquido Cromatografía líquido-sólido 8.2.5 Etapas en la realización de una cromatografía Cromatografía en columna 1.- Preparación del soporte y fase estacionaria. 1.1.- Equilibrado de la columna. 2.- Aplicación de la muestra. 14 3.- Elución: a) Lavado de componentes no retenidos. b) Liberación, desplazamiento o elución propiamente dicha de los componentes retenidos. 4.- Recolección de fracciones o análisis del efluente en continuo. 5.- Análisis, cuantificación o revelado. 6.- Regeneración de la fase estacionaria. Cromatografía plana (papel o capa fina) 1.- Preparación del soporte y fase estacionaria. 2.- Aplicación de la muestra. Secado. 3.- Desarrollo de la cromatografía. 4.- Secado de la placa. 5.- Revelado y cuantificación en su caso. 8.3 Reacción de adamkiewicz La reacción de Adamkiewicz es parte de una prueba bioquímica que se utiliza para detectar la presencia del aminoácido triptófano en las proteínas. Cuando el ácido sulfúrico concentrado se combina con una solución de proteína y ácido glioxílico, se produce un color rojo / púrpura. Lleva el nombre de su descubridor, Albert Wojciech Adamkiewicz. El ácido sulfúrico puro y una cantidad mínima de formaldehído puro, junto con un agente oxidante introducido en el ácido sulfúrico, permiten que prosiga la reacción. En esta reacción de oxidación-reducción, el agente oxidante puede ser la amalgama de sodio, que reduce el ácido oxálico, mientras que el agente reductor es el ácido nítrico, que oxida un alcohol. La reducción del ácido oxálico se realiza en una solución de ácido sulfúrico evitando un aumento de temperatura dentro del cátodo. Una vez finalizada la reducción, el ácido oxálico disminuye y el ácido glioxílico liberado produce las moléculas de indol, lo que le da el color rojo / púrpura. 8.4 Enzimas Las enzimas son proteínas que se comportan como catalizadores muy potentes y eficaces de las reacciones químicas de los sistemas biológicos. (Cinética enzimática, 2010) La catálisis enzimática es esencial para los sistemas vivos. La mayoría de las reacciones químicas ocurrirían muy lento en condiciones biológicamente significativas. Hace posible que en condiciones fisiológicas tengan lugar 15 reacciones que sin catalizador requerirían condiciones extremas de presión, temperatura o pH. Las biomoléculas son muy estables a pH neutro, temperatura suave y ambiente acuoso. • Catalizadores Como catalizadores, los enzimas actúan en pequeña cantidad y se recuperan indefinidamente, in vivo. No llevan a cabo reacciones que sean energéticamente desfavorables, sino que solamente aceleran las que espontáneamente podrían producirse. ΔGo <0 Los enzimas son catalizadores específicos: cada enzima cataliza un solo tipo de reacción, y casi siempre actúa sobre un único sustrato o sobre un grupo muy reducido de ellos. Esto es cierto in vivo, peor no in vitro, lo cual es el origen de las Biotransformaciones. • Estructura-actividad catalítica La actividad catalítica depende del mantenimiento de la conformación proteica nativa. Si se desnaturaliza la proteína o se disocia en subunidades pierde su actividad. Estructuras 1°, 2°, 3° y 4° son esenciales. El sustrato es reconocido por la enzima (centro de reconocimiento) y Biotransformado en el centro activo. • Cofactor (coenzima) Átomo, ion o molécula que participa en el proceso catalítico sin ser enzima ni substrato. Los cofactores participan de dos maneras distintas: 1. A través de una fijación muy fuerte a la proteína y no son modificados en el ciclo catalítico. – cofactor. 2. Como un segundo substrato; se ven modificados en el ciclo catalítico y por lo general requieren otra enzima para volver al estado original. - coenzima 8.4.1 Cinética enzimática La cinética enzimática estudia la velocidad de las reacciones catalizadas por enzimas. Estos estudios proporcionan información directa acerca del mecanismo de la reacción catalítica y de la especifidad del enzima. La velocidad de una reacción catalizada por un enzima puede medirse con relativa facilidad, ya que en muchos casos no es necesario purificar o aislar el enzima. La medida se realiza siempre en las condiciones óptimas de pH, temperatura, presencia de cofactores, etc, y se utilizan concentraciones saturantes de sustrato. En estas condiciones, la velocidad de reacción observada es la velocidad 16 máxima (Vmax). La velocidad puede determinarse bien midiendo la aparición de los productos o la desaparición de los reactivos. (Cinética enzimática, s.f.) Figura 8 Cinética enzimática Al seguir la velocidad de aparición de producto (o de desaparición del sustrato) en función del tiempo se obtiene la llamada curva de avance de la reacción, o simplemente, la cinética de la reacción. A medida que la reacción transcurre, la velocidad de acumulación del producto va disminuyendo porque se va consumiendo el sustrato de la reacción (Figura de la derecha). Para evitar esta complicación se procede a medir la velocidad inicial de la reacción (v0). La velocidad inicial de la reacción es igual a la pendiente de la curva de avance a tiempo cero (Figura de la derecha). De esta forma, la medida de v0 se realiza antes de que se consuma el 10% del total del sustrato, de forma que pueda considerarse la [S] como esencialmente constante a lo largo del experimento. Además, en estas condiciones no es necesario considerar la reacción inversa, ya que la cantidad de producto formada es tan pequeña que la reacción inversa apenas ocurre. De esta forma se simplifican enormemente las ecuaciones de velocidad. Figura 9 Ecuación de velocidad Para estudiar la cinética enzimática se mide el efecto de la concentración inicial de sustrato sobre la velocidad inicial de la reacción, manteniendo la cantidad de enzima constante. Si representamos v0 frente a [S]0 obtenemos una gráfica como la de la Figura de la derecha. Cuando [S]0 es pequeña, la velocidad inicial es directamente proporcional a la concentración de sustrato, y por tanto, la reacción es de primer orden. A altas [S]0, el enzima se encuentra saturada por el sustrato, y la velocidad ya no depende de [S]0. En este punto, la reacción es de orden cero y la velocidad es máxima (Vmax). 17 Figura 10 Enzima saturada por sustrato 8.5 Carbohidratos La fuente principal de energía para casi todos los asiáticos, africanos y latinoamericanos son los carbohidratos. Los carbohidratos constituyen en general la mayor porción de su dieta, tanto como el 80 por ciento en algunos casos. Por el contrario, los carbohidratos representan únicamente del 45 al 50 por ciento de la dieta en muchas personas en países industrializados. (Macronutrientes, s.f.) Los carbohidratos son compuestos que contienen carbono, hidrógeno y oxígeno en las proporciones 6:12:6. Durante el metabolismo se queman para producir energía, y liberan dióxido de carbono (CO2) y agua (H2O). Los carbohidratos en la dieta humana están sobre todo en forma de almidones y diversos azúcares. Los carbohidratos se pueden dividir en tres grupos: monosacáridos, disacáridos y polisacáridos. 8.5.1 Monosacáridos Los monosacáridos son moléculas relativamente pequeñas que constituyen la base estructural de carbohidratos más complejos. Estos varían en términos de su estructura y de su configuración estereoquímica. (Raven, P.H. 2014, Isómeros de azúcar) Los monosacáridos son compuestos derivados de aldehídos o cetonas y contienen al menos tres átomos de carbono en su estructura. No pueden sufrir procesos de hidrólisis para descomponerse en unidades más simples. El número tan alto de moléculas que pueden formar los monosacáridos hace posible que sean ricos tanto en información como en función. De hecho, los carbohidratos son las biomoléculas más abundantes en los organismos. La unión de los monosacáridos da lugar a los disacáridos – como la sacarosa, lactosa y maltosa – y a polímeros de mayor tamaño como el glucógeno, el almidón y la celulosa, los cuales desempeñan funciones de almacenamiento energético, además de funciones estructurales. • Características generales de los monosacáridos Apariencia 18 De manera general, los monosacáridos son sustancias sólidas, de color blanco y de apariencia cristalina con sabor dulce. Como son sustancias polares, son altamente solubles en agua e insolubles en disolventes no polares. Enlaces glicosídicos Pueden enlazarse con otros monosacáridos por medio de enlaces glicosídicos y formar una diversidad de compuestos, de gran importancia biológica y estructuralmente muy variados. Son los carbohidratos más sencillos Los monosacáridos son los carbohidratos más sencillos. Estructuralmente son hidratos de carbono y muchos de ellos pueden ser representados con la fórmula empírica (CH2O)n. Representan una fuente importante de energía para las células y forman parte de distintas moléculas indispensables para la vida, como el ADN. Compuestos por átomos de carbono Los monosacáridos están compuestos por átomos de carbono, oxígeno e hidrógeno. Cuando se encuentran en solución, la forma predominante de azúcares (como la ribosa, la glucosa o la fructosa) no es una cadena abierta, sino que forman anillos energéticamente más estables. Los monosacáridos más pequeños están constituidos por tres carbonos y son la dihidroxiacetona y los d- y l- gliceraldehido. Grupo hidroxilo y carbonílico El esqueleto carbonado de los monosacáridos no posee ramificaciones, y todos los átomos de carbono, excepto uno, posee un grupo hidroxilo (-OH). En el átomo de carbono restante se encuentra un oxígeno carbonílico que puede estar combinado en un enlace acetal o cetal. • Estructura Figura 11 Estructura de un monosacárido Estereoisomería 19 Los monosacáridos – con la excepción de la dihidroxiacetona – poseen átomos de carbono asimétrico, es decir, están enlazados a cuatro elementos o sustituyentes distintos. Estos carbonos son los responsables de la aparición de moléculas quirales y por tanto de isómeros ópticos. Hemiaceles y hemicetales Los monosacáridos tienen la capacidad de formación de anillos gracias a la presencia de un grupo aldehído que reacciona con un alcohol y genera un hemiacetal. Igualmente, las cetonas pueden reaccionar con un alcohol y general un hemicetal. Los diagramas de Haworth sugieren que la estructura de los monosacáridos posee una estructura plana, sin embargo, esta visión no es cierta. Los anillos no son planos por la geometría tetraédrica presente en sus átomos de carbono, por ello pueden adoptar dos tipos de conformaciones, llamadas silla y navío o nave. La conformación en forma de silla es, en comparación con la de nave, más rígida y estable, por esta razón es la conformación que predomina en las disoluciones que contienen hexosas. En la forma de silla se pueden distinguir dos clases de sustituyentes, llamados axial y ecuatorial. En las piranosas, los grupos hidroxilo ecuatoriales sufren procesos de esterificación con mayor facilidad que los axiales. • Propiedades Mutarrotación y formas anoméricas de la d-glucosa Cuando se encuentran en disoluciones acuosas, algunos azúcares se comportan como si tuvieran un centro asimétrico adicional. Por ejemplo, la d-glucosa existe en dos formas isómeras que se diferencian en la rotación específica: la α-d-glucosa β-d-glucosa. A pesar que la composición elemental es idéntica, ambas especies varían en términos de sus propiedades físicas y químicas. Cuando estos isómeros entran en solución acuosa, se evidencia un cambio en la rotación óptica a medida que pasa el tiempo, alcanzando un valor final en el equilibrio. Este fenómeno se denomina mutarrotación y ocurre cuando se mezclan un tercio de isómera alfa con dos tercios del isómero beta, a una temperatura promedio de 20 °C. Modificación de los monosacáridos Los monosacáridos pueden formar enlaces glicosídicos con alcoholes y aminas para formar moléculas modificadas. Del mismo modo, pueden ser fosforilados, es decir, un grupo fosfato puede ser añadido al monosacárido. Este fenómeno es de gran importancia en diversas rutas metabólicas. 20 A medida que la glicólisis avanza, se generan otros intermediarios metabólicos, como la dihidroxiacetona fosfato y el gliceraldehído 3-fosfato, que son azúcares fosforilados. El proceso de fosforilación otorga una carga negativa a los azúcares, evitando que estas moléculas puedan abandonar la célula fácilmente. Además, les da reactividad para que puedan formar enlaces con otras moléculas. Acción del pH en los monosacáridos Los monosacáridos son estables en ambientes a altas temperaturas y con ácidos minerales diluidos. En contraste, cuando son expuestos a ácidos muy concentrados, los azúcares sufren un proceso de deshidratación que produce derivados aldehídicos del furano, llamados furfurales. Cuando los furfurales se condensan con los fenoles, producen sustancias coloreadas que pueden ser usados como marcadores en el análisis de los azúcares. Por otro lado, los ambientes alcalinos suaves producen reordenaciones en torno al carbono anomérico y al carbón contiguo. Cuando se trata a la d-glucosa con sustancias básicas se crea una mezcla de d-glucosa, d-frutosa y d-manosa. Estos productos ocurren a temperatura ambiente. Cuando ocurre un incremento de la temperatura o de las concentraciones de sustancias alcalinas, los monosacáridos sufren procesos de fragmentación, polimerización o reordenación. • Funciones Fuente de energía Los monosacáridos, y los carbohidratos de manera general, los elementos indispensables en la dieta como fuentes de energía. Además de funcionar como combustible celular y almacenamiento de energía, funcionan como metabolitos intermediarios en las reacciones enzimáticas. Interacción celular También pueden estar enlazados a otras biomoléculas – como proteínas y lípidos – y cumplir funciones claves relacionadas con la interacción celular. Los ácidos nucleicos, ADN y ARN, son las moléculas responsables de la herencia y poseen en su estructura azúcares, específicamente pentosas. La d-ribosa es el monosacárido que se encuentra en el esqueleto del ARN. Los monosacáridos también son componentes importantes de lípidos complejos. Componentes de los oligosacáridos y polisacáridos Los monosacáridos son los componentes estructurales básicos de los oligosacáridos (del griego oligo, que significa pocos) y de los polisacáridos, que contienen muchas unidades de monosacáridos, ya sea de una sola clase o variados. 21 • Clasificación Cetonas y aldehídos Los monosacáridos se clasifican de dos maneras distintas. La primera depende de la naturaleza química del grupo carbonilo, ya que este puede ser una cetona o un aldehído. La segunda clasificación se enfoca en el número de átomos de carbono presente en el azúcar. Cetosas y aldosas Por ejemplo, la dihidroxiacetona contiene un grupo cetona y por ello se le llama “cetosa”, en contraste con el gliceraldehido que contiene un grupo aldehído y se considera una “aldosa”. A los monosacáridos se les asigna un nombre en específico dependiendo del número de carbonos que contenga su estructura. Así, un azúcar con dos, tres, cuatro, cinco, seis y siete átomos de carbono se denominan diosas, triosas, tetrosas, pentosas, hexosas y heptosas, respectivamente. De todas las clases de monosacáridos mencionados, las hexosas son, por mucho, el grupo más abundante. Ambas clasificaciones pueden combinarse y el nombre otorgado a la molécula es una mezcla del número de carbonos y del tipo de grupo carbonilo. En el caso de la glucosa (C6H12O6) es considerada una hexosa porque presenta seis átomos de carbono y además es una aldosa. Según las dos clasificaciones esta molécula es una aldohexosa. Del mismo modo, la ribulosa es una cetopentosa. 8.5.2 Disacáridos Los disacáridos (di- = “dos”) se forman cuando dos monosacáridos se unen por medio de una reacción de deshidratación, también conocida como reacción de condensación o síntesis por deshidratación. En este proceso, el grupo hidroxilo de un monosacárido se combina con el hidrógeno de otro, libera una molécula de agua y forma un enlace covalente conocido como enlace glucosídico. 22 Figura 12 Enlace glucosídico. En algunos casos, es importante saber cuáles átomos de carbono de los dos anillos del azúcar están unidos a través de un enlace glucosídico. A cada átomo de carbono de un monosacárido se le asigna un número, comenzando con el carbono terminal más cercano al grupo carbonilo (cuando el azúcar se encuentra en su forma lineal). Arriba se muestra la numeración de la glucosa y la fructosa. En una molécula de sacarosa, el carbono 1 de la glucosa está unido al carbono 2 de la fructosa, por lo que se llama enlace 1-2 glucosídico. Entre los disacáridos comunes se encuentran la lactosa, la maltosa y la sacarosa. La lactosa es un disacárido compuesto de glucosa y galactosa y se encuentra de manera natural en la leche. Mucha gente adulta no puede digerir la lactosa, lo que causa intolerancia a la lactosa (la cual tus amigos o tú seguramente conocen). La maltosa, o azúcar de malta, es un disacárido compuesto de dos moléculas de glucosa. El disacárido más común es la sacarosa (azúcar de mesa), la cual se compone de glucosa y fructosa. 8.5.3 Polisacáridos Los polisacáridos son largas moléculas de hidratos de carbono formadas por la unión de numerosas unidades individuales de monosacáridos unidas entre sí por enlaces glicosídicos. Los polisacáridos son carbohidratos, y por lo tanto contienen carbono, hidrógeno, y oxígeno y tienen la fórmula general Cx(H2O)y. Convencionalmente, se ha considerado polisacárido a aquel polímero constituido por más de 10 monosacáridos unidos por distintos enlaces glucosídicos; los compuestos de menos de 10 monosacáridos (entre 2 y 9) son los oligosacaridos. A pesar de esta distinción, la gran mayoría de los polisacáridos naturales contienen cientos de monómeros y, en ocasiones, varios miles. No producen verdaderas soluciones, sino más bien dispersiones de tamaño coloidal; puros no tienen color, aroma o sabor. Su peso molecular, que puede llegar a ser hasta de millones, es en realidad un promedio de los pesos, puesto que las moléculas no son iguales y siempre presentan una distribución de valores. 23 Los polisacáridos se encuentran como cadenas lineales, o bien, ramificadas, que a su vez pueden estar integradas por un solo tipo de monosacárido (homopolisacárido). De cualquier manera, sus componentes siempre están unidos regularmente con una secuencia y estructura repetitivas, representando polímeros con un alto grado de ordenación. (Polisacáridos, 2013) De los hidratos de carbono contenidos en la mayoría de los tejidos animal y vegetal, los polisacáridos son los más abundantes; los azúcares libres generalmente están en una menor concentración. Interaccionan fuertemente con las proteínas en los sistemas biológicos lo cual determina muchas de las funciones celulares; la unión entre estos polímeros se efectúa principalmente por enlaces electrostáticos, aun cuando pueden existir puentes de hidrógeno, hidrófobos y, en ocasiones, covalentes. Algunos de estos complejos forman geles cuando se calientan y producen una estructura ordenada tridimensional en la que queda atrapada el agua. De acuerdo con su función biológica los polisacáridos se han divido en dos grandes grupos: 1. Los que constituyen la estructura celular y les confieren rigidez a los tejidos (celulosa, pectinas, gomas). 2. Los que representan la reserva energética de animales y vegetales (glucógeno, inulina y almidón). • Características de los polisacáridos Forman puentes de hidrógeno intermoleculares muy fuertes Producen fibras muy rígidas Insoluble en agua Enlaces glucosídicos generalmente B Muy resistentes a enzimas, microorganismos y agentes químicos Sus dispersiones son de alta viscosidad En los polisacáridos, al igual que la de los oligosacáridos, la hidrólisis depende del pH, la temperatura, el tipo de enlace glucosídico, la configuración anomérica y la presencia de grupos voluminosos (vg. sulfatos) que ejercen un efecto estabilizador. Por ejemplo, los α-D-enlaces del almidón son más susceptibles que los β-D-enlaces de la celulosa; a su vez, los α(I, 3) se rompen más fácilmente que los α(I, 6) o los α (I, 4). Las uniones en que intervienen furanosas (fructosa) son más labiles que en las que contienen piranosas. La presencia de grupos sulfato estabiliza los enlaces glucosídicos a pesar de que éstos en forma individual. Son muy sensibles a los ácidos. Los azúcares anhidros, como la 3,6-anhidro-galactosa, son sumamente hábiles y aceleran la hidrólisis de los polisacáridos. Al igual que otras 24 macromoléculas, estos polímeros también pueden tener una conformación ordenada o carecer de ella y estar al "azar"; cada una de éstas es el resultado de las interacciones que tienen sus monómeros constituyentes y que, en términos generales, se agrupan en su entropía conformacional. Debido al gran número de uniones covalentes y no covalentes, los polisacáridos, con un cambio muy pequeño en su energía interna, presentan una cierta rotación y flexibilidad de movimiento. Las estructuras de hélice, como en el almidón y la celulosa, son más ordenadas y rígidas, que las estructuras al azar. Los polisacáridos se encuentran en forma natural en muchos alimentos, pero en algunas ocasiones se añaden a otros para obtener la formulación correcta, coma en el caso del almidón, la carragaenina y las pectinas, que se utilizan por sus propiedades funcionales. Por su gran capacidad de retener agua, producen partículas coloidales muy hidratadas, razón por la cual a los polisacáridos se les da el nombre de hidrocoloides. 8.6 Calorimetría La Calorimetría es la parte de la física que se encarga de medir la cantidad de calor generada o perdida en ciertos procesos físicos o químicos. El aparato que se encarga de medir esas cantidades es el calorímetro. Consta de un termómetro que está en contacto con el medio que está midiendo. En el cual se encuentran las sustancias que dan y reciben calor. Las paredes deben estar lo más aisladas posible ya que hay que evitar al máximo el intercambio de calor con el exterior. De lo contrario las mediciones serían totalmente erróneas. (André Patricio, 2013, ¿Qué es la calorimetría?) También hay una varilla como agitador para mezclar bien antes de comenzar a medir. Básicamente hay dos tipos de calorímetros. Los que trabajan a volumen constante y los que lo hacen a presión constante. Figura 13 Calorímetro La cantidad de calor que recibe o transmite un cuerpo está determinada por la siguiente fórmula: Q = m x Ce x (Tf – Ti) 25 Donde Q es el calor, m es la masa del cuerpo, Ce es el calor específico del cuerpo, que está determinada por el material que lo compone. Y la variación de temperatura se representa por la diferencia entre Tf y Ti (temperatura final e inicial). Cuando un cuerpo transmite el calor hay otro que lo recibe. Este es el principio del calorímetro. El termómetro es el que determinara la temperatura final del proceso también llamada temperatura de equilibrio. El líquido más usado es el agua, que actúa como receptor de las calorías que transmite el cuerpo. 8.7 Glucolisis La Glucolisis o glicolisis es la ruta metabólica mediante la que se degrada la glucosa hasta dos moléculas de piruvato, a la vez que se produce energía en forma de ATP y de NADH. (Tejedor MC, 2014) La ruta está formada por diez reacciones enzimáticas: 3 irreversibles y 7 reversibles Es una ruta metabólica universalmente distribuida en todos los organismos y células. - Se considera que tiene 2 fases o etapas: a) Preparatoria: Cuatro reacciones: dos son de fosforilación y consumen 2 ATP por molécula de glucosa. La ruptura de la hexosa-BP acaba en 2 de gliceraldehido-3-P. b) De beneficios: Oxidación del gliceraldehido-3-fosfato (x 2) hasta piruvato (x 2) y formación acoplada de ATP en 2 de las reacciones, en total se forman 4 ATP y 2 NADH. 26 Figura 14 Glucolisis Regulación de la glucolisis Se realiza sobre las tres enzimas que catalizan las tres reacciones irreversibles, que, junto a la catalizada por la fosfoglicerato quinasa (7), son fuertemente exergónicas. Figura 15 Regulación de la glucolisis. 8.8 Ácido cítrico Los ácidos carboxílicos son los ácidos orgánicos, se encuentran ampliamente distribuidos en la naturaleza, ya sea en su forma original o en la de alguno de sus derivados (ésteres, amidas y anhídridos); por ejemplo: el ácido cítrico se encuentra en las frutas como los limones y las naranjas; el ácido acético en el vinagre; el ácido láctico se produce en la leche cuando esta inicia su descomposición, dando como consecuencia un sabor “agrio”. (Muñoz-Villa Alejandra, 2014, Acido cítrico) Los ácidos carboxílicos pueden ser de origen natural y/o sintético, donde se destacan el ácido cítrico ampliamente usado como reactivo en síntesis orgánica. El ácido cítrico (ácido 2-hidroxi-1,2,3- propanotricarboxílico), es uno ácido orgánico que puede ser considerado natural, sin embargo, también puede ser sintetizado vía laboratorio, es un ácido orgánico que se encuentra en casi todos los tejidos animales y 27 vegetales, se presenta en forma de ácido de frutas en el limón, mandarina, lima, toronja, naranja, piña, ciruela, guisantes, melocotón, así como en los huesos, músculos y sangre de animales. Es considerado un ácido carboxílico versátil y ampliamente utilizado en el campo de la alimentación, de los productos farmacéuticos y cosméticos, entre otros. (Thangavelu y col. 2011). Físicamente es un polvo cristalino blanco que puede presentarse de manera anhidra o como mono hidrato, considerado un tríacido carboxílico. Figura 16 Estructura química del ácido cítrico. Actualmente, la producción mundial de ácido cítrico se estima en millones de toneladas por año, destacando que la producción en su mayoría es lleva a cabo por fermentación, donde se involucra el uso de dextrosa o melaza de caña de azúcar como materia prima y Aspergillus niger como organismo de fermentación. El constante aumento en su consumo cada año, genera la necesidad de encontrar nuevas alternativas para su obtención. 8.8.1 Producción y propiedades del ácido cítrico La producción de ácidos orgánicos mediante el uso de microorganismos constituye una fuerza motriz de gran importancia para el estudio de regulaciones metabólicas, lo cual permite el desarrollo de la biotecnología. La producción industrial del ácido cítrico surgió como resultado de experimentación sistemática y exhaustiva desde los trabajos pioneros de James Currie en 1917 (Papagianni y col. 2007). Sin embargo, no es sino hasta épocas más recientes que los avances en fisiología microbiana permiten lograr un mayor entendimiento de la relación entre medio ambiente y acumulación de ácido cítrico (López y col 2006). La obtención del ácido cítrico está fuertemente influenciada por la composición del medio, especialmente en los procesos de fermentación sumergida. Se ha demostrado que los factores que afectan principalmente a la fermentación cítrica son el tipo y la concentración de la limitación de fuente de carbono, nitrógeno y fosfato, pH, aire, la concentración de oligoelementos, y la morfología del microorganismo productor. Ciertos nutrientes tienen que presentarse en exceso (tales como azúcares y proteínas), otros en los niveles limitantes (aquellos que contengan fosfato) y otros por debajo de los valores umbral bien establecidos. Bioquímica de la Producción de Ácido Cítrico 28 Para revisar la bioquímica de la formación de ácido cítrico se puede decir que el exceso de producción de ácido cítrico requiere una combinación única de las condiciones nutricionales inusuales (exceso de fuente de carbono, iones de hidrógeno y el oxígeno disuelto, y altas concentraciones de ciertos metales traza y de fosfato), que influyen sinérgicamente el rendimiento de fermentación (Papagianni y col. 2007). El ácido cítrico es un intermediario en el ciclo de los ácidos tricarboxílicos (CAT) o ciclo de Krebs. Las funciones de este ciclo son generar energía en forma de ATP en conjunción con la fosforilación oxidativa durante el metabolismo aeróbico de carbohidratos y crear precursores de otros ciclos biosintéticos como aminoácidos. En condiciones ambientales que promueven el desarrollo celular el ciclo funciona en estado estacionario, los intermediarios que lo constituyen se mantienen a niveles bajos sin acumulación de alguno en particular. Tal acumulación resultaría en un ineficiente uso de los nutrientes. El mantenimiento de dicho estado estacionario se efectúa mediante una regulación precisa de enzimas presentes en rutas metabólicas que alimentan el ciclo o que parten de él. Las enzimas pueden ser controladas a nivel de síntesis de proteínas (represión o inducción) o de actividad enzimática (inhibición o activación) (López y col. 2006). Algunas Aplicaciones El uso de compuestos acidulantes en la conservación y mejora de propiedades organolépticas en alimentos es extenso, en particular, los ácidos que contienen uno o más carboxilos son aditivos alimentarios importantes. Estos ácidos orgánicos, son intermediarios o productos terminales de ciclos metabólicos básicos por lo cual ocurren en una gran variedad de organismos vivientes. Tales compuestos incluyen los ácidos cítrico, málico, láctico, acético, tartárico, fumárico y glucónico. (García y col. 1993). El ácido cítrico se utiliza principalmente en la industria alimentaria debido a su agradable sabor ácido y su alta solubilidad en agua. Las industrias farmacéuticas y cosméticas retienen el 10% de su utilización y el resto se utiliza para otros fines. 8.9 Electroforesis La mayoría de las biomoléculas poseen una carga eléctrica, cuya magnitud depende del pH del medio en el que se encuentran. Como consecuencia, se desplazan cuando se ven sometidas a un campo eléctrico. (Electroforesis de proteínas, s.f.) Se denomina electroforesis a la técnica mediante la cual se separan las biomoléculas en disolución cuando se ven sometidas a un campo eléctrico. Se trata de una técnica fundamentalmente analítica, aunque también se puede realizar con fines preparativos. Cada molécula se desplaza por efecto del campo, alcanzando rápidamente una velocidad constante al equilibrarse la fuerza impulsora (fuerza del campo eléctrico) con la resistencia al avance (fuerza de fricción o rozamiento) impuesta por el medio en el que se desplaza. Fuerza del campo eléctrico=Fuerza de fricción 29 q⋅E=f⋅v q = carga (C) E = intensidad del campo (V/m = N/C) f = coeficiente de fricción (C·V·s / m2 = kg/s) v = velocidad de la molécula (m/s) El coeficiente de fricción mide la resistencia intrínseca debida a las características de cada molécula, siendo éstas esencialmente su forma y su tamaño. Así, por ejemplo, las moléculas grandes y de forma irregular poseen un mayor coeficiente de fricción que las pequeñas y compactas. La velocidad por unidad de campo recibe el nombre de movilidad electroforética, μ (Z = número entero; e = carga del electrón). En unas condiciones determinadas de electroforesis, la diferente movilidad de cada molécula definirá su separación en el espacio; al ir transcurriendo el tiempo, se van separando progresivamente unas de otras. Al ser el medio de soporte a su vez un polielectrolito, está constituido por iones, que son atraídos y así recubren los iones de la muestra, lo que altera el comportamiento de éstos en el campo. Todo ello hace que el tratamiento teórico cuantitativo de la electroforesis sea muy difícil y que esta técnica resulte poco útil para obtener información precisa sobre la estructura de las moléculas. Sin embargo, es enormemente útil como técnica analítica y preparativa. Se suele hablar de 3 tipos de electroforesis: • • • De frente móvil: los componentes de la muestra están presentes en toda la disolución y se determina ópticamente la posición del frente de avance o frontera con el disolvente. Zonal: la muestra se aplica como una mancha o banda y sus componentes migran a través de un disolvente, utilizando además un medio que da soporte a éste. En este caso no se determina la movilidad, sino que el único objetivo de la técnica es separar los componentes de la muestra. Continua: la muestra se aplica también en una zona, pero se suministra continuamente a lo largo del proceso Aplicaciones Determinación de la masa molecular 30 Como se ha indicado, se puede obtener una estimación de la masa molecular (en kDa) de proteínas empleando SDS-PAGE, y de fragmentos de DNA (en pb) empleando electroforesis en agarosa. En ambos casos, en uno de los pocillos del gel se carga una mezcla de moléculas patrón de tamaño conocido, con el fin de poder trazar la curva de calibrado. Para las proteínas, la validez del dato obtenido depende de que la desnaturalización con SDS haya sido completa y de que se hayan separado las subunidades gracias a la reducción con mercaptoetanol; además, la presencia de oligosacáridos en las glicoproteínas altera la movilidad, que ya no proporciona valores de masa molecular fiables. Isoenzimas Las variantes de una enzima, con pequeñas diferencias en su estructura y en su actividad enzimática, se analizan rutinariamente mediante electroforesis o, en especial, mediante isoelectroenfoque. De hecho, los nombres de las isoenzimas derivan a veces de su movilidad electroforética. Se puede aplicar análogamente a las isoformas de proteínas no enzimáticas. Mapas de restricción Una de las formas de estudiar la secuencia de los ácidos nucleicos, en especial el DNA, consiste en tratarlo con distintas enzimas de restricción, analizar mediante electroforesis en gel de agarosa los fragmentos resultantes e intentar reconstruir la secuencia de la molécula original formando su mapa de restricción, uno de los tipos de mapa físico. Secuenciación de ácidos nucleicos La obtención de la secuencia completa, nucleótido a nucleótido, también depende del análisis electroforético de fragmentos de DNA, tanto en el método químico de Maxam y Gilbert como en el método enzimático de Sanger. Se utilizan en este caso geles de poliacrilamida, debido al tamaño pequeño de los fragmentos, pudiéndose resolver fragmentos que se diferencian en un solo nucleótido. 8.10 Fotosíntesis La fotosíntesis es un proceso químico que convierte dióxido de carbono en compuestos orgánicos utilizando la energía lumínica, normalmente energía solar. Este proceso se realiza en determinadas células vegetales a partir de materia inorgánica. La fotosíntesis se produce en las plantas, las algas, y algunos grupos de bacterias. En estos procesos fotosintéticos la energía lumínica se transforma en energía química estable. Sin embargo, no todos los organismos que utilizan la luz como fuente de energía efectúan la fotosíntesis. (Planas Oriol, 2018, ¿Qué es la fotosíntesis?) Este proceso permite reducir la cantidad de dióxido de carbono (CO2) en la atmósfera de una manera natural. Tiene una importancia crucial para la vida en la Tierra. Reacción química de la fotosíntesis Durante la fotosíntesis, con la mediación de las moléculas de clorofila, la radiación solar convertirá seis moléculas de CO2 y seis moléculas H2O en una molécula de glucosa (C6H12O6), que es un azúcar fundamental para la vida de la planta. 31 La fotosíntesis es el proceso primario de producción de moléculas orgánicas de sustancias inorgánicas. Como subproducto de la reacción, se libera oxígeno (seis moléculas) a través de los estomas que se encuentran en la hoja. La fórmula de la reacción es la siguiente: 6 CO2 + 6 H2O → C6H12O6 + 6 O2. 8.10.1 Fases de la fotosíntesis La fotosíntesis de la clorofila, también llamada fotosíntesis oxigénica, se lleva a cabo por etapas en dos fases: • Fase luminosa La fase luminosa o reacción dependiente de la luz es el paso de la fotosíntesis en la que se convierte energía solar en energía química. La clorofila y otros pigmentos fotosintéticos como el caroteno absorben la luz. La se utiliza para fragmentar una molécula de agua, por lo que se produce oxígeno como residuo. • Fase oscura La fase oscura es un conjunto de reacciones que se realizan sin luz. (no necesariamente de noche). Durante esta fase, la planta convierte el dióxido de carbono y otros compuestos en glucosa. Estas reacciones toman los productos de la fase luminosa que son básicamente ATP (adenosín trifosfato) y NADPH (nicotín adenín dinucleótido fosfato) y realizan más procesos químicos sobre ellos. Las reacciones de la fase oscuras son la fijación del carbono y el Ciclo de Calvin. 8.10.2 Elementos que intervienen en la fotosíntesis Los factores externos más importantes que intervienen en el rendimiento de la fotosíntesis son: • La temperatura: cada especie vegetal tienen un intervalo de temperaturas en la que se siente más cómoda. • La concentración de dióxido de carbono: el rendimiento aumenta con la concentración de CO2. • La concentración de oxígeno: cuanto más oxígeno, menor rendimiento. • La intensidad luminosa: a mayor intensidad luminosa, mayor rendimiento. • El tiempo de iluminación: existen especies que presentan una mayor producción fotosintética cuanto mayor sea el número de horas de luz. • La abundancia de agua. • El color de la luz: dependiendo del color de la luz y de las características de la especie, la conversión fotosintética es distinta. 8.11 Clorofila 32 Las clorofilas son una familia de pigmentos que se encuentran en las cianobacterias y en todos aquellos organismos que contienen plastos en sus células, lo que incluye a las plantas y a los diversos grupos de protistas que son llamados algas. (La clorofila, s.f.) • Función La función de las clorofilas es la absorción de energía luminosa en la variante de la fotosíntesis que llamamos fotosíntesis oxigénica, la que es característica de los organismos antes enumerados. El principal papel de las clorofilas en la fotosíntesis es la absorción de fotones de luz con la consiguiente excitación de un electrón. Ese electrón excitado cede su energía, volviendo al estado normal, a algún pigmento auxiliar (a veces otras clorofilas), donde se repite el fenómeno. Al final el electrón excitado facilita la reducción de una molécula, quedando así completada la conversión de una pequeña cantidad de energía luminosa en energía química, una de las funciones esenciales de la fotosíntesis. Además del papel citado, el de pigmento primario de la antena fotosintética, las clorofilas abundan en los fotosistemas como pigmentos auxiliares, los que se van transfiriendo la energía de excitación de la manera mencionada en el párrafo anterior. • Estructura química La estructura de la molécula de clorofila tiene dos partes: un anillo de porfirina (sustituida con pequeños grupos enlazados, sustituyentes) y una cadena larga llamada fitol. El anillo de porfirina es un tetrapirrol, con cuatro anillos pentagonales de pirrol enlazados para formar un anillo mayor que es la porfirina. La hemoglobina de la sangre y otras proteínas contienen también una porfirina, que en ese otro caso constituye lo principal de un grupo hemo; y también se encuentra porfirina en la estructura de la vitamina B12. El grupo hemo contiene un átomo de hierro (Fe); la porfirina de la clorofila lleva en lugar equivalente un átomo de magnesio (Mg2+). La absorción de determinados picos del espectro de radiación (ver gráfica más abajo) es una propiedad de aquellas moléculas orgánicas que contienen dobles enlaces conjugados (dobles enlaces alternando con enlaces simples); puede verse en las fórmulas desarrolladas contiguas que el anillo porfirínico es rico en tales enlaces. El fitilo (o resto de fitol; llamamos resto o residuo a la parte de una molécula incorporada a la estructura de otra mayor) es una cadena hidrocarbonada con restos de metilo (-CH3) a lo largo. Tiene, como todas las cadenas orgánicas basadas sólo en C e H, un carácter “hidrófobo”; es decir, que repele al agua. La cadena del fitilo sirve para anclar la molécula de clorofila en la estructura anfipática de los complejos moleculares en que residen las clorofilas. • Localización en las células Las clorofilas se encuentran en las membranas de los tilacoides, que en las cianobacterias son invaginaciones de la membrana plasmática, y en los plastos de las células eucarióticas son vesículas distribuidas por su interior. Las clorofilas aparecen insertas en la membrana, a las que se anclan por la cadena lateral constituida por un resto de fitol, asociadas a proteínas y otros pigmentos, con los que forman los fotosistemas. 33 Cada fotosistema contiene alrededor de 200 moléculas de clorofila, además de pigmentos auxiliares, con los que constituye la llamada antena. La antena está formada por conjuntos ordenados de moléculas de clorofila, otros pigmentos y proteínas, que se llaman complejos colectores de la luz. Sólo una molécula de clorofila a en cada fotosistema convierte propiamente la energía radiante (luz) en energía química, cuando recibe un fotón con energía suficiente desde las moléculas de la antena, que se la van pasando. • Espectro de absorción y color Las clorofilas tienen típicamente dos picos de absorción en el espectro visible, uno en el entorno de la luz azul (400-500 nm de longitud de onda), y otro en la zona roja del espectro (600-700 nm); sin embargo, reflejan la parte media del espectro, la más nutrida y correspondiente al color verde (500-600 nm). Esta es la razón por la que las clorofilas tienen color verde y se lo confieren a los organismos, o a aquellos tejidos, que tienen cloroplastos activos en sus células, así como a los paisajes que forman. Fuera de las plantas verdes, que son de este color, las clorofilas van acompañadas de grandes cantidades de pigmentos auxiliares, principalmente carotenoides y ficobilinas, que son de distinto color y dominan el conjunto, tiñendo al organismo de colores como el amarillo dorado típico de los cromófitos, o el rojo púrpura de las algas rojas. 9. Metodología El trabajo se realizará consultando con las diferentes bibliografías que están disponibles tanto en el temario y las encontradas en diferentes universidades. Para este proyecto lo primero que debemos conocer son las unidades, que fueron proporcionadas por el temario “A007 Bioquímica”. Una vez conocido estos temas procedimos a la investigación de las practicas, donde consultamos distintos tipos de practicas tanto de proyectos de investigación como tesis. Recopilamos todas las practicas referentes a los temas y seleccionamos solo algunas prácticas, posteriormente diseñamos/creamos formato para nuestro manual con un estilo a las Normas Oficiales Mexicanas donde nuestro objetivo fue que los alumnos tengan cierta familiaridad con este manual y finalmente acomodamos y adaptamos las prácticas para nuestro proyecto. 10. Resultados Se realizó con éxito el manual de practicas de la asignatura de Bioquímica (ANEXO II). 11. Conclusiones y recomendaciones Se creo y desarrolló un Manual de prácticas de la asignatura de Bioquímica, donde se espera que dicho manual sirva como base para las nuevas generaciones. Además, la importancia de implementarlo radica en el hecho de que sirve de plataforma para el desarrollo al interior de la institución, dando una serie de actividades, procesos y procedimientos, encaminados a lograr que las características de éste cumplan con los 34 requisitos del profesor a cargo de la clase y claro de igual manera con el estudiante. Con ello, esperar que el laboratorio mantenga una constante vanguardia. Se espera que este proyecto se actualice constantemente con base a las experiencias y opiniones de los alumnos y se mejore con el paso del tiempo y de los avances tecnológicos para la carrera de ingeniería bioquímica y ambiental. También se desarrolló e implementó una metodología para realizar el Manual de prácticas de la asignatura de Bioquímica permitiendo cubrir los requisitos de la clase. Se recomienda que todo lo anterior se haga bajo una mejora continua. 12. Competencias desarrolladas Para las competencias que se desarrollaron en este proyecto fueron las siguientes: • Conocieron la estructura de los compuestos químicos orgánicos, sus propiedades físicas y químicas y el impacto ambiental • Identificaron, compararon y analizaron las características estructurales, y las propiedades de glúcidos y proteínas para tener una base fundamental de la diversidad de grupos funcionales para comprender el metabolismo celular. • identificaron la relación existente entre las biomoléculas y su función en los sistemas biológicos, analizaron los fenómenos bioquímicos y la vinculación con el estudio integral y comprensión del metabolismo para su aplicación en el aprovechamiento de recursos bióticos y en el diseño de sistemas de tratamiento de efluentes y residuos contaminantes. • Conocieron el efecto positivo de los microorganismos en la contaminación ambiental y su aplicación en acciones de remediación. • Identificaron y aplicaron correctamente los diferentes tipos de reacciones orgánicas: sustitución, eliminación, adición, transposición y oxido-reducción. • Aplicaron los mecanismos de reacción de las moléculas • Comprendieron, aplicaron y relacionaron la espectroscopia atómica por absorción molecular ultravioleta y visible para el análisis cualitativo y cuantitativo de diversos componentes moleculares • Emplearon conocimientos sobre estructura y función celular, para comprender los procesos metabólicos. Las competencias desarrolladas fueron aplicadas tanto en el marco teórico como en cada una de las prácticas. 13. Fuentes de información Bibliography ¿Qué es la Cromatografía? (s.f.). Obtenido de TP Laboratorio Químico: https://www.tplaboratorioquimico.com/laboratorio-quimico/procedimientos-basicos-delaboratorio/que-es-la-cromatografia.html 35 Agency for Toxic Substances and Disease Registry. (6 de Mayo de 2016). Agencia para Sustancias Tóxicas y el Registro de Enfermedades. Obtenido de Resúmenes de Salud Pública - Tolueno (Toluene): https://www.atsdr.cdc.gov/es/phs/es_phs56.html Alejandra Muñoz-Villa, A. S.-G.-L.-S. (2014). Ácido Cítrico: Compuesto Interesante . Revista Científica de la Universidad Autónoma de Coahuila. Asociación Nacional de la Industria Química. (s.f.). Asociación Nacional de la Industria Química. Obtenido de TOLUENO: https://aniq.org.mx/directorio/Productos-Quimicos/lista-empresaproducto.asp?id=3718 Becerril, I. M. (9 de Mayo de 2012). ELECTROFORESIS. Obtenido de Universidad Nacional Autónoma de México: http://depa.fquim.unam.mx/amyd/archivero/Exposicion_electroforesis_5087.pdf Cambios de energía en las reacciones químicas. (s.f.). Obtenido de Agrega Educación: http://agrega.educacion.es/repositorio/13032014/64/es_2013121113_9163343/cambios_d e_energa_en_las_reacciones_qumicas.html#:~:text=En%20las%20reacciones%20qu%C3 %ADmicas%20se,de%20energ%C3%ADa%2C%20adem%C3%A1s%20de%20materia.&t ext=En%20todas%20las%20reaccio Celada, H. D. (12 de Febrero de 2020). Práctica 3 / Separación de aminoácidos por cromatografía. Obtenido de Youtube: https://www.youtube.com/watch?v=YdtlX04h0YU&ab_channel=HectorDanielMo%20ntene groCelada Coralía Aguiar T, F. C. (20 de Junio de 2014). CROMATOGRAFÍA DE AMINOÁCIDOS. Obtenido de Laboratorios de Química: https://sites.google.com/site/laboratoriosbioquimica/bioquimica-i/cromatografia-deaminoacidos Corao, G. M. (2004). EXPERIMENTO 2 . Obtenido de web del profesor: http://webdelprofesor.ula.ve/farmacia/gmendez/manuales%20PDF/EXPERIMENTO%202 %20IDENT%20AA%2006-04.pdf Costas, G. (25 de Noviembre de 2018). ¿Qué es el ATP? Obtenido de Ciencia y Biológia: https://cienciaybiologia.com/que-es-el-atp/ Cromatografía. (s.f.). Obtenido de Biomodel: http://biomodel.uah.es/tecnicas/crom/inicio.htm Cruz, L. M. (6 de Noviembre de 2014). Manual de métodos generales para determinación de carbohidratos. Obtenido de SlideShare: https://es.slideshare.net/LeidyCristancho/manualde-mtodos-generales-para-determinacin-de-carbohidratos DÍAZ, A. (10 de Diciembre de 2002). LA ESTRUCTURA DE LAS CATALASAS. Obtenido de Universidad Autonoma de Ciudad Juarez: http://www3.uacj.mx/ICB/redcib/Documents/REB_DOC/2003/06/20032_LA%20ESTRUC_.pdf Electroforesis de proteínas. (s.f.). Obtenido de Biomodel: http://biomodel.uah.es/tecnicas/elfo/inicio.htm ELECTROFORESIS EN PAPEL DE AMINOACIDOS. (s.f.). Obtenido de Universidad Pablo de Olavide : https://www.upo.es/depa/webdex/quimfis/docencia/biotec_FQbiomol/Practica4FQB.pdf Fernández, G. (2010). Aminoácidos. Obtenido de Química Orgánica: https://www.quimicaorganica.org/aminoacidos-peptidos/525-aminoacidos.html Fernández, G. (Noviembre de 2011). obtencion del acido citrico a partir del jugo de limon. Obtenido de quimicaorganica: https://www.quimicaorganica.org/foro/80-acidoscarboxilicos/3198-obtencion-del-acido-citrico-a-partir-del-jugo-del.html Fuentes, A. (11 de Mayo de 2020). Laboratorio No. 2: Identificación de aminoácidos por cromatografía en papel - Grupo 11 Sección A. Obtenido de Youtube: https://www.youtube.com/watch?v=-e8VA2wy84I&ab_channel=AlejandraFuentes Gabriel pinto, M. M. (Septiembre de 2015). El reactivo de Tollens: de la identificación de aldehídos a su uso en nanotecnología. Aspectos históricos y aplicaciones didácticas. Obtenido de Anales de Química: https://www.researchgate.net/publication/282568021_El_reactivo_de_Tollens_de_la_ident ificacion_de_aldehidos_a_su_uso_en_nanotecnologia_Aspectos_historicos_y_aplicacione s_didacticas Gago, J. V. (17 de Febrero de 2010). Cinética Enzimática. Obtenido de Universidad Complutense 36 Madrid: https://webs.ucm.es/info/btg/personales/jvsgago/fundaments%20de%20biocatalis3%20%5 bModo%20de%20compatibilidad%5d.pdf Gelambi, M. (17 de Diciembre de 2020). Monosacáridos: características, funciones y ejemplos. Obtenido de Lifeder: https://www.lifeder.com/ejemplos-de-monosacaridos/ Jacqueline Pasillas Bautista, F. D. (2017). Practica nº6 separacion de aminoacidos por Cromatografia en Papel. Obtenido de StuDocu: https://www.studocu.com/esmx/document/universidad-autonoma-de-aguascalientes/bioquimica/practicas/practica-no6separacion-de-aminoacidos-por-cromatografia-en-papel/4822096/view Jorge Luis Contreras Vidal, E. R. (2020). LAS CIENCIAS NATURALES DESDE LAS TAREAS DOCENTES INTEGRADORAS. Editorial Académica Universitaria (Edacun). Obtenido de Universidad de las tunas . Jorge Reyes, W. Q. (Febrero de 2012). PRÁCTICA No. 2: Cromatografía en Papel. Obtenido de sisoyyomismo: https://sisoyyomismo.files.wordpress.com/2012/02/prc3a1ctica-no-2-qf-y-qaminoc3a1cidos.pdf José Peinado Peinado, F. T. (s.f.). 10. Cromatografía en papel de aminoácidos. Obtenido de Universidad de Corodoba: https://www.uco.es/dptos/bioquimica-biolmol/pdfs/10%20CROMATOGRAFIA%20PAPEL%20AAs.pdf Kark, G. (29 de Junio de 2018). Adamkiewicz reaction (Hopkin’s-cole test). Obtenido de Online Biology notes: https://www.onlinebiologynotes.com/adamkiewicz-reaction-hopkins-coletest-objective-principle-reagents-procedure-and-result/ Khan Academy. (s.f.). Carbohidratos. Obtenido de Khan Academy: https://es.khanacademy.org/science/ap-biology/chemistry-of-life/properties-structure-andfunction-of-biological-macromolecules/a/carbohydrates Khan Academy. (s.f.). El ciclo del ácido cítrico. Obtenido de Khan Academy: https://es.khanacademy.org/science/biology/cellular-respiration-andfermentation/pyruvate-oxidation-and-the-citric-acid-cycle/a/the-citric-acid-cycle Laboratorio de enzimas bioquímica. (9 de Septiembre de 2012). Obtenido de Slideshare: https://es.slideshare.net/yayitalinda0709/laboratorio-de-enzimas-bioqumica Latham, M. C. (2002). Macronutrientes: carbohidratos, grasas y proteínas. Obtenido de Food and Agriculture Organization of the United Nations: http://www.fao.org/3/w0073s/w0073s0d.htm#:~:text=Los%20carbohidratos%20son%20co mpuestos%20que,de%20almidones%20y%20diversos%20az%C3%BAcares Lozano, J. T. (s.f.). GUÍA No 9: ENSAYOS PARA RECONOCIMIENTO DE AMINOACIDOS. Obtenido de Universidad de Bogota: http://avalon.utadeo.edu.co/comunidades/estudiantes/ciencias_basicas/organica/guia_9_a minoacidos.pdf Luna, D. F. (23 de Junio de 2017). MANUAL DE PRÁCTICAS DE LA ASIGNATURA BIOTECNOLOGÍA AMBIENTAL. Obtenido de Instituto Tecnológico de Tizimín: http://www.ittizimin.edu.mx/wp-content/uploads/2018/03/BAMBI.pdf Mañas, J. M. (s.f.). CINÉTICA ENZIMÁTICA. Obtenido de University of the Basque Country: http://www.ehu.eus/biomoleculas/enzimas/enz3.htm#e Martínez Sifuentes, V., Alonso Dávila, P., López Toledo, J., Salado Carbajal, M., & Rocha Uribe, J. (2000). Simulación de procesos en ingeniería química. México: Plaza y Valdés Editores. Miñarro, J. R. (s.f.). NORMAS DE SEGURIDAD EN EL LABORATORIO . Obtenido de Quimica web: http://www.quimicaweb.net/ciencia/paginas/laboratorio/normas.html Morales, M. G. (25 de Abril de 2016). Práctica 3. Identificación de carbohidratos. Obtenido de SlideShare: https://www.slideshare.net/LesRomero/prctica-3-identificacin-de-carbohidratos OBTENCIÓN DEL ÁCIDO CÍTRICO A PARTIR DEL LIMÓN . (s.f.). Obtenido de Scribd: https://www.scribd.com/doc/287766545/Obtencion-Del-Acido-Citrico-a-Partir-Del-Limon Ofelia Esperanza Arroyo Fal, L. E. (Agosto de 2011). Química Practicas para IME . Obtenido de UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE ESTUDIOS SUPERIORES CUAUTITLÁN: http://portal.cuautitlan.unam.mx/manuales/Manual_Quimica_(Practicas_IME).pdf Pagano, A. M. (2010). Facultad de Ingeniería Universidad Nacional del Centro de la Provincia de Buenos Aires. Obtenido de Proyectos Integrales de Actividades Prácticas Inter-Cátedras basados en Estudio de Casos mediante aplicaciones de Aspen HYSYS : 37 https://www.fio.unicen.edu.ar/usuario/cgely/q13-0/Trabajos%20Practicos/piapic2010.pdf Planas, O. (24 de Agosto de 2018). Fotosintesis. Obtenido de https://solar-energia.net/cambioclimatico/fotosintesis POLISACÁRIDOS. (1 de Febrero de 2013). Obtenido de Textos Cientificos: https://www.textoscientificos.com/quimica/carbohidratos/polisacaridos Practica 10 Reacciones de carbohidratos. (s.f.). Obtenido de Universidad Autónoma MetropolitanaUnidad Iztapalapa: http://sgpwe.izt.uam.mx/files/users/uami/jaislocr/BIOQUIMICA_I/PRACTICA_7.pdf Propiedades de los aminoácidos. (s.f.). Obtenido de Universidad de Murcia : https://www.um.es/molecula/prot03.htm#:~:text=Los%20amino%C3%A1cidos%20son%20 compuestos%20s%C3%B3lidos,y%20con%20un%20comportamiento%20anf%C3%B3ter o Qué es la calorimetría. (18 de Mayo de 2013). Obtenido de Química y algo mas: https://quimicayalgomas.com/fisica/que-es-la-calorimetria/ Química, I. (Mayo de 2020). Youtube. Obtenido de producción de tolueno - Simulación de procesos: https://www.youtube.com/watch?v=b6BSXYJ6wzk&ab_channel=IngenieriaQuimica&fbclid =IwAR2jfbINTDYkxqI4Syd10ZNNBCgab_--dnx7J6QQAZbwTpWoFUfjgOOdf3k Quimica.es. (SF). Clorofila. Obtenido de https://www.quimica.es/enciclopedia/Clorofila.html Quiroz, J. A. (Diciembre de 2018). Instituto Politecnico Nacional. Obtenido de Diseño de un reactor químico para la obtención de tolueno por deshidrogenación de metilciclohexano: https://tesis.ipn.mx/bitstream/handle/123456789/26897/Dise%C3%B1o%20de%20un%20r eactor%20qu%C3%ADmico%20para%20la%20obtenci%C3%B3n%20de%20tolueno%20 por%20deshidrogenaci%C3%B3n%20de%20metilciclohexano.pdf?sequence=1&isAllowe d=y Reacción exotérmica y endotérmica. (s.f.). Obtenido de Universidad Nacional Autónoma de México: https://e1.portalacademico.cch.unam.mx/alumno/quimica1/unidad1/reaccionesQuimicas/re accionexotermicaendotermica Ronquillo, M. R. (Octubre de 2015). Manual de prácticas de bioquímica. Obtenido de Universidad Veracruzana: https://www.uv.mx/pozarica/cba/files/2017/09/9-Manual-de-practicas-debioquimica.pdf Tejedor, C. (2014). Glucolisis. Obtenido de Universidad de Alcalá: http://www3.uah.es/bioquimica/Tejedor/bioquimica_quimica/tema13.htm#:~:text=La%20Gl ucolisis%20o%20glicolisis%20es,de%20ATP%20y%20de%20NADH Transformaciones Energéticas. (2019). Obtenido de TecnologiaIndustrial: https://www.tecnologiaindustrial.es/tecnologiaindustrial/transformaciones-energeticas/ Trudy Mckee, J. R. (2013). Bioquímica las bases moleculares de la vida. México D.F: McGrawHill. 38 14. ANEXO l 13.1 Normas de seguridad en el laboratorio 13.1.1 Normas generales 1. No fumes, comas o bebas en el laboratorio. 2. Utiliza una bata y tenla siempre bien abrochada, así protegerás tu ropa. 3. Guarda tus prendas de abrigo y los objetos personales en un armario o taquilla y no los dejes nunca sobre la mesa de trabajo. 4. No lleves bufandas, pañuelos largos ni prendas u objetos que dificulten tu movilidad. 5. Procura no andar de un lado para otro sin motivo y, sobre todo, no corras dentro del laboratorio. 6. Si tienes el cabello largo, recógetelo. 7. Dispón sobre la mesa sólo los libros y cuadernos que sean necesarios. 8. Ten siempre tus manos limpias y secas. Si tienes alguna herida, tápala. 9. No pruebes ni ingieras los productos. 10. En caso de producirse un accidente, quemadura o lesión, comunícalo inmediatamente al profesor. 11. Recuerda dónde está situado el botiquín. 12. Mantén el área de trabajo limpia y ordenada. 13.1.2 Normas para manipular instrumentos y productos 1. Antes de manipular un aparato o montaje eléctrico, desconéctalo de la red eléctrica. 2. No pongas en funcionamiento un circuito eléctrico sin que el profesor haya revisado la instalación. 3. No utilices ninguna herramienta o máquina sin conocer su uso, funcionamiento y normas de seguridad específicas. 4. Maneja con especial cuidado el material frágil, por ejemplo, el vidrio. 5. Informa al profesor del material roto o averiado. 6. Fíjate en los signos de peligrosidad que aparecen en los frascos de los productos químicos. 7. Lávate las manos con jabón después de tocar cualquier producto químico. 39 8. Si te salpicas accidentalmente, lava la zona afectada con agua abundante. Si salpicas la mesa, límpiala con agua y sécala después con un paño. 9. Evita el contacto con fuentes de calor. No manipules cerca de ellas sustancias inflamables. Para sujetar el instrumental de vidrio y retirarlo del fuego, utiliza pinzas de madera. Cuando calientes los tubos de ensayo con la ayuda de dichas pinzas, procura darles cierta inclinación. Nunca mires directamente al interior del tubo por su abertura ni dirijas esta hacia algún compañero. 10. Todos los productos inflamables deben almacenarse en un lugar adecuado y separados de los ácidos, las bases y los reactivos oxidantes. 11. Los ácidos y las bases fuertes han de manejarse con mucha precaución, ya que la mayoría son corrosivos y, si caen sobre la piel o la ropa, pueden producir heridas y quemaduras importantes. 12. Si tienes que mezclar algún ácido con agua, añade el ácido sobre el agua, nunca, al contrario, pues el ácido «saltaría» y podría provocarte quemaduras en la cara y los ojos. 13. No dejes destapados los frascos ni aspires su contenido. Muchas sustancias líquidas emiten vapores tóxicos. 14. Al acabar la práctica, limpia y ordena el material utilizado. 15. Anexo ll 14.1 Manual de prácticas de bioquímica MANUAL DE PRÁCTICAS DE BIOQUÍMICA MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS ÍNDICE OBJETIVOS ................................................................................................................................ 3 RESUMEN DEL MÉTODO ..................................................................................................................... 4 REACTIVOS REQUERIDOS. ................................................................................................................ 6 SOLUCIONES PARA PREPARAR. ....................................................................................................... 7 EQUIPO REQUERIDO ........................................................................................................................... 8 MATERIAL REQUERIDO ....................................................................................................................... 9 PROCEDIMIENTO .................................................................................................................... 10 OBSERVACIONES .............................................................................................................................. 12 PREGUNTAS. ...................................................................................................................................... 13 2 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS OBJETIVOS • Observar los cambios de energía de una reacción endotérmica. • Observar e identificar una reacción exotérmica mezclando dos soluciones. 3 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS RESUMEN DEL MÉTODO. Toda reacción química puede considerarse como un proceso en el que la materia que constituye el sistema, se encuentra inicialmente en forma de ciertas sustancias (reactivos) y al final como otras muy distintas (productos). Los cambios químicos casi siempre van acompañados de cambios de energía. La combustión de materiales fósiles, tales como la hulla, los derivados del petróleo y el gas natural, constituyen en la actualidad la principal fuente de aprovisionamiento de energía de nuestra civilización. Constantemente tienen lugar numerosas reacciones químicas, muchas de ellas a nuestro alrededor. Unas ocurren a temperatura ambiente, como la decoloración de tejidos (por ejemplo, con lejía) y del pelo (con una disolución acuosa de peróxido de hidrógeno), la fermentación de la leche, la fotosíntesis, la maduración de frutas y vegetales, el revelado de fotos y la corrosión de los metales y las aleaciones. Otras reacciones químicas ocurren a temperaturas superiores al ambiente, por lo cual es necesario calentar las sustancias que participan en la reacción. Ejemplo de estas son la extracción de metales a partir de sus minerales y las reacciones de combustión. También en el cuerpo humano, animales y plantas se llevan a cabo diversas y complejas reacciones químicas, como las que ocurren durante el proceso de la respiración. Ahora bien, en las reacciones químicas no sólo ocurre la transformación de unas sustancias en otras, también en todas ellas se desprende o se absorbe energía. Las que ocurren con desprendimiento de energía en forma de calor se llaman reacciones exotérmicas. Ejemplo de esta son las que tienen lugar durante la respiración y la de combustión. Las reacciones que ocurren con absorción de energía en forma de calor se denominan reacciones endotérmicas. La fotosíntesis y la descomposición térmica de la caliza en cal viva y dióxido de carbono son reacciones endotérmicas. 4 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS El término oxidación se aplicó originalmente a la ganancia de oxígeno en una reacción; posteriormente se generalizó a las reacciones con otros elementos (por ejemplo, a la pérdida de hidrógeno) y se acuñó la palabra “reducción” para el proceso inverso. 5 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS REACTIVOS REQUERIDOS. Agua 2 g de Permanganato de potasio (KMnO4) 2 g de cloruro de amonio (NH4Cl) o tiocinato de amonio (NH4SCN) 5 ml de etanol (CH3CH2OH) Glicerina 2g de Hidróxido de bario octahidratado Ba(OH)2 • 8H2O 10 ml de peróxido de hidrógeno comercial (H2O2 6 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS SOLUCIONES PARA PREPARAR. *No se requiere 7 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS EQUIPO REQUERIDO. *No se requiere EQUIPO 8 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS MATERIAL REQUERIDO. MATERIAL 1 espátula 1 jeringa desechable Papel indicador 1 pipeta Pasteur 1 probeta de 25 ml 1 termómetro 1 vaso de precipitado de 150 ml 1 vaso de precipitado de 250 ml 1 vidrio de reloj 1 varilla de vidrio 9 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS PROCEDIMIENTO. Practica 1a. Reacción endotérmica I. Agregar aproximadamente 2 g de cristales de hidróxido de bario octahidratado [Ba(OH)2•8H2O] en un vaso de precipitado de 150 ml. II. El vaso de precipitado deberá estar sobre un vidrio de reloj el cual contendrá un poco de agua. III. Anotar la temperatura ambiente en la cual se está trabajando. IV. Agregar al vaso de precipitado los 1 g de cloruro de amonio o tiocianato de amonio, mezclar con la varilla de vidrio. Trabajar en la campana de extracción. V. La reacción es la siguiente: Ba(OH) 2 ∙8H2O (s) + 2 NH4Cl (s) → BaCl2∙2H2O (s) + 2 NH3 (a q) + 8 H2 O (l) VI. Confirmar la presencia de amoniaco usando papel indicador. VII. Anotar sus observaciones. Medir la disminución de la temperatura. Practica 1b. Reacciones exotérmicas A. Colocar una pequeña cantidad de algodón y encima 1 g de permanganato de potasio granular, en el centro de un vidrio de reloj. B. Agregar gota a gota glicerina (aproximadamente de 15 a 20 gotas) encima del permanganato de potasio. C. La reacción es la siguiente: 14 KMO4 + 4 C3H5(OH)3 → 7 K2CO3 + 7 Mn2O3 + 5 CO2 + 16 H2O. D. La reacción ocurrirá en 15 o 20 s. El producto de la reacción produce una llama de un color intenso. E. Disolver lo que quedó en el vidrio de reloj en agua y filtrar. Anotar todas las observaciones. 10 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS Practica 1c. 1. Colocar el vidrio de reloj en la campana de extracción sobre una zona resistente al calor. Agregar 6 ml de una disolución de peróxido de hidrógeno comercial y 3 ml de etanol, encender la mezcla con un cerillo. 2. Espolvorear aproximadamente 0.1 g de permanganato de potasio dentro del vidrio de reloj. Inmediatamente habrá una serie de fuertes explosiones. 3. La reacción que ocurre es la siguiente: 2MnO4 – (aq) + 5H2O2 (aq) + 6H+ (aq) → 2MnO2 (s) + 3O2(g) + 8H2O(l) 45 4. Observar lo que ocurre y anotar todas sus observaciones. 11 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS OBSERVACIONES. 12 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 1 REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS PREGUNTAS. 1.- Investigar aplicaciones enfocadas en la bioquímica de una reacción endotérmica. 2.- Investigar aplicaciones enfocadas en la bioquímica de una reacción exotérmica. 3.- ¿La temperatura inicial de las soluciones afectará el cambio final en la temperatura? 4.- ¿Cuál es la reacción que se lleva a cabo utilizando el tiocianato de amonio? 5.- ¿Cuál es el color del producto en la práctica 1a? 13 MANUAL DE PRÁCTICAS DE BIOQUÍMICA MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 2 PROPIEDADES FISICOQUÍMICAS DE LOS AMINOÁCIDOS ÍNDICE OBJETIVOS ......................................................................................................................3 RESUMEN DEL MÉTODO. ............................................................................................... 4 REACTIVOS REQUERIDOS ......................................................................................................5 SOLUCIONES PARA PREPARAR .............................................................................................6 EQUIPO REQUERIDO...................................................................................................... 7 MATERIAL REQUERIDO ...........................................................................................................8 PROCEDIMIENTO......................................................................................................................9 CÁLCULOS.....................................................................................................................10 PREGUNTAS ..................................................................................................................11 2 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 2 PROPIEDADES FISICOQUÍMICAS DE LOS AMINOÁCIDOS OBJETIVOS • Identificar las características fisicoquímicas a partir de pruebas sencillas como Ninhidrina. 3 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 2 PROPIEDADES FISICOQUÍMICAS DE LOS AMINOÁCIDOS RESUMEN DEL MÉTODO. Los aminoácidos son las unidades constituyentes de las proteínas, biomoléculas estas últimas de interés en las organizaciones estructurales y funcionales de células y tejidos. Téngase en cuenta que todas las enzimas, fundamentales para las reacciones bioquímica, y todos los anticuerpos, esenciales en los procesos de inmunidad, son proteínas y se encuentran por tanto constituidos por aminoácidos. Prueba de ninhidrina Esta prueba se utiliza para la identificación de α-aminoácidos en esta reacción intervienen dos moléculas de ninhidrina por cada molécula de aminoácido, se produce la liberación de CO2 (g), NH3 y se forma un complejo de color violeta conocido como Purpura de Ruhemann que está estabilizado por resonancia. La ninhidrina produce este color independientemente de la estructura del aminoácido original, pues la cadena lateral de los aminoácidos se pierde en forma de aldehído. Por esto esta prueba es positiva para todos los grupos libres, ya sea en aminoácidos, péptidos o proteínas. Tipo de aminoácido dependiendo del color producido en la reacción de ninhidrina. 4 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 2 PROPIEDADES FISICOQUÍMICAS DE LOS AMINOÁCIDOS REACTIVOS REQUERIDOS. Agua destilada Lisina 0.5% Aspártico 0.5% Prolina 0.5% Ninhidrina Etanol 5 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 2 PROPIEDADES FISICOQUÍMICAS DE LOS AMINOÁCIDOS SOLUCIONES PARA PREPARAR. Reactivo de ninhidrina: disolver 100 mg. de ninhidrina en 10 ml. de etanol a 95% y aforar a 100 ml con agua destilada. 6 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 2 PROPIEDADES FISICOQUÍMICAS DE LOS AMINOÁCIDOS EQUIPO REQUERIDO. EQUIPO Calentador 7 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 2 PROPIEDADES FISICOQUÍMICAS DE LOS AMINOÁCIDOS MATERIAL REQUERIDO. MATERIAL 3 tubo de ensaye 20 ml 1 pipeta graduada 5 ml 1 vaso precipitado 250 ml 8 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 2 PROPIEDADES FISICOQUÍMICAS DE LOS AMINOÁCIDOS PROCEDIMIENTO. En un tubo de ensaye agregar 2 ml de lisina posteriormente en un segundo tubo de ensaye 2 ml de aspártico y por último en un tercer tubo agregar 2 ml prolina. Después agregaremos 2 ml de ninhidrina en cada uno de los tubos y calentar en baño maría durante 6 minutos. Observar los cambios en los tubos y anotar resultados en la tabla. 9 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 2 PROPIEDADES FISICOQUÍMICAS DE LOS AMINOÁCIDOS CÁLCULOS. Tabla 1. Identificación del aminoácido Tubo Color de la mezcla Tipo de aminoácido 1 2 3 10 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 2 PROPIEDADES FISICOQUÍMICAS DE LOS AMINOÁCIDOS PREGUNTAS. 1.- ¿Para qué nos sirve conocer que tipo de aminoácido es? 2.- ¿Qué es un mecanismo de reacción? 3.- Ilustre el mecanismo de reacción de la ninhidrina. 11 MANUAL DE PRÁCTICAS DE BIOQUÍMICA MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL ÍNDICE OBJETIVOS ................................................................................................................................ 3 RESUMEN DEL MÉTODO ..................................................................................................................... 4 REACTIVOS REQUERIDOS. ................................................................................................................ 6 SOLUCIONES PARA PREPARAR. ....................................................................................................... 7 EQUIPO REQUERIDO ........................................................................................................................... 8 MATERIAL REQUERIDO ....................................................................................................................... 9 PROCEDIMIENTO .................................................................................................................... 10 OBSERVACIONES .............................................................................................................................. 12 PREGUNTAS ....................................................................................................................................... 13 2 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL OBJETIVOS Llevar a cabo la separación de aminoácidos mediante la aplicación del método indicado, usando papel cromatográfico. Analizar en qué aminoácidos se obtiene una coloración morada. Determinar la presencia de los aminoácidos presentes en la muestra problema y establecer una relación con los estándares utilizados. 3 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL RESUMEN DEL MÉTODO. La cromatografía se engloba dentro de las llamadas técnicas de separación y permite el análisis de mezclas complejas de compuestos muy estrechamente relacionados químicamente. Son varias las modalidades usadas y se clasifican según la fase móvil (de gases, líquida) y por el tipo de soporte (columna, capa fina, papel) usados. La separación se lleva a cabo según la distinta interacción que presenta cada uno de los componentes de una muestra respecto a dos fases: una estacionaria y otra móvil que fluye sobre ella. Esta interacción puede ser de varios tipos que a su vez dan lugar a distintas subclases de cromatografía: de absorción, de reparto, de cambio iónico, de afinidad, etc. En esta práctica, vamos a usar la más simple de ellas, la cromatografía ascendente sobre papel. La fase estacionaria es la celulosa del papel y la móvil una mezcla de disolventes orgánicos y agua. La celulosa retiene una cierta cantidad de agua entrelazada entre sus fibras y puede dar lugar a un mecanismo de reparto de los componentes de una muestra aplicados sobre ella cuando se hace fluir un disolvente de polaridad distinta de la del agua. Según la solubilidad que tengan los componentes de la muestra respecto de las dos fases así será su movilidad. El uso de la cromatografía en papel para la separación e identificación de aminoácidos es de gran importancia desde que fue introducida por Martin en 1944, la fase móvil empleada generalmente es una mezcla de n‐butanol/ácido acético/agua o dilución acuosa de fenol (polar y ácida), estas combinaciones de fases móviles poseen densidad mayor que otr os sistemas de solventes y requiere de por lo menos de 2 a 3 horas para que el frente del solvente alcance una distancia prudente en una placa relativamente larga. Los procesos cromatográficos tanto instrumentales como no instrumentales (en cualquiera de sus variantes), son receptivos a nuevas alternativas metodológicas y 4 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL continuamente sufren cambios que beneficien en aspectos como resolución, separación, empleo de recursos y tiempo por mencionar algunos. 5 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL REACTIVOS REQUERIDOS. Glutamina Agua Fenilalanina Treonina Arginina Sustancia desconocida proporcionada por el maestro n-butanol Acido acético 6 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL SOLUCIONES PARA PREPARAR. Fase móvil: 12 partes de n-butanol, 3 partes de acido acético y 5 partes de agua preparar para un volumen de 120 ml. Solución de ninhidrina: disolver 100 mg. de ninhidrina en 10 ml. de etanol a 95% y aforar a 100 ml con agua destilada. 7 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL EQUIPO REQUERIDO. *No se requiere EQUIPO 8 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL MATERIAL REQUERIDO. MATERIAL Vaso precipitado de 500 ml que servirá como cámara cromatográfica Probeta 50 ml Probeta 10 ml Papel whatmann Tijeras Regla 5 capilares o goteros 5 frascos ensaye pequeños Secadora de pelo en caso de no tener, utilizar horno Atomizador 9 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL PROCEDIMIENTO. 1. Realizar las mediciones de altura y circunferencia de la cámara cromatográfica en el papel Whatman. 2. Recortar dos rectángulos con las medidas de las cámaras, un rectángulo debe ser un poco más pequeño de manera que quede de esta forma. 3. Realizar pruebas para para que el cilindro menor no toque las paredes de la cámara. Si es el caso, corregir las medidas y continuar con el procedimiento. 4. En el cilindro pequeño medir en la parte inferior 1.5 cm de separación y trazar una línea horizontal, una vez trazada marcar 5 puntos de forma equitativa de esta forma. 10 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL 5. Teniendo el cilindro de papel se debe sembrar la muestra. Para esto introducir el primer cilindro (grande) en la cámara cromatográfica, humedeciéndolo para que se adhiera a las paredes, retirar el exceso de agua. 6. Introducir una pequeña cantidad de cada una de las soluciones en cada tubo. 7. Agitar los frascos e introducir un CAPILAR y poner solo una gota en el papel whatmann SE DEBE SEMBRAR CON UN CAPILAR DIFERENTE CADA SOLUCIÓN. 8. Con la secadora de pelo secar la gota y agregar otra, repetir esto hasta alcanzar las 5 muestras. 9. Identificar cada posición de la muestra 10. Cuando el cilindro este seco doblas los extremos del papel de manera que se pueda engrapar en la parte superior e inferior del final. 11. Dejar en mesa hasta que esté lista la fase móvil. 12. Preparar la fase móvil y introducir una pequeña cantidad en la cámara cromatográfica (aproximadamente a una altura de 0.5cm) posteriormente taparla. 13. Destapar la cámara cromatográfica e introduzca el cilindro (pequeño) de la fase estacionaria sin que toque el papel que la rodea NO SE DEBEN TOCAR, SI SE TOCAN NO SERVIRA EL EXPERIMENTO. 14. Después de introducir la fase estacionaria cerrar la cámara y dejar en un lugar en donde no sea movida. 15. El tiempo de espera es de 20 minutos, o dependerá de lo que indique el maestro 16. Pasado el tiempo se debe sacar la fase estacionaria. NO tocar el papel que rodea la cámara Quitar las 2 grapas. 17. Con lápiz dibujar una línea hasta donde corrió la fase móvil eluyente. Secar el exceso de solvente con la secadora. 18. Preparar la solución de ninhidrina. 19. Cuando la fase estacionaria esta seca llevarla al área de revelado y rociarla con el atomizador con la solución de ninhidrina, hacerlo con precaución. Secar con la secadora de pelo hasta obtener un cambio en la fase estacionaria. 11 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL OBSERVACIONES. 12 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 3 CROMATOGRAFÍA EN PAPEL PREGUNTAS. 1.- ¿Qué tipo de aminoácido era la muestra? 2.- ¿Qué utilidad tiene la cromatografía en papel? 3.- Escriba una conclusión sobre todas las observaciones 13 MANUAL DE PRÁCTICAS DE BIOQUÍMICA MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 4 PRUEBA DE ADAMKIEWICS. ÍNDICE OBJETIVOS ................................................................................................................................ 3 RESUMEN DEL MÉTODO ..................................................................................................................... 4 REACTIVOS REQUERIDOS. ................................................................................................................ 5 SOLUCIONES PARA PREPARAR. ....................................................................................................... 6 EQUIPO REQUERIDO ........................................................................................................................... 7 MATERIAL REQUERIDO ....................................................................................................................... 8 PROCEDIMIENTO ...................................................................................................................... 9 CÁLCULOS. .............................................................................................................................. 10 2 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 4 PRUEBA DE ADAMKIEWICS. OBJETIVOS • Propiedades fisicoquímicas de los aminoácidos, identificar las características fisicoquímicas a partir de pruebas sencillas como Prueba de Adamkiewics. 3 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 4 PRUEBA DE ADAMKIEWICS. RESUMEN DEL MÉTODO. El triptófano es un componente vital de las proteínas. Su destrucción se asocia con sabores desagradables en los alimentos irradiados y con el amarillamiento de la lana. Varios productos metabólicos son importantes en la función normal del cerebro y en la regulación del crecimiento de las plantas, y algunos son fármacos potentes. Puede ser incluso más importante en funciones actualmente desconocidas. Es nutricionalmente esencial para muchos animales y para el hombre. Debido a estos significados conocidos y sospechados. La reacción de Hopkins-Cole, también conocida como reacción del ácido glioxílico o reacción de Adamkiewics es una prueba química que se utiliza para detectar la presencia de triptófano en proteínas. La positividad se reconoce por la aparición de un anillo color violeta-rojizo. La reacción es la siguiente: 4 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 4 PRUEBA DE ADAMKIEWICS. REACTIVOS REQUERIDOS. Triptofano 1% Glicina 1% H2SO4 Reactivo de Hopkins- Cole Albumina (clara de huevo) Sustancia desconocida (proporcionada por el profesor) Agua destilada 5 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 4 PRUEBA DE ADAMKIEWICS. SOLUCIONES PARA PREPARAR. Reactivo de Hopkins- Cole Preparación: 10 mg de magnesio en 250 ml de ácido oxálico, se afora a 1 litro con agua destilada 6 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 4 PRUEBA DE ADAMKIEWICS. EQUIPO REQUERIDO. *No se requiere EQUIPO 7 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 4 PRUEBA DE ADAMKIEWICS. MATERIAL REQUERIDO. MATERIAL 4 tubos de ensaye 10 ml Pipeta graduada 5 ml Gradilla 8 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 4 PRUEBA DE ADAMKIEWICS. PROCEDIMIENTO. Rotule 4 tubos de ensayo como: • blanco • triptófano • problema • albúmina de huevo Adicione a cada uno 2 mL. de la solución correspondiente y 2 mL. del reactivo de Hopkins Cole. Mezcle bien el contenido y adicione a cada tubo por las paredes lenta y cuidadosamente, sin mezclar 1 mL. de ácido sulfúrico concentrado, pronto vera un cambio en el color de la interfase. Anote sus observaciones 9 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 4 PRUEBA DE ADAMKIEWICS. CÁLCULOS. Tabla 1 Tubo ¿Cambio en el color de la interfase? blanco triptófano problema albúmina de huevo 10 MANUAL DE PRÁCTICAS DE BIOQUÍMICA MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA ÍNDICE OBJETIVOS................................................................................................................................ 3 RESUMEN DEL MÉTODO.......................................................................................................... 4 REACTIVOS REQUERIDOS. ..................................................................................................... 6 SOLUCIONES PARA PREPARAR.............................................................................................. 7 EQUIPO REQUERIDO ............................................................................................................... 8 MATERIAL REQUERIDO............................................................................................................ 9 PROCEDIMIENTO.................................................................................................................... 10 CÁLCULOS. ............................................................................................................................. 12 PREGUNTAS. .......................................................................................................................... 13 2 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA OBJETIVOS • Conocer el mecanismo de acción de las enzimas durante una reacción química • Identificar factores que afectan la actividad enzimática • Distinguir entre inhibición competitiva e inhibición no-competitiva 3 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA RESUMEN DEL MÉTODO. Las células son sistemas abiertos y, como tales, intercambian constantemente materia, energía e información con el exterior. El metabolismo celular es el conjunto de reacciones de degradación y síntesis a través de las cuales las células intercambian materia y energía con el medio, permitiendo el mantenimiento del sistema. Para hacer posibles estos procesos a temperaturas compatibles con los tejidos vivos, la velocidad de reacción de estos procesos es modificada por los catalizadores biológicos o enzimas. El término cinética enzimática implica el estudio de la velocidad de una reacción catalizada por una enzima y los efectos que pueden tener factores como los inhibidores. Es esencial entender estos mecanismos para desarrollar nuevas herramientas moleculares, por ejemplo, para combatir enfermedades en las que se conoce a la enzima que la produce. También es usual medir la actividad enzimática con diferentes sustratos para entender su especificidad o bien, medir la actividad de la enzima de diferentes tejidos u organismos para entender cómo las diferencias en actividad están relacionadas con la función y/o la fisiología del organismo del que proceden. Las enzimas, en su mayoría proteínas o RNA (riboenzimas), son catalizadores químicos que agilizan una reacción que envuelve la formación o rompimiento de enlaces químicos. Las enzimas reducen la energía de activación necesaria para llevar a cabo una reacción; es decir, reducen la barrera de energía que hay que sobrepasar para que la reacción se lleve a cabo. Los activadores se conocen como cofactores y pueden ser tan simples como iones metálicos. Los cofactores orgánicos se conocen como coenzimas. Las enzimas pueden afectarse negativamente por inhibidores que impidan la actividad enzimática. Estos inhibidores pueden afectar el sitio activo de dos maneras: competitivamente, al bloquear 4 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA el sitio activo, o no competitivamente, al pegarse en otro lugar de la enzima y alterar indirectamente la forma del sitio activo. 5 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA REACTIVOS REQUERIDOS. Peroxido de hidrogeno 3M de HCL 3M de NaOH 6 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA SOLUCIONES PARA PREPARAR. *No se requiere 7 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA EQUIPO REQUERIDO. EQUIPO Calentador 8 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA MATERIAL REQUERIDO. MATERIAL Hígado Papa Espinaca 11 tubos de ensaye grandes Gradilla Pipeta graduada 5 ml Termómetro Hielo 3 vasos de precipitado de 100 ml Mortero 9 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA PROCEDIMIENTO. Practica 5 En esta práctica se prepararán varias muestras para obtener particular pequeñas y uniformes al mezclarlas con el agua. 1. Para preparar las muestras, corte en pedazos por separado las muestras de papa, espinaca e hígado. 2. Usando una licuadora o mortero muela el material con un poco de agua hasta diluir parte de la muestra; no muela excesivamente para que no queden pedazos muy pequeños del material. 3. Rotule cuatro tubos de ensayo con las letras A a Ia D. 2. Ponga 3 ml. de cada muestra en los tubos como sigue: A. Hígado B. Papa C. Espinaca D. Agua 3. Marque el nivel hasta donde Ilega cada muestra. 4. Ponga 3 ml. de peróxido de hidrogeno en cada tubo de ensayo. 5. Observe Ia reacción que sucede en cada tubo y marque el cambio en el nivel del líquido. 6. Tabule los resultados en Ia Tabla 1 Practica 6 1. Rotule cuatro tubos de ensayo del 1 al 4 y caliente un baño de agua con dos vasos de precipitado uno hasta 37 °C y otro hasta 80°C. 10 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA 2. Añada 5 mL de hígado en forma de muestra a cada tubo. 3. Mantenga los tubos a las siguientes temperaturas: • Tubo 1 = 80 °C por 15 minutos • Tubo 2 = 37 °C por 15 minutos • Tubo 3 = Temperatura ambiental • Tubo 4 = Hielo por 30 minutos 4. Añada 2 ml. de peróxido de hidrógeno al tubo 1. 5. Mida el tiempo transcurrido desde que se añadió el peróxido hasta que se comienzan a producir burbujas, y anótelo en la Tabla 2. 6. Repita con los demás tubos. 7. Compare sus resultados en término de tiempo de reacción vs. temperatura. Practica 7 1. Rotule tres tubos de ensayo A, B y C 2. Añada 3 ml de muestra de hígado a cada tubo. 3. Añada soluciones 3M de HCI y 3M de NaOH a los tubos como sigue, y agite suavemente hasta mezclar: • Tubo A — 3 ml de 3M HCI • Tubo B— 3 ml de 3M NaOH • Tubo C — control (sin ácido ni base) 4. Añada 3 ml. de peróxido de hidrógeno a cada tubo. 5. Observe y anote las reacciones en la Tabla 3. 11 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA CÁLCULOS. Tabla 1. Resultados producción de catalasa en varios organismos Tubo Cantidad de burbujas Cantidad de muestra consumida A B C D Tabla 2. Resultados del efecto de temperatura Tubo Temperatura 1 80°C 2 37°C 3 Ambiente 4 Hielo Tiempo que tardo en comenzar la reacción Observaciones Tabla 3. Resultados del efecto del pH sobre la actividad enzimatica Tubo Tiempo que toma la reacción en completarse Descripción comparativa de las reacciones A B C 12 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 5 a 7 ACCIÓN ENZIMATICA PREGUNTAS. 1.- ¿En dónde hubo un mayor cambio del nivel del líquido? ¿por qué? 2.- ¿En que muestra tardo más en reaccionar debido al efecto de la temperatura? ¿por qué? 3.- ¿Cuál muestra tardo más en reaccionar? ¿por qué? 13 MANUAL DE PRÁCTICAS DE BIOQUÍMICA MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS ÍNDICE OBJETIVOS ................................................................................................................................ 3 RESUMEN DEL MÉTODO ..................................................................................................................... 4 REACTIVOS REQUERIDOS. ................................................................................................................ 7 SOLUCIONES PARA PREPARAR. ....................................................................................................... 8 EQUIPO REQUERIDO ........................................................................................................................... 9 MATERIAL REQUERIDO ..................................................................................................................... 10 PROCEDIMIENTO .................................................................................................................... 11 CÁLCULOS. .............................................................................................................................. 13 PREGUNTAS. ...................................................................................................................................... 15 2 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS OBJETIVOS • Identificación de carbohidratos: Monosacáridos, disacáridos y polisacáridos. • Poder diferenciar la estructura y propiedades de mono, di y polisacáridos mediante pruebas coloreadas sencillas como Fehling, Tollens y Barfoed. • Reconocer la capacidad oxido-reductora de los monosacáridos 3 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS RESUMEN DEL MÉTODO. El sistema digestivo maneja todos los carbohidratos de la misma forma: los rompe (o trata de romperlos) en moléculas de azúcar simples, ya que sólo éstos son lo suficientemente pequeños para pasar al torrente sanguíneo. También convierte la mayoría de los carbohidratos digestibles en glucosa (también conocida como azúcar en la sangre), porque las células están diseñadas para utilizar esto como una fuente de energía universal. Los carbohidratos son biomoléculas que presentan un grupo funcional carbonilo (aldehído y cetona) y varios grupos hidroxilos en cada carbono. Los carbohidratos también llamados polihidroxicetonas azúcares, o osas compuestos o sacáridos, poliméricos son que por polihidróxialdehidos hidrólisis o producen polihidróxialdehidos y polihidroxicetonas. Según el número de unidades de azúcares sencillos que posean se clasifican en: MONOSACÁRIDOS o azúcares sencillos, que a su vez pueden ser ALDOSAS cuando contienen el grupo aldehído o CETOSAS cuando contienen el grupo cetona. Los monosacáridos naturales pertenecen a la serie D de los azúcares y pueden tener entre tres y hasta siete átomos de carbono. DISACÁRIDOS que están formados por dos monosacáridos unidos entre sí por enlaces glucosídicos. OLIGOSACÁRIDOS que tienen entre tres y diez monosacáridos unidos también por enlaces glucosídicos. POLISACÁRIDOS que son polímeros naturales con varios miles de unidades de azúcar sencillo ligadas entre sí. De acuerdo con lo anterior, además de reconocer si un compuesto pertenece a la familia de los carbohidratos, diferenciaríamos si se trata de un monosacárido tipo aldosa o cetosa, si es fácilmente oxidable o no, es decir si es un AZÚCAR REDUCTOR o no lo es, si es de cinco átomos de carbono (pentosa) o de seis átomos de carbono (hexosa), si es disacárido o polisacárido. 4 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS Prueba de Fehling. El ensayo con el licor de Fehling se fundamenta en el poder reductor del grupo carbonilo de un aldehído. Éste se oxida a un ácido carboxílico y reduce la sal de cobre (II) en medio alcalino a óxido de cobre (I), que forma un precipitado de color rojo. Un aspecto importante de esta reacción es que la forma aldehído puede detectarse fácilmente, aunque exista en muy pequeña cantidad. Si un azúcar reduce el licor de Fehling a óxido de cobre (I) rojo, se dice que es un azúcar reductor. Esta reacción se produce en medio alcalino fuerte, por lo que algunos compuestos no reductores como la fructosa (que contiene un grupo cetona) puede enolizarse a la forma aldehído dando lugar a un falso positivo. Reacción de Barfoed. Es un ensayo químico utilizado para detectar monosacáridos. Esta prueba fue descrita por primera vez por el químico danés Christen Thomsen Barfoed y se utiliza principalmente en botánica. La prueba es similar a la prueba de Fehling. El reactivo de Barfoed se compone de una solución de 0.33 molar de acetato de cobre neutro en una solución de 1% de ácido acético. No es recomendable guardar el reactivo, sino prepararlo previamente a su uso. Se basa en la reducción de cobre (II) (En forma de acetato) a cobre (I) (En forma de óxido), el cual forma un precipitado color rojo ladrillo. Los disacáridos también pueden reaccionar, pero en forma más lenta. El grupo aldehído del monosacárido que se encuentra en forma de hemiacetal se oxida a su ácido carboxílico correspondiente. Muchas sustancias, entre ellas el cloruro de sodio,3 pueden interferir en la prueba. Reactivo de Tollens Sin duda, el nombre de Tollens está asociado para la mayor parte de profesores y alumnos de Química Orgánica con el reactivo que recibe su nombre para reconocer los aldehídos. Apareció publicado en 1882. Su descubrimiento forma parte de sus trabajos de investigación para tratar de identificar compuestos químicos que obtenía a partir de árboles para utilizar en la alimentación del ganado, dentro de su labor en la Escuela de Agronomía. 5 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS El reactivo de Tollens tiene importancia desde el punto de vista didáctico no solo para identificación de aldehídos sino para el estudio de reacciones redox y, sobre todo, para que los estudiantes se den cuenta de que una forma de mantener los iones de plata en una disolución muy básica, para que puedan reaccionar con los aldehídos, es formando el complejo amoniacal. Para entenderlo, deberían escribir la reacción entre nitrato de plata e hidróxido de sodio en disolución acuosa, pues así precipitaría el hidróxido de plata (óxido de plata hidratado). Al tratarse de un sólido ya no estarían presentes los iones plata en disolución y se dificultaría la reacción con aldehídos. 6 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS REACTIVOS REQUERIDOS. Sulfato de cobre pentahidratado Tartrato sódico-potásico Hidróxido de sodio (II) Acido acético glacial Glucosa Galactosa Nitrato de plata Maltosa Hidróxido de amonio Lactosa Acetato de cobre Sustancia problema proporcionada por el profesor Agua 7 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS SOLUCIONES PARA PREPARAR. Solución de Tollens: añadir 2 gotas de una disolución de NaOH al 5% a 1 ml de disolución acuosa de AgNO3 al 5%. Agitar el tubo y añadir gota a gota y con agitación NH4OH 2N, hasta que se consiga disolver el precipitado de AgOH, que previamente se había formado. Solución de Barfoed: Pesar 13,3 g Acetato de cobre cristalizado en 200 ml de H2O destilada, filtrar si es necesario. Añadir 1,8 ml de ácido acético glacial (CH2 COOH). Solución de Fehling se divide en dos soluciones: Solución A: Disolver 3´5 gr de sulfato de cobre (II) pentahidratado en 50 mL. de agua. Solución B: Disolver 17´3 gr de tartrato sódico-potásico (KNaC4H4O6.4H2O) y 5 gr de hidróxido sódico en agua. Una vez frío, diluir hasta 50 mL con agua. Nota. El reactivo de Tollens debe ser preparado en el momento y nunca almacenado por más de un par de horas. Después de realizar el test, la mezcla resultante debe ser acidificada con ácido diluido antes de ser desechada. Estas precauciones previenen la formación del altamente explosivo fulminato de plata. Así como el reactivo de Fehling y el de Barfoed también deben ser preparados en el momento debido a la corta duración de vida que tienen estos reactivos. 8 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS EQUIPO REQUERIDO. EQUIPO Baño maría o Calentador 9 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS MATERIAL REQUERIDO. MATERIAL Tubos de ensaye Pipeta graduada 5 mL Espátula Pinzas para tubos de ensayo Cronometro 10 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS PROCEDIMIENTO. Prueba de Barfoed En cuatro tubos de ensaye introducir un 1 mL de carbohidrato a cada tubo de la siguiente forma: • Glucosa 1% • Galactosa 1% • Maltosa 1% • Lactosa 1% • Sustancia problema Agregar Reactivo de Barfoed 2,5 ml a cada una de las muestras. Mezclar y calentar en baño hirviente, contando los minutos y sacar del baño cada tubo inmediatamente después que haya aparecido el precipitado rojo ladrillo de oxido cúprico. Anotar el tiempo que corresponde a cada carbohidrato en la tabla 1. La aparición de un precipitado antes de los 6 minutos indica la presencia de un monosacárido, un escaso precipitado rojo a los 9 y 12 minutos indica la presencia de disacárido Prueba de Fehling En cuatro tubos de ensaye introducir un 1 mL de carbohidrato a cada tubo de la siguiente forma: • Glucosa 1% • Galactosa 1% • Maltosa 1% • Lactosa 1% • Sustancia problema 11 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS Agregar 1 ml del reactivo Fehling A y 1 ml del reactivo Fehling B. Mezclar bien y ponerlo a baño maría o en la flama del mechero durante cierto tiempo. Sí mira a marrón o rojo la prueba es positiva. Esta prueba es una reacción de oxidoreducción, los alcoholes del azúcar se oxidan a aldehídos y ácidos, el cobre se reduce de cúprico a cuproso por eso cambia de color la solución y se forma el precipitado. Anotar los resultados en la tabla 2. Prueba de Tollens En cuatro tubos de ensaye introducir un 1 mL de carbohidrato a cada tubo de la siguiente forma: • Glucosa 1% • Galactosa 1% • Maltosa 1% • Lactosa 1% • Sustancia problema Añadir 1 ml de reactivo de Tollens a los tubos de ensaye. Agitar perfectamente y calentar a baño maría durante 5 minutos máximo. Observar la forma de espejo de plata (las paredes del tubo se recubren con una fina capa de plata) que se forma si es positivo. 12 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS CÁLCULOS. Tabla 1 Prueba de Barfoed Tubo Resultados Observaciones Resultados Observaciones Resultados Observaciones Glucosa Galactosa Maltosa 1 Lactosa Sustancia problema Tabla 2 Prueba de Fehling Tubo Glucosa Galactosa Maltosa 1 Lactosa Sustancia problema Tabla 3 Prueba de Tollens Tubo Glucosa 13 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS Galactosa Maltosa 1 Lactosa Sustancia problema 14 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 8 IDENTIFICACIÓN DE CARBOHIDRATOS PREGUNTAS. 1.- Explique el mecanismo de reacción de cada una de las pruebas. 2.- ¿Qué es un azúcar reductor? 3.- ¿Qué efecto puede tener en el organismo, la presencia de azucares reductores en los alimentos? 4.- ¿Qué es un epímero? 15 MANUAL DE PRÁCTICAS DE BIOQUÍMICA MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 9 FERMENTACIÓN ÍNDICE OBJETIVOS ................................................................................................................................ 3 RESUMEN DEL MÉTODO ..................................................................................................................... 4 REACTIVOS REQUERIDOS. ................................................................................................................ 6 SOLUCIONES PARA PREPARAR. ....................................................................................................... 7 EQUIPO REQUERIDO ........................................................................................................................... 8 MATERIAL REQUERIDO ....................................................................................................................... 9 PROCEDIMIENTO .................................................................................................................... 10 OBSERVACIONES .............................................................................................................................. 11 PREGUNTAS. ...................................................................................................................................... 12 2 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 9 FERMENTACIÓN OBJETIVOS • Comprobar la producción de dióxido de carbono y etanol durante la fermentación de glucosa por levaduras. 3 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 9 FERMENTACIÓN RESUMEN DEL MÉTODO. Se cree que la glucólisis, es un conjunto de reacciones que ocurren en todas las células, es de las vías bioquímicas más antiguas. Tanto las enzimas como el número y los mecanismos de los pasos de la vía son muy semejantes en las procariotas y en las eucariotas. Además, la glucólisis es un proceso anaerobio, que debió ser necesario en la atmósfera carente de oxígeno de la Tierra pre-eucariota. En la glucólisis cada molécula de glucosa se divide y se transforma en dos unidades de tres carbonos (piruvato). Durante este proceso se oxidan numerosos átomos de carbono. La pequeña cantidad de energía que se captura durante las reacciones glucolíticas (alrededor del 5% de la total disponible) se almacena de forma temporal en dos moléculas de ATP (trifosfato de adenosina) y una de NADH (deshidrogenasa del dinucleótido de nicotinamida y adenina) por cada triosa. El destino metabólico subsiguiente del piruvato depende del organismo que se considere y de sus circunstancias metabólicas. En los organismos anaerobios (aquellos que no utilizan oxígeno para generar energía), el piruvato puede convertirse en productos de desecho como etanol, ácido láctico, ácido acético y moléculas semejantes. Utilizando oxígeno como aceptor electrónico terminal, los organismos aerobios, como los animales y los vegetales, oxidan por completo el piruvato para formar CO2 y H2O en un complejo mecanismo escalonado, conocido como respiración aerobia. La fermentación es un proceso catabólico, es decir, se rompe una molécula en componentes más simples. Por ejemplo, los productos finales de la degradación de la glucosa (glucólisis) pueden ser ácido láctico o alcohol, bióxido de carbono y energía química. Como se mencionó, la fermentación en los seres vivos es un proceso que no necesita oxígeno por lo que es considerada anaerobia, es propia de microorganismos como bacterias y levaduras. Sin embargo, también se produce fermentación (láctica) en el tejido muscular de los animales o los humanos cuando el aporte de oxígeno a sus células no es suficiente para el metabolismo y la contracción muscular. Desde el punto 4 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 9 FERMENTACIÓN de vista energético, la fermentación es menos eficiente porque produce 2 moléculas de ATP a partir de una molécula de glucosa, mientras que en la respiración celular aerobia se producen 38 moléculas de ATP. La fermentación ha sido utilizada por el ser humano en la producción de cerveza, vino, queso y yogurt, procesos que implican el uso de bacterias o levaduras con el fin de convertir un producto natural en un producto fermentado. De acuerdo al tipo de producto, la fermentación puede dividirse en términos generales en: láctica y alcohólica. 5 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 9 FERMENTACIÓN REACTIVOS REQUERIDOS. Solución de glucosa al 10% 6 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 9 FERMENTACIÓN SOLUCIONES PARA PREPARAR. 7 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 9 FERMENTACIÓN EQUIPO REQUERIDO. EQUIPO Balanza 8 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 9 FERMENTACIÓN MATERIAL REQUERIDO. MATERIAL 1 matraz Erlenmeyer (125 mL) Espátula Balanza Globos pequeños Levadura de cerveza activa Hoja de papel Cronometro 9 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 9 FERMENTACIÓN PROCEDIMIENTO. Colocar en el matraz Erlenmeyer 25 mL aproximadamente de solución de glucosa al 10% y agregar 1 g de levadura de cerveza. Tapar el matraz con el globo de forma que selle completamente la boca del matraz Marcar el volumen inicial de la mezcla Después de algunos minutos (tomar tiempo), observa el desprendimiento de burbujas. Observar si hay algún efecto en el globo. Por último, marca el volumen final de la mezcla y destapa el matraz, ¿Qué olor despide la mezcla? 10 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 9 FERMENTACIÓN OBSERVACIONES. 11 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 9 FERMENTACIÓN PREGUNTAS. 1.- ¿Qué sucedió en el matraz y el globo? 2.- ¿Cuáles fueron los productos obtenidos de esta reacción? 3.- Que es piruvato? 4.- Las células musculares pueden presentar también la respiración anaerobia ¿cuál es el compuesto producto de este proceso? 5.- ¿Hubo un cambio en el volumen del matraz? Si es así, explica por qué sucedió 12 MANUAL DE PRÁCTICAS DE BIOQUÍMICA MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 10 OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE JUGO DE LIMÓN ÍNDICE OBJETIVOS ................................................................................................................................ 3 RESUMEN DEL MÉTODO ..................................................................................................................... 4 REACTIVOS REQUERIDOS. ................................................................................................................ 5 SOLUCIONES PARA PREPARAR. ....................................................................................................... 6 EQUIPO REQUERIDO ........................................................................................................................... 7 MATERIAL REQUERIDO ....................................................................................................................... 8 PROCEDIMIENTO ...................................................................................................................... 9 OBSERVACIONES .............................................................................................................................. 10 PREGUNTAS. ...................................................................................................................................... 11 2 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 10 OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE JUGO DE LIMÓN OBJETIVOS • comprensión de los términos de solubilidad, pureza, reacciones ácidos bases, recristalización, etc. • Aprendizaje sobre el uso de microscopio. • Familiarizar al alumno con la técnica de extracción de ácido cítrico. 3 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 10 OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE JUGO DE LIMÓN RESUMEN DEL MÉTODO. Los ácidos carboxílicos son los ácidos orgánicos, se encuentran ampliamente distribuidos en la naturaleza, ya sea en su forma original o en la de alguno de sus derivados (ésteres, amidas y anhídridos); por ejemplo: el ácido cítrico se encuentra en las frutas como los limones y las naranjas; el ácido acético en el vinagre; el ácido láctico se produce en la leche cuando esta inicia su descomposición, dando como consecuencia un sabor “agrio”. Para revisar la bioquímica de la formación de ácido cítrico se puede decir que el exceso de producción de ácido cítrico requiere una combinación única de las condiciones nutricionales inusuales (exceso de fuente de carbono, iones de hidrógeno y el oxígeno disuelto, y altas concentraciones de ciertos metales traza y de fosfato), que influyen sinérgicamente el rendimiento de fermentación. El ácido cítrico es un intermediario en el ciclo de los ácidos tricarboxílicos (CAT) o ciclo de Krebs. Las funciones de este ciclo son generar energía en forma de ATP en conjunción con la fosforilación oxidativa durante el metabolismo aeróbico de carbohidratos y crear precursores de otros ciclos biosintéticos como aminoácidos. En condiciones ambientales que promueven el desarrollo celular el ciclo funciona en estado estacionario, los intermediarios que lo constituyen se mantienen a niveles bajos sin acumulación de alguno en particular. Tal acumulación resultaría en un ineficiente uso de los nutrientes. El mantenimiento de dicho estado estacionario se efectúa mediante una regulación precisa de enzimas presentes en rutas metabólicas que alimentan el ciclo o que parten de él. Las enzimas pueden ser controladas a nivel de síntesis de proteínas (represión o inducción) o de actividad enzimática. 4 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 10 OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE JUGO DE LIMÓN REACTIVOS REQUERIDOS. Ácido sulfúrico Agua destilada Carbonato de calcio 5 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 10 OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE JUGO DE LIMÓN SOLUCIONES PARA PREPARAR. *No se requiere 6 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 10 OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE JUGO DE LIMÓN EQUIPO REQUERIDO. EQUIPO Microscopio 7 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 10 OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE JUGO DE LIMÓN MATERIAL REQUERIDO. MATERIAL Varilla de vidrio Mechero de Bunsen Vidrio de reloj Papel tornasol Una tira de ph 6 papeles filtro Trípode Porta objeto 20 ml de jugo de limón Algodón Vaso precipitado 8 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 10 OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE JUGO DE LIMÓN PROCEDIMIENTO. a) Colocar 20 ml de jugo de limón con ayuda de un algodón filtrar el jugo en un vaso de precipitado, enjuagado previamente con agua destilada, y agregar igual volumen de agua. Luego agitar con la varilla de vidrio. b) Filtrar. Añadir al filtrado carbonato de calcio, hasta que desaparezcan las burbujas con el agitado c) En un vidrio de reloj colocar una pequeña porción de papel tornasol rojo y con la varilla de vidrio humedecida en la solución mojar el papel, verificar en la tira de PH, si es un ácido continuar agregando carbonato de calcio. d) Como el vaso de precipitado va a poseer un exceso de carbonato de calcio, filtrar nuevamente. e) Calentar lo filtrado a ebullición suave, hasta obtener un precipitado blanco. f) Filtrar nuevamente en caliente. g) Retirar, con cuidado, el papel de filtro y depositar lo obtenido en un nuevo vaso de precipitado, agregar agua destilada, de a poco hasta disolver el sólido, revolviendo constantemente. h) Agregar gota a gota ácido sulfúrico concentrado, hasta que no se forme más precipitado (aproximadamente 30 gotas de ácido sulfúrico). i) Filtrar y aguardar el líquido filtrado. Tomar una gota del líquido, con una varilla de vidrio, en un porta objeto y mirar la muestra por el microscopio. j) Evaporar la solución lentamente hasta que la solución quede a un tercio del volumen. Dejar enfriar o entibiar, y sacar una gota para mirarlo por el microscopio. 9 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 10 OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE JUGO DE LIMÓN OBSERVACIONES. 10 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 10 OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE JUGO DE LIMÓN PREGUNTAS. 1.- Escriba las reacciones implicadas en la obtención del ácido cítrico a partir de los limones 2.- Escriba detalladamente que observaciones notaron en cada paso 3.- Mencione que otro producto se podría extraer del limón 11 MANUAL DE PRÁCTICAS DE BIOQUÍMICA MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 11 ELECTROFORESIS EN PAPEL DE AMINOACIDOS ÍNDICE OBJETIVOS ................................................................................................................................ 3 RESUMEN DEL MÉTODO ..................................................................................................................... 4 REACTIVOS REQUERIDOS. ................................................................................................................ 5 SOLUCIONES PARA PREPARAR. ....................................................................................................... 6 EQUIPO REQUERIDO ........................................................................................................................... 7 MATERIAL REQUERIDO ....................................................................................................................... 8 PROCEDIMIENTO ...................................................................................................................... 9 PREGUNTAS. ...................................................................................................................................... 11 NOTAS. .................................................................................................................................... 12 2 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 11 ELECTROFORESIS EN PAPEL DE AMINOACIDOS OBJETIVOS • Comprobar la migración electroforética de los aminoácidos sometidos a un campo eléctrico en función de su carga y PI • Separación, identificación y análisis de aminoácidos. 3 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 11 ELECTROFORESIS EN PAPEL DE AMINOACIDOS RESUMEN DEL MÉTODO. La electroforesis es una técnica para la separación de moléculas según la movilidad de estas en un campo eléctrico a través de una matriz porosa, la cual finalmente las separa por tamaños moleculares y carga eléctrica, dependiendo de la técnica que se use. La técnica clásica utiliza una tira recubierta de una sustancia porosa impregnada de un electrolito. Sus extremos se sumergen en dos depósitos independientes que contienen ambos al electrolito y están unidos a los electrodos del generador de corriente. La muestra se deposita en forma de un pequeño trazo transversal en la tira. La distancia de migración se mide en relación un marcador interno. Las placas son reveladas con sales de plata, azul de Coomassie, o reactivos en particular. La electroforesis capilar (CE) es una técnica de separación que se ha desarrollado gracias a los avances de la cromatografía líquida de alta eficacia junto con los procedimientos más tradicionales de electroforesis. Esta técnica permite separar bastante bien biomoléculas, donde la cromatografía líquida se muestra menos eficaz, y compuestos de pequeña masa molecular, difíciles de estudiar por los procedimientos clásicos de electromigración en soporte. Puede decirse que cuando una molécula cargada se coloca en un campo eléctrico se moverá hacia uno u otro electrodo dependiendo de: 1) su carga eléctrica, 2) su tamaño, 3) la intensidad del campo eléctrico y 4) la temperatura del medio. Si la molécula tiene carga positiva migrará hacia el cátodo; si tiene carga negativa, hacia el ánodo. 4 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 11 ELECTROFORESIS EN PAPEL DE AMINOACIDOS REACTIVOS REQUERIDOS. Glicina 1% Ninhidrina Leucina 1% Acido aspártico 1% Etanol Muestra problema proporcionada por el profesor Lisina 1% Piridina Acido acético glacial Agua 5 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 11 ELECTROFORESIS EN PAPEL DE AMINOACIDOS SOLUCIONES PARA PREPARAR. Tampón piridina 6,1: 40 ml piridina, 3.2 ml ácido acético glacial y aforar con agua hasta 1L Solución de ninhidrina: disolver 100 mg. de ninhidrina en 10 ml. de etanol a 95% y aforar a 100 ml con agua destilada 6 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 11 ELECTROFORESIS EN PAPEL DE AMINOACIDOS EQUIPO REQUERIDO. EQUIPO Secador Una fuente de alimentación que suministre un potencial constante (300 V). Una cubeta de electroforesis en papel de celulosa. La cubeta posee dos compartimentos separados, cada uno de los cuales contiene un electrodo de platino, que deben conectarse a la fuente de alimentación mediante los cables con conectores adecuados, uno para el electrodo que hace de cátodo y otro para el que hace de ánodo. 7 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 11 ELECTROFORESIS EN PAPEL DE AMINOACIDOS MATERIAL REQUERIDO. MATERIAL Papel whatmann #1 Pinzas de madera Micropipeta Pulverizador u atomizador Tijeras Guantes Celulosa 8 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 11 ELECTROFORESIS EN PAPEL DE AMINOACIDOS PROCEDIMIENTO. Se traza con el lápiz una línea muy débil en el centro del papel. En la línea se señalan débilmente cinco puntos distribuidos equitativamente a lo ancho del papel. Al mismo tiempo se señala en el margen superior derecho de la tira de papel el signo (+), para indicar el extremo del papel que se va a situar en el compartimento de la cubeta que va a actuar como ánodo. Una vez aplicadas las muestras, se rocía ligeramente el papel con la solución tampón de electroforesis mediante el pulverizador, procurando no mojar directamente las muestras. Se quita la tapadera de la cubeta, se coge el papel con las pinzas y se coloca sobre la cubeta. Se introducen cada uno de los extremos del papel en los compartimentos de la cubeta, procurando que el extremo señalado en el papel con (+) sea el compartimento del ánodo. Si los extremos no quedan bien sumergidos en la solución tampón de electroforesis, se llenan los compartimentos con más tampón. Antes de comenzar la electroforesis, hay que asegurarse que el papel está bien humedecido. Se coloca la tapadera en la cubeta, se conecta la fuente de alimentación a la red de alimentación y se enciende la misma. Con el mando del voltaje se ajusta el potencial a unos 300 V. 9 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 11 ELECTROFORESIS EN PAPEL DE AMINOACIDOS Al cabo de media hora se apaga la fuente, se desconecta de la red, se quita la tapadera, se saca el papel de la cubeta mediante las pinzas, procurando no romperlo y se coloca encima del papel de filtro de la mesa del laboratorio. Se airea el papel para que se seque y con las pinzas de madera se sumerge en la cubeta que contiene la solución de ninhidrina. Nada más que se impregne, se saca de la solución, dejando que escurra el exceso de la misma. Se espera hasta que se produce la reacción de color la detección de los aminoácidos patrón y de la muestra problema se realiza por la aparición de las manchas de color púrpura. Los aminoácidos contenidos en la muestra problema se identifican mediante la comparación de los desplazamientos de las manchas con los correspondientes a los de los aminoácidos patrones. 10 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 11 ELECTROFORESIS EN PAPEL DE AMINOACIDOS PREGUNTAS. 1.- ¿Qué aminoácidos están presentes en la muestra problema? 2.- Señala de que factores depende el movimiento de los aminoácidos en la electroforesis en papel 3.- ¿Se podría identificar mediante esta técnica una mezcla de los aminoácidos valina y triptófano utilizando las condiciones de la práctica? 4.- ¿Qué reacción se produce entre los aminoácidos y la ninhidrina? 11 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 11 ELECTROFORESIS EN PAPEL DE AMINOACIDOS NOTAS. Las principales precauciones que hay que tener son: El papel de celulosa hay que procurar no tocarlo con los dedos. El papel hay que manejarlo con las pinzas de madera. No contaminar las soluciones de los aminoácidos patrón y de la muestra problema. Desde el momento en que se conecte la fuente de corriente a la cubeta de electroforesis, hasta que termine la misma, no se deben de tocar los cables, conexiones o disolución que esté en contacto con la corriente. 12 MANUAL DE PRÁCTICAS DE BIOQUÍMICA MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD ÍNDICE OBJETIVOS ................................................................................................................................ 3 RESUMEN DEL MÉTODO ..................................................................................................................... 4 REACTIVOS REQUERIDOS. ................................................................................................................ 6 SOLUCIONES PARA PREPARAR. ....................................................................................................... 7 EQUIPO REQUERIDO ........................................................................................................................... 8 MATERIAL REQUERIDO ....................................................................................................................... 9 PROCEDIMIENTO .................................................................................................................... 10 OBSERVACIONES .............................................................................................................................. 12 PREGUNTAS. ...................................................................................................................................... 13 2 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD OBJETIVOS • Conocer el efecto que produce la luz sobre las plantas de Elodea en condiciones de luminosidad y oscuridad. • Comprobar que las plantas producen oxígeno • Analizar que el bióxido de carbono, el agua y la luz son necesarios para que se realice la fotosíntesis 3 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD RESUMEN DEL MÉTODO. La fotosíntesis fabrica todas las moléculas orgánicas básicas que un vegetal necesita para sobrevivir, prosperar y reproducirse. De manera general, los organismos fotosintéticos posibilitan la existencia de los organismos no fotosintéticos La fotosíntesis es un proceso de anabolismo autótrofo. Constituye no sólo la forma de nutrición del reino vegetal sino por la base de la alimentación de todas las cadenas tróficas. Consta de dos fases: una luminosa y otra oscura. En ellas se produce la transformación no sólo de materia inorgánica en orgánica, sino también de energía luminosa en energía química de enlace. Para que se lleve a cabo la fotosíntesis se necesitan los siguientes elementos: Sol (energía solar), gas carbónico (CO2) que entrara por las estomas de las hojas, Clorofila, Agua y Sales minerales (absorbidas por las raíces). La fotosíntesis se realiza en los cloroplastos, donde se encuentran los pigmentos capaces de captar y absorber la energía luminosa procedente del sol. Estos pigmentos son: clorofila (verde), xantofila (amarillo) y carotenoides (anaranjados). Se trata de uno de los procesos anabólicos más importantes de la naturaleza, ya que la materia orgánica sintetizada en su transcurso permite la realización del mismo. El proceso de utilizar la energía luminosa para convertir CO2 y H20 en azucares consiste en dos series de reacciones: las reacciones luminosas y el ciclo de Calvin. Además, la fotosíntesis produce la mayor parte del oxígeno de la atmosfera, esta se realiza en dos etapas: Fase luminosa. Fase en donde se transforma la energía luminosa en química: que es usada por todos los seres vivos. Los vegetales son el primer y único eslabón productor de la cadena trófica. Esta fase depende de la luz que reciben los cloroplastos de las células vegetales que son captados por medio de la clorofila, esta energía lumínica descompone el agua en Oxigeno e Hidrogeno, liberándose el oxígeno y generándose 2 4 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD moléculas por medio del movimiento de sus electrones de un nivel a otro liberando energía para producir la molécula ATP y el poder reductor que es la molécula NADPH2 que aportaran a la fase siguiente energía química para la transformación de CO2 en Hidratos de carbono En la Fase oscura en la que ya no interviene la luz y las moléculas formadas en la fase luminosa (ATP y NADPH2) participan en la reducción del bióxido de carbono (CO2) mediante una serie de reacciones el “Ciclo de Calvin” en donde se combina Se combina CO2 con RDP (difosfato de ribulosa) para formar PGA (ác. Fosfoglicérido) Se combina PGA con NADPH2 y ATP por lo que se libera agua, se forma PGAL para la nutrición de la planta, se produce glucosa a partir de PGAL, este azúcar se disuelve en agua y recorre toda la planta proporcionándole la energía necesaria para crecer se transforma materia inorgánica en orgánica: a partir de la fuente de carbono del dióxido de carbono del aire. 5 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD REACTIVOS REQUERIDOS. Sulfato de cobre pentahidratado Tartrato sódico-potásico (II) Hidróxido sódico Glucosa 1% Agua destilada 6 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD SOLUCIONES PARA PREPARAR. Solución A: Disolver 3.5 gr de sulfato de cobre (II) pentahidratado en 50 mL. de agua. Solución B: Disolver 17.3 gr de tartrato sódico-potásico (KNaC4H4O6.4H2O) y 5 gr de hidróxido sódico en agua. Una vez frío, diluir hasta 50 mL con agua. Nota. El reactivo de Fehling debe ser preparado en el momento debido a la corta duración de vida que tienen estos reactivos. 7 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD EQUIPO REQUERIDO. EQUIPO Balanza granataria electrónica Parrilla con agitador magnético Microscopio óptico 8 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD MATERIAL REQUERIDO. MATERIAL 1 Palangana 1 pliego de papel aluminio 1 vaso de precipitados de 250 ml 2 vasos de precipitados de 600 ml 1 caja de Petri ó vidrio de reloj 2 embudos de vidrio de tallo corto 2 tubos de ensayo 1 probeta de 10 ml 1 gotero 1 espátula Cerillos 2 ramas de Elodea 9 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD PROCEDIMIENTO. I. Enjuaga con agua de la llave la planta de Elodea que se utilizará en la práctica. II. Selecciona dos ramas jóvenes. Verifica en la balanza granataria electrónica que las ramas pesen exactamente lo mismo. III. Llena la palangana con agua de la llave. Lo siguiente deberá hacerse dentro de la palangana, por debajo del agua: • Introduce un vaso de precipitados de 600 ml • Coloca una rama de Elodea dentro de un embudo de vidrio de tallo corto e introduce el embudo en forma invertida al vaso de precipitados de 600 ml, cuidando que la planta se mantenga dentro del embudo. • Posteriormente introduce un tubo de ensayo y colócalo en forma invertida en el tallo del embudo, verificando que no contenga burbujas. • Saca el montaje y colócalo sobre la mesa. Repite la misma operación con la otra rama de Elodea IV. Una vez que ya se tienen los dos montajes, colócalos a temperatura ambiente. Uno de ellos se dejará en condiciones de luminosidad natural y el otro se cubrirá con papel aluminio. V. Deja transcurrir 48 horas Después de transcurridas las 48 horas. Antes de iniciar la actividad observa ¿Qué se formó en los tubos de ensaye de los montajes que dejaste en luz y en oscuridad? VI. Enseguida toma el montaje que se dejó en condiciones de luminosidad natural y agrega más agua al dispositivo, de tal manera que, al sumergir la mano al vaso de precipitados, puedas tapar con el dedo pulgar ó índice la boca del tubo de ensayo que se encuentra invertido en el vaso de precipitados, con el propósito de impedir la salida del gas contenido en el interior del tubo. 10 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD VII. Enciende un cerillo, y espera hasta que aparezca una pequeña brasa, apaga la flama de la pajilla e introdúcela al interior del tubo que contiene el gas, observa qué le sucede a la brasa de la pajilla. VIII. Repite los pasos VI y VII con el montaje que se dejó envuelto con el papel aluminio. Practica 13 Identificación de glucosa en Elodea 1. Preparar Glucosa al 1% 2. Mezcla 2 ml de Solución A y 2 ml de Solución B en un tubo de ensayo, agrega 10 ml de la solución de glucosa al 1%. Agita suavemente. 3. Calienta en baño maría hasta la ebullición y observa lo que sucede. 4. Toma todas las hojas de la planta de Elodea del montaje que se dejó en condiciones de luz, y tritúralas en un mortero hasta obtener un homogenizado. 5. Para Preparar la prueba de identificación de glucosa debemos Mezcla 2 ml de Fehling A y 2 ml de Fehling B en otro tubo de ensayo. 6. Coloca el macerado de las hojas de Elodea. Ponlos a calentar en baño maría hasta la ebullición. 7. Realiza una preparación temporal de Elodea y observa al microscopio con el objetivo de 10x. 8. Repite la practica 13 desde el paso 4, con el montaje que se dejó en condiciones de oscuridad. Si en la prueba de identificación de glucosa, se observa el cambio de coloración de azul a naranja, indica positivo para la presencia de glucosa. Si al examinar la preparación en el objetivo de 10x se observan zonas teñidas de color naranja, indican positivo para la presencia de glucosa. 11 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD OBSERVACIONES. 12 MANUAL DE PRÁCTICAS DE BIOQUÍMICA PRÁCTICA 12 Y 13 PRODUCCIÓN DE OXÍGENO E IDENTIFICACIÓN DE GLUCOSA EN ELODEA EXPUESTA A LA LUZ Y A LA OSCURIDAD PREGUNTAS. 1.- ¿Qué sucedió con el encendedor al acercarla a los dos tubos de ensayo? ¿Por qué crees que ocurrió esto? 2.- ¿Cómo se llama lo que se produjo dentro de los tubos de ensayo? 3.- ¿Cuáles son los productos para que se inicie la fotosíntesis? 4.- ¿Cuál es el papel de la luz en la fotosíntesis? 5.- ¿Qué relación existe entre la elodea, el agua y la luz? 13