UNIVERSIDAD AUTÓNOMA “BENITO JUÁREZ” DE
OAXACA
FACULTAD DE CIENCIAS QUÍMICAS
MANUAL DE LABORATORIO DE BIOQUÍMICA
Dr. ANTONIO CASTELLANOS MARTINEZ
Semestre 2021-2022
Septiembre 2022
PRACTICA N. 1
TECNICAS BASICAS DE MEDICION BIOQUIMICA
Uso de micropipetas y uso del espectrofotómetro
Objetivo. Aprender el uso de micropipetas para la medición de volúmenes pequeños
Realizar primero las conversiones de la hoja 2
Material, equipo y reactivos
-Micropipetas de diferentes rangos de medición
-Cubetas (celdas de plástico)
- 1 vaso de precipitado
-Agua destilada
Procedimiento
Para medir con precisión, por ejemplo las cantidades del anexo 1, son necesarias las
micropipetas y que usarás la P1000 (100-1000 µL), P200 (20-200 µL) y la P20 (2-20 µL).
Considerando los volúmenes de las primeras dos columnas de la tabla, elige la micropipeta y
vierte de:
Un vaso de precipitado a un tubo Eppendorf o celda.
De un tubo Eppendorf o celda a otro tubo Eppendorf o celda.
Procedimiento. Uso de la micropipeta
1 -Elegir la micropipeta de acuerdo al volumen que vayas a colocar.
2 -Seleccionar el volumen en la pantalla
3 -Tomar la punta
4 -Presionar el émbolo hasta el primer tope (volumen seleccionado) y sumergir la punta en
el líquido (solo lo indispensable). Suelta el émbolo despacio.
5 -Selecciona el recipiente donde colocarás el volumen, que la punta tenga contacto con el
recipiente y ahora presiona suavemente el émbolo hasta los dos topes.
6 -Ahora elimina la punta oprimiendo el émbolo correspondiente.
Uso del espectrofotómetro
El profesor te mencionará las partes principales del espectrofotómetro y funcionamiento.
Revisar los componentes de un espectrofotómetro
Es importante que tengas presente el rango del espectro visible y ultravioleta, que es lo más
utilizado en bioquímica
Conversión de unidades de volumen
Convierte de µl a ml o viceversa
ml
μl
ml
μl
ml
2 ml
25 µl
0.05 ml
0.5 ml
5 µl
2.5 μl
5.5 ml
0.001ml
0.1 ml
800 µl
250μl
2 ml
0.15ml
1500 µl
2500μl
250 µl
750 µl
5 ml
1 ml
0.25 ml
10 µl
1000 µl
250 µl
μl
ml
50μl
1000μl
0.5ml
0.03ml
0.05ml
2ml
900μl
0.25ml
0.005ml
100μl
μl
500μl
60μl
0.025 ml
1750 µl
0.5 ml
ml
1ml
0.005 ml
0.025 ml
500 µl
μl
5000μl
5ml
350μl
2500μl
PRACTICA N. 2
ESPECTRO DE ABSORCIÓN DEL AZUL DE METILENO
Objetivo. Determinar la región de mayor absorbancia de una solución de azul de metileno a
diferentes nm.
Materiales, equipo y reactivos
-2 celdas
-Un espectrofotómetro
-Azul de metileno
Procedimiento
1 -En una celda colocar 1 ml de agua destilada (blanco)
2 -En la otra celda colocar 10 μl de azul de metileno y completar a 1 ml de agua.
3 -Medir la absorbancia desde 540 nm a 660 nm de 20 en 20 nm Cada vez que se cambie de
longitud de onda es necesario ajustar a cero de absorbancia con el blanco.
4. - Ahora con los datos de longitud de onda y sus respectivos valores de absorbancia, hacer
una gráfica en excell semejente a la siguiente:
5 - A que longitud de inda se debe de medir la absorbancia del azul de metileno?
PRÁCTICA No. 3
PREPARACION DE UNA CURVA PATRON
Objetivo.- Realizar una curva patrón y la medición experimental de una muestra problema
Materiales, equipo y reactivos
-13 celdas
-1 vaso de precipitado con agua destilada
-1 espectrofotómetro
-Micropipetas
-Solución de azul de metileno
Procedimiento
1 -A cada celda añadir en el orden y volúmenes indicados en la tabla (hacer por duplicado,
excepto el 1)
CURVA PATRON
Celdas
1
2
3
4
5
6
7
Azul de metileno
0
0.2
0.4
0.6
0.8
1.0
0
Agua destilada
1.0
0.8
0.6
0.4
0.2
0
0.5
Muestra problema
0
0
0
0
0
Nota: Todo es en ml
0
0.5
1 ml
2 -Ajustar el espectrofotómetro a ____nm
3 -Colocar las celda 1 en el espectrofotómetro y ajustar a cero de absorbancia (blanco).
4 -Colocar las demás celdas y determinar su absorbancia
Tabular los resultados obtenidos de la siguiente manera.
Celda
ml de azul de Concentración del azul de Absorbancia
metileno
metileno en μM
1
0
2
0.2
3
0.4
4
0.6
5
0.8
6
1.0
7
2.- Realizar en excell la gráfica de la curva patrón graficando los micromoles del azul de
metileno (x) vs la absorbancia(y). ¿Cuál es la concentración de la muestra problema (tubo 7)?
Una curva patrón siempre debe ir acompañada de los siguientes datos en la misma hoja de
la gráfica
a) Título de la grafica
b) Aparato utilizado (marca y modelo)
c) Diámetro de la celda
d) Longitud de onda
e) Fecha de realización
f) Persona quien la hizo
3.- Analiza y discute los resultados obtenidos
CUESTIONARIO
1.- ¿En la determinación en qué se pueden utilizar estas curvas patrón?
2.- ¿Qué haría usted si los puntos le quedaran muy cerca del origen?
3.-¿Para qué sirve el blanco?
PRACTICA N.4
USO DE AMORTIGUADORES EN EL LABORATORIO DE BIOQUIMICA
Requisitos de los amortiguadores biológicos
Los principales sistemas naturales de amortiguamiento son el sistema del fosfato (H2PO4/HPO4-2), las proteínas disueltas y muchos ácidos orgánicos débiles. Sin embargo, también es
importante el uso rutinario de amortiguadores en los estudios de laboratorio. Es
indispensable, para estudios in vivo e in vitro, establecer antes que nada un pH fisiológico en
el sistema y luego impedir que éste cambie en forma apreciable. Más aún, en ciertos casos la
intención puede ser determinar el efecto del pH sobre el sistema en estudio, lo cual exige la
preparación de varias soluciones, cada una con distintos valores de pH.
¿Qué puntos deben considerarse al elegir un amortiguador? El requisito primordial debe ser
que el valor del pKa sea muy cercano al pH en que se pretende usar el amortiguador.
Recuérdese que un amortiguamiento tiene su máxima eficacia en el pH idéntico a su valor
de pKa. Así, para un amortiguamiento fisiológico. El pKa debe ser cercano a 7 o estar en el
intervalo del 6 al 8. Otros requisitos son ausencia de toxicidad, estabilidad y solubilidad en el
agua.
En la tabla se identifican algunos sistemas de amortiguamiento de uso rutinario. Además de
los conocidos sistemas de amortiguamiento del fosfato y del N-tris (hidroximetil)
aminometano (abreviado TRIS), en esa lista se incluyen dos ejemplos de sustancias
zwitterionicas cada vez más usadas, las que, por razones hasta ahora desconocidas, suelen
ser superiores como amortiguadores biológicos. (Se conocen como “amortiguadores de
Good” en honor a N. E. Good, quien inició las investigaciones de desarrollo de estas
sustancias para eliminar ciertos inconvenientes de los amortiguadores clásicos.) El término
zwitterionicas se refiere a la presencia de cargas positivas y negativas en la misma sustancia
molecular. Debido a su naturaleza doble, esos iones suelen denominarse iones dipolares.
Elaboración de soluciones amortiguadoras
Los amortiguadores se preparan de dos maneras:
1) Los dos componentes del par ácido-base conjugado se pesan por separado para obtener
la porción adecuada y luego se disuelven en agua.
2) Ambos componentes se obtienen a partir de una cantidad determinada de uno de ellos,
de modo que el otro se forma por incorporación de cierta cantidad de un ácido o una base
fuertes. Lo que se necesita para elaborar ambos tipos de amortiguadores es un
conocimiento del sistema conjugado ácido-base, el pKa del sistema y la ecuación de
Henderson-Hasselbach. En seguida se presenta un ejemplo de cada método.
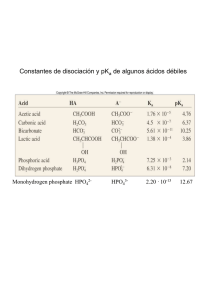
Valores de pKa de algunos pares conjugados ácido-base con función amortiguadora
ACIDO
BASE
Fosfato de dihidrogeno
pKa
Fosfato de Monohidrógeno
H2PO-4
7.2
HPO4-2
N-tris (hidroximetil) amino metano (TRIS)
TRIS-H+
TRIS
(Forma protonada)
(amina libre)
(HOCH2)3CNH3+
8.3
(HOCH2)3CNH2
Sulfonato de N-tris (hidroximetil) metil-2 aminometano (TES)
TES-H
TES
(HOCH2)3CNH2CH2CH2SO3
7.55
(HOCH2)CNHCH2CH2CH2SO3
Sulfonato de N-2-hidroxietilpiperazín-N´-2-etano (HEPES)
HEPES H+
HEPES
(forma zwitterionica)
7.55
(forma aniónica)
TIPO 1 SE PESAN POR SEPARADO AMBOS COMPONENTES.
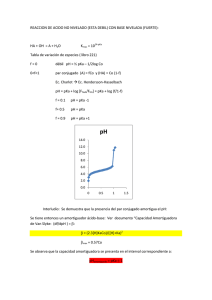
Ejemplo 2.1 El objetivo es preparar 1 L de un amortiguador de fosfato 0.5 M a un pH de 7.5
Supóngase que se dispone de H3PO4, KH2Po2, K2HPO4, y K3Po4. ¿Cómo debe elaborarse el
amortiguador?
Solución
Paso 1. En todos los casos, lo primero es determinar cuál de los dos componentes del
sistema de amortiguamiento será el más importante. Esto es problema en el caso de un
ácido monopólico, pero en los sistemas de ácidos dipróticos o poliproticos los componentes
pueden variar según el pH deseado. En este caso se especifica un pH de 7.5. Así, el sistema
en equilibrio se determinara seleccionando la ionización que tiene el valor de pKa más
cercano al pH deseado. Por consiguiente el sistema que conviene es uno con H2PO4-/HPO42 cuyo valor de pKa es 7.21. El sistema H3PO4/H2PO4- tiene un pKa de 2.12, mientras que el
sistema HPO4-/PO-3 tiene un pKa de 12.3. Esos valores son demasiado bajo y demasiado
alto, respectivamente, de modo que ninguno se comportara como amortiguador eficaz a pH
7.5. Después de elegir los componentes, el siguiente paso es escribir la ecuación de
equilibrio e identificar el par ácido-base conjugado:
H2PO4ACIDO DE BRONSTED
HPO4-2+H
BASE DE BRONSTED
pKa=7.21
Paso 2. Calcular la proporción deseada del par ácido-base a partir de la ecuación de
Henderson-Hasselbach:
pH=pKa2+log{HPO4-2]/´{H2PO4-]
log{HPO4-2]/´{H2PO4-]=7.5/.21=0.29
{HPO4-2]/´{H2PO4-]=antilog(0.29)=1.95
Así, la proporción deseada es de 1.95 partes de HPO4-24 por una parte de H2PO-4- como
esta proporción representa un total de 2.95 partes, el porcentaje de cada componente se
puede calcular de modo directo:
%HPO4-2=1.95/2.95 x 100=66.2
%H2PO4-=1.00/2.95 x 100=33.8
Para verificar la solución en este punto, se determina si la proporción es consistente con el
pH deseado. Este pH se encuentra en el lado alcalino del valor de pKa. Asi, debe haber una,
mayor concentración de la base conjugado que del ácido conjugado. Esto se verifica
mediante la proporción calculada.
Paso 3. Elegir los medios más factibles para obtener los componentes deseados. En este
caso, la elección obvia es pesar la cantidad necesarias de las sales potásicas del par ácido
base es decir, K2HPO4 y KH2PO4 las que al disolverse se ionizarán por completo para formar
los dos componentes del par conjugado.
Paso 4. Calcular la cantidad necesaria de cada material. Dado que la concentración total de
fosfato se especificó como 0.5 M, y puesto que se desea obtener 1 l de solución,
P. M. K2HPO4=174.2g/mol
P. M. KH2PO4=136.1g/mol
Numero de moles de K2HPO4 necesarias/litro=(0.662)(0.5)=0.331
Numero de moles de KH2PO4 necesarias/litro=(0.338)(0.5)=0.169
Por último, los gramos necesarios de cada una (Nota 2.3) son:
(0.331mol) (174.2 g/mol)= 57.7 g de K2HPO4
Y
(0.169 mol)(136.1) g/mol)=23.0 g de KH2PO4
Paso 5. Elaborar el amortiguador. Pesar 23.0 g de KH2PO4 y 57.7 g de K2HPO4 y disolver las
dos sustancias en alrededor de 750 ml de agua destilada. En este punto conviene verificar el
pH con un potenciómetro y de ser necesario, ajustarlo. Por último, aforar el volumen total
de la solución a 1L con agua destilada.
TIPO 2 AMBOS COMPONENTES SE OBTIENEN A PARTIR DE UNA SOLA SUSTANCIA.
Ejemplo 2.2. Se necesita elaborar 1 L de amortiguador TRIS 0.1M y con pH 8.3. Supóngase
que se dispone de un TRIS cristalino, HCl 1M y NaOH 1M. ¿Cómo se debería proceder?
(Nota: En estado cristalino el TRIS existe todo como la amina libre, es decir, con NH2)
Solución
Paso 1. El equilibrio deseado es
(HOCH2)3CNH3+
(HOCH2)3CNH2+H+
Acido de Bronsted
Base de Bonsted
Protonado
con amina libre
pKa=8.3
Paso 2. Calcular la proporción de base/ácido mediante el uso de la ecuación de HendersonHasselbach:
pH=PKa + Log [amina libre]/ [amina protonada]
8.3=8.3 + log [-NH2]/[NH3+]
[-NH2]/[NH3+]=anti log (0.0) =1.0
Entonces, la solución debe contener 50% de amina libre y 50% de la sustancia protonada. A
todas luces, este paso no es realmente necesario porque siempre existirá una mezcla de
ácido base 50:50 cuando el pH del amortiguador sea igual al pKa.
Paso 3. Los dos componentes del amortiguador se forman a partir del TRIS cristalino. Se
necesita 0.1 mol de TRIS cristalino para obtener 1 L de amortiguador con una concentración
total de TRIS de 0.1 M. El siguiente problema es determinar la cantidad de ácido fuerte
necesaria para lograr la composición deseada del par de ácido-base. Como la mezcla debe
contener 50% de la sustancia protonada, se necesita 0.05 mol de ácido fuerte. Esta cantidad
produce 0.05 mol de la fórmula NH+3 y queda 0.05 mol de la forma NH2; 50 ml HCL 1M
formarán 0.05 mol de H+.
Paso4 Elaborar el amortiguador. Pesar 0.1 mol (12.1 g) de TRIS cristalino y disolverla en
aproximadamente 500 ml de agua. Agregar 50 ml de HCL 1M y mezclar. Medir el pH con un
potenciómetro y, de ser necesario, ajustar. Aforar el volumen a 1L con agua.
Importante: El profesor te dirá el tipo, concentración, pH y volumen del amortiguador a
preparar.
CUESTIONARIO:
1.- Qué requisitos debe reunir un buen amortiguador?
2.-Investigue otros amortiguadores utilizados en Bioquímica y sus valores de pKa.
PRACTICA No. 5
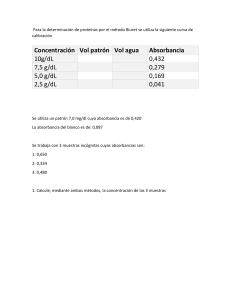
DETERMINACION DE PROTEINAS POR EL METODO DE BRADFORD
Objetivo:
1.- El alumno elaborará una curva patrón para determinar cuantitativamente la cantidad de
proteínas
Materiales, equipo y reactivos:
13 celdas
Micropipetas
Espectrofotómetro
Solución de albúmina
Muestra problema
Procedimiento:
1.- Para elaborar la curva patrón a cada cubeta añadir con extremo cuidado lo siguiente:
Cubetas
µg de proteínas
µl de proteínas
Agua
Reactivo de
Bradford
1
0
0
800
200
2
5
5
795
200
3
15
15
785
200
4
25
25
775
200
5
50
50
750
200
6
70
70
730
200
50
750
200
7
2.- Agitar cada cubeta por inversión.
3.-Una vez agitada leer la absorbancia utilizando una longitud de onda de 595 nm
ANALISIS DE RESULTADOS
1.- Graficar la absorbancia contra µg de proteínas
2.-Determinar la cantidad de proteína problema
Cuestionario
1.- Cite otro método cuantitativo para determinar la cantidad de proteína
2.- ¿Qué haría usted si su muestra presentara una absorbancia muy alta?
3.- Por lo contrario, si fuera muy baja.
4.- ¿Por qué se midió la absorbancia a 595 nm
5.- Mencione algunas características de la albúmina de suero bovino.
PRACTICA No. 4
OBTENCIÓN DE CRISTALES DE ALBÚMINA SERICA BOVINA
Objetivo
Obtener cristales de albúmina de suero bovino de una alta pureza
Introducción
En esta práctica obtendrás cristales de albúmina sérica bovina de una forma muy sencilla
mediante la realización de solamente 2 pasos: la desnaturalización diferencial de todas las
proteínas plasmáticas excepto la albúmina, seguida de la precipitación de ésta con etanol
frio al 60%.
Éste método se basa en la alta afinidad que posee la albúmina por moléculas pequeñas e
hidrofóbicas que poseen cargas electrostáticas negativas como por ejemplo el caprilato. Una
vez obtenido los cristales realizaras una electroforesis en geles de poliacrilamida SDS (PAGE)
para determinar el PM y el grado de pureza. La albúmina de suero bovino obtenida podrá
utilizarse en la práctica “DETERMINACION DE PROTEINAS POR EL METODO DE BRADFORD”.
También harás un barrido espectrofotométrico en un intervalo de 266 a 283 nm.
Material, equipo y reactivos
2 matraces Erlenmeyer de 500 ml (estéril)
4 tubos de ensaye de 50 ml
1 baño maría
5 vasos de precipitado de 500 ml (estéril)
1 centrifuga para tubos grandes
Hielo
1 tina de aluminio
1 mechero
Potenciómetro
Reactivos
Octanato de sodio 0.04 M
HCL al 0.1N
Procedimiento
1.- Colectar 500 ml de sangre bovina (sin el coagulo)
2.- Centrifugar a 300 rpm durante 10 min, separar el suero y el contenido celular, y una vez
más centrifugar a 3000 rpm durante 5 min (el suero). Separe y conserve en refrigeración 1
ml de suero. Etiquetar como muestra número uno.
3.-Mezclar el suero en una solución de octanato de sodio 0.04 M estéril, en proporción 1:1 y
ajuste el pH a 7 con una solución de HCl 0.1 N en condiciones estériles.
4.- Calentar la solución resultante a 70 o C en un baño de agua por espacio de 60 minutos.
5.-Esperar a que se enfríe y llegue a 22º C aproximadamente
6.- Ajustar el pH a 4.2 con la solución de HCl con la finalidad de precipitar a todas las demás
proteínas presentes en el suero. Estas proteínas forman una masa coloidal amarillenta la
cual hay que separarla del suero.
7.- se centrifuga a 3000 rpm durante 10 minutos a una temperatura de 10oC
8.-El sobrenadante transparente se decanta en un matraz Erlenmeyer estéril para poder
obtener la albúmina de este. (Separe y conserve en refrigeración 1 ml del líquido decantado.
Etiquetar como muestra 2. El precipitado se recolecta en un recipiente limpio.
9.-Enfriar a una temperatura de 5oC . Para esto haga lo siguiente; a un baño maría agregue
hielo y una cantidad de NaCl (Propiedades coligativas) mida la temperatura y enfríe el
contenido del matraz.
10.-Añadir al matraz un volumen de etanol absoluto hasta alcanzar una concentración de
60% para precipitar la albúmina. Agitar por 10 minutos manteniendo la temperatura a 5oC .
11.-Mantener la mezcla durante 4 horas a 5oC.
12.- Centrifugar 10 minutos a 3000 rpm y decantar. El sobrenadante recolectar en un
recipiente limpio.
13.-Juntar el precipitado (separe y conserve en refrigeración 1 ml) en un vaso de precipitado
y meterlo al refrigerador a 10oC durante 72 hrs. Etiquetar como muestra tres.
14.-Por último dejarlo secar a 5oC durante 24 hrs.
15.- Los cristales que obtuvo ahora los someterá a unas pruebas analíticas.
Cuestionario
1.- En la purificación de proteínas es común utilizar el método de cromatografía de exclusión
molecular. Cite el fundamento.
2.- Cite el fundamento de la cromatografía de afinidad.
3.- Cite el fundamento de la cromatografía de intercambio iónico.
4.- Cite el fundamento de electroforesis nativas y desnaturalizantes.
5.-El sulfato de amonio es un reactivo muy utilizado en la purificación de proteínas. Explique
Prácticas virtuales
Tu profesor te indicará las prácticas virtuales que has de realizar para ampliar tus
conocimientos.