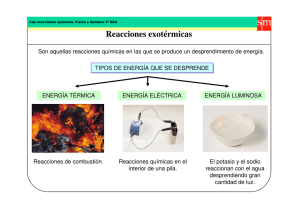
Por: Mario Alberto Desgarennes Asignatura: Química Carrera: Ingenieria Informática E Ingeniería En Sistemas Computacionales Profesor: Gerardo Villalva Tipos de Reacciones Químicas Introducción Las reacciones químicas ocurren absolutamente en todas partes. Si bien a veces asociamos reacciones químicas con el ambiente estéril del tubo de ensayo y el laboratorio, nada podría estar más lejos de la verdad. De hecho, la colosal cantidad de transformaciones crea una serie vertiginosa, casi incomprensible, de nuevas sustancias y cambios de energía que tienen lugar en nuestro mundo cada segundo de cada día. ¡En la naturaleza, reacciones químicas pueden ser mucho menos controladas que lo que se encuentra en el laboratorio, y a veces más desordenadas, y generalmente ocurren, aunque no se quieran! Ya sea un incendio quemando un bosque, el proceso lento de hierro oxidándose en la presencia de oxígeno y el agua sobre un periodo de años o la manera delicada en la cual una fruta se madura en un árbol, el proceso de convertir un conjunto de sustancias químicas (reactantes) a otro conjunto de sustancias (los productos) se conoce como reacción química. Existen una gran cantidad de reacciones químicas. ocurren constantemente dentro de nuestro cuerpo, dentro de plantas y animales, en el aire que circula a nuestro alrededor, en los lagos y mares en los que nadamos y hasta en la tierra en donde sembramos y construimos. De hecho, existen tantas reacciones químicas que ocurren que sería difícil (o imposible) entenderlas todas Carrera: Sistemas ática e I en Tipos de Reacciones Químicas Reacción de síntesis Varios gases se caracterizaron comúnmente como tipos de "aire" o partes faltantes de aire - por ejemplo, términos utilizados comúnmente eran “aire inflamable” o “aire desflogisticado.” Lavoisier pensó diferentemente y fue convencido que estas fueron sustancias diferentes. Llevo a cabo experimentos en donde mezcló aire inflamable con aire deflogisticado y una chispa y encontró que las sustancias combinadas para producir agua. La respuesta de esto fue que nombre aire inflamable “hidrógeno” del griego hidro para “agua” y genes para “crear”. Al hacer esto, Lavoisier identificaba una reacción de síntesis. Generalmente, una reacción de síntesis es una en la cual sustancias más simples se combinan para formar una más compleja. Ejemplo: Algunas reacciones de síntesis se dan al combinar un óxido básico con agua, para formar un hidróxido, o al combinar el óxido de un no metal con agua para producir un oxi-ácido. Reacciones de Descomposición En el año 1774, el científico Joseph Priestley cambio su curiosidad a un mineral llamado cinabrio – un mineral rojo. Cuando puso el mineral bajo la luz del sol amplificado por una lupa poderosa, encontró que un gas era producido el cual describió como teniendo una “naturaleza exaltada” debido a que una candela quemó en el gas brevemente. Sin darse cuenta, había descubierto el oxígeno como resultado de una reacción de descomposición. Las Reacciones de descomposición son comúnmente pensadas como el opuesto de reacciones de síntesis debido a que involucran un compuesto desintegrado en compuestos más simples o incluso hasta en elementos. Ejemplo: mediante la electrólisis del agua (H2O), esta se separa en hidrógeno (H) y oxígeno (O). Reacciones de reemplazo simple En este tipo de reacción química, se reemplazan los elementos de los compuestos. Puede tratarse de reacciones simples (un elemento desplaza a otro) o dobles (se intercambian elementos). En ambos, casos el resultado es la formación de nuevos compuestos químicos. Este deslazamiento sencillo particular se llama desplazamiento de metal debido a que involucra un metal reemplazando a otro metal y muchos tipos de baterías se basan en reacciones que reemplazan metales. Sin embargo, varios otros tipos de reacciones de reemplazo sencillo, existen como cuando un metal puede reemplazar el hidrogeno en un ácido o en el agua, o un halógeno puede reemplazar otro halógeno en ciertos compuestos de sal. Ejemplo: La reacción entre el cinc metálico y el ácido clorhídrico para producir cloruro de zinc e hidrógeno gaseoso es un ejemplo de una reacción de desplazamiento simple. Reacciones de Combustión La combustión química no es más que la reacción de un combustible (madera, aceite, gasolina, etc.) con oxígeno. Para que la combustión se pueda llevar a cabo, debe de haber un combustible y gas de oxígeno. Sim embargo, estas reacciones a menudo requieren energía de activación (discutido más a menudo el módulo Enlaces Químicos: La Naturaleza del Enlace Químico), el cual puede ser proveido por una chispa o fuente de energía para el encendido. Combustible, oxígeno y energía son las tres cosas que forman el triángulo del fuego. Y si hace falta una de ellas, la combustión no se llevará a cabo. Ejemplo: La leña arde y se combina con el oxígeno para formar dióxido de carbono y vapor de agua, al mismo tiempo que genera gran cantidad de energía química en forma de calor y luz. Reacción de reducción de oxidación En una definición, la oxidación se describe como el proceso en el cual una especie pierde electrones y la reducción es un proceso en donde una especie obtiene electrones y la reducción es un proceso en donde una especie obtiene electrones. En esta manera, podemos ver como el par puede llevarse a cabo junto. Si una sustancia química pierde sus electrones (y por ende se oxida), entonces debe tener otra sustancia química interdependiente a la le puede dar esos electrones. En el proceso, la segunda sustancia (la que gana electrones) se reduce. Ejemplo: Semireacción de reducción. Reducción del cobre al captar dos electrones. Disminuye su estado de oxidación. Reacciones ácido-base Este tipo de reacción química una sustancia básica y otra ácida se neutralizan entre ellas. Como resultado, se forma un compuesto neutro y agua. Ejemplo: cuando el ácido clorhídrico reacciona con el hidróxido de sodio se produce sal (cloruro de sodio) y agua. Reacciones nucleares En las reacciones nucleares no se modifican los electrones de los átomos, sino su núcleo. Hay dos tipos de reacciones químicas nucleares: la fusión, en la que se combinan diferentes átomos; y la fisión, en la que el núcleo de los átomos se fragmenta. Ejemplo: las reacciones nucleares se utilizan para obtener energía. Es lo que ocurre con el uranio, cuando es bombardeado con neutrones con tal de romper su núcleo. Tipos de reacciones químicas según la energía Llamamos reacciones exotérmicas las que provocan la emisión de energía, que normalmente se produce al menos en forma de calor. Aunque, por ejemplo, en el caso de las explosiones también se emite energía cinética. En cambio, cuando se absorbe energía se está produciendo una reacción endotérmica. Como resultado, el producto final es más enérgico que los reactivos. REFERENCIAS https://concepto.de/reacciones-redox/ https://www.zschimmer-schwarz.es/noticias/que-es-una-reaccion-quimicadefinicion-ejemplos-y-tipos-de-reacciones-quimicas/ https://es.wikipedia.org/wiki/Reacci%C3%B3n_de_s%C3%ADntesis https://www.visionlearning.com/es/library/Qumica/1/Reacciones-Qumicas/54