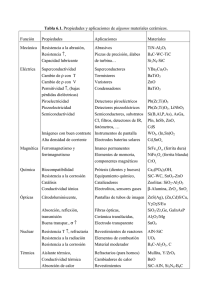
Caracterización por XRD y UV-Vis-DR de nanocatalizadores CuO/ZrO2 J. A. Flores-Ramírez1*, F. Morales-Anzures2, P. Salinas-Hernández2, J. J. Castro-Arellano3, C. MejíaGarcía1, F. Chávez-Rivas1 1 Departamento de Física, ESFM-IPN, C. P. 07738. Ciudad de México, México. Universidad del Istmo, Av. Universidad s/n Barrio Sta. Cruz, Santo Domingo Tehuantepec, C. P. 70760, Oaxaca, México. 3 Laboratorio de Posgrado, ESIQUIE-IPN. C. P. 07738, Ciudad de México, México. Teléfono (97) 1160-1250 *E-mail: flores.ramirez.jorgea@gmail.com 2 Resumen –– Se prepararon muestras de ZrO2 puro y con incorporación de CuO al 1, 3.6, 5 y 10 % mol mediante el método sol-gel en medio básico. Estos catalizadores fueron calcinados a 400 ºC y caracterizados por Difracción de rayos-X (XRD) y Espectroscopía UV-Visible con Reflectancia Difusa (UV-Vis-DR). Los patrones de difracción del conjunto de muestras presentaron una fase predominantemente tetragonal, a partir de la cual se determinó el tamaño de cristalito de los nanocatalizadores, aplicando el método de Debye-Scherrer. Se encontró que el tamaño de cristalito es del orden de 7 nm y que es independiente de la carga de cobre. Los espectros UV-Vis-DR del conjunto de muestras, fueron analizados por simulación de bandas Gaussianas, estos ajustes mostraron que los espectros pueden ser explicados por cuatro bandas observadas en 208, 270, 440 y 760 nm. Las primeras tres pueden ser atribuidas a la transferencia de carga entre el O2--Zr4+, O2--Cu2+ y complejos de CuO-Cu, respectivamente. Finalmente, la amplia banda de absorción alrededor de 760 nm es asignada a las transiciones electrónicas del tipo d-d de los iones de Cu2+ situados en un entorno octaédrico tetragonalmente distorsionado. Palabras Clave–Sol-gel, CuO/ZrO2, ecuación de DebyeScherrer, UV-Vis-DR. Abstract––. Samples of pure ZrO2 were prepared with incorporation of CuO at 1, 3.6, 5 and 10% mol, using the sol-gel method in basic medium. These catalysts were calcined at 400 °C and characterized by UV-Visible Diffuse Reflectance Spectroscopy (UV-Vis-DR). The diffraction patterns of the set of sample show a predominantly tetragonal phase, from which the crystallite size of the nanocatalysts was determined, applying the Debye-Scherrer method, it was found that the crystallite size is of the order of 7 nm and that is independent of the cooper load. The UV-Vis-DR spectra of the set of samples were analyzed by simulation of Gaussians bands, these fittings show that the spectra can explained by four Gaussian bands observed c.a. at 208, 270, 440 and 760 nm. The first tree can be attributed to charge transfer between O2-Zr, O2-Cu and Cu-O-Cu complexes, respectively. Finally, the wide absorption band around 760 nm is assigned to the d-d type electronic transitions of Cu2+ ions located in a tetragonally distorted octahedral environment. Keywords ––Sol-gel, Cu/ZrO2, Debye-Scherrer equation, UVVis-DR. Este trabajo ha sido patrocinado por la Secretaría de Investigación y Posgrado del IPN por los proyectos SIP-2021080 y COFAA-IPN. I. INTRODUCCIÓN Debido a las propiedades especiales que presenta la materia en la escala nanométrica, muchas de las innovaciones tecnológicas en la industria se deben al desarrollo de nuevos catalizadores y soportes catalíticos [1]. Existen muchos tipos de nanocatalizadores, entre los cuales, uno de los más usados es el constituido por una mezcla de óxidos de metales semiconductores, que actúan como catalizador propiamente dicho, y nanopartículas metálicas que aportan selectividad [2]. De igual manera, el uso de metales de transición como soportes ha cobrado mayor importancia, debido a que reducen el costo que implica usar metales nobles en la preparación de catalizadores. En años recientes, se han llevado a cabo considerables trabajos de investigación sobre la síntesis de materiales catalíticos avanzados a través del método sol-gel. Este importante tipo de síntesis permite la preparación de materiales de calidad con alta pureza, homogéneos y con un alto control en el tamaño de partícula [3-5]. Los catalizadores de CuO/ZrO2 han recibido gran atención debido a su alta actividad catalítica en una serie de reacciones como son: síntesis de metanol a partir de mezclas de hidrógeno y óxidos de carbono [6], reducción de NO con hidrocarburos [7] o CO [8], desplazamiento gas-agua [9], combustión y la oxidación de CO [10]. El Cu es un metal dúctil muy abundante sobre la corteza. Por otro lado, el óxido de zirconio tiene propiedades cerámicas tales como: resistencia química, estabilidad térmica, alta resistencia mecánica y conductividad iónica a altas temperaturas. El ZrO2 preparado por la técnica sol-gel, es un material propuesto para su uso como catalizador o soporte de catalizadores en procesos petroquímicos. Por ejemplo, se ha demostrado su utilidad en la reacción de isomerización de nhexano a alto octano, empleando catalizadores bifuncionales de circonia-sílice en productos tales como 2,2 dimetilbutano y 2,3 dimetilbutano [11]. En la literatura hay pocos reportes sobre catalizadores de CuO/ZrO2 preparados por el método sol-gel en medio básico. Flores et al. [12], reportaron que los materiales CuO/ZrO 2 sintetizados por el método sol gel se caracterizan por presentar un patrón XRD con una fase tetragonal predominante, con pequeños porcentajes de la fase monoclínica a bajos porcentajes mol de CuO. También, por SEM-HR encontraron que las muestras se caracterizan por presentar partículas de morfología semiesférica y de diferentes tamaños, predominando aquellas del orden de 5001000 nm de diámetro. Derivado de lo anterior, el objetivo de este trabajo es complementar el estudio del efecto del contenido de Cu2+ en el catalizador CuO/ZrO2 por medio de las técnicas físicas XRD y UV-Vis-DR, para determinar el tamaño de cristalito (Fig. 1) y las principales bandas de transferencia electrónica presentes en las muestras sintetizadas. Posteriormente, se determinó el pico más intenso no superpuesto de la fase cristalina predominante de cada patrón de difracción. Mediante el software Origin se realizó el ajuste Gaussiano para determinar la intensidad, el área bajo la curva y el valor de FWHM. Finalmente, se aplicó la ecuación de Debye-Scherrer para el cálculo del tamaño de cristalito. 𝐷= 𝐾𝜆 𝛽𝑐𝑜𝑠𝜃 (1) Donde: II. METODOLOGÍA A. Síntesis de catalizadores Se prepararon muestras de ZrO2 puro y con incorporación de CuO, mediante el método sol-gel en medio básico, con diferentes contenidos de Cu (0, 1, 3.6, 5 y 10 % en mol), denotados como XCuZr, donde X representa el porcentaje en mol de Cu, por ejemplo, 5CuZr representa al catalizador de cobre soportado en circonia con 5 % mol de Cu. El n-butóxido de Zirconio (Zr[O(CH2 )3 CH3 ]4 , pureza 76.80 %, Stream Chemicals), se mezcló con etanol en un matraz de reflujo. Se adicionó hidróxido de amonio (NH4OH, pureza 29.57 %, J. T. Baker) para alcanzar pH>7. En el caso de las muestras de ZrO2 con incorporación de cobre, se adicionó acetato de cobre (Cu(CH3COO)2.H2O, Aldrich) en la cantidad requerida para tener la concentración de CuO deseada en el catalizador final. La solución resultante se calentó hasta alcanzar la temperatura de reflujo (80 °C), y se mantuvo bajo agitación constante durante 10 minutos antes de comenzar el proceso de hidrolisis por adición gota a gota, de 20 ml de H2O mezclada con 100 ml de etanol. Los geles formados se dejaron en reflujo por 50 minutos más con agitación continua y posteriormente se dejaron añejar por 24 horas a temperatura ambiente. Finalmente, las muestras sólidas se secaron a 105 °C durante 24 horas y luego se calcinaron a 400 °C por 24 horas. B. Difracción de rayos-X Para determinar las fases cristalinas y el tamaño de cristalito (Fig. 1) de los sólidos calcinados, se obtuvieron los patrones de difracción en un difractómetro de rayos-X D8 Advance marca Bruker AXS, acoplado a un tubo de rayos-X de ánodo de cobre (radiación CuKα) λ: 1.5418 Å, bajo las siguientes condiciones: el equipo se operó a 50 kV y 20 mA con un intervalo de tiempo de 1s por punto y velocidad de barrido de 0.03°/s. Las muestras se analizaron en un intervalo 2θ de10 a 90°. Los patrones de difracción obtenidos se compararon con las tarjetas del JCPDS para identificar las fases cristalinas presentes. Partícula ≥ Grano ≥ Cristalito ≥ Celda unitaria ≥ Molécula/Átomo Figura. 1. Proceso de formación de partículas por granos y cristalitos. 𝐷: tamaño medio de cristalito. 𝐾: constante Scherrer, 0.94 (granos cúbicos). 𝜆: longitud de onda de los rayos-X, CuKα= 1.5406 Å. 𝛽: ancho a media altura, FWHM, en radianes. 𝜃: ángulo de Bragg en grados, mitad de 2𝜃. C. Espectroscopia UV-Vis-DR Para determinar las diferentes transiciones electrónicas asociadas a las bandas de absorción de las muestras, así como analizar la variación de estas bandas conforme se incrementa el porcentaje de óxido de cobre en el soporte, se midieron los espectros de reflectancia difusa UV-vis-DR a temperatura media ambiente en un espectrofotómetro UV-vis marca Varían, modelo Cary-100 equipado con una esfera de integración de 60 nm, en el intervalo de longitud de onda de 200-800 nm, y a 2 nm de paso. Como material de referencia se utilizó sulfato de bario (BaSO4). III. RESULTADOS Y DISCUSIÓN A. Difracción de rayos-X La Fig. 2 muestra los patrones de difracción de rayos-X de los materiales CuO/ZrO2 tratados térmicamente a 400 ºC reportados en la XXV Reunión Nacional Académica de Física y Matemáticas por Flores et al.,[12]. Figura 2. Patrones XRD de los nanocatalizadores CuO/ZrO2 reportados por Flores et al., [12] de donde se tomaron los planos (101) y (112) para el cálculo del tamaño de cristalito aplicando la ecuación de Debye-Scherrer. De la figura anterior se observa que los patrones XRD presentan picos característicos de la fase tetragonal (ficha JCPDS 79-1769), con valores 2θ: 30.3, 35.5, 50.4, 60.1, 62.66, 74.63, 82.09 y 85.06 ° y corresponden a las reflexiones (101), (110), (112), (211), (202), (220), (301) y (310), dichos valores están en buen acuerdo con los reportado en la literatura para el ZrO2 [13-15]. La Fig. 3 muestra el ajuste Gaussiano de los planos (101) y (112), los cuales representan los picos más intensos del patrón de difracción de las muestras calcinadas a 400 ºC. 1800 3500 3000 1600 Pico real Ajuste Intensidad (u.a.) Intensidad (u.a.) (a) 2000 (a) 1400 2500 1500 1000 1000 800 600 400 500 200 0 0 25 26 27 28 29 30 31 32 33 34 48 49 2 theta (grados) 50 51 52 53 2 theta (grados) 3500 1800 Pico real Ajuste 3000 2500 1600 2000 (b) 1400 (b) Intensidad (u.a.) Intensidad (u.a.) Pico real Ajuste 1200 1500 1000 Pico real Ajuste 1200 1000 800 600 400 500 200 0 0 25 26 27 28 29 30 31 32 33 34 48 49 2 theta (grados) 3500 1600 Pico real Ajuste (c) 2500 (c) 1400 Intensidad (u.a.) 3000 Intensidad (u.a.) 51 52 53 1800 4000 2000 1500 1000 Pico real Ajuste 1200 1000 800 600 400 500 200 0 0 25 26 27 28 29 30 31 32 33 48 34 49 2 theta (grados) 50 51 52 53 2 theta (grados) 2000 4500 1800 4000 Pico real Ajuste 3000 (d) 2500 (d) 1600 Intensidad (u.a.) 3500 Intensidad (u.a.) 50 2 theta (grados) 2000 1500 Pico real Ajuste 1400 1200 1000 Tabla 1. Cálculo del tamaño de cristalito del plano (110) usando la ecuación de Debye-Scherrer. 800 600 1000 400 500 200 0 0 25 26 27 28 29 30 31 32 33 48 34 49 50 51 52 53 350 1400 800 300 Pico real Ajuste (e) Pico real Ajuste 250 Intensidad (u.a.) Intensidad (u.a.) 1000 (e) 600 400 200 Posición angular (2θ) FWHM Área. Intensidad Tamaño de cristalito (nm) 0CuZr 30.22 1.06 3270.21 7.74 1CuZr 30.24 0.99 3109.03 8.29 3.6CuZr 30.31 0.99 3028.68 8.31 5CuZr 30.33 0.96 3303.02 8.56 10CuZr 30.33 1.08 594.17 7.59 150 100 50 200 Muestra 2 theta (grados) 2 theta (grados) 1200 En la columna izquierda de la figura 3, se observa el ajuste realizado para hallar la intensidad y el área bajo la curva del pico localizado a 2θ=30.5°, se puede apreciar que el pico principal se encuentra rodeado por un pequeño pico localizado a la izquierda con un valor de 2θ=28.4°, el cual corresponde a la fase monoclínica y una especie de ensanchamiento con un valor aprox., de 2θ=31.5° del lado derecho del pico central. Debido a que solo nos interesa el área y la intensidad del plano (101), se realizó una simulación Gaussiana con tres picos para reproducir el perfil real y de esta manera hallar los parámetros microestructurales del pico central. Dicha simulación fue realizada con el software Origin Pro 2021. De los ajustes de las muestras 0CuZr, 1CuZr y 3.6CuZr (Fig. 3a, b y c, columna izquierda) se puede observar que tanto el pico asociado a la fase monoclínica (lado izquierdo) como el ensanchamiento en forma de hombro (lado derecho) disminuyen en intensidad al incrementar el porcentaje de CuO. Lo anterior se corrobora observando el ajuste de la muestra 5CuZr (Fig. 3d, columna izquierda). Para la muestra 10CuZr (Fig. 3e, columna izquierda), la cual representa una muestra con pérdida de cristalinidad, se le aplicó el mismo ajuste Gaussiano reproduciéndose el perfil en el intervalo seleccionado. En las Figs. 3a, b, c, d y e, columna derecha, se muestra el ajuste realizado al plano 112 (2θ=50.6°), del patrón de difracción correspondiente a la serie de nanocatalizadores. A diferencia del ajuste realizado para el plano 101, el plano 112 se encuentra aislado en el difractogràma, no existen ensanchamientos ni picos que se superpongan, por lo tanto, el ajuste se realizó de manera más sencilla. Derivado de lo anterior, en la Tabla 1, se muestran los principales parámetros microestructurales obtenidos de la simulación Gaussiana para el cálculo del tamaño de cristalito del plano 110 (2θ=30.5°). 0 0 18 20 22 24 26 28 30 32 34 36 38 40 42 2 theta (grados) -50 48 49 50 51 52 53 Angulo (2 theta) Figura 3. Columna izquierda: ajuste a una función Gauss del plano 101 (2θ=30.5°) de las muestras: (a) 0CuZr, (b) 1CuZr, (c) 3.6CuZr, (d) 5CuZr y (e) 10CuZr.Columna derecha: ajuste a una función Gauss del plano 112 (2θ = 50.6°) de las muestras: (a) 0CuZr, (b) 1CuZr, (c) 3.6CuZr, (d) 5CuZr y (e) 10CuZr. Para efectos de comparación, también se reporta el tamaño de cristalito para el segundo pico más intenso del difractograma de las muestras sintetizadas, el cual corresponde al plano 112 (2θ=50.6°), Tabla 2. Muestra Posición angular (2θ) FWHM Área. Intensidad Tamaño de cristalito (nm) 0CuZr 50.38 1.41 2173.64 6.18 1CuZr 50.41 1.42 2185.57 6.18 3.6CuZr 50.49 1.44 2294.15 6.07 5CuZr 50.51 1.36 2346.93 6.42 10CuZr 50.54 1.43 341.48 6.12 De la Tabla 1, se puede observar que el tamaño de cristalito es homogéneo cuando se adiciona 1, 3.6 y 5 porciento mol de CuO, sin embargo, este tiende a disminuir cuando se adiciona 10 porciento mol de cobre, este efecto puede asociarse a la perdida de cristalinidad de la muestra, tal y como se puede apreciar en la Fig. 2. Por otro lado, de la Tabla 2, se puede apreciar que existe un tamaño de cristalito más homogéneo, prácticamente no varía con el incremento del porcentaje mol de cobre, esta característica puede estar relacionada con la condición de que se trata de un pico aislado, es decir, que no tiene superposición con otro pico, además, no presenta ensanchamiento debido a microtensiones internas en la muestra [16-18]. Realizando el comparativo de las tablas 1 y 2, se puede apreciar que el tamaño de cristalito entre el plano (110) y (112) disminuye aproximadamente 2 nm. Una probable estimación del tamaño de cristalito podría ser tomar el promedio de los dos picos más intensos (Tabla 3), por lo que tendríamos un valor del orden de 7 nm aproximadamente. Tabla 3. Promedio del tamaño de cristalito a partir de los planos (110) de la tabla 1 y de los planos (112) de la tabla 2. Muestra 0CuZr 1CuZr 3.6CuZr 5CuZr 10CuZr Tamaño de cristalito (nm) 7 7.2 7.2 7.5 6.9 B. Espectroscopia UV-Vis-DR En la Fig. 4, se muestran los espectros de reflectancia difusa UV-Vis, (UV-Vis-DR por sus siglas en inglés) de los catalizadores 0CuZr, 1CuZr, 3.6CuZr, 5CuZr y 10CuZr. Se ha reportado que los catalizadores de CuO sintetizados por vía sol-gel soportados en ZrO2 presentan una banda de absorción a 220 nm [19]. Chary et al [20], por ejemplo, reportaron espectros UV-visibles de muestras de CuO/ZrO2 preparadas por el método de impregnación. Los autores describen que el ZrO2 puro presenta un espectro que exhibe una banda característica alrededor de 220 nm debida a la transferencia de carga de O2--Zr4+, lo cual está en buen acuerdo con los espectros UV-visibles que se observan en la Fig. 4. De dicha figura se puede apreciar una primera banda de absorción debida a la transferencia de carga del ligando al metal (O2--Zr4+) con una longitud de onda de 210 nm aproximadamente. Del mismo modo, es posible observar otra banda de absorción con forma de hombro con una longitud de onda alrededor de 270 nm, dicha banda es más pronunciada en las muestras con alto contenido de CuO y puede ser atribuida a la transferencia de carga de O2--Cu2+, de acuerdo con Morales et al [21,22]. 1.6 0CuZr 1CuZr 3.6CuZr 5CuZr 10CuZr 1.4 Absorbancia (a. u.) Tabla 2. Cálculo del tamaño de cristalito del plano (112) usando la ecuación de Debye-Scherrer. 1.2 1.0 0.8 0.6 0.4 0.2 0.0 200 300 400 500 600 700 800 Longitud Longitud de de onda onda (nm) (nm) Figura 4. Espectros UV-Vis-RD de los nanocatalizadores de CuO/ZrO2. Por otro lado, para las muestras 1CuZr, 3.6CuZr, 5CuZr y 10CuZr se observa una banda ancha con una longitud de onda en el intervalo de 600-800 nm, dicha banda puede ser asociada a transiciones electrónicas de spin permitido E2g-T2g de tipo d-d de iones aislados de Cu2+ en coordinación octaédrica distorsionada tetragonalmente en la matriz del soporte. Dichos resultados concuerdan con lo reportado en la literatura [19-23]. Para identificar gráficamente y analizar la variación de las bandas de absorción con el incremento del porcentaje de CuO, se simularon los perfiles de los espectros UV-visibles de la serie de nanocatalizadores. La simulación se realizó empleando el software Origin Pro2021 con ajuste a una función Gaussiana. En la Fig. 5 se observa que los espectros UV-Vis-DR del conjunto de muestras pueden ser explicados mediante bandas Gaussianas, las cuales varían en intensidad con el incremento del porcentaje de cobre. De la muestra 0CuZr (Fig. 5a) se pueden apreciar dos bandas de transiciones electrónicas con máximos en 210 y 288 nm de longitud de onda, dichas bandas están asociadas a la transferencia de carga del O2--Zr4+ [19-23]. Sin embargo, la banda localizada a 210 nm es mucho más intensa que la correspondiente a 288 nm, tal y como se refleja en la Fig. 4 para el espectro UV-visible de la muestra 0CuZr. Para las muestras 1CuZr, 3.6CuZr, 5CuZr y 10CuZr se observa que el perfil del espectro UV-visible puede ser reproducido con 4 bandas Gaussianas (Fig. 5b, c, d y e). 1.6 Absorbancia (u.a.) (a) 210 1.4 1.2 ZrO2 1.0 Sum 0.8 0.6 0.4 288 0.2 0.0 200 300 400 500 600 700 800 Longitud de onda (nm) 1.6 1.4 207 Absorbancia (u.a.) Absorbancia (u.a.) 1.2 (c) 1.6 (b) 1.4 1.0 CuZrO2 Sum 1.0 0.8 0.6 273 0.4 412 0.2 3.6 CuZrO2 Sum 1.2 1.0 0.8 203 269 0.6 0.4 436 0.2 764 748 0.0 0.0 200 300 400 500 600 700 200 800 300 1.6 (d) 600 700 800 (e) 1.4 1.2 5.0 CuZrO2 1.0 0.8 500 1.6 202 Absorbancia (u.a.) Absorbancia (u.a.) 1.4 400 Longitud de onda (nm) Longitud de onda (nm) Sum 271 0.6 0.4 427 0.2 762 0.0 formación de especies de CuO del tamaño de los nanómetros. Al aumentar el contenido de CuO, se produce un cambio en el espectro UV-vis de los catalizadores, tal y como se observa en la Fig. 4, mostrando una gradual aparición de una absorción de borde en el intervalo 350-500 nm, que se atribuye a especies de CuO bulk. La presencia de esta especie CuO bulk se observa más claramente en los catalizadores 3.6CuZr, 5CuZr y 10CuZr [23,24]. Finalmente, la banda ancha identificada en el intervalo 600-800 nm de longitud de onda en la Fig. 4, mediante simulación se pudo corroborar que tiene valores máximos de 748 nm para 1CuZr, 764 para 3.6CuZr, 762 nm para 5CuZr y 747 nm para 10CuZr, esta banda es característica de las transiciones d-d de iones Cu+2 localizados en un entorno octaédrico. Además, esta banda de absorción aumenta con el incremento del contenido de cobre, lo cual se debe al aumento de las especies de Cu2+ que se encuentran dispersas en el soporte. En esta banda la simetría local del ion cobre se distorsiona, indicando que se mantiene una interacción entre el cobre y el soporte [19,21-23]. En la Tabla 4 se muestran los principales parámetros microestructurales obtenidos con la simulación Gaussiana de las muestras 0CuZr, 1CuZr, 3.6CuZr, 5CuZr y 10CuZr, de dichos valores se puede apreciar que las bandas 2 y 4 son las que gobiernan el proceso de transición electrónica entre el O2-Cu2+ y los orbitales d-d de iones Cu+2 respectivamente, debido a que son las más intensas. Tabla 4. Parámetros de las Gaussianas cuya suma reproducen el perfil de los espectros de absorción de las muestras de cobre soportado en ZrO2. 10.0 CuZrO2 Sum 1.2 282 1.0 0.8 0.6 747 0.4 Muestra 425 191 0.2 0.0 200 300 400 500 600 Longitud de onda (nm) 700 800 200 300 400 500 600 700 800 Longitud de onda (nm) Figura 5. Simulación de los espectros UV-visibles mediante el ajuste de bandas Gaussianas. (a) 0CuZr, (b) 1CuZr, (c) 3.6CuZr, (d) 5CuZr y (e) 10CuZr. La primera banda Gaussiana está asociada a la transferencia de carga ligando-metal, O2--Zr4+, tal como en el soporte [19-23]. La segunda banda de transferencia electrónica registra valores de longitud de onda: 273 nm para 1CuZr, 269 para 3.6CuZr, 271 para 5CuZr y 282 para 10CuZr, y está asociada a la transferencia de carga entre el O2--Cu2+ [19-23]. Esta banda a 270 nm es típica de complejos del cobre en los cuales el Cu2+ se encuentra enlazado a seis moléculas de agua de la siguiente forma: [Cu(H2O)6]2+. La tercera banda Gaussiana, y una de las menos intensas, registra longitudes de onda: 412 nm para 1CuZr, 436 nm para 3.6CuZr, 427 nm para 5CuZr y 425 nm para 10CuZr. Esta banda de absorción no es visible gráficamente en los espectros originales de la Fig. 4, sin embargo, y de acuerdo con lo reportado en la literatura, está relacionada con la ZrO2 1.0CuZrO2 3.6CuZrO2 5.0CuZrO2 10CuZrO2 Banda nm2 Ancho Área. Intensidad 210 54 81 288 207 61 21 7 58 273 412 748 57 53 169 94 8 71 203 269 23 69 43 174 436 764 202 32 163 54 5 102 43 271 427 155 90 179 9 762 191 413 32 130 56 282 425 747 75 49 169 245 22 225 IV. CONCLUSIONES Se sintetizaron nanocatalizadores de cobre soportados en ZrO2 por el método sol-gel en medio básico. El análisis XRD mostró que los sólidos cristalizan mayormente en la fase tetragonal con pequeños porcentajes de la fase monoclínica a bajos contenidos de CuO. Por medio de la ecuación DebyeScherrer, se determinó el tamaño de cristalito para los dos picos más intensos de cada difractograma, encontrándose que existe una diferencia de alrededor de 2 nm entre ambos picos, lo cual, probablemente esté relacionado con las condiciones de aplicación de la ecuación de Debye-Scherrer. A partir de la simulación de los espectros UV-visible, fue posible determinar que los perfiles reales pueden reproducirse mediante 4 bandas Gaussianas, las cuales registran máximos con longitudes de onda de 210, 288, 436 y 764 nm y están asociadas a las transiciones electrónicas entre el O2--Zr4+, O2-Cu2+ y orbitales del tipo d-d en iones Cu2+ principalmente. AGRADECIMIENTOS J. A. Flores Ramírez agradece la beca del CONACyT para realizar sus estudios de posgrado. REFERENCIAS [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] J. López, H. Pérez, J. Trejo, T. García, “Efecto del método de preparación en las propiedades de los óxidos mixtos de Zr-Ti”, Revista Mexicana de Ingeniería Química, vol. 1, pp. 29-36, 2002. A. Somorjai, H. Freinz, Y. Park, “Advancing the frontier in nanocatalysis, biointerfaces, and renewable energy conversion by innovations of surface techniques”, Journal of the American Chemical Society, pp. 1-64, 2010. J. Brinker y G. Scherer. “Sol-Gel Science”, Academic Press; San Diego (1985). T. López and R. Gómez, in “Sol-Gel Optics:Processing and Applications” (L.C. Klein, Ed.),Chap.16, p.345, Kluwer, Boston, (1994). K. Tanabe, Mater. Chem. Phys. 13, 347 (1985). M. Rhodes, A. Bell, “The effects of zirconia morphology on methanol synthesis from CO and H2 over Cu/ZrO2 catalysts part 1. Steady –state studies”, Journal of Catalysis, vol. 233, pp. 198-209, 2005. H. Aritani, S. Kawaguchi, T. Yamamoto, T. Tanaka, S. Imamura, Y. Okamoto, “Cu/ZrO2 catalysts for NO- CH4 reaction”, Chemistry Letters, vol. 29, pp. 532-533, 2000. Y. Okamoto, T. Kubota, H. Gotoh, Y. Ohto, H. Aritani, T. Tanakac, S. Yoshida, “XAFS study of zirconia-supported copper catalysts for the NO-CO reaction: Deactivation, rejuvenation and stabilization of Cu species”, Journal of the Chemical Society Faraday Transactions, vol. 94, pp. 3743-3752, 1998. Y. Li, Q. Fu, M. Flytzani, “Low-temperature water-gas shift reaction over Cu and Ni-loaded cerium oxides catalysts”, Applied Catalysis B: Environmental, vol. 27, pp. 179-191, 2000. P. Dow, J. Huang, “Effects of oxygen vacancy of Yttria-stabilized zirconia support on carbon monoxide oxidation over copper catalysts”, Journal of Catalysis, vol. 147, pp. 322-332, 1994. T. López, J. Navarrete, R. Gómez, O. Novaro, F. Figueras and H. Armendáriz, App. Catal. A 125,217 (1995). J. A. Flores, F. Morales, P. Salinas, J. J. Castro, C. Mejía. F. Chávez “Síntesis y caracterización por XRD y SEM-HR de nanocatalizadores de Cu/ZrO2”, XXV Reunión Nacional Académica de Física y Matemáticas, No. 25, pp. 352-357, 2020. J. R. Sohn, T. D. Kwon, S. B. Kim, Bull. Korean Chemical Society, vol. 22, p. 1309, 2001. [14] M. Rezaei, S. M. Alavi, S. Sahebdelfar, P. Bai, X. Liu, Z. F. Yan, Applied Catalysis. B, vol. 77, p. 346. 2008. [15] J. A. Wang, M. A. Valenzuela, J. Salmones, A. Vázquez, A. GarcíaRuiz, X. Bokhimi, Catalysis Today, vol. 68, p. 21, 2001. [16] M. H. Garduño, “Análisis de parámetros microestructurales: tamaño de cristalita y microdeformación de compuestos tipo hidrotalcita de cobalto (Tesis de Maestría)”, IPN-ESFM, Ciudad de México, 96 p. 2007. [17] O. L. Fernández, “Determinación del tamaño de grano cristalino por difracción de rayos-X de polvo (Tesis de Licenciatura)”, Universidad Nacional Mayor de San Marcos, Facultad de Ciencias Físicas, Lima, Perú, 39 p, 2015. [18] L. M. Goyeneche, “Determinación del tamaño de partícula mediante difracción de rayos-X (Tesis de Licenciatura)”, Universidad de Cantabria, 62 p, 2018. [19] A. L. Ramos, “Estudio de nanocatalizadores de cobre soportados en ZrO2 para la producción de biodiesel (Tesis de Licenciatura), Universidad del Istmo, Campus Tehuantepec, Oaxaca, 91 p, 2016. [20] V. R. Chary, Sagar, G. Vidya, S. Chakravarthula, R. Vattikonda. “Characterization and Catalytic Functionalities of cooper Oxide Catalysts Supported on Zirconia”, Journal of physical chemistry, vol. 111, pp. 543-550. [21] F. Morales, M. Viniegra, R. Arroyo, G. Cordoba and T. A. Zepeda. “CO oxidation over CuO/ZrO2 catalysts: effect of loading and incorporation procedure of CuO.” Materials Research Innovations 2010 Vol. 14, No. 2, 183. [22] F. Morales-Anzures, F. Chávez-Rivas, J. Hernández-Ventura, P. Salinas-Hernández, G. Berlier, G. Zacahua-Tlacuatl, “Spectroscopic characterization of CuOx/TiO2–ZrO2 catalysts prepared by a-step sol– gel method.” Applied Catalysis A: General. 489(2015) 218. [23] M. Carrera, F. Morales, P. Salinas, “XRD, TPR y UV-Vis de catalizadores de Cu-ZrO2 preparados por el método sol-gel en medio ácido”, XXIV Reunión Nacional Académica de Física y Matemáticas, No. 24, pp. 44-47, 2019. [24] G. F. Águila, “Estudio y caracterización de catalizadores de Cu soportado y su aplicación en las reacciones de oxidación de CH4 y CO (Tesis de Doctorado)”, Universidad de Chile, Facultad de Ciencias Físicas y Matemáticas, Santiago de Chile, 187 p, 2010.