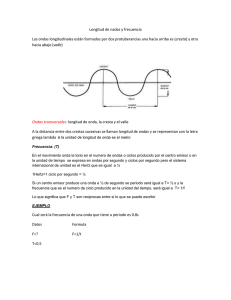
La luz https://www.youtube.com/watch?v=e6h7zuryULY Link (ver primero) https://www.youtube.com/watch?v=eTQ0smpy87w Teoría Cuántica Y Estructura Atómica Max Planck en 1900 al analizar los datos de la radiación emitida por sólidos a varias temperaturas, descubrió que los átomos y moléculas emiten energía únicamente en números enteros múltiplos de ciertas cantidades bien definidas. En contraparte, los físicos siempre habían considerado que la energía es continua, lo que significa que cualquier cantidad de energía se puede liberar en un proceso de radiación. Planck demostró que la energía se puede liberar solo en ciertas cantidades definidas llamados cuantos: dando lugar con esto a la teoría cuántica. Para entender la teoría cuántica de Planck, es necesario conocer la naturaleza de la radiación, que es la emisión y trasmision de energía a través del espacio en forma de ondas. Propiedades de las Ondas: Una onda se puede considerar como una perturbación vibracional por medio de la cual se trasmite la energía. La velocidad de la onda depende del tipo de onda y de la naturaleza del medio a través del cual viaja (por ejemplo, ondas de agua), las ondas de agua se generan por diferencias en la presión de la superficie del agua en varias regiones; se observa que la onda es de carácter periódico, es decir que, la forma de la onda se repite a si misma a intervalos regulares. La distancia entre puntos idénticos en ondas sucesivas se llama longitud de onda (lambda). La frecuencia (v , nu) de la onda, es el número de onda que pasa a través de un punto específico en un segundo (el número de veces / segundo que se completa un ciclo ascendente y descendente; (esto es en agua)). La amplitud es la distancia vertical de la línea media de la onda a la cresta o al valle. Una propiedad importante de una onda que viaja a través del espacio es su velocidad. La velocidad de una onda depende del número de ciclos de la onda que pasa a través de un punto dado por segundo (esto es, de la frecuencia) y de la longitud de onda. La velocidad de una onda (u) está dada por el producto de su longitud de onda y su frecuencia: u = lambda X v distancia / onda X ondas / tiempo = distancia / tiempo lambda v u Las longitudes de onda comúnmente se expresan en metros, centímetros, o nanómetros. La frecuencia se mide en hertz = 1 ciclo/s La palabra “ciclo” se puede eliminar y la frecuencia se expresa por ejemplo, en 25/s (que se lee como “25 por segundo”). 1.-Calcúlese la velocidad de una onda cuya longitud de onda es de 17.4 cm y su frecuencia es de 87.4 hz. u = 17.4 cm x 87.4 hz u = 17.4 cm x 87.4 /s u = 1.52 x 10³ RADIACION ELECTROMAGNETICA La radiación es la emisión y transmisión de energía a través del espacio en forma de ondas. En 1873 James Maxwell demostró teóricamente que la luz visible consta de ondas electromagnéticas: de acuerdo con la teoría de Maxwell, una onda electromagnética tiene por componente un campo eléctrico y un campo magnético. Estos dos componentes tienen la misma longitud de onda y la misma frecuencia y en consecuencia la misma velocidad, pero viajan en planos mutuamente perpendiculares. Esta teoría proporciona una descripción matemática del comportamiento general de la luz, en particular, su modelo describe con exactitud como se puede propagar la energía en forma de radiación a través del espacio en forma de vibración de campos eléctrico y magnético. Se sabe que la luz se comporta como radiación electromagnética; que es la emisión de energía en forma de ondas electromagnéticas. Las ondas electromagnéticas viajan a 3.00 x 108 m/s ó 186,000 millas por segundo que es la velocidad de la luz en el vacío. A pesar de que la velocidad difiere de un medio a otro, las variaciones son lo suficientemente pequeñas para que se pueda usar 3.00 x 108 m/s como la velocidad de la luz en los cálculos. Por convención se usa el símbolo c para la velocidad de la luz. (la long de onda de las ondas electromagnéticas esta dada en nanómetros, nm). Ejemplo; la longitud de onda de de la luz verde de un semáforo se centra en 522 nm ¿cual es la frecuencia de esta radiación?. v = c/ lambda. Se sustituye u por c cuyo valor es 3.00 x 108 m/s 1 nm = 1 x10-9 m 3.00 x 108 m/s v= ___________________ 522nm (1 x 10-9 m / 1nm) v = 5.75 x 1014 /s Significa que 5.75 x 1014 ondas pasan por un punto fijo c/segundo. las ondas largas de radio se emiten por grandes antenas como las que usan las radiodifusoras. Las longitudes de onda visibles mas cortas son producidas por el movimiento de los electrones dentro de los átomos y las moléculas. Las ondas de mínima longitud, que también tienen la máxima frecuencia son aquellas asociadas con los rayos gamma, las cuales resultan de cambios en el interior del núcleo del átomo. Mientras mayor sea la frecuencia, mayor energía tendrá la radiación, así, la radiación ultravioleta, los rayos x y los rayos gamma son radiaciones de alta energía. ESPECTROS ÁTOMOS Y NÚCLEOS El desarrollo de la física moderna ha permitido comprender la organización íntima de la materia. El estudio de los espectros de líneas de diferentes elementos químicos forzó el desarrollo de nuevas teorías que fueran capaces de explicar los resultados experimentales. A los modelos sobre la estructura del átomo han seguido los modelos sobre el núcleo atómico en un intento de abarcar los fenómenos de la física del núcleo tales como las intenciones entre sus componentes, la desintegración radiactiva o las reacciones nucleares. Los experimentos llevados a cabo por Newton sobre el análisis de la luz blanca pusieron de manifiesto que estaba compuesta por la superposición de un conjunto de colores sucesivos que van desde el violeta hasta el rojo. Esta gama de los colores del arco iris recibe el nombre de espectro visible. Con cierta frecuencia el término espectro se toma como sinónimo de gama. Así el espectro electromagnético constituye la gama o conjunto de radiaciones electromagnéticas que comprende desde los rayos y hasta las ondas de radio y del cual el espectro visible es sólo una pequeña fracción. Desde el siglo pasado los estudios sobre la dispersión de la luz emitida por la combustión de diferentes elementos químicos han revelado una estructura discontinua de líneas que también recibe el nombre de espectro (de líneas). Investigaciones posteriores han dado lugar a nuevas utilizaciones científicas del término espectro. En su principal significado un espectro es una representación gráfica, fotográfica o meramente visual de la distribución de la intensidad de la radiación electromagnética emitida o absorbida por una sustancia en función de la frecuencia o de la longitud de onda. ESPECTROS ATÓMICOS Espectros de emisión Cuando un elemento químico en forma gaseosa o de vapor recibe energía, bien por calentamiento a alta temperatura, bien por una descarga eléctrica de alta tensión, emite luz que puede ser analizada mediante un espectroscopio. Multitud de observaciones de este tipo fueron realizadas durante el siglo XIX, obteniéndose una secuencia de líneas que resultó ser característica del elemento empleado como fuente de luz. Los espectros de emisión se convirtieron así en métodos de identificación de los elementos y de los átomos que los constituyen, por lo cual se les denomina también espectros atómicos. Hacia 1860 Kirchhoff y Balmer analizando la luz proviniente del Sol mediante un espectroscopio consiguieron demostrar la existencia en su atmósfera de diferentes elementos químicos, entre ellos el hidrógeno. La aplicación del estudio espectroscópico a la determinación de la composición de las sustancias (análisis espectroquímico) se desarrolló rápidamente. Así se consiguió determinar la composición de los meteoritos, y analizando por este procedimiento el vapor de agua mineral se llegó a descubrir la existencia de dos nuevos elementos, el rubidio y el cesio. Espectros de absorción Los espectros de emisión se caracterizan por una serie de líneas brillantes; los de absorción, por el contrario, están formados por una secuencia de líneas oscuras que aparecen sobre el fondo luminoso del espectro visible. Se producen cuando un haz de luz blanca se hace pasar por una muestra gaseosa. Si se analiza mediante un espectroscopio el haz de luz que emerge de la muestra, se observará ese conjunto de líneas oscuras que constituyen el espectro de absorción de la sustancia considerada. La luz blanca contiene una gama continua de longitudes de onda, pero sólo unas componentes definidas son sustraídas o absorbidas por los átomos que constituyen la muestra gaseosa empleada. Todas las líneas del espectro de absorción de una muestra dada ocupan posiciones que se corresponden con algunas de las líneas del espectro de emisión de esa misma muestra. Como sucede con los espectros de emisión, los de absorción son también característicos de cada elemento químico; su análisis permite, por tanto, la identificación del elemento que en forma gaseosa se interpuso entre la fuente de luz blanca y el espectroscopio. El físico alemán Fraunhofer fue el primero en detectar un espectro de absorción. Analizando la luz solar observó la presencia de más de setecientas líneas oscuras distribuidas a lo largo del espectro visible. Del análisis de este espectro pudo identificarse un grupo de líneas que no correspondía a ningún elemento conocido, deduciéndose así la existencia en la atmósfera solar de un nuevo elemento gaseoso, el helio, que en griego significa Sol.