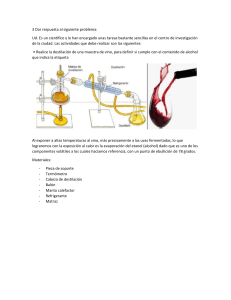
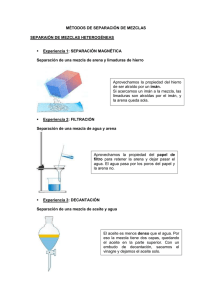
QUÍMICA I Código: CB005SA PRÁCTICA 2: SEPARACIÓN DE MEZCLAS INGENIERÍA AMBIENTAL Y SANITARIA Métodos o Técnicas de Separación de mezclas 1.1 Materiales y Reactivos • • • • • • • • • • • • Embudo de decantación Soporte universal y pinza 2 Vaso de precipitado de 500mL Erlenmeyer de 500mL Embudo de filtración Papel filtro Balón de destilación Placa de calentamiento Termómetro Condensador Piedras de destilación. Hielo • • • • • • • • • • • Aceite Arena Viruta de hierro Imán Caja Petri Etanol (alcohol) 2 probetas 250 mL Carbonato de calcio CaCO3 (tiza) Mortero y pistilo Espátula Cronómetro 1.2 Procedimiento Parte I: Preparación de mezclas. • Mezcla 1: Adicione ___ mL de aceite la misma cantidad de H2O. • Mezcla 2: Adicione cualquier cantidad arena fina con 150 mL de H2O, luego adicione una cantidad suficiente de CaCO3 y mezcle. • Mezcla 3: Mezcla de etanol (puede ser un vino o licor de su preferencia que contenga alcohol, preferiblemente con color). (Este proceso es para todo el grupo). Mezcla 4: Mezcle la cantidad de arena que desee con viruta hierro y adicionarlos a una caja Petri (pese la viruta antes de mezclar). Parte II: Separación de las mezclas preparadas en la primera parte. En primer lugar, debe identificar de acuerdo a las características de la mezcla, el método o • QUÍMICA I Código: CB005SA PRÁCTICA 2: SEPARACIÓN DE MEZCLAS INGENIERÍA AMBIENTAL Y SANITARIA técnica adecuado para obtener los componentes que la conforman. Posteriormente, realizar los montajes mostrados en la figura 1 (destilación), 2 (decantación) y 3 (filtración) siguiendo las siguientes orientaciones. Decantación: 1. Realizar el montaje de la figura. 2. Se vierte la mezcla en el embudo de decantación, asegurándonos antes de que la llave de la parte inferior está cerrada (en posición horizontal), para que la mezcla no salga mientras la vertemos. 3. Se deja reposar hasta que ambos líquidos se separan bien. 4. Se coloca un vaso de precipitados debajo del embudo y se abre la llave. Empezará a salir el líquido más denso (es decir, el que está en la parte inferior de la mezcla). 5. Cerramos la llave en cuanto haya pasado todo este primer líquido. 6. El líquido menos denso seguirá en el embudo. Para recuperarlo, conviene sacarlo por la parte superior de este; así evitaremos contaminarlo con los restos de la otra sustancia que hayan podido quedar en la llave. • Para una mezcla líquido sólido también posible hacer la separación por decantación; para estos casos. 7. Dejar en reposo la mezcla hasta que se sedimente o flote el sólido. 8. Si se sedimenta, verter el líquido en otro recipiente sin dejar pasar material sólido; por el caso contrario, si el sólido flota, tomar el material adecuado para recoger el sólido con la menor cantidad de líquido posible. Destilación: 1. Realizar el montaje de la figura. 2. Introducir la mezcla (agua y alcohol) en el matraz de destilación con la ayuda del embudo. 3. La solución de agua - alcohol se calientan en un balón de destilación. Mientras es calentada la mezcla se generará vapor de agua. 4. El vapor de agua generado viaja por el tubo refrigerante convirtiendo el agua de estado gaseoso a estado líquido (condensación). 5. Finalmente, la totalidad de alcohol se condensa en un recipiente separado. El agua no se evapora y se queda en el balón de destilación. • QUÍMICA I Código: CB005SA PRÁCTICA 2: SEPARACIÓN DE MEZCLAS INGENIERÍA AMBIENTAL Y SANITARIA Para la destilación se va a tomar el tiempo con un cronómetro desde el momento en que se comienza a calentar, registrando en cada momento la temperatura. Filtración: 1. Se realiza el montaje de la figura. 2. Doblar el papel filtro en pliegues. 3. Se vierte la mezcla por el papel filtro que se encarga de retener las partículas de sólido y el líquido pasa al vaso de precipitado. Magnetización: 1. Con un imán separe el material magnético del no magnético. 2. Pese el material separado. Después de aplicar los tres métodos de separación medir la masa de los componentes de la mezcla y realizar la respectiva comparación con los datos de masas iniciales, calculando el rendimiento del procedimiento mediante la siguiente ecuación. %𝑅 = %R = porcentaje recuperado mf = masa final o recuperada mo = masa inicial 𝑚𝑓 ∗ 100 𝑚𝑜 QUÍMICA I Código: CB005SA PRÁCTICA 2: SEPARACIÓN DE MEZCLAS INGENIERÍA AMBIENTAL Y SANITARIA 1.3 Resultados Medir la masa de los componentes de la mezcla inicial y la masa obtenida después de la separación y calcular el rendimiento. Argumente el resultado obtenido. Complete la siguiente tabla con la información observada en el laboratorio. Mezcla Tipo de mezcla* Solubilidad** Cantidad de fases 1 2 3 4 *indique si es una mezcla homogénea o heterogénea. **indique si es soluble o no es soluble en agua. Con los datos tomados en el laboratorio y calculados, complete la siguiente tabla. Cantidad Cantidad Cantidad perdida Porcentaje de Sustancia agregada [g] recuperada [g] [g] recuperación [%] C2H5OH Fe Aceite Agua Responda las siguientes preguntas. 1. ¿Por qué se dan las pérdidas al realizar el proceso de separación? 2. Al mezclar el aceite con agua y esperar que se separen bien las fases, el agua queda en el fondo. ¿a qué se debe este fenómeno? 3. ¿Qué es inmiscible? 4. ¿Por qué el aceite y el agua son inmiscibles? Usted creería que al separar el etanol del agua se obtiene un 100% de pureza en el alcohol, ¿sí o no?, justifique su respuesta. 5. Haga una gráfica de t [s/min/h] vs T [°C/°F/K]. a. ¿En qué tiempo la temperatura empezó a ser constante y, en qué momento empezó nuevamente a ascender? b. ¿Por qué en un momento dado la temperatura se mantiene constante en el tiempo? QUÍMICA I Código: CB005SA PRÁCTICA 2: SEPARACIÓN DE MEZCLAS INGENIERÍA AMBIENTAL Y SANITARIA Referencias http://www.tiposde.org/ciencias-naturales/111-tipos-de-mezclas/#ixzz4v3RnWUy5 https://www.tplaboratorioquimico.com/laboratorio-quimico/procedimientos-basicos-delaboratorio/que-es-la-filtracion.html Martinez, W. (2014). Los caminos del saber – Química I. Editorial Santillana.