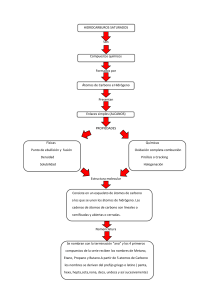
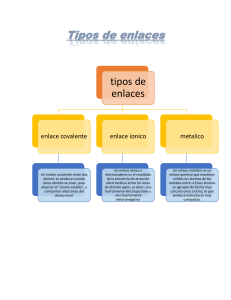
Matería Masa Cantidad de partícula Punto de ebullición Densidad Volumen Punto de congelación Poder calorífico Área Tensión superficial Entropía Número de moles Presión de vapor Índice de refracción Capacidad calorífica Longitud Punto de fusión Energía interna Carga eléctrica Conductividad térmica Conductividad eléctrica “Todo aquello que tiene un lugar en el espacio y tiene masa” Propiedades Extensivas Intensivas Dependen de la cantidad o tamaño de la muestra de materia. No dependen de la cantidad o tamaño de la muestra de materia. Volumen Color ACTIVIDAD 1 Pag. 13. Dibuja cada concepto ACTIVIDAD 2 Modelos atómicos (Cuadro comparativo) Modelo ¿Quién lo propuso? Breve descripción del modelo ACTIVIDAD 3 Imagen Pág 14-16. Experimento o Cualquier evidencia que lo limitación o respalde debilidad “Los Átomos NO Son Así”(Resumen) https://www.youtube.com/watch?v=wxIxWTTsBj4 Átomos (Elementos de la tabla periodica) 12 Número total de electrones por nivel. Z= 6 p+= 6 e- = 6 A= 12 n0 = 6 Q= 0 ACTIVIDAD 4 Calculo de masa atómica Realiza apuntes de la siguiente liga: https://www.youtube.com/watch?v=yj95PMPsIFU “Masa Atómica Relativa y Abundancia Isotópica ⚛ Ejercicios y problemas” Isótopos Átomos (Elementos de la tabla periodica) Átomos (Elementos de la tabla periodica) Excepción de la regla del octeto Regla del octeto EXCEPCIONES ENLACE COVALENTE ACTIVIDAD 5 Estructuras de lewis • Realiza los apuntes de la siguiente liga: https://www.youtube.com/watch?v=dWh4wf5VgMs “QUÍMICA. Estructuras de Lewis (teoría + ejercicios)” ACTIVIDAD 6 Completa la tabla e identifica los cationes y aniones. Si se trata de un isótopo escribe cual es su función. Elemento Z P+ e- A no Q Diagrama ACTIVIDAD 7 Dibuja los diagramas de Lewis • CO2 • H2SO4 • NH3 Configuración electrónica Configuración electrónica Configuración electrónica Configuración electronica Bloques Escribe la configuración electronica y el diagrama de orbitales, y dibujalo. ACTIVIDAD 8 Elemento Número átomico Bromo 12 Dibujo Configuración Diagrama Bloque al que pertenece Pág 22-24. ACTIVIDAD 9 ¿Cómo se ordena? ¿Quién la creo? ¿Cuántos elementos actuales son? ¿Qué es? ¿Qué es? Periodos Tabla periódica Consta de … Grupos o familias Propiedades periódicas Energía de ionización Ej. O F /Rb P Afinidad electronica Ej. Na ¿Qué es? Bloques Clasificación general en… Metales Caract. Mg Distancia que existe entre el núcleo y la capa más externa. Aumenta de der. a izq. y de arriba para abajo. Metaloides Caract. Ej. Ca Rb /Cs H Electronegatividad Ej. F Na /O B ¿Qué es? No metales Caract. PROPIEDADES PERIÓDICAS Pág 25. “La escala del universo” • Contertar preguntas en el libro. ACTIVIDAD 10 Enlaces químicos NM+NM No iguales Iguales M+M Resolver pág 28 y 29 M+NM Reacción quÍmica Resolver pág.31, 35 y 36. Breve explicación Ej (3) Ej (3) Fisicos Químicos Propiedades físicas se altera sin cambiar composición química ACTIVIDAD 12 Rompimiento y formación de nuevos No ocurre Se altera la composición química Cambios No pueden separarse por medtodos físicos Sustancia pura Contiene átomos de dos o más tipos Contiene átomos de un solo tipo Métodos de separación Materia Pág 30-35 ACTIVIDAD 11 Elemento Ej (3) Compuesto ENLACES Ej (3) Pueden separarse por medtodos físicos Componentes no se distinguen Homogéneas Ej (3) Video* Mezcla Componentes se distinguen Heterogéneas Ej (3) *https://www.youtube.com/watch?v=nJw0mRE6t_E Reacción química Balanceo por tanteo H3P + Ca Ca3P2 + H2 1 Ca 3 1P 2 3H2 2H3P + 3Ca Ca3P2 + 3H2 3=3x1 Ca 3 2=2x1 P 2 6 3 H 2x3=6 1. Identificar los elementos presentes. 2. Ordenar por métales, no métales, hidrogeno y por último oxigeno. 3. Cuantificar átomos de lado de reactivos y productos. 4. Buscar número que multiplicado me da el número buscado. 5. Colocarlo como coeficiente. 6. Cuantificar de nuevo átomos. 7. Repetir procedemiento hasta que se balancea. Balanceo por tanteo Al2(SO4)3 + 6H2O 2Al2(OH)3 + 3H2SO4 1 1 5 7 2Al2(OH)3 + 3H2SO4 Al 2 S 2 H2 O 13 Al2(SO4)3 + 6H2O 2=2x1 Al 2 3=3x1 S 2 12 8 5 H 2x6 = 12 18 10 7 O 13 18 1. Identificar los elementos presentes. 2. Ordenar por métales, no métales, hidrogeno y por último oxígeno. 3. Cuantificar átomos de lado de reactivos y productos. 4. Buscar número que multiplicado me da el número buscado. 5. Colocarlo como coeficiente. 6. Cuantificar de nuevo átomos. 7. Repetir procedemiento hasta que se balancea. ACTIVIDAD 13 Resolver pág. 33 (Por método de tanteo y con simulador, realiza captura de pantalla) ACTIVIDAD 14 Resolver pág. 6 y 7. Estados de agregación (def. y caract.) Se emplean en …(3 ej.) GAS caracteristicas Fluidos Los gases no tiene forma definida, adoptan el volumen y la del . Además sus móleculas . propiedades Compresibilidad Expansibilidad Expansión térmica Se emplean en …(2 ej.) Se caracterizan… Las --------------- son aquellas que mantienen las paerticulas de los fluidos interactuando entre si. Fuerzas Las particuas se mantienen en una estructura . fluyen y no se debido a . Y los sólidos tienen una densidad . Tiene un definido y son relativamente . Fluye y se adapta a la forma de recipiente pero conserva .Se caracteriza por tener fuerzas de cohesión , lo que le permite . propiedades Se emplean en …(1 ej.) Volumen definido caso particula de las Fluidez Cristalinos propiedades Dureza Elasticidad Densidad Incompresibilidad Según su estructura se dividen en Resistencia ejemplo Mezclabilidad Presión SÓLIDO LÍQUIDO Amorfos Conductividad térmica Fuerzas electrostáticas son Tensión superficial Tenacidad Difusión Viscosidad Baja densidad Transparencia Estados de Cíneti agregación ca LÍQUI (Cinética) GA S SÓLID O DO estudia El modelo cínetico molecular establece El modelo cínetico molecular establece aplicaciones Leyes Ley de Boyle Ley de Gay-Lussac Ley de Charles Ley de Avogadro Los átomos o moléculas individuales en un sólido pueden . aplicaciones En líquidos con fuerzas de atracción intermoleculares fuertes las móleculas se . Por lo que estos líquidos tienenuna viscosidad y una tasa de difusión . ejemplo En líquidos con fuerzas de atracción intermoleculares débiles las móleculas tiene más liberartad . Por lo que estos líquidos tienenuna viscosidad y una tasa de difusión . ejemplo Ej de 2 propiedades que se pueden modificar Cuadro comparativo “Leyes de los gases” Ley Ley de Boyle Ley de GayLussac Ley de Charles Ley de Avogadro Pág. 38, 39, 40 y 44. Formula Postulado Experimento Ej. de ejercicio Meme Busca un meme y explicalo. Adicionalmente traducelo en inglés. Explanation Natural diamonds were born deep below the earth’s surface in environments of extreme pressure and temperature. At depths of over 120km, through intense heat of between 900°C and 1300°C, pressures of 45 kbar and above and over millions and often billions of years, this incredible miracle happens – carbon crystallises to form diamonds.