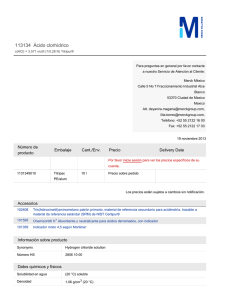
FACULTAD DE CIENCIAS QUIMICAS GUIA DE PRÁCTICAS LABORATORIO DE QUÍMICA INORGÁNICA INDUSTRIAL Asignatura: Química Inorgánica Industrial Unidad Curricular: Operaciones Unitarias – Balance de Materia y Energía Práctica N° 02: Síntesis del Ácido Sulfúrico 1. Objetivo General Obtener ácido sulfúrico mediante la combustión de azufre elemental. 2. Objetivos Específicos - Acoplar un sistema de síntesis industrial a las necesidades del laboratorio. - Determinar la concentración del ácido sulfúrico obtenido. 3. Fundamento Teórico La obtención del ácido sulfúrico se realiza a partir del SO2, éste se oxida a SO3 y luego se obtiene ácido sulfúrico por reacción con el agua. En la actualidad hay dos variantes para la obtención del trióxido de azufre (proceso lento), denominadas el método de contacto y el método de las cámaras de plomo. El primero es más caro, pero produce ácido sulfúrico muy concentrado (95%) y de elevada pureza. El segundo es más económico, tiene mayor capacidad de producción, pero el ácido sulfúrico obtenido es de menor concentración (70%) y de menor pureza (ver anexo). En ambos métodos, se parte del dióxido de azufre previamente obtenido (a partir de la tostación de la pirita) y se oxida a trióxido de azufre utilizando un catalizador. El método de contacto necesita un trióxido de azufre muy puro para no envenenar el catalizador que suele ser arsénico u óxido de hierro, y es por esta razón por lo que resulta más caro. El trióxido de azufre obtenido se enfría y se hace pasar por una torre de absorción donde se combina con ácido sulfúrico concentrado formándose el ácido pirosulfúrico: H2SO4 + SO3 H2S2O7 que luego se descompone por acción del agua según la reacción: H2S2O7 + H2O 2 H2SO4 No es conveniente mezclar directamente el trióxido de azufre sobre agua para obtener el ácido sulfúrico según la reacción: SO3 + H2O H2SO4 porque en dicha reacción se desprende muchísima energía, haciendo que la mayor parte del trióxido de azufre se volatilice sin reaccionar para formar el ácido sulfúrico. 4. Parte Experimental Equipos, materiales - Mechero Bunsen - Tubo de hierro/acero - Material de vidrio FACULTAD DE CIENCIAS QUIMICAS GUIA DE PRÁCTICAS LABORATORIO DE QUÍMICA INORGÁNICA INDUSTRIAL Reactivos - Azufre Procedimiento a. Tomando como referencia el esquema de la figura 1. Armar el equipo de extracción11. b. Utilizando la estequiometria de las diferentes etapas de las reacciones que se dan en el proceso para la obtención del ácido sulfúrico hacer los cálculos respectivos para obtener 20g de ácido sulfúrico al 2%(p/p). c. Colocar en el interior del tubo de metal flor de azufre (quemador de azufre). d. Llenar de agua el recolector de gas y cerrar el sistema e. Llevar a la llama el quemador de azufre, asegurándose que no existan fugas. f. Cuando se detenga la emisión de gas2, desarme el equipo. g. Finalmente, determinar la concentración del ácido obtenido3. Figura 1 Esquema simplificado del método de obtención de ácido sulfúrico a escala industrial. Manejo de residuos, tratamiento y etiquetado Residuo Manejo Tratamiento/almacenaje/etiquetado Azufre fundido Utilizar todo el equipo de Una vez frío, recolectar el sólido en un protección. recipiente plástico y etiquetarlo siguiendo el NO inhalar y lavarse las formato del anexo C manos después de Mantener alejado de chispas y fuentes de manipular el producto. ignición. Ácido Sulfúrico 1 Utilizar todo el equipo de protección. NO inhalar y lavarse las manos después de manipular el producto. Recolectar el ácido en un frasco ambar y etiquetarlo siguiendo el formato del anexo D. Producto no inflamable bajo condiciones normales de almacenamiento, manipulación y uso. Realizar ésta experimentación dentro de una campana de extracción y utilice todo el equipo de seguridad necesario. 2 Importante: No desarmar el equipo hasta que la reacción haya finalizado. 3 Entregar el producto final obtenido debidamente etiquetado. Siguiendo el formato indicado en el anexo D. FACULTAD DE CIENCIAS QUIMICAS GUIA DE PRÁCTICAS LABORATORIO DE QUÍMICA INORGÁNICA INDUSTRIAL Lecturas adicionales sugeridas Impacto ambiental de los residuos ácidos sulfurados. 5. Cuestionario a. ¿Cómo comprobaría la obtención del ácido sulfúrico producido? b. Considerando que se trata de un proceso exotérmico, liberando un total de 5671 kJ/kg de energía, analice el siguiente cuadro, discutiendo que consideraciones de seguridad que tomaría para el control de cada etapa en la producción a escala industrial. 6. Referencias bibliográficas Ciaquímica (2020). Obtención de ácido sulfúrico. Recuperado de: http://www.100ciaquimica.net/temas/tema11/punto7b.htm 7. Anexos