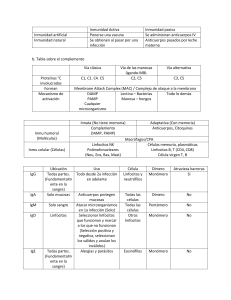
LIBRO DE PRÁCTICAS DE INMUNOLOGÍA DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR III E INMUNOLOGÍA INDICE Práctica 1: CITOMETRÍA DE FLUJO. INTERPRETACIÓN DE LOS RESULTADOS APLICADOS A LA IDENTIFICACIÓN DE SUBPOBLACIONES LEUCOCITARIAS Práctica 2: CITOTOXICIDAD MEDIADA POR COMPLEMENTO: TIPAJE HLA DE CLASE I SEROLÓGICO. Práctica 3: EVALUACIÓN DE LA RESPUESTA INMUNITARIA. DETERMINACIÓN DE LOS ANTICUERPOS CONTRA EL TOXOIDE TETÁNICO MEDIANTE INMUNOENSAYO (ELISA) Práctica 4: DETECCIÓN DE AUTOANTICUERPOS POR INMUNOFLUORESCENCIA 2 Inmunología Práctica 1 INMUNOLOGÍA PRÁCTICA 1 CITOMETRÍA DE FLUJO INTERPRETACIÓN DE LOS RESULTADOS APLICADOS A LA IDENTIFICACIÓN DE SUBPOBLACIONES LEUCOCITARIAS 3 Inmunología Práctica 1 OBJETIVOS GENERALES DE LA PRÁCTICA: • Los alumnos aprenderán el fundamento del citómetro de flujo y sus aplicaciones más importantes. • Conocerán la información que nos da el citómetro sobre las distintas poblaciones celulares, fundamentalmente aplicado a poblaciones sanguíneas. • Aprenderán como se pueden identificar distintas moléculas en la superficie de una célula; y como de esta forma se pueden diferenciar células que bajo microscopia rutinaria es muy difícil o imposible. • Aprenderán una de las utilidades más importantes de los anticuerpos monoclonales, y como con ellos se pueden identificar esas moléculas de la superficie de la célula. • Reforzaran el conocimiento de los marcadores más importantes de utilidad clínica y usados en la caracterización de las distintas subpoblaciones linfocitarias • Asimilarán la diferencia entre inmunofluorescencia directa e indirecta. • Comprenderán, con ejemplos, su aplicación al estudio de inmunodeficiencias (ej. SIDA) y al estudio de las leucemias. 4 Inmunología Práctica 1 La Citometría de flujo consiste en el análisis rápido de células en suspensión dentro de un sistema de flujo laminar, sobre el que incide un haz de luz que proporciona información acerca de sus características físico-químicas. En 1969 se aplicó el láser como fuente luminosa y quedaron establecidas las bases de la citometría de flujo moderna. 1. ELEMENTOS DE UN CITÓMETRO: Un citómetro de flujo se compone de tres sistemas instrumentales: • Sistema de inyección o fluidos • Sistema óptico • Sistema informático 1.1. Sistema de inyección y manejo de la muestra: Consiste en un mecanismo hidráulico presurizado compuesto por jeringas o bombas peristálticas de inyección, conductos y electroválvulas. Este sistema tiene como misión recoger la muestra y, a través de una corriente de solución salina (fluido envolvente), conducirla hasta el canal de flujo, comúnmente formado por un elemento de cuarzo en su centro. De este modo, al quedar sometida la muestra de células en suspensión a una presión envolvente por el tampón salino, se genera su flujo hacia el canal capilar de contaje en forma de elementos alineados sobre los que incidirá la luz del sistema óptico. La inyección se realiza habitualmente por un sistema volumétrico compuesto de bomba y/o jeringa, capaz de inyectar un volumen exacto de la suspensión celular. Además, el sistema consta de un contador volumétrico para el recuento de las unidades celulares que fluyen por el capilar. 1.2. Sistema óptico: Según el carácter del haz luminoso, los primeros sistemas de citometría empleaban lámparas de mercurio y redes de difracción. Estos sistemas actualmente no se utilizan y han sido sustituidos por los sistemas multiparamétricos o de luz láser debido principalmente a sus propiedades de intensidad, estabilidad y monocromaticidad. Existen diferentes tipos de láser: Láseres en estado gaseoso. El utilizado con más frecuencia es el de ion argón, que emite a una longitud de onda (λ) de 488 nm correspondiente con la zona azul del espectro visible. También se usan con frecuencia el de ion kriptón para excitación violeta y UV (λ= 407nm, 350nm) y el de helio-neón (HeNe) para excitación en el rojo lejano (λ= 633 nm). El principal inconveniente de estos sistemas es que son muy voluminosos, requieren de refrigeración y del agotamiento del gas empleado, que requiere su recarga periódica. Láseres en estado sólido, o láseres de diodo (DPSS). El medio activo es un material cristalino dopado con elementos denominados “tierras raras” en la tabla periódica. Entre los más comunes están el de nitruro de galio (GaN), el granate de aluminio-itrio dopado con neodimio (Nd:YAG), el ortovanadato de itrio dopado con neodimio (Nd:YVO), o los de rubí o zafiro. Se 5 Inmunología Práctica 1 consigue emisiones de luz discretas típicamente a λ= 405 nm, 488 nm y 642 nm. Presentan más ventajas que los anteriores ya que son mucho más pequeños, tienen menores requisitos de potencia y no requieren de un calentamiento previo al análisis. Otros elementos de importancia dentro del sistema óptico son las lentes colectoras, los filtros ópticos, los espejos dicroicos y los detectores o fotomultiplicadores (fig. 1). Figura 1: Representación esquemática de un citómetro de flujo. 1.3. Unidad informática En general consta de: Diversos amplificadores de señal.Un transformador analógico-digital, que convierte los pulsos electrónicos que llegan a los fotomultiplicadores en información digital. Un ordenador de gran capacidad que almacena y analiza los datos, proporcionando estudios estadísticos y representación gráfica de los mismos A B Figura 2. Ejemplos de citómetros de flujo. A. Sistema convencional con sistema óptico láser en estado gaseoso. B. Sistema compacto con láseres en estado sólido. 6 Inmunología Práctica 1 2. FUNCIONAMIENTO DE UN CITÓMETRO Tras la introducción del tubo de ensayo con la muestra problema a analizar, ésta es succionada por la jeringa conectada a una bomba hidráulica y es conducida mediante canalizaciones hasta la cámara de contaje, donde es envuelta por un fluido salino que rodea a las células alineándolas en su centro. De esta forma se consigue que las células pasen alineadas de una en una. A continuación, el haz de luz del láser atraviesa este flujo de células en lo que se denomina enfoque hidrodinámico. La interacción del láser con las células es recogida por los detectores correspondientes y convertida a pulsos electrónicos, que son transformados en números por el ADC (convertidor analógico-digital). Esos datos son interpretados y almacenados por el sistema informático. Por lo tanto, el archivo de almacenamiento de datos incluye una descripción de la muestra adquirida, además de la información sobre el citómetro en el que se recogieron los datos, el conjunto de éstos y los resultados. Una vez que un archivo de datos se ha guardado, la información recogida de las células se puede mostrar en formatos diferentes. En ausencia de fluorocromos unidos a las células, la incidencia del láser sobre éstas proporciona 2 tipos de señales ópticas en función del ángulo de recolección de la luz dispersada por parte de 2 fotodetectores diferentes (figura 3). Los ángulos de medida utilizados son: • Forward scatter (FSC): Configuración frontal, entre 1°-20°. Nos da información del tamaño de la célula. • Side scatter (SSC): Configuración lateral a 90°. Nos da información de la granularidad o complejidad intracelular. Figura 3. Se representa la dispersión de luz frontal (FSC, tamaño) y lateral (SSC, complejidad) Mediante el análisis de la información proporcionada por la configuración frontal y lateral de los elementos que fluyen por el citómetro, es posible agruparlos en distintas clases por tamaño y granularidad, de forma que el instrumento discrimina entre ellas y es capaz de mostrarlas en diferentes zonas. A mayor valor de FSC mayor tamaño, mientras que a mayor valor SSC, mayor complejidad. Esta información respecto a la morfología celular se representa en forma de ventanas, que serán diferentes según la información que le pidamos al citómetro. 7 Inmunología Práctica 1 Información proporcionada por la configuración frontal y lateral de los elementos A B )r e tt a c s e d i S ( Granulocitos Monocitos Linfocitos (Forward scatter) )r e tt a c s e d i S ( Granulocitos R1 Monocitos Linfocitos (Forward scatter) Figura 4. Esta ventana es con la que trabajamos de base para ver si la distribución celular es la correcta y analizar posteriormente toda la muestra (A) o bien seleccionar una población determinada (B) atendiendo a los parámetros FSC y SSC. En paralelo, si las células van marcadas con un fluorocromo, la señal producida como consecuencia de la excitación de éste por el láser, nos permitirá por ejemplo conocer el porcentaje de esas células marcadas respecto al total. Generalmente, el fluorocromo está incorporado a un anticuerpo que reconoce específicamente un antígeno de la superficie celular. El análisis estadístico de las poblaciones celulares (la total por un lado y la seleccionada en regiones por otro) proporciona el canal medio de fluorescencia (Mode Channel) en el que se distribuyen FSC y SSC, su desviación típica y el coeficiente de variación. Actualmente, cuando realizamos estudios con poblaciones leucocitarias, dado la pequeña proporción de muchas de ellas y el tamaño, a veces coincidente con el que se establece en la ventana FSC/SSC, se recurre a hacer la combinación SSC/CD45 (Figura 5). Figura 5. La representación SSC/CD45 es una estrategia que nos permite trabajar solo con células CD45+ (antígeno panleucocitario), por lo que los detritus, agregados plaquetarios y los posibles eritrocitos presentes en la muestra quedan a la izquierda en la ventana. 8 Inmunología Práctica 1 3. REPRESENTACIÓN DE LA INFORMACIÓN Las poblaciones de células según su morfología o bien si están marcadas con algún fluorocromo, se pueden mostrar en varios formatos diferentes. Entre ellos los más usados son los 2 siguientes: 3.1. Histograma: Se emplea para representar en el eje horizontal (abscisas) las variaciones de un parámetro como la morfología celular o la intensidad de fluorescencia de un determinado marcaje en función del número de eventos (células) que el citómetro analiza. Dentro del histograma podemos definir una o varias regiones acotadas en un intervalo que nosotros definamos. Veamos el ejemplo de la figura 6. Figura 6. Histogramas que representan la intensidad de fluorescencia emitida por el fluorocromo FITC (isotiocianato de fluoresceína) acoplado a un anticuerpo concreto. Partimos de la ventana previa FSC/SCC en la que hemos definido la región R1 correspondiente a los linfocitos, por lo que los histogramas representados en la figura 6 corresponden exclusivamente a la señal que proviene de dicha región y no del total de la población. • En el primer histograma, el anticuerpo marcado con FITC ha sido anti-CD3, por lo que la fluorescencia detectada por el citómetro solo vendrá de los linfocitos que expresen CD3 en su superficie y se corresponde con el pico mayoritario de la derecha (linfocitos T, CD3+). Las células que no lo expresen quedarán a la izquierda y representan la población minoritaria, correspondiente al resto de linfocitos (CD3-). • En el histograma central aparecen 2 poblaciones más o menos similares en número pero con distinta intensidad de fluorescencia que proviene del marcaje con un anti-CD4. Este histograma nos indica que una de ellas no expresa CD4 (izquierda) y la otra sí (derecha) • En el último histograma, el anticuerpo empleado en el marcaje ha sido un anti-CD8. Como resultado también obtenemos una población CD8- (izquierda) y otra CD8+ (derecha) que corresponderá en este caso con la subpoblación de linfocitos T citotóxicos. En comparación podemos concluir que la expresión de CD8 es mayor que la de CD4, debido a que detectamos una mayor intensidad de fluorescencia (escala del eje X). 9 Inmunología Práctica 1 3.2. Dlot plot Son los más utilizados en citometría, ya que al representar 2 parámetros simultáneamente muestran más información (análisis multiparamétrico). Este tipo de representación es la que hemos visto anteriormente de tamaño y complejidad (FSC/SSC) o bien complejidad y expresión de CD45 (SSC/CD45). Sin embargo, normalmente este tipo de representaciones se emplea para mostrar 2 señales de fluorescencia distintas, correspondientes cada una de ellas a un anticuerpo marcado con un fluorocromo distinto (figura 7). DOT PLOT 103 104 100 101 102 CD3 PE 103 104 102 100 102 Fluorocromo 1 100 101 CD3-/CD830% CD3+/CD850% 101 CD3+/CD420% CD8 FITC 102 CD3-/CD430% 101 CD4 FITC 103 102 100 104 (+,-) CD3+/CD8+ 20% 103 (-,-) CD3+/CD4+ 50% 103 (+,+) 101 100 Fluorocromo 2 (-,+) C 104 B 104 A 100 101 102 CD3 PE 103 104 Figura 7. Dot-plots que representan la intensidad de fluorescencia de 2 fluorocromos distintos (FITC, isotiocianato de fluoresceína; PE, Ficoeritrina) acoplados cada uno a un anticuerpo específico. Al representar 2 señales de fluorescencia distintas, las células se pueden catalogar según se distribuyan en cada uno de los 4 cuadrantes: • En el dot-plot izquierdo se reflejan los cuatro cuadrantes, y las células se ordenarán según se cumpla una condición u otra. Es decir, en el cuadrante (-/-) se localizarán aquellas células que no sean reconocidas con ninguno de los anticuerpos marcados con fluorescencia. En el cuadrante (+/-) se encontrarán aquellas células que solo hayan sido reconocidas por el anticuerpo marcado con el fluorocromo 1. Del mismo modo, en el cuadrante (-/+) estarán las que solo expresen el antígeno reconocido por el anticuerpo marcado con el fluorocromo 2. Por último, en el cuadrante (+/+) se recogerán solo las células que sean reconocidas por ambos anticuerpos simultáneamente. • El dot-plot central esquematiza el marcaje simultáneo de leucocitos con un anticuerpo antiCD4 marcado con FITC y un anticuerpo anti-CD3 marcado con PE. Se ha restringido el análisis a la región de los linfocitos (R1). Observamos que existe una población que no emite señal para ninguno de los marcajes y que se corresponde con el 30% del total de linfocitos en R1. Vemos otra población que solo ha sido reconocida por el anticuerpo anti-CD3PE y que corresponde al 20% de R1. Finalmente, existe otra población en la que las células que la integran expresan ambos antígenos simultáneamente, por lo que son reconocidas por ambos anticuerpos y emiten ambas fluorescencias. Es la población doble positiva CD3/CD4 y representan el 50% de R1, que se correspondería con linfocitos T colaboradores. • Del mismo modo, el dot-plot de la derecha muestra un doble marcaje con anticuerpos antiCD3PE y anti-CD8FITC. Encontramos 3 poblaciones distintas dentro de la región R1 (linfocitos) según hayan sido marcados. Así, observamos una población que solo expresa CD3 10 Inmunología Práctica 1 (50%), otra que no expresa ninguno de estos 2 marcadores (doble negativa CD3/CD8, 30%) y otra de células que expresan ambos marcadores simultáneamente (doble positiva CD3/CD8, 20%), que representarían los linfocitos T citotóxicos. En la siguiente figura 8 se muestran ejemplos reales del citómetro. Normalmente, la ordenación en cuadrantes no es tan evidente, puesto que muchas moléculas de la superficie celular tienen un nivel de expresión gradual. Además, en los citómetros modernos se suelen representar las distintas poblaciones no tanto por cuadrantes sino por colores. En este estudio, las células sanguíneas se han incubado con 5 anticuerpos distintos, cada uno acoplado a un fluorocromo diferente. Estos han sido: anti-CD3APC, anti-CD4V450, anti-CD8FITC, anti-CD19PE-Cy7, y anti-CD56PE. Una vez seleccionada la población que por tamaño y complejidad (FSC/SSC) corresponde con los linfocitos (región R1), analizamos la señal de fluorescencia que proviene de cada marcaje exclusivamente en dicha región R1. Figura 8. Se muestra un análisis de las distintas poblaciones linfocitarias. A. Población azul, cuadrante inferior izquierda, corresponde con linfocitos que no expresan ni CD3 ni CD19. La población mayoritaria verde expresa solamente CD3. No hay células que expresen CD3 y CD19 simultáneamente. B. Se observan las poblaciones que expresan las moléculas CD3 y/o CD56, caracterizando las poblaciones linfocitarias T (verde) y NK (púrpura). C. Se distinguen los linfocitos que expresan CD4 (azul oscuro) y CD8 (rojo). Existe una tercera población doble negativa para ambos marcadores (azul claro). D. En la tabla se recogen los marcadores que se emplean para identificar una población de linfocitos determinada. 11 Inmunología Práctica 1 4. TÉCNICAS DE MARCAJE CON FLUORESCENCIA La fluorescencia es una propiedad de ciertas moléculas, denominadas fluorocromos o fluoróforos, que al ser irradiadas con energía electromagnética de longitud de onda adecuada emiten radiación de longitud de onda característica permitiendo su cuantificación. Así, las moléculas de un fluorocromo absorben luz de una determinada longitud de onda λ1 y energía E1 y emiten luz de una mayor longitud de onda λ2 pero de menor energía E2 (figura 9). Figura 9. Espectros de excitación y emisión de FITC. Se muestra la longitud de onda a la que emite el láser azul (488 nm) y el ancho de banda del canal de detección (fotomultiplicador, canal verde, 530/30 nm). Cada fluorocromo tiene un espectro de excitación y emisión característico, de modo que si utilizamos 2 de forma simultánea con un espectro de excitación similar pero distinto espectro de emisión se pueden medir 2 características distintas al mismo tiempo (fluorescencia de 2 colores o a veces de 3 o más) (figura 10). Figura 10. Los fluorocromos FITC y PE suelen utilizarse simultáneamente debido a que se excitan a la misma longitud de onda (láser azul) pero sus espectros de emisión son lo suficientemente diferentes como para poder detectarlos cada uno en un canal distinto (fotodetector) del citómetro de flujo. 12 Inmunología Práctica 1 El fluorocromo más frecuentemente utilizado en citometría de flujo es el isotiocianato de fluoresceína (FITC), con una absorción máxima a 495 nm y emisión a 520 nm (emite luz color verde). El segundo más utilizado es la ficoeritrina (PE, phycoerythrin), con una excitación máxima a los 495 nm y emisión a 576 nm (emite luz color amarillo-naranja). Ambos fluorocromos son especialmente útiles en estudios de doble fluorescencia (figura 10). Por último, destacaremos los conjugados covalentes de ficoeritrina y cianinas, entre ellos la cianoficoeritrina (tabla 1). FLUOROCROMO LÁSER UV Alexa Fluor 405 DAPI Pacific Blue Alexa Fluor 488 FITC Ioduro de propidio PerCP PerCP-Cy5.5 PE PE-Cy5 PE-Cy7 TRITC APC APC-Cy5.5 APC-Cy7 Alexa Fluor 647 O O VIOLETA 405 nm EMISIÓN (nm) AZUL 488 nm ROJO 633/635 O O 442 470 421 519 520 O 617 O O O O O O 678 695 575 694 767 576 660 694 767 668 O O O O O O Tabla 1. Fluorocromos más frecuentes empleados en citometría de flujo. Se indica el láser con el que se excitan y la longitud de onda a la que emiten. Los fluorocromos pueden ligarse de forma covalente a los anticuerpos sin alterar la capacidad de éstos para unirse a sus correspondientes antígenos. Por ello, los fluorocromos vinculados a anticuerpos específicos constituyen un medio útil de visualizar los lugares donde ocurre la reacción antígeno-anticuerpo. El modo de unión a los anticuerpos depende del tipo de fluorocromo. Así por ejemplo, el FITC se liga mediante enlace covalente con los grupos amino libres de las proteínas a pH alcalino. La técnica que emplea anticuerpos acoplados a fluorocromos se denomina inmunofluorescencia, y se emplea para la detección de antígenos celulares. Por lo tanto, la base molecular de esta técnica es la reacción antígeno-anticuerpo, y cuando mayor sea la especificidad de un anticuerpo por su antígeno mejor será la detección y el análisis (figura 11). 13 Inmunología Práctica 1 Existen 2 procedimientos: • Inmunofluorescencia directa. Cuando los anticuerpos necesarios para detectar los antígenos objeto de estudio se marcan directamente con el fluorocromo. Tiene el inconveniente de que hay que marcar con fluorocromos cada uno de los anticuerpos necesarios. Se utiliza fundamentalmente en clínica, donde normalmente se manejan siempre los mismos anticuerpos, ya que hay establecida una rutina y las casas comerciales los venden ya preparados. • Inmunofluorescencia indirecta. No se marca directamente el anticuerpo específico de la molécula a estudiar, sino que se utiliza secundariamente una anti-inmunoglobulina marcada con fluorocromo que reconocerá el anticuerpo específico. La inmunofluorescencia directa se utiliza fundamentalmente en clínica, donde normalmente se manejan siempre los mismos anticuerpos, ya que hay establecida una rutina y las casas comerciales los venden ya preparados. Por su parte, la indirecta es normalmente el procedimiento a utilizar en investigación, donde se utilizan muchos y diferentes anticuerpos cada vez (anticuerpos primarios) y no interesa marcar cada uno. Figura 11. Técnicas de inmunofluorescencia directa e indirecta. Tanto en la técnica directa como el anticuerpo primario de la indirecta deben ser anticuerpos monoclonales para asegurarnos la especificidad del marcaje. En la indirecta, además, se debe analizar en paralelo siempre un control de isotipo del anticuerpo primario utilizado para determinar posibles interacciones inespecíficas del anticuerpo secundario. 14 Inmunología Práctica 1 5. APLICACIONES DE LA CITOMETRÍA DE FLUJO La posibilidad de estudiar células de forma individualizada y multiparamétrica hace de la citometría de flujo una herramienta de gran utilidad en citología, inmunología, hematología y anatomía patológica, tanto a nivel clínico como en investigación. El desarrollo progresivo de las técnicas y su simplificación ha traído como consecuencia un auge de la citometría en los últimos años y su incorporación al laboratorio de forma rutinaria. Las aplicaciones más frecuentes son: Análisis fenotípico de células sanguíneas, mediante la detección de marcadores de la superficie celular. Ejemplos, CD3, CD19, CD4, etc. Identificación de antígenos intracelulares. requiere la previa permeabilización de la membrana plasmática y fijación de las estructuras celulares. Ejemplos, α-actina de músculo liso (αSMA), factores de transcripción como FoxP3, ki-67, HIF, etc. Cuantificación de DNA y ciclo celular, mediante el uso de compuestos que aumentan su emisión de fluorescencia al intercalarse generalmente en el surco menor de las moléculas de DNA del núcleo celular. Ejemplos, ioduro de propidio, DAPI, Hoescht, etc. Determinación de la viabilidad celular, para discriminar células vivas de células muertas en ensayos de toxicidad. Ejemplo, similar al anterior ya que sólo las células muertas captarán estos compuestos al tener sus membranas celulares dañadas. Evaluación de la activación y proliferación celular, determinando metabolitos fluorescentes de ciertos compuestos que se añaden o bien la incorporación directa o previa acción de esterasas de colorantes fluorescentes en los componentes celulares. Ejemplo, vibrant DiO, bromodesoxiuridina (BrdU), carboxifluoresceína succinimidil ester (CFSE), etc. Análisis de reticulocitos, mediante la detección del RNA residual ya que son formas inmaduras. Ejemplo, ReticONE, cianina CD4K530, etc. Apoptosis, detectándose la fosfatidilserina que desde la cara interna de la membrana plasmática se relocaliza en la cara externa. Ejemplos, anexina V acoplada a un fluorocromo, técnica TUNEL, etc. Detección de autoanticuerpos y citoquinas en suero, mediante el uso de microesferas donde estas moléculas son captadas y posteriormente detectadas por los correspondientes anticuerpos marcados. Cuantificación del potencial de membrana, gracias al uso de compuestos permeables a los que las alteraciones en el potencial de membrana cambian su estructura electrónica y pueden emitir fluorescencia. Ejemplos, ANEP, sondas RH, carbocianinas, MitoProbe JC-1, etc. Medida del calcio intracelular, se emplean compuestos que al captar el calcio que se libera en un momento dado emiten fluorescencia. Ejemplos, Fluo-3, Fura red, etc. Determinación del pH intracelular, de modo similar al anterior, cambios en el pH afectan a la estructura de ciertos compuestos y los hacen fluorescentes. Ejemplos, pHrodo, BCECF, etc. Determinación del estrés oxidativo, gracias a sondas que reaccionan con radicales libres del oxígeno (ROS, reactive oxygen species) y emiten fluorescencia. Ejemplos, CellROX, Diclorodihidrofluoresceína diacetato (DCFH-DA), etc. 15 Inmunología Práctica 1 DESARROLLO DE LA PRÁCTICA: APLICACIÓN DE LA CITOMETRÍA DE FLUJO AL ESTUDIO CUANTITATIVO DE SUBPOBLACIONES LEUCOCITARIAS 1. OBJETIVOS ESPECIFICOS: Identificar y cuantificar las principales poblaciones leucocitarias en porcentaje usando la aplicación informática del citómetro. Definir y trabajar con regiones (gates). Cálculo del porcentaje y número absoluto de las principales poblaciones linfocitarias mediante análisis multiparamétrico. Interpretación del recuento de la población linfocitaria (linfocitosis, linfopenia, infecciones virales, leucemias y síndromes linfoproliferativos crónicos. Marcador Ac. (isotipo) Origen Reconoce Población Significado CD45 mAb (IgG1) Ratón Humano Leucocitos Panleucocitario CD3 mAb (IgG1) Ratón Humano CD4 mAb (IgG1) Ratón Humano CD8 mAb (IgG1) Ratón Humano CD19 mAb (IgG1) Ratón Humano CD14 mAb (IgG1) Ratón CD56 mAb (IgG1) Ratón Rango (%) Totales 61-84 T helper 32-60 T citotóxicos 13-40 Linfocitos B Totales 10-31 Humano Monocitos Monocitos 2-10 Humano Linfocitos NK Linfocitos NK 5-27 Linfocitos T Tabla 2. Se recogen los anticuerpos monoclonales que se emplearán en la práctica. El anticuerpo anti-CD3 reconoce una molécula de la superficie celular que forma parte del complejo del receptor de células T (TCR). Los anticuerpos anti-CD4 y anti-CD8 reconocen moléculas de superficie de una subpoblación de células T-CD3+ que modulan la respuesta inmunológica: linfocitos T helper (colaboradores) y citotóxicos, respectivamente. El anticuerpo anti-CD19 reconoce una molécula de la superficie de las células B. El anticuerpo CD56 se utiliza para la caracterización de células NK. 16 Inmunología Práctica 1 2. PROTOCOLO Reactivos necesarios: Lanceta, alcohol y gasa (para la obtención de la muestra de sangre). Tubos eppendorf vacíos y tubos con EDTA como anticuagulante. Tampón de lisis de eritrocitos (BD FACSTM Lysing Solution). Procedimiento: 1. Lavamos las manos. 2. Masajeamos la zona de punción para producir vasodilatación, esterilizamos y punzamos con la lanceta estéril: Seleccionamos la posición más larga de la lanceta, quitamos el protector, posicionamos sobre la yema del dedo y presionamos el botón. 3. Mientras que el donante presiona la zona, el otro miembro de la pareja recoge la sangre con una pipeta con punta amarilla. Para que haya un número adecuado de células se debe recoger unos 50100 μl de sangre (unas 5 gotas), que pondremos en un tubo eppendorf de 1,5 ml junto con 1 μl de EDTA-2K 500 mM. 4. Mientras que el donante tapona el pinchazo, el compañero mezcla bien la muestra con la pipeta para que no coagule. 5. Ponemos 1,5 μl del anticuerpo con el que vamos a marcar la muestra en el fondo de cada tubo eppendorf de 1,5 ml. Importante: rotular el tubo con el marcador en el lateral del tubo, no en la tapa. 6. Repartimos la muestra de sangre en alícuotas de 15 μl sobre el anticuerpo correspondiente y resuspendemos bien asegurándonos que no queda sangre por la pared del tubo. 7. Incubamos 30 minutos a 4°C en oscuridad 8. Añadimos 500 μl de solución de lisis y agitamos bien golpeando el tubo con los dedos. 9. Dejamos actuar 10 minutos a temperatura ambiente. 10. Analizamos en el citómetro de flujo. Como alternativa, y según la disponibilidad, la práctica se podrá realizar con una muestra de sangre anónima, por lo que el protocolo comenzaría en el punto 5. 3. CÁLCULO CUANTITATIVO DE LAS POBLACIONES LEUCOCITARIAS El método que hemos descrito anteriormente parte del conocimiento previo de la fórmula sanguínea y de los leucocitos del donante en sangre periférica. El citómetro de flujo que se empleará es un Guava EasyCyte 8. Su particular sistema de inyección de fluidos nos permite establecer un número fijo de células a analizar, calcular el volumen exacto de muestra analizada y por lo tanto determinar la concentración de células. Respecto a la parte óptica, en este citómetro la integran 3 láseres en estado sólido que emiten luz a 405 nm (láser violeta), 488 (láser azul) y 640 (láser rojo); además de 8 detectores de recogida de señal: FSC, SCC y 6 canales de fluorescencia. 17 Inmunología Práctica 1 Control negativo (sin marcaje fluorescente). A B Plot P01, ungated Plot P02, ungated Monocytes 0 Gr.57.28% Gr.65.28% Mo.8.34% Mo.8.34% LymphocytesLf.25.30% Lf.25.30% Side Scatter (SSC-HLin) 20000 40000 60000 80000 Granulocytes R4 0 0 Side Scatter (SSC-HLin) 20000 40000 60000 80000 0.30% 100 101 102 103 104 105 Green-B Fluor… (GRN-B-HLog) 20000 50000 80000 Forward Scatter (FSC-HLin) Figura 12. A. Se identifican las 3 poblaciones mayoritarias. B. Las 3 poblaciones, granulocitos (amarillo), monocitos (verde), linfocitos (azul), se alinean en la zona del dot-plot que definimos como negativa al no estar marcadas con ningún anticuerpo acoplado a fluorocromo. Marcaje CD45-FITC/CD14-PE A B Plot P02, ungated Plot P06, ungated 8.40% 0 100 101 102 103 104 105 Green-B Fluor… (GRN-B-HLog) CD45-FITC Side Scatter (SSC-HLin) 20000 40000 60000 80000 R4 R5 0 Side Scatter (SSC-HLin) 20000 40000 60000 80000 95.72% 100 101 102 103 104 105 Yellow-B Fluor…e (YEL-B-HLog) CD14-PE Figura 13. A. Todas las células CD45+ (leucocitos, 95.72%) se sitúan en la zona positiva del dot-plot. Por lo tanto, las células que quedan a la izquierda son CD45-, que por su baja complejidad corresponderían con eritrocitos no lisados. B. El marcaje con CD14 identifica a los monocitos, que son aquellas células de la zona positiva. Nótese que el porcentaje de células CD14+ corresponde con el de monocitos de la figura 12.A. 18 Inmunología Práctica 1 Marcaje CD3- FITC/CD19-PE A B Plot P02, ungated Plot P03, gated on P01.Lymphocy 58.37% 65.37% Side Scatter (SSC-HLin) 20000 40000 60000 80000 Side Scatter (SSC-HLin) 20000 40000 60000 80000 14.10% R4 0 0 R4 100 101 102 103 104 105 Green-B Fluor… (GRN-B-HLog) 100 101 102 103 104 105 Green-B Fluor… (GRN-B-HLog) CD3-FITC CD3-FITC Figura 14. A. Células CD3+, linfocitos T totales, son el 14.10% de los leucocitos. B. Al analizar exclusivamente la población de linfocitos (gate) obtenemos que los linfocitos T totales son el 65.37%. C. Células CD19+, linfocitos B, son el 3.42% de los leucocitos. D. Al hacer un gate de linfocitos obtenemos que los linfocitos B son el 15.84%. Marcaje CD4-FITC/CD8-PE B C 0 100 101 102 103 104 105 Green-B Fluor… (GRN-B-HLog) CD4-FITC Side Scatter (SSC-HLin) 20000 40000 60000 80000 R4 Plot P07, gated on P01.Lymphocy 22.94% R5 Plot P10, gated on P01.Lymphocy 21.50% 0.96% R6 E P 8 D C 0 Side Scatter (SSC-HLin) 20000 40000 60000 80000 Plot P03, gated on P01.Lymphocy 37.89% Yellow-B Fluorescence (YEL-B-HLog) 100 101 102 103 104 105 A 100 101 102 103 104 105 Yellow-B Fluor…e (YEL-B-HLog) CD8-PE 40.61% %36.93 100 101 102 103 104 105 Green-B Fluor… (GRN-B-HLog) CD4-FITC Figura 15. A. Se analiza la subpoblación de células CD4+ (T helper) sobre el gate de linfocitos totales. B. Sobre el gate de linfocitos se detectan los CD8+ (citotóxicos). C. Las 2 subpoblaciones anteriores se muestran simultáneamente representando en el dot-plot los 2 canales de fluorescencia correspondientes a los marcajes CD4-FITC y CD8-PE. La población doble negativa (CD4-/CD8-) correspondería con el resto de linfocitos, mientras que la doble positiva (CD4+/CD8+) apenas es representativa en condiciones normales. 19 Inmunología Práctica 1 Resultados y valores normales de referencia para adultos. Resultados Rango Granulocitos 65.28% 60 - 70% Monocitos 8.34% 5 - 10% Linfocitos 25.30% 25 - 40% Marcador Resultados Rango Linf. T totales CD3+ 65.37% 61 - 84% Linf. T helper CD4+ 37.89% 32 - 60% Linf. T citotóxicos CD8+ 22.94% 13 - 40% Linf. B CD19+ 15.84% 10 - 31% Linf. NK CD56+ (CD3-) ~18% 5 - 27% Índice CD4/CD8 1.72 1 – 2.5 20 Inmunología Práctica 2 INMUNOLOGÍA PRÁCTICA 2 CITOTOXICIDAD MEDIADA POR COMPLEMENTO: TIPAJE HLA DE CLASE I SEROLÓGICO 21 Inmunología Práctica 2 OBJETIVOS ESPECÍFICOS DE LA PRÁCTICA: 1. Observarán otra forma de visualizar la reacción antígeno-anticuerpo. 2. Experimentarán como el complemento produce la lisis celular tras su activación por la unión antígeno-anticuerpo. 3. Los alumnos experimentarán como se realiza un tipaje HLA de clase I serológico. 4. Reforzarán el concepto de polimorfismo y especificidad (alelo). 5. Comprenderán mejor el concepto de determinante antigénico compartido: aprendiendo a distinguir entre especificidades públicas y privadas. 6. Comprenderán que los anticuerpos policlonales (sueros) no son muy específicos. 7. Comprenderán las aplicaciones clínicas de un tipaje HLA 22 Inmunología Práctica 2 CITOTOXICIDAD MEDIADA POR COMPLEMENTO: TIPAJE HLA DE CLASE I SEROLÓGICO COMPLEMENTO El sistema del complemento está compuesto de un gran número de proteínas plasmáticas, que se activa por una reacción en cascada, que puede ser activada por 3 vías: la clásica, la alternativa y la de las lectinas. La unión antígeno-anticuerpo activa principalmente la vía clásica. Algunos componentes del sistema del complemento tienen funciones como la opsonización, favoreciendo la fagocitosis, y la quimiotaxis, pero el fin último de la activación del sistema del complemento es producir la lisis de la célula o bacteria a la que está unido el anticuerpo, produciendo poros en la membrana celular. La unión antígeno-anticuerpo activa el complemento a través de la fracción Fc de la inmunoglobulina, y este una vez activado produce la lisis de la célula a cuyo antígeno se había unido el anticuerpo (citotoxicidad mediada por complemento). En el laboratorio esta propiedad del complemento se utiliza principalmente para realizar el tipaje HLA serológico. MOLÉCULAS HLA La mayoría de los linfocitos T reconocen, a través de su receptor específico (TCR), sólo los péptidos antigénicos que le son presentados por unas moléculas presentes en la superficie de las células presentadoras de antígeno. Estas moléculas van a formar parte de lo que llamamos Sistema Principal de Histocompatibilidad (Mayor Histocompatibility Complex, MHC). El MHC se descubrió por su intervención en el rechazo de los trasplantes. Los individuos que recibían trasplantes de otros individuos con el mismo MHC no los rechazaban o lo hacían mucho más tarde, mientras que si sus moléculas del MHC eran diferentes se producía el rechazo del órgano trasplantado. Pero el rechazo de trasplantes no es un fenómeno biológico natural, y por tanto estas moléculas debían tener otra función fisiológica. Hoy sabemos que esta función es presentar péptidos antigénicos a los linfocitos T. El Complejo Principal de Histocompatibilidad está formado por un conjunto de genes que se encuentran en todos los mamíferos. Las moléculas codificadas por este conjunto de genes reciben diferentes nombres según las especies animales, en humanos a estas moléculas se las denomina HLA (Human Leucocyte Antigens). Este complejo genético contiene 2 grupos de genes altamente polimórficos (variables), llamados genes HLA de clase I y genes HLA de clase II. Estos genes codifican para 2 grupos de moléculas, HLA de clase I y HLA de clase II, que se expresan en la superficie de la célula y le presentan péptidos antigénicos a los linfocitos T. Los genes del MHC son codominantes, es decir tanto los alelos maternos y como los paternos se expresan. En humanos hay 3 loci polimórficos de clase I denominados: HLA-A, HLA-B y HLAC, y cada persona hereda un grupo de genes paterno y otro materno, así cada célula puede expresar 6 moléculas HLA de clase I diferentes. También tenemos otros 3 grupos de genes de clase II, denominados HLA-DR, HLA-DQ y HLA-DP, y también cada célula puede expresar 6 moléculas diferentes (clase II es un poco más compleja). 23 Inmunología Práctica 2 A su vez la mayoría de los genes del MHC son altamente polimórficos, es decir que existen muchos alelos diferentes para cada gen, lo que hace que los individuos de una determinada especie sean muy diferentes entre si (ver lista de especificidades HLA que se adjunta). Las moléculas HLA de clase I se expresan en la mayoría de las células del organismo, mientras que las moléculas HLA de clase II se expresan fundamentalmente en las células presentadoras de antígeno profesionales. Como hemos comentado anteriormente estas moléculas, junto con las moléculas de los grupos sanguíneos, son las responsables de los rechazos de los trasplantes, y dado el polimorfismo (variabilidad) de estas moléculas la probabilidad de que 2 personas no emparentadas tengan las mismas moléculas HLA es muy baja. Hoy sabemos que cuanto más parecidas son las moléculas HLA de receptor y donante menos probabilidad de rechazo (siempre que los grupos sanguíneos sean compatibles). Por tanto, es importante conocer las moléculas HLA de receptor y donante antes de realizar el trasplante. TIPAJE O TIPIFICACIÓN HLA Por tipaje HLA, entendemos, la asignación de los alelos que un individuo porta, en cada uno de los locus del "Sistema Principal de Histocompatibilidad (HLA)". Estos locus se agrupan según su estructura y función biológica en locus de Clase I y Clase II que serán tipados separada e independientemente. Existen dos formas de determinar el tipaje HLA: a. Tipaje Serológico b. Tipaje Genómico a. El tipaje serológico, es aquel que para la definición de las especificidades (formas alélicas a nivel genético) HLA, presentes en un individuo, usa sueros (anticuerpos policlonales) o anticuerpos monoclonales, de especificidad conocida. Es decir estudia las moléculas en la superficie de la célula. b. El tipaje genómico, es aquel que recurre, directamente al estudio del ADN, presente en cada individuo, para la determinación de los distintos alelos para cada uno de los locus del Sistema Principal de Histocompatibilidad. TIPAJE HLA SEROLÓGICO DE CLASE I La técnica que nosotros vamos a utilizar para este tipaje es la "Citotoxicidad mediada por Complemento", realizada en microplacas Terasaki de sesenta pocillos. Las placas Terasaki contienen los sueros (anticuerpos policlonales) o anticuerpos monoclonales que definen las especificidades HLA, se garantiza que las placas contengan las especificidades HLA-A, HLA-B y HLA-C más frecuentes en nuestra población. En cada pocillo de la placa se pone 1µl de anticuerpo específico contra una especificidad HLA. Cada especificidad será definida, si ello es posible, por al menos tres anticuerpos diferentes, introduciéndose en cada placa 24 Inmunología Práctica 2 un control negativo y otro positivo. Estas placas se realizan en base a una plantilla (ver plantilla, al final) que nos servirá de referencia para la posterior lectura. Se preparan con anterioridad a la realización de la técnica, y se mantienen congeladas a -20º C, hasta su utilización. Las dianas serán, células mononucleares, obtenidas por gradiente de Ficoll. Una vez obtenidas las células, se ajustan a una concentración entre 2-3 x 106 cel/ml. Las placas de tipaje para Clase I, se habrán sacado, desde el arcón congelador, diez minutos antes, dejándolas descongelarse y atemperarse (el ensayo se realiza a Tª ambiente). 25 Inmunología Práctica 2 PROCEDIMIENTO A SEGUIR: 1. Se siembra 1µl de la suspensión celular por cada pocillo de la placa Terasaki, previamente descongelada y atemperada. 2. Dejamos incubar durante 30 minutos a Tª ambiente. 3. Añadiéndole, posteriormente, 6µl de complemento de conejo (suero de conejo), a la dilución de trabajo (que se determinará con cada lote). Si ha existido unión Ag (célula) - Ac (suero), se fijara el complemento que lisará la célula, sino la célula continuará viva. 4. Se deja incubar una hora con el complemento. 5. Para determinar la viabilidad celular se pueden usar distintos métodos: método de Bromuro de Etidio-Naranja de Acridina, tinción azul Tripán y método de Eosina-Formol (cuando se desee mantener durante un tiempo). En esta práctica utilizaremos la tinción de azul Tripán. 26 Inmunología Práctica 2 Tinción con Azul Tripán 6. Se incuba una hora con el complemento, añadiéndose posteriormente 6 µl de la solución de azul Tripán. 7. Dejamos incubar todo ello unos 10-15 minutos, 8. El azul Tripán es un colorante azoico que se utiliza en tinciones histológicas para ensayos de viabilidad que permiten diferenciar células vivas de células muertas. Las células vivas o tejidos con la membrana celular intacta no se colorean debido a que no puede atravesar la membrana celular. Por el contrario, sí atraviesa la membrana de las células muertas, se tiñe especialmente el citoplasma de las células de un color oscuro. 9. Al visualizar en el microscopio veremos las células vivas que emiten luz (amarilla), y las células muertas azul oscuro. 10. Y leemos la viabilidad en un microscopio de contraste de fases invertido. La citotoxicidad (azul oscuro), con cada uno de los sueros, se cuantifica del 1 al 8: 0- Cuando no se puede evaluar 1- Menos de un 20% de las células muertas (azul oscuro) la mayoría células vivas (luz amarilla) 2- Del 20% al 40% de las células muertas 4- Del 40% al 60% de las células muertas 6- Del 60% al 80% de las células muertas 8- Más del 80% de las células muertas El tipaje se deducirá, según el patrón de reactividad obtenido, en base a la plantilla de la placa. 27 Inmunología Práctica 2 LISTA DE ESPECIFICIDADES HLA EN EL RECONOCIMIENTO SEROLOGICO Y CELULAR A B C DR DQ DP DPw1 DQ1 DR1 Cw1 B5 B50(21) A1 DQ2 DPw2 Cw2 DR103 B51(5) B7 A2 DPw3 DQ3 DR2 B5102 Cw3 B703 A203 DQ4 DPw4 Cw4 DR3 B5103 B8 A210 DQ5(1) DPw5 Cw5 DR4 B52(5) B12 A3 DQ6(1) DPw6 Cw6 DR5 B53 B13 A9 DQ7(3) Cw7 DR6 B14 B54(22) A10 DQ8(3) Cw8 DR7 B15 B55(22) A11 DQ(3) Cw9(w3) DR8 B16 B56(22) A19 Cw10(w3) DR9 B17 B57(17) A23(9) DR10 B18 B58(17) A24(9) DR11(5) B21 B59 A2403 DR12(5) B22 B60(40) A25(10) DR13(6) B27 B61(40) A26(10) DR14(6) B2708 B62(15) A28 DR1403 B35 B63(15) A29(19) DR1404 B37 B64(14) A30(19) DR15(2) B38(16) B65(14) A31(19) DR16(2) B39(16) B67 A32(19) DR17(3) B3901 B70 A33(19) DR18(3) B3902 B71(70) A34(10) B72(70) A36 B40 B73 A43 B4005 DR51 B41 B75(15) A66(10) DR52 B42 B76(15) A68(28) DR53 B44(12) B77(15) A69(28) A74(19) B45(12) B78 B81 A80 B46 B47 B48 B49(21) Bw4 Bw6 WHO Nomenclature Committe for factors of the HLA System. Updated 31st March 2001 ESPECIFICIDADES ASOCIADAS A Bw4 y Bw6 Bw4: B5, B5102, B5103, B13, B17, B27, B37, B38(16), B44(12), B47, B49(21), B51(5), B52(5), B53, B57(17), B58(17), B59, B63(15), B77(15) y A9, A23(9), A24(9), A2403, A25(10), A32(19) Bw6: B7, B703, B8, B14, B18, B22, B2708, B35, B39(16), B3901, B3902, B40, B4005, B41, B42, B45(12), B46, B48, B50(21), B54(22), B55(22), B56(22), B60(40), B61(40), B62(15), B64(14), B65(14), B67, B70, B71(70), B72(70), B73, B75(15), B76(15), B78, B81. WHO Nomenclature Committe for factors of the HLA System. Updated 31st March 2001 28 Inmunología Práctica 2 FECHA: Tª CLAVE: PACIENTE: CAUSA DE TIPAJE: LECTOR: TIPAJE: 1 2 3 4 5 6 7 8 9 10 1 2 3 4 5 6 7 8 9 10 1 2 3 4 5 6 AB (-) FGR 592 A2 X1MoAb A3 FGR 948 A24 CLB 118 A26 MT 8125 A29 CLB 224 A31+(33) PF1339B A33 NS4366 B52+62 W6/32 (+) FGR 272 A1 FGR 351 A2+28 Za 62 A23+24 C0 122 A25+26 NS 4830 A26+68 Graffity S. A29 Belmonte A32 Fe 89 A33+31+29 Tivol B52 AB (-) FGR 113 A1 CLB168 A28 FGR 304 A23+24 De Genova A25+26 Breaux A11 PF 1548A A30+(31) Fe 77 A32+25+62 FGR 324 B51+52 FGR 653 B7 FGR 568 B8 FGR 500 A1 OF901299 A28 FGR 1429 A23 Farnworth A25 NS 4828 A11 Ma 768 A30 CATA-1 A32+25 CLB 030 B51+52 CTM 11 B7 SEB782704 B8 FGR 692 A2 SP 1255 A3 CC551.2 A23 Pail A25 Colombani A11 NS 4251 A30+31 FGR 263 A33+26+31 FGR 608 B51 FGR 303 B7 FGR 678 B44 +(50) CO156 A2+57+63 CLB 229 A3 1BA A24 TS232 A26+66 OHA-104 A29 Albinet A31 Beringuer A33+26 Y276/69 B51 Y700/69 B8 FGR 681 B44+45 AB (-) FGR 268 B13 FGR 543 B62+63 CLB 276 B38+39 S 1394.2 B57+58 Simpkins B49 Sevi 670 B55 FGR 1020 B27 FGR 671 B35+B51 W6/32 (+) FGR 434 B44 Hatcher B13 Rickart B62 T 4011 B38+67 PF 1598 B18 Price B49+52 Guimard B55 FGR 451 B27+(47) TS 174 II B37 AB (-) Primoc123 B44 FGR 1013 B14 Matherne B62 Ma 763 B38 CLB 292 B18 Scott B50 9151 B55 CLB 310 B35 CLB 232 B37+44 Stroman B40+41+48 Schu B45 Hoffman B14+(18) Ma 1071 B63 Raff B39 SEB900405 B18 Daubus B50 Larock B56 Za 103 B35 Pro B37 Miller B60+33+66 M. See.P B45+(50) RyC 37b B14+(8) CTM 30 B63+B57 Peters B39 TS 190 B49+50 TS 214 B55+ 56 NS 2656 B27+47 FGR 432 B35+B51 FGR 654 B40+68 SEB921802 B60+48 FGR 657 B13 Nichols B62+63 SEB950102 B38+39 S 583 B57+58 FGR 50 B49+B50 Dubo B55+56 MET B27 FGR 496 B35 VR 8612 B60+61 CLB 237 B41 AB (-) Neuville B35+70+50.. Mahner Cw2 Apple Cw4 CLB 147 Cw7 FGR 408 Bw6 CLB 283 B41 Bark Cw1 TS242 Cw3 Her Cw5 CLB 308 Cw7 CC 40.2 Bw6 Thi B60+61+41 CLB 164 Cw1 Philphot Cw3 FGR 371 Cw5 FGR 530 Bw4 AB (-) FGR 247 B7+42+22 CLB 090 Cw1 CLB 300 Cw3+Cw1 SEC 912405 Cw5+Cw8 Kurt Bw4 W6/32 (+) 3711 DL B42 Bouq Cw2 Sevi 379 Cw4 Winzer Cw6 116.5.28 Bw4 CLB 073 B27+13+47 CLB 123 Cw2 FGR 629 Cw4 Cooper Cw4+Cw6 126.39 Bw6 A B C D E F 7 Esta es la plantilla que utilizamos en el laboratorio del HOSPITAL VIRGEN DE LAS NIEVES, para realizar un tipaje HLA. 29 Inmunología Práctica 2 PACIENTE: CAUSA DE TIPAJE: LECTOR: TIPAJE: 1 2 3 4 5 6 7 8 9 10 1 2 3 4 5 6 7 8 9 10 1 2 3 4 5 6 AB (-) FGR 592 A2 X1MoAb A3 FGR 948 A24 CLB 118 A26 MT 8125 A29 CLB 224 A31+(33) PF1339B A33 NS4366 B52+62 W6/32 (+) FGR 272 A1 FGR 351 A2+28 Za 62 A23+24 C0 122 A25+26 NS 4830 A26+68 Graffity S. A29 Belmonte A32 Fe 89 A33+31+29 Tivol B52 AB (-) FGR 113 A1 CLB168 A28 FGR 304 A23+24 De Genova A25+26 Breaux A11 PF 1548A A30+(31) Fe 77 A32+25+62 FGR 324 B51+52 FGR 653 B7 FGR 568 B8 AB (-) FGR 268 B13 FGR 543 B62+63 CLB 276 B38+39 S 1394.2 B57+58 Simpkins B49 Sevi 670 B55 FGR 1020 B27 FGR 671 B35+B51 W6/32 (+) FGR 434 B44 Hatcher B13 Rickart B62 T 4011 B38+67 PF 1598 B18 Price B49+52 Guimard B55 FGR 451 B27+(47) TS 174 II B37 AB (-) AB (-) Neuville B35+70+50.. Mahner Cw2 Apple Cw4 CLB 147 Cw7 FGR 408 Bw6 CLB 283 B41 Bark Cw1 TS242 Cw3 Her Cw5 CLB 308 Cw7 CC 40.2 Bw6 A B FGR 500 FGR 692 A1 A2 OF901299 SP 1255 A28 A3 FGR 1429 CC551.2 A23 A23 Farnworth Pail A25 A25 NS 4828 Colombani A11 A11 Ma 768 NS 4251 A30 A30+31 CATA-1 FGR 263 A32+25 A33+26+31 CLB 030 FGR 608 B51+52 B51 CTM 11 FGR 303 B7 B7 FGR 678 SEB782704 B44 +(50) B8 CO156 A2+57+63 CLB 229 A3 1BA A24 TS232 A26+66 OHA-104 A29 Albinet A31 Beringuer A33+26 Y276/69 B51 Y700/69 B8 FGR 681 B44+45 1 8 8 4 1 1 1 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 8 6 8 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 6 8 6 1 8 1 1 1 8 4 Primoc123 B44 FGR 1013 B14 Matherne B62 Ma 763 B38 CLB 292 B18 Scott B50 9151 B55 CLB 310 B35 CLB 232 B37+44 Stroman B40+41+48 Schu B45 Hoffman B14+(18) Ma 1071 B63 Raff B39 SEB900405 B18 Daubus B50 Larock B56 Za 103 B35 Pro B37 Miller B60+33+66 FGR 657 B13 Nichols B62+63 SEB950102 B38+39 S 583 B57+58 FGR 50 B49+B50 Dubo B55+56 MET B27 FGR 496 B35 VR 8612 B60+61 CLB 237 B41 1 8 8 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 6 1 1 1 8 1 1 1 1 1 Thi B60+61+41 CLB 164 Cw1 Philphot Cw3 FGR 371 Cw5 FGR 530 Bw4 AB (-) FGR 247 3711 DL B7+42+22 B42 CLB 090 Bouq Cw1 Cw2 CLB 300 Sevi 379 Cw3+Cw1 Cw4 Winzer SEC 912405 Cw5+Cw8 Cw6 116.5.28 Kurt Bw4 Bw4 W6/32 (+) CLB 073 B27+13+47 CLB 123 Cw2 FGR 629 Cw4 Cooper Cw4+Cw6 126.39 Bw6 1 1 1 4 1 1 1 8 6 4 1 1 1 1 1 4 6 8 8 1 1 1 1 8 1 1 8 8 8 8 8 8 1 8 C D M. See.P B45+(50) RyC 37b B14+(8) CTM 30 B63+B57 Peters B39 TS 190 B49+50 TS 214 B55+ 56 NS 2656 B27+47 FGR 432 B35+B51 FGR 654 B40+68 SEB921802 B60+48 E F Esta es la plantilla que utilizamos en el laboratorio del HOSPITAL VIRGEN DE LAS NIEVES, para realizar un tipaje HLA. 30 Inmunología Práctica 3 INMUNOLOGÍA PRÁCTICA 3 EVALUACIÓN DE LA RESPUESTA INMUNITARIA. DETERMINACIÓN DE LOS ANTICUERPOS CONTRA EL TOXOIDE TETÁNICO MEDIANTE INMUNOENSAYO (ELISA) Inmunología Práctica 3 OBJETIVOS PRINCIPALES DE LA PRÁCTICA Aprender el fundamento de la técnica de detección por ELISA Manejar muestras biológicas y estimar diluciones según el rango de detección de la metodología Monitorizar la detección de anticuerpos específicos anti-toxoide tetánico Interpretar los resultados según la titulación de IgG específica presente en las muestras biológicas (vacunación, inmunodeficiencia, etc) INTRODUCCIÓN La toxina tetánica El tétanos es una enfermedad bacteriana infecciosa causada por el bacilo anaeróbico estricto esporulante Clostridium tetani. El crecimiento de este bacilo, ubicuo en nuestro ambiente, se ve favorecido en heridas sucias y zonas necróticas, donde puede producir una neurotoxina denominada tetanoespasmina. Esta toxina bloquea los neurotransmisores inhibidores del sistema nervioso central y provoca la rigidez muscular y espasmos característicos del tétanos generalizado. La protección contra el tétanos es dependiente de anticuerpos y depende de la capacidad de las inmunoglobulinas antitoxina para neutralizar la tetanoespasmina. Esta protección se puede lograr mediante dos métodos: Inmunización activa, gracias a la vacuna antitetánica, Inmunización pasiva, mediante la administración de la inmunoglobulina antitetánica específica. Las vacunas contra el tétanos se basan en el toxoide tetánico, una neurotoxina modificada que induce la formación de dichos anticuerpos antitoxina protectores. Sin embargo, al igual que ocurre con otras vacunas, la respuesta inmunitaria al toxoide tetánico es deficiente en individuos inmunodeprimidos, como sucede por ejemplo en los enfermos de SIDA, y pacientes con anormalidades del timo. ‐ ‐ Actualmente, la vacuna antitetánica está disponible en el mercado internacional en forma monovalente (TT), en vacunas combinadas que contienen además toxoide diftérico (DT o dT, dependiendo de la cantidad de toxoide diftérico) y en vacunas combinadas con otros componentes como antidiftéricos, antitosferínicos, antipoliomielítica inactivada, la vacuna contra la hepatitis B y la vacuna contra Haemophilus influenzae de tipo B. La concentración y avidez de los anticuerpos antitoxina, así como la duración de la protección, dependen de varios factores, como la edad de los vacunados, el número de dosis de la vacuna y los intervalos entre las dosis. La administración de tres dosis de toxoide tetánico durante el periodo de lactancia proporcionará de 3 a 5 años de protección, una dosis adicional o de refuerzo (p. ej., en los primeros años de la infancia) proporcionará protección hasta la adolescencia, y una o dos dosis de refuerzo adicionales inducirán la inmunidad hasta bien entrada la edad adulta (se ha sugerido que la duración puede ser de 20 a 30 años). Las dosis de refuerzo pueden provocar respuestas inmunitarias incluso transcurridos de 25 a 30 años desde la dosis anterior, lo que demuestra la persistencia de la memoria inmunitaria. Inmunología Práctica 3 Anticuerpos específicos y vacunas La respuesta inmunitaria de una persona puede variar según el tipo de antígeno que provoque la respuesta. Si no se produce una respuesta de anticuerpos específicos o si se producen anticuerpos funcionalmente inactivos se pueden producir infecciones recurrentes o persistentes. Un sistema inmunitario sano es capaz de reconocer los antígenos de naturaleza proteica correctamente desde el primer año de vida. Los antígenos polisacáridos son más difíciles de reconocer para el sistema inmunitario y es frecuente que los niños pequeños no puedan iniciar una respuesta ante ellos. La capacidad de respuesta a los antígenos polisacáridos empieza a madurar a la edad de 2-3 años hasta la edad adulta. Cuando el sistema inmunitario pierde la capacidad funcional de fabricar anticuerpos específicos, es probable que la primera respuesta que disminuya sea la respuesta a estos antígenos. No obstante, la hipogammaglobulinemia puede aparecer solo cuando disminuye la capacidad de respuesta a los antígenos proteicos. La vacunación se ha utilizado con frecuencia para medir la capacidad del sistema inmunitario para producir anticuerpos específicos funcionalmente activos. Es importante investigar la respuesta tanto a los antígenos proteicos como a los polisacáridos puros. La respuesta de anticuerpos frente a los patógenos naturales también puede ser útil, sobre todo si se sabe que la persona ha estado expuesta a un patógeno en concreto. Tipo de antígeno Vacunas recomendadas Proteína Toxoide tetánico Polisacárido puro Polisacárido + Péptido Patógenos naturales Antineumocócica (23-valente, no conjugada) Samonella typhi Vi Haemophilus influenzae tipo B (Hib) Antineumocócica (7-valente, conjugada) Virus varicela-zóster (VVZ) Antigripal La respuesta vacunal se mide con una muestra sérica justo antes de la vacunación y una segunda muestra 3-4 semanas después. Los niveles normales de anticuerpos específicos pueden variar considerablemente en función de la población, edad, raza, historial de vacunación, etc. La diferencia entre los niveles de anticuerpos específicos en las muestras anterior y posterior a la vacunación sirve para valorar la respuesta del sistema inmunitario. Es significativo si el nivel de anticuerpos se multiplica por 4 como respuesta a una proteína o si se duplica como respuesta a un polisacárido puro. Las pruebas de respuesta a la vacunación también pueden ser útiles en la investigación y el control de pacientes con inmunodeficiencias secundarias, es decir, las causadas por un factor externo como una infección vírica (como el VIH) o tratamientos farmacológicos (como la quimioterapia). Inmunología Práctica 3 Inmunodeficiencias primarias (IDP) Las inmunodeficiencias primarias (IDP) se deben a la pérdida física o funcional de una parte del sistema inmunitario. Las IDP son enfermedades genéticas que surgen de manera predominante por un mecanismo de herencia mendeliana. Se han descrito más de 200 entidades y se han identificado mutaciones nocivas en unos 150 genes, aunque puede no manifestarse hasta la edad adulta. Los individuos afectados por una IDP suelen presentar infecciones graves o recurrentes causadas por patógenos habituales que, en circunstancias normales, no deberían causar una enfermedad grave. A su vez, también pueden ser sensibles a patógenos menos habituales que no suelen provocar una infección en personas con un sistema inmunitario sano. Las IDP pueden afectar tanto al sistema inmunitario innato (neutropenia congénita grave, asplenia, deficiencia de la adherencia leucocitaria, deficiencia del complemento, etc.) como al adaptativo (deficiencias de linfocitos, deficiencias del metabolismo de purinas, agenesia del timo, etc.). En este sentido, las IDP que afectan de manera predominante a los linfocitos B son las más frecuentes (6070% de los casos). Por este motivo, la cuantificación de las inmunoglobulinas y de sus isotipos en suero es una prueba básica esencial para el diagnóstico y la investigación de las IDP. ‐ Análisis de IgG, IgA e IgM. Los resultados suelen ser la base de las pruebas posteriores sobre otros aspectos, como el funcionamiento de los anticuerpos. % IgG total Función Patología típica IgG1 60-65% Ag proteicos (timo) Fagocitosis Activación del complemento Hipogammaglobulinemia IgG2 20-25% Ag polisacáridos Infecciones respiratorias recurrentes en niños IgG3 5-10% Ag proteicos Se asocia a la deficiencia de IgG1 IgG4 5% % IgA total Ag no polisacáridos Alergias, asma, dermatitis atópica, algunos parásitos Función Patología típica Reacciones anafilácticas por cambios en la proporción IgA1/IgA2 Pueden pasar desapercibidas IgA1 85% Ag proteicos Ag policáridos débil IgA2 15% Ag polisacáridos y lipopolisacáridos Inmunología ‐ ‐ Práctica 3 Análisis de IgD. La deficiencia de fagocitosis y el síndrome febril recurrente se asocian a la hiperinmunoglobulinemia D. Proteínas monoclonales. Producidas por un único clon de células B y son características de enfermedades neoplásicas. Fundamento de la metodología La detección de los anticuerpos específicos antitoxina tetánica se realiza en la clínica habitualmente mediante un test de ELISA (Enzyme-Linked ImmunoSorbent Assay) en placas de microtitulación de 96 pocillos. Esta metodología se basa en la alta especificidad de un anticuerpo monoclonal por su antígeno. En estos pocillos el toxoide tetánico está inmovilizado al plástico tapizando la cara interna. Todos los pocillos de la placa tienen la misma cantidad de toxoide adsorbido. TMB + H2O2 Ac. anti‐IgG1 humana (Detección) HRP (H3PO4) Ac. anti‐toxoide (SUERO) Toxoide (Ag de captura) La técnica consiste en una primera incubación de los pocillos con las soluciones de calibración, los controles y las muestras a analizar. Las inmunoglobulinas presentes en estas soluciones que detecten el toxoide quedarán firmemente retenidas (interacción Ag-Ac). Tras el lavado de los pocillos para eliminar todas las proteínas no fijadas, se añade IgG purificada producida en conejo que reconoce específicamente la porción Fc de la inmunoglobulina humana que ha reconocido el toxoide. Esta IgG de conejo está marcada con el enzima peroxidasa (IgGHRP). Es decir, el conjugado se fija al anticuerpo humano capturado por el toxoide inmovilizado y el exceso se elimina mediante lavados. El conjugado fijado se visualiza con el reactivo tetrametilobenzidina 3,3’,5,5’ (TMB) y peróxido de hidrógeno (H2O2) dando un color azul. La intensidad es proporcional a la concentración de anticuerpos en la muestra. Para parar la reacción de la HRP se acidifica la solución añadiendo a cada pocillo una solución concentrada de ácido, en este caso ácido fosfórico 3M. Esto produce además un color amarillo a punto final, cuya absorbancia es legible en un lector de placas a una longitud de onda de a 450 nm. Inmunología Práctica 3 MATERIAL • Kit comercial VaccZyme™ Anti-Tetanus Toxoid IgG Enzyme Immunoassay (Binding Site, Birmingham, UK). Este kit contiene: ‐ 12 tiras de 8 columnas con pocillos tapizados con el toxoide tetánico ‐ Tampón diluyente de muestras ‐ Tampón de lavado ‐ Calibradores IgG anti-toxoide: 0,01; 0,03; 0,09; 0,26; 0,78; 2,33; 7 IU/ml ‐ Controles positivos de bajo y alto rango ‐ Conjugado IgGHRP anti-IgG humana ‐ Substrato TMB (NO EXPONER A LA LUZ) ‐ Solución de parada ácido fosfórico 3M (CUIDADO, IRRITANTE) Muestras de suero humano. Deben provenir de extracciones venosas, dejándolas coagular naturalmente, separando después el suero. Agua destilada Pipeta multicanal y micropipetas. Tubos para hacer las diluciones. Lector de placas PROTOCOLO Pasos previos al desarrollo de la práctica. 1. Atemperar todos los componentes del kit a temperatura ambiente (RT). Mezclar con cuidado cada componente antes de usar. 2. Dilución del tampón de lavado 1/20: Añadir 25 ml del tampón de lavado concentrado a 475 ml de agua destilada. 3. Dilución de las muestras 1/100 en el tampón diluyente. 4. Preparación de las tiras y diseño del experimento: Colocar el número necesario de tiras de pocillos en el marco. Desde la posición del pocillo A1 rellenar las columnas de izquierda a derecha. Mientras se manipula la placa, apretar los cantos largos del marco para evitar que los pocillos se salgan. Las tiras no utilizadas se deben guardar inmediatamente en la bolsa de origen para minimizar la exposición a la humedad. Inmunología Práctica 3 Procedimiento. Es importante mantener la misma secuencia de dispensación durante todo el proceso para evitar diferencias en los tiempos de incubación entre los primeros pocillos y los últimos, lo que se denomina deriva del análisis. El tiempo de las incubaciones empieza a contar a partir de la adición de última muestra. 1. Adición de la muestra. Añadir 100 µl de los calibradores, los controles y las muestras diluidas a los pocillos correspondientes. Incubar 30 minutos a RT. 2. Lavado. Las muestras se eliminan por inversión de los pocillos sobre papel absorbente y se añaden 300 µl de tampón de lavado por pocillo. Se repite esta operación 3 veces. Es recomendable usar una pipeta multicanal. 3. Adición del conjugado. Pipetear 100 µl de conjugado por pocillo e incubar 30 minutos. 4. Lavado. De modo similar al punto 2. Secar las posibles salpicaduras con papel absorbente. 5. Adición del substrato (TMB + H2O2). Añadir 100 µl e incubar 30 minutos a RT protegiendo los pocillos de la luz. 6. Parada de la reacción. Pipetear 100 µl de la solución de parada por pocillo. Observar el cambio de color. 7. Medición de la densidad óptica. Leer la absorbancia de cada pocillo a 450 nm en un lector de microplacas en los siguientes 30 minutos a la reacción. RESULTADOS Se debe calcular la dispersión de las lecturas (% CV). Para trabajar de forma precisa, los CV deben ser <15%. Trazar la curva de calibración, mediante regresión lineal del tipo y=ax+b y calcular el ajuste (valor r2). Calcular los valores Control de Bajo (LR) y Alto (HR) rango y las Muestras problema. Interpretar los resultados obtenidos de las muestras analizadas. Aclaración: la representación de los valores de absorbancia respecto a la [IgG1 α-TTx] para la calibración no sigue una distribución lineal y un ajuste multiparamétrico es más correcto. Este hecho se debe tener en cuenta a la hora de discutir los resultados. Inmunología Práctica 3 ANEXO I. Ejemplo de curva de calibración e interpolación de muestras con el programa OPTIMA 2.20 R8 (Mars BMG LabTech). Ajuste lineal de la recta patrón: y = 0,342x + 0,249 (r2=0,9109) La concentración de anticuerpos anti-toxoide presente en las muestras de suero se calcula en el ejemplo de la siguiente tabla: Abs.1 Muestra 1 0,328 Muestra 2 0,517 Muestra 3 1,651 Abs.2 0,314 0,816 1,429 Abs.3 CV Conc.1 Conc.2 Conc.3 Media SD 0,352 5,8% 0,23 0,19 0,30 0,24 0,06 0,732 22,4% 0,78 1,66 1,41 1,28 0,45 1,715 9,4% 4,10 3,45 4,29 3,95 0,44 Alternativamente, se puede realizar un ajuste multiparamétrico con OPTIMA, que nos dará un valor de r2 perfecto para la curva de calibrado y nos permitirá la validación del ensayo mediante la extrapolación de las lecturas de los controles positivos de bajo y alto rango de IgG1 humana antitoxoide tetánico. ANEXO II. Substancias interferentes en la detección. Substancia Concentración (máx.) Bilirrubina F (libre) 183 mg/ml Bilirrubina C (conjugado) 190 mg/ml Hemoglobina hemolizada 4900 mg/ml Quilo Factor reumatoide 19300 U 500 IU/ml ANEXO III. Nivel de protección. En una población normal, la literatura indica un nivel de anticuerpos de protección variable en función de diversos factores, principalmente la edad. En general, se establece que un individuo es inmunocompetente frente al tétanos si posee un valor de IgG1 anti-TTx en suero por encima de 0,15 IU/ml. Inmunología Práctica 4 INMUNOLOGÍA PRÁCTICA 4 DETECCIÓN DE AUTOANTICUERPOS POR INMUNOFLUORESCENCIA Inmunología Práctica 4 OBJETIVOS ESPECÍFICOS DE LA PRÁCTICA: 1. Aprender a determinar ANA (anticuerpos antinucleares) en el suero de pacientes sospechosos de padecer una determinada enfermedad autoinmune. 2. Realizar una técnica de screening, basada en la reacción antígeno-anticuerpo que se produce entre un antígeno nuclear de la línea celular Hep-2 fijada a un porta y el anticuerpo presente o no en el suero del paciente. 3. Realizar la técnica de inmunofluorescencia indirecta, para la visualización de la reacción antígeno- anticuerpo. 4. Hacer una semi-cuantificación de la cantidad de anticuerpo presente en el suero (titulación del suero) mediante el uso de diluciones seriadas. 5. Ver el tipo de reacción en el microscopio de fluorescencia. Observar ejemplos de distintos patrones de tinción. DETECCIÓN DE AUTOANTICUERPOS INTRODUCCIÓN A ENFERMEDADES AUTOINMUNES El sistema inmune protege frente a los agentes infecciosos, sin embargo, en algunas ocasiones puede ocasionar daño tisular y enfermedades. Esto puede ocurrir en dos situaciones: - Cuando la respuesta inmune frente a antígenos extraños es incontrolada o excesiva tienen lugar las reacciones de hipersensibilidad - Cuando la respuesta inmunológica se desarrolla frente a antígenos propios por fallos en la tolerancia central y periférica, tienen lugar las enfermedades autoinmunes. Por lo tanto, las enfermedades autoinmunes se desencadenan por una respuesta inmune anómala frente a antígenos propios. Los mecanismos efectores son los mismos que utiliza el sistema inmune en la respuesta celular y humoral frente a antígenos extraños. En las enfermedades autoinmunes el daño se produce por formación de inmunocomplejos o por anticuerpos que se unen a antígenos celulares o extracelulares. Los anticuerpos que originan las enfermedades autoinmunes van dirigidos frente a antígenos propios, es decir son autoanticuerpos. Sólo en algunos casos son anticuerpos contra antígenos extraños que tienen reacción cruzada con el propio tejido. 1. Formación de complejos antígeno-anticuerpo (inmunocomplejos) que se forman en la circulación y se depositan en la pared vascular, dañando el tejido en el que se depositan, por la activación que originan del sistema inmunológico. Por lo tanto, el daño no es específico de una célula en particular, sino que pueden dañar diversos tejidos. Así las enfermedades autoinmunes producidas por inmunocomplejos son sistémicas, sin especificidad frente un antígeno celular específico de un órgano o tejido. Inmunología Práctica 4 Los inmunocomplejos se originan durante la respuesta inmune normalmente, pero sólo ocasionan daño cuando se producen en grandes cantidades o no se depuran de forma adecuada. El vaso en el que se depositan depende de las propias características de éste, generalmente los capilares glomerulares y de la sinovial de las articulaciones son los más afectados. El lugar de depósito también depende de las características fisicoquímicas del antígeno y el anticuerpo (carga, valencia, isotipo, etc…). El prototipo de enfermedad causada por inmunocomplejos es el Lupus Eritematoso Sistémico (LES): enfermedad autoinmune en la que se producen muchos autoanticuerpos, lo que conduce a diversas manifestaciones clínicas (glomerulonefritis, artritis, etc..). 2. Anticuerpos que se unen a antígenos celulares o extracelulares: estos anticuerpos reconocen de forma específica a un antígeno, dañando específicamente la célula o el tejido en el que se encuentra dicho antígeno. En este caso los mecanismos efectores que intervienen son: la activación del Complemento, la liberación de enzimas por desgranulación de células del sistema inmunológico y la interferencia de las funciones celulares por unión a moléculas o receptores. ANTICUERPOS CONTRA COMPONENTES DEL NÚCLEO Los anticuerpos contra el núcleo (ANA-anti-nuclear-antibodies) son un conjunto heterogéneo de autoanticuerpos que reaccionan contra antígenos del núcleo celular, aunque algunos de ellos también se encuentran en el citoplasma. Los antígenos contra los que van dirigidos los ANA con frecuencia forman parte de proteínas que intervienen en funciones esenciales para las células, como la replicación o la trascripción del DNA y el procesamiento del RNA. Con frecuencia, los epítopos reconocidos por los ANA son lugares activos o funcionales de estas proteínas. Los ANA se encuentran con mucha frecuencia elevados en enfermedades autoinmunes sistémicas y, en general, cuando no se detectan debe reconsiderarse el diagnóstico. Por tanto, el análisis de los ANA es un método de escrutinio poderoso y sensible en estos pacientes. Los Ac antinucleares pueden detectarse en personas sanas, incrementándose con la edad (38% en ancianos). Habitualmente, los ANA en personas sanas son de baja afinidad y títulos bajos (< 1/40-1/60). En nuestro hospital se considera que empiezan a tener significación patológica a partir de la dilución 1/80. Recientemente se ha descubierto que títulos elevados de ANA sin asociación con la positividad de algún ENA no son debidos a enfermedades autoinmunes, sino a otras patologías (síndromes paraneoplásicos, tumores hematológicos e infecciones). En los estudios de autoinmunidad se utilizan varias técnicas analíticas para la detección de los autoanticuerpos. En esta práctica vamos a utilizar la técnica de inmunofluorescencia. Inmunología Práctica 4 DETERMINACIÓN DE ANTICUERPOS ANTINUCLEARES MEDIANTE INMUNOFLUORESCENCIA Existen muchos tipos de anticuerpos antinucleares (ANA), dependiendo la especificidad de cada uno de ellos son más característicos de una enfermedad u otra. En el Lupus Eritematoso Sistémico los ANA son positivos en el 90-95% de los pacientes, siendo los más específicos los dirigidos frente al ADN de doble cadena o nativo, y los que reconocen ribonucleoproteínas (RNP-Sm). Para detectar si un suero posee ANA o no, normalmente, se utiliza la técnica de inmunofluorescencia sobre tejidos animales o sobre células de una línea celular humana (línea HEP-2 procedente de un carcinoma de laringe) fijadas en un porta. Esta técnica nos sirve de screening, si aparecen ANA a títulos altos, y dependiendo del patrón de tinción: homogéneo, moteado, nucleolar, etc.., podemos tener una orientación hacia determinados grupos de enfermedades, pues nos sugiere el tipo de antígeno contra el que van dirigidos, pero no nos lo identifica. Para poder identificar el antígeno concreto hay que utilizar otras técnicas, normalmente técnicas en las que el antígeno (el especifico que queremos identificar) está fijado a una fase sólida, ej. ELISA, inmunofijación, etc .. FUNDAMENTO DE LA TÉCNICA Se va a realizar una inmunofluorescencia indirecta. El antígeno presente en la célula va a reaccionar con el anticuerpo presente en el suero del paciente, posteriormente se le añade un anticuerpo que reconozca todas la inmunoglobulinas marcado con fluoresceína, que nos va a permitir visualizar la reacción mediante un microscopio de fluorescencia. Es importante determinar el título al que funcione el suero y el patrón de reacción (por ello no se realiza por citometría de flujo). TÉCNICA 1. Se realizan las diluciones de los sueros: se empieza por 1/40 y se hacen seriadas al 1/2: 1/80, 1/160, 1/320 …etc …... 2. Se añade cada dilución a un pocillo del porta donde está fijada la línea HEP-2 (se conserva en frio), se pone suficiente cantidad de suero para cubrir el pocillo (≈ 20 µl). 3. Se incuba en cámara humedad 30 minutos a Tª ambiente. 4. Se lava en PBS/TWEEN (2 ml de tween en un litro de PBS) 5 minutos. 5. Se le añade el anticuerpo marcado con fluoresceína (≈ 20 µl) 6. Se incuba otros 30 minutos. 7. Se lava en PBS/TWEEN 5 minutos. 8. Se escurre bien el porta y se deja secar un poco, sin que se sequen mucho las células. 9. Se monta el cubre con medio de montaje acuoso (a base de glicerina). 10. Se visualiza al microscopio. En la lectura en el microscopio de fluorescencia hay que tener en cuenta el patrón de tinción y la intensidad con las distintas diluciones. El patrón de tinción nos puede orientar sobre la enfermedad que padece el paciente y las diluciones nos aproximan a la cantidad de autoanticuerpos que tiene el paciente en el suero. La dilución mayor en la que se detecta positividad se considera el título de anticuerpo que tiene ese paciente. Así, sí en un paciente la dilución 1/320 es negativa, pero la 1/160 es positiva, este paciente tendría un título de autoanticuerpos de 1/160. Si la última dilución que hemos realizado, en nuestro caso 1/320, fuera positiva, tendríamos que seguir estudiando este suero hasta encontrar una negativa, ….1/640, 1/1280 …… Inmunología Práctica 4 El utiilizar dilucioones seriadaas empezanddo por 1/40 se s hace para que haya un una homogen neidad entre los disstintos laborratorios de lo os distintos hhospitales. Inmunología Práctica 4 Inmunología Práctica 4