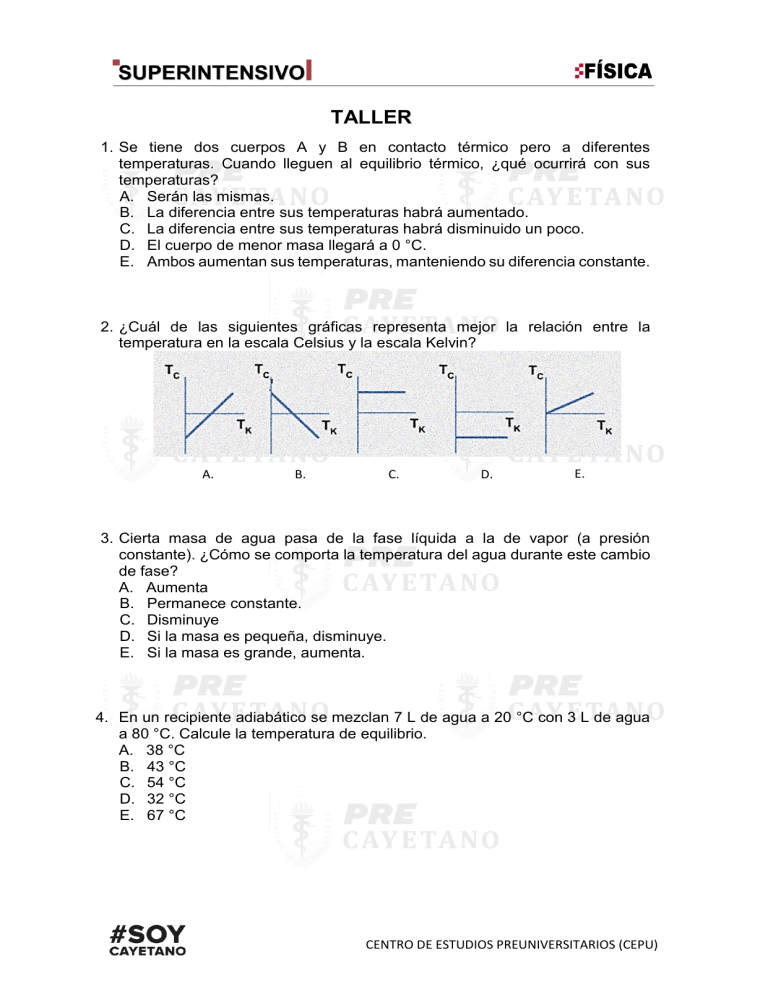
TALLER 1. Se tiene dos cuerpos A y B en contacto térmico pero a diferentes temperaturas. Cuando lleguen al equilibrio térmico, ¿qué ocurrirá con sus temperaturas? A. Serán las mismas. B. La diferencia entre sus temperaturas habrá aumentado. C. La diferencia entre sus temperaturas habrá disminuido un poco. D. El cuerpo de menor masa llegará a 0 °C. E. Ambos aumentan sus temperaturas, manteniendo su diferencia constante. 2. ¿Cuál de las siguientes gráficas representa mejor la relación entre la temperatura en la escala Celsius y la escala Kelvin? A. B. C. D. E. 3. Cierta masa de agua pasa de la fase líquida a la de vapor (a presión constante). ¿Cómo se comporta la temperatura del agua durante este cambio de fase? A. Aumenta B. Permanece constante. C. Disminuye D. Si la masa es pequeña, disminuye. E. Si la masa es grande, aumenta. 4. En un recipiente adiabático se mezclan 7 L de agua a 20 °C con 3 L de agua a 80 °C. Calcule la temperatura de equilibrio. A. 38 °C B. 43 °C C. 54 °C D. 32 °C E. 67 °C CENTRO DE ESTUDIOS PREUNIVERSITARIOS (CEPU) 5. Un bloque de oro de 225 g a 85,0 °C está inmerso en 155 g de agua a 25,0 °C. Si suponemos que el sistema está aislado y que la capacidad calorífica del recipiente puede ser despreciada, ¿cuál es la temperatura de equilibrio? coro = 0, 030 8 cal/g∙ °C cagua = 1,00 cal/g∙ °C A. 24,0 °C B. 25,2 °C C. 26,0 °C D. 27,0 °C E. 27,9 °C 6. A una muestra de 100 g de hielo a -40 °C se le transfieren 4 kcal. Calcule la temperatura final. A. 0 °C B. 20 °C C. 10 °C D. 30 °C E. 40 °C 7. La gráfica representa cómo se comporta la temperatura de una masa de agua desde T° = -25 °C hasta T° = 125 °C (a presión constante) en función al tiempo. ¿Entre cuáles de los puntos señalados encontraremos fase líquida y fase sólida al mismo tiempo? A. Entre a y b. B. Entre b y c. C. Entre c y d. D. Entre d y e. E. Desde e en adelante. 8. 100 g de hielo a 0 °C se colocan en un recipiente con 100 g de vapor de agua a 100 °C. Calcule la temperatura de equilibrio. A. 0 °C B. 50 °C C. 70 °C D. 30 °C E. 100 °C PÁG. 2 9. La figura representa una barra metálica inicialmente a temperatura ambiente cuyo extremo derecho es puesto al fuego. Luego de cierto tiempo una persona pone su dedo en el extremo izquierdo y se quema. ¿Cómo se transfirió el calor de un extremo a otro a través de la barra? A. Radiación B. Convección C. Conducción D. No hay transferencia de calor de un extremo a otro. E. Falta saber cuál es el metal del que está hecha la barra. 10. A un gas ideal se le transfiere 100 J de calor durante la expansión y realiza un trabajo de 20 J. Calcule la variación de la energía interna durante la expansión. A. 80 J B. 60 J C. 50 J D. 40 J E. 20 J 11. Con relación al proceso adiabático realizado por un gas ideal, es correcto afirmar que A. el trabajo realizado por el gas siempre es positivo. B. nunca hay cambio en la energía interna del gas. C. el trabajo realizado por el gas coincide con el cambio de su energía interna. D. la presión del gas se mantiene constante. E. no hay transferencia de calor. 12. Un gas ideal cambia su estado desde (V1; P1) hasta (V2; P2) a través de tres procesos, tal como se representa en el esquema. El trabajo efectuado por el gas es A. mayor siguiendo el proceso 132. B. menor siguiendo el proceso 12. C. el mismo para los tres procesos. PÁG. 3 D. el mismo en los procesos 132 y 142. E. cero en los tres procesos. 13. Un gas ideal pasa del estado 1 al 2 mediante tres procesos diferentes. ¿En cuál de los tres procesos el cambio en la energía interna del gas es mayor? A. En 132 B. En 12 C. En 142 D. En toso el cambio es positivo y el mismo. E. En todos los cambios son cero. 14. La figura muestra un sistema termodinámico que recibe calor, pero no hace trabajo. ¿Qué proceso se habría llevado a cabo? A. Isotérmico. B. Isobárico. C. Adiabático. D. Isocórico. E. No es posible que no haga trabajo. 15. Cierta cantidad de gas experimenta un proceso representado en la figura. ¿Qué proceso experimentó este sistema? A. Expansión isotérmica. B. Expansión adiabática. C. Expansión isobárica. D. Expansión isocórica. E. Contracción adiabático. PÁG. 4







