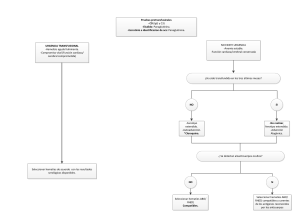
PRÁCTICA N.º 22: SOLUCIONES HIPERTÓNICAS E HIPOTÓNICAS FUNDAMENTO Los glóbulos rojos en soluciones isotónicas presentan una morfología muy característica de disco bicóncavo, que es capaz de doblarse sobre si mismo debido al material viscoelástico que compone su membrana celular. Esto permite un grado de deformabilidad esencial para poder atravesar la microcirculación y en especial el filtro esplénico. Por ello si suspendemos los eritrocitos en una solución hipertónica, tenderá a salir agua de la célula para equilibrar las diferencias de concentración, produciendo un plegamiento de la membrana que da lugar a un aspecto de célula arrugada o crenada. Por el contrario, si usamos soluciones hipotónicas se producirá una entrada de agua en la célula que se hinchará pudiendo salir la hemoglobina de la célula a través de los poros de la membrana. Observamos entonces unos hematíes grandes, incoloros, con poco contraste, que se conocen como hematíes fantasmas. Posteriormente se produce la rotura de la membrana o hemólisis. Por tanto, el fundamento de esta práctica es suspender los hematíes en distintas soluciones hipo e hipertónicas para observar los cambios morfológicos que se produzcan al microscopio óptico. MATERIAL NECESARIO Microscopio óptico. Tubos de hemólisis. Tubos de ensayo. Pipetas pasteur. Pipetas graduadas o pipetas automáticas. Matraces aforados de 100 ml. Balanza. Porta y cubreobjetos. Vidrio de reloj. Embudo. REACTIVOS Cloruro sódico puro. Agua destilada. Aceite de inmersión. Laca de uñas o sellador histológico. MUESTRA Sangre venosa fresca anticoagulada con EDTA K3, que se deja reposar verticalmente para permitir la sedimentación de los eritrocitos. TÉCNICA 1. Preparación de las soluciones hipotónicas: a partir de la solución isotónica al 0,9% se prepara la siguiente batería de tubos: 2. 1 2 3 4 5 Solución al 0,9 % en ml 4,4 5,5 6,6 7,7 8,8 Agua destilada en ml 5,6 4,5 3,4 2,3 1,2 Concentración final en % 0,4 0,5 0,6 0,7 0,8 Preparación de la solución isotónica que es cloruro sódico al 0,9 %. (Tubo 6) 3. Preparación de las soluciones hipertónicas: pesamos 1,5 g de cloruro sódico y lo echamos en un matraz de 100 ml. Enrasamos con agua destilada hasta los 100 ml. Con ello obtenemos una solución al 1,5 %, y a partir de ella realizamos la siguiente batería de tubos: 4. 7 8 9 10 11 Solución al 1,5 % en ml 6,6 7,3 8 8,6 9,33 Agua destilada en ml 3,4 2,7 2 1,4 0,7 Concentración final en % 1 1,1 1,2 1,3 1,4 Preparación de la suspensión de eritrocitos: rotulamos 11 tubos de hemólisis indicando la concentración de la solución salina que contienen. Dispensamos 5 gotas de la solución salina correspondiente en cada uno de los tubos. En los tubos 1 a 5 añadimos cinco gotas de las soluciones hipotónicas; en el tubo 6 añadimos cinco gotas de la solución isotónica; en los tubos 7 a 11 añadimos cinco gotas de las soluciones hipertónicas. Añadimos a cada tubo una gota de los hematíes sedimentados en el tubo de sangre y mezclamos por inversión. Dejamos reposar los tubos 10 minutos a temperatura ambiente. Rotulamos 11 portas con la concentración correspondiente de solución salina que figura en los tubos de hemólisis. En cada porta depositamos 1 gota de la suspensión de eritrocitos correspondiente y cubrimos con un cubreobjetos. Sellamos con laca de uñas o sellador histológico. LECTURA DE LOS RESULTADOS Observamos con el objetivo de 40 x cada uno de los portas. Posteriormente aplicamos una gota de aceite de inmersión en el cubre y observamos con el objetivo de 100 x. En el tubo correspondiente a la solución salina de concentración 0,9 % los hematíes no deben presentar variaciones morfológicas y se apreciará su forma bicóncava característica. En los tubos correspondientes a las soluciones hipotónicas observaremos un hinchamiento celular con pérdida de hemoglobina, hasta llegar a una hemólisis total o parcial en el tubo correspondiente a la concentración 0,4 %. Por el contrario, en los tubos correspondientes a las soluciones hipertónicas, los hematíes se observarán arrugados o crenados. ACTIVIDADES 1. Contestar a las siguientes cuestiones: a) ¿Qué son los eritrocitos crenados? b) ¿En qué tipo de soluciones aparecen los hematíes fantasmas? c) ¿Qué les ocurre a los hematíes cuando están en una solución isotónica? 2. Resultados obtenidos: observe al microscopio óptico los eritrocitos suspendidos en las distintas soluciones y dibuje su aspecto. PRÁCTICA N.º23: DETERMINACIÓN MANUAL DEL TIEMPO DE PROTROMBINA FUNDAMENTO El tiempo de protrombina (TP) o tiempo de Quick es el tiempo que tarda en coagular un plasma, cuando se pone en contacto con un exceso de calcio y de tromboplastina hística. El reactivo utilizado para la realización de esta prueba es una mezcla de tromboplastina hística (TH) y de calcio, por lo que recibe el nombre de tromboplastina cálcica. Esta TH procede de extractos de cerebro o de pulmón, de hombre o de animales (generalmente de conejo o de vaca). MATERIAL NECESARIO Una gradilla. Un rotulador de vidrio de punta fina. Una pipeta automática capaz de dispensar 100 y 200 μl. Dos puntas de pipeta automática adecuadas para contener 100 y 200 μl (color amarillo y azul). Tubos de hemólisis. Un baño de agua ajustable a 37 ºC. Dos tubos de ensayo de plástico. REACTIVOS Una tromboplastina cálcica comercial. TÉCNICA 1. Homogeneizar la tromboplastina cálcica, sin agitarla bruscamente. 2. Depositar el volumen total de tromboplastina cálcica que se va a necesitar, en un tubo de ensayo de plástico, adecuadamente rotulado. 3. Atemperar la tromboplastina cálcica, a 37 ºC. Para ello, se sitúa el tubo que contiene esta sustancia en un baño de agua, ajustado a 37 ºC, entre 5 y 15 minutos. 4. Pipetear 100 μl de plasma en un tubo de hemólisis limpio e incubar durante 2 a 5 minutos a 37ºC. 5. Añadir 200 μl de tromboplastina cálcica, preincubada a 37 ºC, y poner en marcha el cronómetro simultáneamente. 6. Observar la formación del coágulo y parar el reloj cuando aparezca la primera red de fibrina. Es conveniente realizar cada determinación por duplicado. LECTURA DE LOS RESULTADOS El TP es el tiempo transcurrido desde la adición de la tromboplastina cálcica hasta la formación del coágulo de fibrina. Los valores del TP están comprendidos, normalmente, entre los 11 y los 15 segundos. Lo más correcto es determinar 2 veces el TP de la muestra y dar, como resultado final, la cifra media calculada a partir de cada par de valores. INTERPRETACIÓN DE LOS RESULTADOS OBTENIDOS El tiempo de protrombina está alargado en pacientes con déficits de factores de la vía extrínseca, en enfermos sometidos a terapias con dicumarinas y en pacientes que sufren algunos trastornos hepáticos. ACTIVIDADES 1. Contestar a las siguientes cuestiones: a) ¿Cual es el % normal de actividad de la protrombina? b) ¿En qué circunstancias se altera el TP? 2. Resultados obtenidos: TP de la muestra, en segundos: % de actividad de la protrombina contenida en la muestra, obtenido mediante interpolación en la curva de actividad preparada previamente: 3. Valoración de los resultados La muestra ensayada tiene un TP: Acortado. Normal. Alargado. PRÁCTICA N.º 24: PREPARACIÓN DE UN POOL DE PLASMAS FUNDAMENTO Un pool de plasmas es una mezcla de varios plasmas, que puede ser utilizada como líquido de referencia, ya que las sustancias que contiene están presentes en ella a una concentración comprendida dentro de los límites de la normalidad. MATERIAL NECESARIO Tubos de recogida de sangre. Una centrífuga. Una pipeta Pasteur de plástico. Un vaso de precipitados de plástico y de 25 ml de capacidad. Tubos Eppendorf para congelación de plasma. Una pipeta automática. Puntas de pipeta automática. Un rotulador de vidrio de punta fina. MUESTRA Sangre venosa recientemente extraídas, adecuadamente anticoaguladas y procedentes de 6 a 10 personas que no reciban ninguna medicación y que no padezcan ninguna enfermedad. REACTIVOS Anticoagulante: si el pool de plasmas se destina a estudios de coagulación, el anticoagulante que deben contener los tubos de recogida de sangre es citrato trisódico 0,11 M y éste debe mezclarse con la sangre en una proporción de 1 a 9. TÉCNICA 1. Centrifugar todas las sangres a 3.000 r.p.m. durante 10 minutos, si se pretende preparar un pool de plasmas pobres en plaquetas, o a 1.000 r.p.m. durante 10 minutos, si se pretende preparar un pool de plasmas rico en plaquetas. 2. Desechar los plasmas hemolizados, hiperlipémicos o hiperbilirrubinémicos. 3. Extraer rápidamente los plasmas considerados válidos y depositarlos en un solo vaso de precipitados. 4. Mezclar bien todos los plasmas para formar el pool. 5. Repartir un mismo volumen del pool (por ejemplo 300 μl) en tubos Eppendorf, hasta agotar la mezcla de plasmas preparada. 6. Rotular en los tubos Eppendorf el nombre del producto que se ha preparado (pool de plasmas) y la fecha de elaboración. 7. Proteger del deterioro al pool, mediante: Un cierre correcto de los tubos, para evitar la evaporación del agua que forma parte de la mezcla de plasmas y, por tanto, para eludir la hiperconcentración de las sustancias que ésta contiene. Una reducción de su exposición a la luz, para soslayar la descomposición de alguna de las sustancias que incluye (por ejemplo, la bilirrubina). Una conservación a baja temperatura, para impedir la acción bacteriana que puede conducir a la alteración de alguna de las sustancias que engloba (consumo de glucosa). 8. Emplear el pool, solamente, dentro de los plazos adecuados de almacenamiento: Unas 8 horas, si se mantiene a temperatura ambiente (20-25 ºC). De 2 a 3 días, si se conserva a unos 4 ºC y se pretende determinar una sustancia enzimática. Una semana, si se conserva a 4 ºC y se pretende determinar una sustancia no enzimática. Un mes, si se conserva a -20 ºC y se pretende determinar una sustancia enzimática. Dos meses, si se conserva a -20 ºC y se pretende determinar una sustancia no enzimática. ACTIVIDADES 1. Responder brevemente a las siguientes cuestiones: a) ¿Qué es un pool de plasmas? b) ¿De cuántas personas deben proceder las sangres necesarias para preparar un pool de plasmas? c) ¿Cuándo deben desecharse los plasmas? d) ¿Qué se debe rotular en los tubos Eppendorf? e) ¿Para qué se conservan los plasmas a baja temperatura? f) Cuando se pretende determinar una sustancia enzimática, ¿en qué plazo puede utilizarse un pool de plasmas que se conserva a -20 ºC? 2. Resultados obtenidos: Número de tubos de sangre procesados: Volumen total de pool preparado: Volumen de pool dispensado en cada tubo Eppendorf: Número de tubos Eppendorf necesitados: PRÁCTICA N.º 25: DETERMINACIÓN DEL GRUPO HEMÁTICO ABO POR LA TÉCNICA EN PORTA FUNDAMENTO Consiste en observar la aglutinación que se produce cuando se enfrentan los hematíes del paciente que contienen sustancias antigénicas (aglutinógenos), con una serie de antisueros conocidos (aglutininas). Todo ello permite la determinación del grupo ABO del individuo. MATERIAL Un portaobjetos o tarjeta visualizadora de fondo blanco. Un rotulador de vidrio. Una pipeta Pasteur desechable. Palillos mezcladores. Un reloj. REACTIVOS Suero anti-A. Suero anti-B. Suero anti-AB MUESTRA Sangre capilar o sangre total anticoagulada con EDTA, citratada u oxalatada. TÉCNICA 1. Dividir el portaobjetos o tarjeta visualizadora en dos secciones con el rotulador de vidrio. Marcar una con la letra A y otra con la letra B. 2. Depositar una gota de suero anti-A (azul) en la sección A del portaobjetos, y una gota del suero anti-B (amarillo) en la sección B. 3. Situar una pequeña gota de sangre (aproximadamente la mitad del volumen usado de antisuero) junto a la gota de antisuero. 4. Mezclar ambas gotas en cada sección utilizando un palillo distinto en cada una de ellas y formando un círculo de 2 a 2,5 cm de diámetro. 5. Hacer oscilar suavemente el portaobjetos hacia delante y hacia detrás, durante dos minutos. 6. Observar la presencia o ausencia de aglutinación. LECTURA DE RESULTADOS La aglutinación se pone de manifiesto por la aparición de una serie de grumos rojos que flotan en un líquido claro. En el caso contrario, los hematíes permanecen en forma de suspensión homogénea de color rojizo. La presencia o ausencia de aglutinación puede confirmarse mediante examen microscópico de las mezclas. En general estas pruebas son muy eficaces, ya que la presencia de plasma en la muestra aumenta la velocidad de la reacción y el tamaño de los grumos. El resultado puede observarse en unos segundos, aunque conviene reexaminar la reacción al cabo de 2 minutos para comprobar que no se ha pasado por alto ninguna reacción débil. Estas suelen ocurrir en menos de un 1% de las muestras analizadas. Hematíes y suero anti-A Hematíes y suero anti-B Grupo eritrocitario aglutinación no aglutinación A no aglutinación aglutinación B aglutinación aglutinación AB no aglutinación no aglutinación O INTERPRETACIÓN CLÍNICA DE LOS RESULTADOS OBTENIDOS Atendiendo a los resultados obtenidos se asignarán los correspondientes grupos eritrocitarios. En el caso de que el grupo obtenido sea el A, los hematíes problema deberán ser ensayados de nuevo con lectina anti-A1, de forma que si se produce aglutinación, el sujeto pertenecerá al subgrupo A1. ACTIVIDADES 1. Responder brevemente a las siguientes cuestiones: a) ¿Qué tipo de técnica inmunológica se emplea en este análisis? b) ¿Qué muestra utilizamos? c) ¿Cómo se ve la aglutinación positiva? d) ¿Qué debemos hacer si el grupo obtenido es el A? 2. Completar la siguiente tabla con los resultados obtenidos: Aglutinación No aglutinación Mezcla de hematíes y suero anti-A Mezcla de hematíes y suero anti-B 3. A la vista de los resultados, la sangre analizada es del grupo: A B AB O PRÁCTICA N.º 26: DETERMINACIÓN DEL GRUPO HEMÁTICO ABO POR LA TÉCNICA EN TUBO FUNDAMENTO Consiste en observar la aglutinación que se produce cuando se enfrentan los hematíes del paciente que contienen sustancias antigénicas (aglutinógenos), con una serie de antisueros conocidos (aglutininas). Todo ello permite la determinación del grupo ABO del individuo. MATERIAL Tubos de hemólisis. Un rotulador de vidrio. Pipetas Pasteur desechable. Centrífuga. Gradillas. REACTIVOS Suero anti-A. Suero anti-B. Suero anti-AB. Solución salina fisiológica. MUESTRA Sangre total anticoagulada. Para esta técnica es preferible usar una suspensión de hematíes problema. TÉCNICA 1. En primer lugar realizamos el lavado de los hematíes problema. Para ello rotulamos convenientemente un tubo de centrífuga y añadimos 0,5 ml de la muestra de sangre. Completamos el tubo con solución salina y agitamos para suspender los hematíes. Centrifugamos 4 minutos a 2.000 r.p.m. y decantamos el sobrenadante; repetimos esta operación tres veces hasta que el sobrenadante esté totalmente transparente. 2. A continuación, preparamos una suspensión al 5% de los hematíes. Para ello cogemos 0,1 ml de hematíes lavados y añadimos 1,9 ml de salino. 3. Se rotulan tres tubos de hemólisis bien limpios con las letras A, B y AB. 4. Se añade a cada tubo una gota de la suspensión de hematíes al 5%. 5. Se añaden dos gotas de suero anti-A en el tubo A, dos gotas de anti-B en el tubo B, y dos gotas de anti- AB en el tubo AB. 6. Centrifugamos todos los tubos durante 1 minuto a 1.000 r.p.m. o 30 segundos a 3.400 r.p.m. LECTURA DE RESULTADOS Después de centrifugar, golpeamos suavemente el fondo de cada tubo para desprender el sedimento y observar macroscópicamente la presencia o ausencia de aglutinación. Si la reacción es negativa, los hematíes se resuspenden homogéneamente. Si la reacción es positiva se observa un botón de hematíes que permanecen unidos una vez desprendido el sedimento. INTERPRETACIÓN CLÍNICA DE LOS RESULTADOS OBTENIDOS Se realiza igual que en la técnica en porta. Es importante destacar que los restos de detergente o sustancias extrañas en los tubos puede ocasionar falsos negativos. También pueden darse falsos positivos por dos motivos: Aglutinación no específica: se debe a la presencia de ácido hialurónico en la sangre, procedente de la gelatina de Wharton del cordón umbilical, y se elimina añadiendo una gota de hialuronidasa a la suspensión de hematíes. Fenómeno de Rouleaux: consiste en una agrupación no específica de hematíes que adoptan una imagen de pilas de monedas. Las sustancias que más frecuentemente originan este tipo de fenómeno son el fibrinógeno, las gammaglobulinas, el dextrano y la polivinilpirrolidona. Estos fenómenos pueden evitarse con el lavado previo de los hematíes problema. ACTIVIDADES 1. Responder brevemente a las siguientes cuestiones: a) Qué tipo de técnica inmunológica se emplea en este análisis? b) A qué concentración se prepara la suspensión de hematíes problema? c) Cómo se ve la aglutinación positiva? d) A qué se debe el fenómeno de Rouleaux? e) Cómo se pueden evitar los falsos positivos? 2. Completar la siguiente tabla con los resultados obtenidos: Aglutinación No aglutinación Mezcla de hematíes y suero anti-A Mezcla de hematíes y suero anti-B 3. A la vista de los resultados, la sangre analizada es del grupo: A B AB O PRÁCTICA N.º 27: DETERMINACIÓN DEL GRUPO Rh POR LA TÉCNICA EN PORTA FUNDAMENTO Esta técnica está basada en la detección del antígeno D sobre la superficie de los hematíes problema, empleando como reactivo un suero monoclonal humano que contiene anticuerpos anti-D. En el caso de que los hematíes contengan el antígeno D se producirá una aglutinación que puede observarse a simple vista. En la determinación del grupo Rh por la técnica en porta conviene mencionar que la aglutinación se favorece por el calor, de manera que es necesario disponer de un visualizador que permita tanto calentar el porta, como observar mejor el resultado de la reacción. MATERIAL Un portaobjetos. Un rotulador de vidrio. Una pipeta Pasteur desechable. Palillos mezcladores. Un visualizador luminoso. REACTIVOS Suero anti-D. Albumina bovina al 30%. MUESTRA Sangre capilar o sangre total anticoagulada, citratada u oxalatada. TÉCNICA 1. Dividir el portaobjetos en dos secciones con el rotulador de vidrio y marcar una con la letra S (sangre) y otra con la letra A (albumina). 2. En la sección S colocamos dos gotas de suero anti-D, y en la sección A ponemos dos gotas de albúmina bovina al 30%. 3. Depositamos una gota de sangre en cada una de las secciones y mezclamos con palillos distintos. 4. Colocamos el porta sobre el visualizador previamente calentado, y lo balanceamos para favorecer la mezcla de sangre y reactivos. LECTURA DE RESULTADOS Esperamos dos minutos antes de dar el resultado de la prueba. La presencia de aglutinación positiva se manifiesta por la aparición de grumos rojos sobre un fondo claro. No deben confundirse con pequeños coágulos de fibrina presentes en la muestra. La presencia de una aglutinación negativa se manifiesta porque la mezcla da lugar a una suspensión homogénea de los hematíes. La mezcla de sangre con albumina bovina debe dar siempre aglutinación negativa. En caso de no ser así, no podemos informar del resultado de la prueba. INTERPRETACIÓN CLÍNICA DE LOS RESULTADOS OBTENIDOS Los resultados se interpretan según el siguiente cuadro Sección S Sección A Interpretación aglutinación no aglutinación Rh postivo no aglutinación no aglutinación Rh negativo aglutinación aglutinación No tiene Para confirmar un Rh negativo es necesario realizar la prueba en tubo. ACTIVIDADES 1. Responder brevemente a las siguientes cuestiones: a) ¿Qué tipo de muestra empleamos en esta técnica? b) ¿Para qué se utiliza el visualizador? c) ¿Qué puede dar lugar a falsas aglutinaciones? d) ¿Qué ocurre si aglutina la sección A? 2. Completar la siguiente tabla con los resultados obtenidos: Aglutinación Sección S Sección A 3. A la vista de los resultados, la sangre analizada es del grupo: □ Rh positivo □ Rh negativo PRÁCTICA N.º 28: DETERMINACIÓN DEL GRUPO Rh POR LA TÉCNICA EN TUBO FUNDAMENTO Esta técnica está basada en la detección del antígeno D sobre la superficie de los hematíes problema, empleando como reactivo un suero monoclonal humano que contiene anticuerpos anti-D. En el caso de que los hematíes contengan el antígeno D se producirá una aglutinación que puede observarse a simple vista. La determinación del grupo Rh por la técnica en tubo se hace para confirmar resultados, siempre que en la técnica en porta salga Rh negativo. La razón de utilizar albúmina bovina, tanto en esta técnica como en la de en porta, reside en el hecho de que los hematíes pueden revestirse in vivo de anticuerpos o proteínas plasmáticas anormales, y en presencia de albúmina producir una agregación que daría la idea de una glutinación positiva. Por ello empleamos un control de albúmina, de manera que si aparece aglutinación en ese tubo debemos repetir la prueba, pero usando un suero anti-D en medio salino. MATERIAL Tubos de centrífuga y de hemólisis. Un rotulador de vidrio. Una pipeta Pasteur desechable. Gradillas para tubos. Una centrífuga. REACTIVOS Suero anti-D. Albumina bovina al 30%. Solución salina fisiológica al 0,9%. MUESTRA Sangre capilar o sangre total anticoagulada, citratada u oxalatada. TÉCNICA 1. En primer lugar realizamos el lavado de los hematíes problema. Para ello rotulamos convenientemente un tubo de centrífuga y añadimos 0,5 ml de la muestra de sangre. Completamos el tubo con solución salina y agitamos para suspender los hematíes. Centrifugamos 4 minutos a 2.000 r.p.m. y decantamos el sobrenadante. Repetimos esta operación tres veces. 2. A continuación, preparamos una suspensión al 5% de los hematíes. Para ello cogemos 0,1 ml de hematíes lavados y añadimos 1,9 ml de salino. 3. Rotulamos dos tubos de hemólisis limpios con las letras D y A. 4. En el tubo D añadimos una gota de suero anti-D y en el tubo A ponemos una gota de albúmina bovina al 30%. 5. A cada tubo le añadimos una gota de la suspensión de hematíes al 5% y agitamos suavemente para mezclar el contenido de los tubos. 6. Centrifugamos durante 1 minuto a 1.000 r.p.m. o 30 segundos a 3.500 r.p.m. LECTURA DE RESULTADOS Se dan suaves golpes en el fondo de los tubos para despegar el botón hemático y se observa la presencia de aglutinación. Se considera aglutinación positiva si se formen grumos de color rojo en un líquido claro. Por el contrario, si se resuspenden homogéneamente los hematíes, decimos que la aglutinación es negativa. El tubo con albúmina es un control negativo, y debe dar siempre ausencia de aglutinación. En caso de no ser así, el resultado de la prueba no es válido. INTERPRETACIÓN CLÍNICA DE LOS RESULTADOS OBTENIDOS Si el tubo D presenta aglutinación y el tubo A no, decimos que el paciente es Rh positivo. Si no se produce aglutinación en ninguno de los dos tubos, procederemos a incubar ambos a 37 1C durante media hora, al cabo de las cuales centrifugamos a 1.000 r.p.m. durante un minuto y observamos la presencia de aglutinación. En el caso de persistir la negatividad comprobaremos que el paciente no posee un Du (D débil) mediante una prueba de Coombs indirecta. Si después de todos estos pasos el resultado es la no aglutinación, informaremos que el paciente es Rh negativo. ACTIVIDADES 1. Responder brevemente a las siguientes cuestiones: a) ¿Por qué utilizamos el control de albúmina? b) ¿Qué ocurre si no aparece aglutinación en el tubo D? c) ¿Qué debemos detectar mediante un Coombs indirecto? d) ¿Cómo se prepara la muestra problema? 2. Completar la siguiente tabla con los resultados obtenidos: Aglutinación Tubo D Tubo A 3. A la vista de los resultados, la sangre analizada es del grupo: □ Rh positivo □ Rh negativo PRÁCTICA N.º 29: DETERMINACIÓN DEL ANTÍGENO Du (D DÉBIL) FUNDAMENTO El Du es un antígeno débil que no se pone de manifiesto en las pruebas normales de determinación del Rh. Por ello debemos sensibilizar previamente los hematíes problema con un suero que contiene anticuerpos anti-D, y posteriormente enfrentarlos al suero de Coombs. Si existe el antígeno Du en la superficie de los eritrocitos, se producirá en una primera fase la unión de los anticuerpos anti-D a sus receptores de membrana, y en una segunda fase la aglutinación de los hematíes en presencia del suero antiglobulina humana. Esta técnica no es más que un test de Coombs indirecto. MATERIAL Tubos de centrífuga y tubos de hemólisis. Una pipeta Pasteur desechable. Gradillas para tubos. Una centrífuga. Un baño de agua. Un reloj. REACTIVOS Suero anti-D humano. Suero antiglobulina humana de conejo (suero de Coombs). Solución salina fisiológica al 0,9%. MUESTRA Hematíes de la sangre problema previamente lavados tres veces en solución salina fisiológica, y suspendidos al 5% en dicha solución. TÉCNICA 1. En un tubo de hemólisis colocamos una gota de suero anti-D y una gota de suspensión de hematíes al 5%. 2. Mezclamos suavemente e incubamos a 37 1C durante 45 minutos. 3. Después de incubar, lavamos los hematíes en solución salina fisiológica tres veces consecutivas. Decantamos completamente la solución salina después del último lavado. 4. Añadimos sobre el sedimento hemático una gota de suero de Coombs, y mezclamos suavemente. 5. Centrifugamos el tubo a 1.000 r.p.m. durante un minuto. LECTURA DE RESULTADOS Observamos la aparición o no de aglutinación, mediante golpes suaves en el fondo del tubo. En caso de duda, observamos al microscopio entre porta y cubre con el objetivo de 40x. INTERPRETACIÓN CLÍNICA DE LOS RESULTADOS OBTENIDOS Si existe aglutinación, el resultado es positivo. Esto indica que en la membrana de los hematíes hay antígeno Du, y se clasifica la sangre como Rh + variante Du. En caso de no existir aglutinación se clasificará la sangre como Rh negativo. Para evitar falsos positivos debidos a una sensibilización previa de los hematíes in vivo, debemos realizar una prueba de Coombs directa con los hematíes problema. Esto nos servirá como control negativo. ACTIVIDADES 1. Responder brevemente a las siguientes cuestiones: a) ¿Qué contiene el suero de Coombs? b) ¿Qué se detecta con la prueba directa? c) ¿Qué podemos detectar con la prueba indirecta? d) ¿Que buscamos en la sangre del paciente? e) ¿Qué ocurre si el control es positivo? 2. Completar la siguiente tabla con los resultados obtenidos: Aglutinación Prueba indirecta Prueba directa 3. A la vista de los resultados, la sangre analizada es del grupo: □ Rh positivo □ Rh negativ PRÁCTICA N. 30: PRUEBA CRUZADA MAYOR FUNDAMENTO Se utiliza sobre todo en terapia transfusional, cuando se quiere saber si existen incompatibilidades entre donante y receptor. Consiste en enfrentar el suero del receptor con los hematíes del donante, primero en medio salino, posteriormente en medio albuminoso, y por último frente al suero antiglobulina de Coombs. Con este último paso detectaremos los anticuerpos que se hayan quedado fijados a la membrana eritrocitaria. Es importante respetar los tiempos de incubación para evitar posibles errores en la técnica. MATERIAL Tubos de hemólisis. Una pipeta Pasteur desechable. Gradillas para tubos. Una centrífuga. Un baño de agua. Un reloj. REACTIVOS Albúmina bovina al 30%. Suero antiglobulina humana de conejo (suero de Coombs). Solución salina fisiológica al 0,9%. MUESTRA Suero del receptor, obtenido de sangre coagulada y libre de hemólisis. Debe ser fresco (menos de 24 horas desde la extracción) y conservado a 4 ºC. Hematíes del donante, previamente lavados tres veces en solución salina fisiológica y resuspendidos en ella al 2-5%. TÉCNICA 1. En un tubo de hemólisis depositamos una gota de la suspensión de hematíes del donante y dos gotas del suero del receptor. 2. Mezclamos suavemente, y dejamos a temperatura ambiente durante 2-3 minutos. 3. Centrifugamos a 3.500 r.p.m. durante 30 segundos, y leemos el resultado en medio salino. 4. Añadimos al tubo 3 gotas de albúmina bovina al 30%. 5. Mezclamos bien e incubamos a 37 C durante 30 minutos. 6. Centrifugamos a 3.500 r.p.m. durante 30 segundos, y leemos el resultado en medio albuminoso. 7. Lavamos tres veces los hematíes con solución salina para eliminar los anticuerpos que no se han fijado a los eritrocitos. Se retira bien todo el sobrenadante del último lavado. 8. Añadimos al tubo una gota de suero de Coombs y se mezcla bien. 9. Centrifugamos a 1.000 r.p.m. durante 2 minutos y leemos los resultados. LECTURA DE RESULTADOS La lectura de los resultados se realiza resuspendiendo el botón hemático con suavidad después de cada una de las centrifugaciones. En caso de reacciones débiles positivas, conviene observar al microscopio entre porta y cubre con objetivo de 40 x. INTERPRETACIÓN CLÍNICA DE LOS RESULTADOS OBTENIDOS La ausencia de aglutinación en todos los pasos indica que las sangres son compatibles, y por tanto, la transfusión es posible. La aglutinación en cualquiera de las fases indica incompatibilidad. Si se observa hemólisis en cualquiera de los pasos, también es signo de incompatibilidad. En ocasiones es conveniente realizar esta prueba en medio enzimático. Dado que el empleo de enzimas como la bromelina o la papaína refuerza las reacciones antígeno-anticuerpo, esta prueba se usa para re- examinar a los receptores que han sufrido reacciones transfusionales. ACTIVIDADES 1. Responder brevemente a las siguientes cuestiones: a) ¿Qué se enfrenta en la prueba cruzada mayor? b) ¿Cuándo se debe realizar la prueba cruzada menor c) ¿Por qué debemos realizar la prueba en medio salino y albuminoideo? d) ¿Que pone de manifiesto el suero antiglobulina de Coombs? 2. Completar la siguiente tabla con los resultados obtenidos: Resultado Medio salino Medio albuminoideo Suero antiglobulina 3. A la vista de los resultados, las sangres analizadas son: □ Compatibles □ Incompatibles