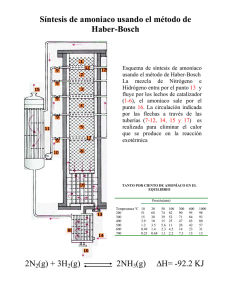
Monografía Producción de amoníaco verde a partir de glicerol subproducto de la industria de biodiesel
Anuncio

Producción de amoníaco verde a partir de glicerol subproducto de la industria de biodiesel MONOGRAFÍA Petroquímica II Autores: Arapa, Mauro Acuña Arthur, Matías Chiquiar, Elías Portal, Gabriel Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química 1. Objetivos ● Búsqueda de fuentes alternativas de materias primas para la producción de amoniaco verde. ● Analizar las reacciones involucradas en el proceso de síntesis y las condiciones operativas óptimas. ● Realizar el estudio de mercado del producto y de las materias primas. 2. Introducción La agroindustria argentina, fundamental para la economía y generadora de divisas, depende en gran medida de los fertilizantes nitrogenados, como la urea, para garantizar la producción eficiente de cultivos [1][2]. Sin embargo, la fabricación de estos fertilizantes, que utiliza amoníaco como insumo principal, enfrenta desafíos significativos debido a su dependencia del gas natural. La volatilidad de los precios de este recurso, impulsada por factores como la guerra entre Rusia y Ucrania, ha afectado la producción nacional, incrementando la importación de fertilizantes, que ya cubre el 60% de la demanda [3][4][5]. Además, la producción de amoníaco es altamente intensiva en energía y responsable de cerca del 2% de las emisiones globales de gases de efecto invernadero, contribuyendo al cambio climático [6]. Por ello, la necesidad de transitar hacia procesos más sostenibles ha impulsado el interés en fuentes alternativas, como el hidrógeno verde, para producir amoníaco verde. En este contexto, se plantea una propuesta poco convencional basada en el uso de glicerol crudo, un subproducto de la producción de biodiesel, como materia prima para obtener hidrógeno verde y, a partir de este, producir amoníaco verde. Esta opción no solo aprovecha un subproducto de la industria local del biodiesel, sino que también promueve la sostenibilidad ambiental y la independencia energética. El desarrollo del amoníaco verde representa una oportunidad estratégica para Argentina, permitiendo fortalecer su agroindustria y posicionarse en un mercado global emergente impulsado por políticas de descarbonización. Aunque actualmente es más costoso que el amoníaco convencional, su adopción contribuiría a la transición hacia una economía más circular y sostenible, con perspectivas de crecimiento y competitividad a largo plazo. 3. Procesos de síntesis de amoniaco El proceso Haber-Bosch es el método universalmente adoptado para fijar el nitrógeno atmosférico, en combinación con hidrógeno para la síntesis directa de amoniaco. A lo largo del tiempo se desarrollaron procesos que se diferencian en la forma de obtención del hidrógeno “Figura 3.1” y en las alternativas tecnológicas para llevar a cabo la síntesis con mayor eficiencia. Las tecnologías se basan en el uso de catalizadores, materiales y distintas configuraciones del proceso para controlar el equilibrio reduciendo la temperatura con el fin de abaratar costos sin comprometer la calidad del producto. En los procesos convencionales, el hidrógeno se obtiene como una mezcla de H2/CO conocida como “gas de síntesis”, el cual es tratado y luego purificado para dar hidrógeno de gran pureza y remover el gas ácido. En esta alternativa, el gas se obtiene por medio de tres vías tecnológicas: el reformado con vapor, la oxidación parcial y el reformado autotérmico. “Ver ANEXO 1”. Acuña, Arapa, Chiquiar, Portal 1 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química Figura 3.1: Rutas de producción de amoniaco. Fuente [7] Como podemos ver en la Figura 3.1, actualmente existen dos fuentes renovables para la obtención de hidrógeno verde: la biomasa y el agua. Para el procesado de biomasa existen diferentes alternativas como lo son los procesos biológicos entre los cuales se encuentra la biofotolisis, fotofermentación y la fermentación oscura [8] y los procesos térmicos entre los cuales se encuentra la gasificación de biomasa y reformado de con vapor de agua de compuestos derivados de la biomasa como bioetanol, glicerina y furfural [9]. En lo que respecta a la electrólisis del agua consiste en la ruptura del enlace entre los hidrógenos y el oxígeno gracias a la aplicación de voltaje y corriente continua al agua que provocan que estos se liberen en estado gaseoso tal y como se muestra a continuación: 1 𝐻2 𝑂 + 𝐸𝑛𝑒𝑟𝑔í𝑎 → 𝐻2 + 𝑂2 2 En este proceso, la energía eléctrica es esencial para que se lleven a cabo las reacciones químicas que provocan la rotura molecular del agua. Si la electricidad se genera mediante energías renovables como la eólica, solar, etc. [10] Dentro de estas alternativas para la producción de hidrogeno verde y su posterior conversión a amoniaco verde, como ya se mencionó, se empleará el reformado en fase vapor de materias primas provenientes de biomasa. Dentro de las materias primas disponibles provenientes de biomasa, el glicerol es una alternativa interesante debido a su alto contenido en H2, su no toxicidad, y sencillo manejo, almacenamiento y, en particular, a la gran disponibilidad que existe en Argentina, como consecuencia del desarrollo de la industria del biocombustible [11]. Además, en este contexto, al no haber aumentado la demanda de glicerina en la misma magnitud que su producción se ha generado un exceso que puede convertirse en un problema ambiental debido a que no puede depositarse en el ambiente sin haber sido antes tratada, ya que el glicerol crudo tiene un porcentaje de metanol que puede ser tóxico para los microorganismos presentes en el suelo y para el desarrollo de las plantas [12]. El análisis termodinámico y cinético del tratamiento de la materia prima, así como la selección del catalizador empleado se describe con detalle en el ANEXO 2. 3.1 Mercado nacional e internacional del amoniaco El amoníaco es un compuesto químico inorgánico compuesto de átomos de nitrógeno e hidrógeno, de fórmula química NH3. Actualmente, en torno a un 80 % del amoníaco que se produce en todo el mundo se utiliza como fuente de nitrógeno para fabricar fertilizantes, Acuña, Arapa, Chiquiar, Portal 2 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química mientras que el 20 % restante se emplea en distintas aplicaciones industriales, como la producción de plásticos, fibras, explosivos, hidracina, aminas, amidas, nitrilos y otros compuestos orgánicos de nitrógeno que sirven de productos intermedios en la fabricación de tintes y productos farmacéuticos [6]. 3.1.1 Contexto internacional En 2022 el amoníaco fue el producto número 250 más comercializado del mundo con un tamaño en el mercado mundial de 17.000 millones de dólares al año. La capacidad mundial de producción de amoniaco anhidro en el periodo 2018 - 2022 fue alrededor de 187 millones de toneladas según la FAO [13]. Cerca del 80% del amoníaco se utiliza en la producción de fertilizantes para el sector agrícola, en donde además de consumir el amoníaco de manera directa, este se usa principalmente para sintetizar urea. Dada la importancia del amoníaco para la industria de la urea, los niveles de producción de ambos productos están fuertemente relacionados (Figura 3.2). Figura 3.2: Producción mundial de amoníaco y urea - Periodo 2009 - 2020. Fuente [6] De esta manera, la creciente demanda de fertilizantes es uno de los principales factores que impulsa el incremento en los niveles productivos de las industrias productoras de amoníaco. 3.1.2 Contexto nacional Los principales productores de amoníaco a nivel nacional (Tabla 3.1) destinan el 95% de la producción de amoniaco a la producción de Urea y el 5% restante a otros fines, como refrigerantes y en la industria química. Tabla 3.1: Principales productos de amoníaco en Argentina Productor Localización Capacidad instalada Proceso (ton/año al 31/12/22) Materias primas Austin Powder El Galpón 60.000* Argentina S.A. (Salta) Girdler Corp. Gas Natural Bunge Argentina S.A. Campana (Bs.As.) 29.700 N-Ren Gas Natural Profertil S.A Bahía Blanca 790.000 (Bs.AS.) Haldor Topsoe Gas Natural *Puesta en marcha en Junio de 2021 Fuente: elaboración propia a partir de [14] El consumo nacional, las tendencias del mercado y una proyección de la demanda nacional se encuentran disponibles en el ANEXO 3, de donde se concluye que los datos proyectados indican que a partir del tercer año del proyecto, existe una demanda no cubierta Acuña, Arapa, Chiquiar, Portal 3 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química por la capacidad productiva instalada (880000 ton/año, aproximadamente). Esto implica que hay un pequeño mercado que puede ser cubierto en el país de unas 140000 ton/año hasta 2034. Por otro lado, en Chile la totalidad del amoniaco que se utiliza es importado. En 2023 este país importó amoniaco por un valor CIF cercano a 182.938 millones de dólares siendo el principal exportador a este país EE.UU. y el segundo Trinidad y Tobago. Argentina representa sólo un 0,03% de este total [15], debido a esto se busca cubrir parte de esta demanda y ganar competitividad en el mercado chileno a futuro, así como también abastecer al mercado argentino cuando la capacidad productiva de las plantas actuales no permite cubrir la demanda interna de amoniaco. 3.2 Mercado de la materia prima 3.2.1 Glicerol El glicerol es un compuesto químico obtenido principalmente como subproducto de la producción de biodiesel a partir de aceites vegetales, principalmente de soja. Aproximadamente se genera un 10% p/p de glicerol respecto al producto total. Al estar tan ligado a este biocombustible, el breve análisis se hará respecto al biodiesel. Acompañado de políticas que buscan el desarrollo de una industria más sustentable, la producción de biodiesel ha incrementado en los últimos años, siendo los principales productores la Unión Europea, Estados Unidos, Indonesia y Brasil, quienes abarcan casi el 80% de la producción mundial. A nivel nacional, los principales productores históricos son Bioenergy SA, AGD Bioenergy y Biogas SA. La mayoría de las industrias tienen sus plantas principalmente en las provincias de Santa Fe y Buenos Aires. La producción de biodiesel ha disminuido durante el último lustro, lo cual se indica en las tablas y figuras del ANEXO 4, principalmente debido a la pandemia, políticas nacionales y la reciente sequía que afectó a los cultivos de soja. El costo de la sequía 2022/23 ya asciende a más de US$ 14.140 millones para los productores de soja, trigo y maíz. A pesar de este escenario desalentador, se tienen perspectivas positivas a futuro. El incremento del campo cultivado de soja, la presentación de un proyecto de ley que busca el incremento del corte del gasoil y/o diésel con biodiesel, la estabilización del precio del biocombustible y ciertas políticas internacionales generan una perspectiva positiva respecto al futuro de la industria del biodiesel y, en conjunto, del glicerol y su disponibilidad [16][17]. A pesar de que si se realizara un pronóstico lineal de la producción de biodiesel se obtendría un decaimiento del biocombustible, las razones mencionadas asientan un futuro prometedor para la disponibilidad del glicerol. 3.3 Análisis termodinámico La síntesis de amoníaco está dada por la siguiente reacción: 𝑁2 (𝑔) + 3𝐻2 (𝑔) ↔ 2𝑁𝐻3 (𝑔) 𝛥𝐻 = −46,2 kJ/mol A partir de la reacción, se puede deducir a través del principio de Le`Chatelier que la reacción se verá favorecida a bajas temperaturas, debido a su exotermicidad, y a altas presiones, como consecuencia de un mayor número de moles en los reactivos. Sin embargo, esto afectará a la interacción entre las moléculas de los reactivos de tal manera que será necesario tener que hacer un análisis más riguroso sobre los efectos de la temperatura y presión. 3.3.1 Efecto de la temperatura El perfil de temperatura de reacción es de particular importancia debido a que la velocidad de reacción responde a los cambios de temperatura: cuando se trata de una reacción endotérmica la velocidad de reacción aumenta monótonamente con la temperatura, mientras que para una reacción exotérmica (como lo es la síntesis de amoniaco), para cada valor del grado de avance existe una temperatura donde la velocidad de reacción es máxima [18]. Acuña, Arapa, Chiquiar, Portal 4 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química La curva indicada en la Figura 3.3 muestra la dependencia de las curvas de velocidad con la temperatura y la concentración de amoniaco. La curva de velocidad nula AB corresponde a la velocidad de reacción una vez que se ha alcanzado el equilibrio, mientras que la curva CD representa el lugar geométrico de temperatura-concentración de máxima velocidad de reacción o progresión óptima de temperatura. Figura 3.3: Efecto de la temperatura y concentración de amoniaco en la velocidad de reacción. Fuente [19] Hay que tener presente que cuando se trata de reacciones exotérmicas reversibles, como la de síntesis de amoníaco, hay dos factores en oposición: cuando se eleva la temperatura aumenta la velocidad de la reacción directa, pero disminuye la conversión máxima. En consecuencia, cuando el sistema está lejos del equilibrio resulta ventajoso emplear una temperatura elevada para la cual la velocidad es alta; cuando se han alcanzado condiciones próximas a las del equilibrio la temperatura debe ser más baja para que se desplace el equilibrio hacia valores más favorables de la conversión. Por lo tanto, en general, para las reacciones exotérmicas reversibles la progresión óptima de temperatura (progresión que hace mínimo el valor de V/Fao para una determinada conversión de reactante) corresponde a una variación de temperatura, empezando por una temperatura alta que va disminuyendo al aumentar la conversión. En la figura 3.5 se puede observar que si se plantea el diseño en condiciones isotermas, no se podría asegurar unas condiciones óptimas de operación, ya que si se trabaja a temperaturas elevadas el equilibrio condiciona el proceso a obtener conversiones muy bajas. Por el contrario, si se trabaja a temperaturas bajas, el proceso está favorecido termodinámicamente, pero, en cambio, la reacción ocurre de manera tan lenta que no se apreciaría formación de amoniaco en tiempos razonables y sería necesaria una gran cantidad de catalizador. De esta manera, trabajar dentro de la zona de máxima velocidad de reacción o progresión optima de temperatura, se logra con una cascada de reactores operando adiabáticamente con enfriamiento entre los diferentes lechos describiendo un perfil de reacción en forma de zig-zag alrededor de la curva de máxima velocidad de reacción [19]. 3.3.2 Efecto de la presión Como consecuencia de una mayor cantidad de moles gaseosos en los reactivos que en los productos, resulta lógico que incrementar la presión del sistema favorecerá la producción de amoníaco (Figura 3.4). Sin embargo, esto implica condiciones más severas de operación, lo cual lleva a reactores de mayor complejidad. Acuña, Arapa, Chiquiar, Portal 5 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química Figura 3.4: Efecto de la presión y temperatura en la síntesis de amoniaco. Fuente [20] En la actualidad, los reactores pueden trabajar a presiones tan altas entre 15 a 25 MPa para poder alcanzar las conversiones deseadas. Por lo tanto, a la hora de diseñar un reactor, resulta crucial determinar la presión de operación óptima que asegure la capacidad de producción planteada, así como también una operación segura del mismo. 3.4 Análisis cinético En 1940 Temkin y Pyzhev desarrollaron una ecuación de velocidad de reacción la cual ofrece una aproximación satisfactoria para la síntesis de amoníaco sobre un catalizador de hierro [20]. 𝛼 1−𝛼 2 𝑝𝑁𝐻 𝑝𝐻32 3 𝑟 = 𝑘1 𝑝𝑁2 [ 2 ] − 𝑘−1 [ 3 ] 𝑝𝑁𝐻3 𝑝𝐻2 Donde las expresiones de 𝑘1 y 𝑘−1 son: −𝐸 −𝐸 𝑘1 = 𝑘1𝑜 × [ 1 ] 𝑘−1 = 𝑘−1𝑜 × [ 2 ] 𝑅×𝑇 𝑅×𝑇 Los valores de cada parámetro son los siguientes: Tabla 3.2: Parámetros cinéticos Directa 𝑘𝑚𝑜𝑙 𝑘1𝑜 [ 3 ] 𝑚𝑐𝑎𝑡 × 𝑏𝑎𝑟 1,5 × ℎ 17900 Inversa 𝐸2 [ 𝑘𝑐𝑎𝑙 ] 𝑘𝑚𝑜𝑙 20815 𝑘𝑚𝑜𝑙 × 𝑏𝑎𝑟 0,5 𝑘−1𝑜 [ ] 3 𝑚𝑐𝑎𝑡 ×ℎ 2,57 x 1016 𝐸2 [ 𝑘𝑐𝑎𝑙 ] 𝑘𝑚𝑜𝑙 47434 Fuente: Elaboración propia a partir de [20] Como es usual para las reacciones exotérmicas, el incremento de la temperatura favorecerá el avance de la reacción a los productos, hasta un máximo a partir del cual favorecerá la reacción inversa. Su correlación con la termodinámica se explicó en la sección 3.3.1. 3.4.1 Catalizadores para la síntesis Como se mencionó, la naturaleza de la reacción impediría trabajar a bajas temperaturas, ya que cinéticamente desfavorece la velocidad de reacción disminuyendo la posibilidad de colisión entre las moléculas. Sin embargo, con las ayudas de los catalizadores, se pueden operar a condiciones tales que favorezcan ambos factores, cinético y termodinámico. Por lo tanto, el catalizador más efectivo será aquel que de una velocidad razonable de la conversión a la temperatura más baja posible. En la industria actual existe una gran variedad de catalizadores de diversos materiales, cada uno con sus correspondientes condiciones de operación óptimos (Tabla 3.3) Tabla 3.3: Catalizadores para la síntesis de amoniaco Catalizadores Características Condiciones de operación Hierro Eficientes. Económicos. Promotores: Al2O3, P: 150 - 200 atm Acuña, Arapa, Chiquiar, Portal 6 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica K2O. Ingeniería Química T: 400 - 500 °C Rutenio Mayor actividad catalítica y estabilidad. Costo P: 50 - 100 atm alto. Soportado en carbón activado o alúmina. T: 500 - 600 °C Óxido de Zinc Promotor en combinación con catalizadores, principalmente de hierro. Mejora la actividad y estabilidad. otros P: 150 - 200 atm T: 400 - 500 °C Óxido de Manganeso Promotor para mejorar la actividad y estabilidad P: 150 - 200 atm térmica. T: 400 - 500 °C De los mencionados, los más comunes industrialmente son los de hierro, debido principalmente a su eficiencia y su bajo costo, además de una gran diversidad de este mismo en el mercado. Es por ello que se utilizará este tipo de catalizador para este proyecto. Sin embargo, es importante destacar que constantemente se realizan investigaciones sobre nuevos catalizadores que permitan operar a temperatura y presiones más bajas, de tal manera que se abaraten los costos y se minimice la huella de carbono. Por ejemplo, algunos avances muestran que la combinación de partículas de hierro con BaH2 permitirían operar a temperaturas cercanas a 100°C [21]. Además, la empresa Copernic Catalyst está invirtiendo millones de dólares en el escalamiento de un nuevo tipo de catalizador que permitiría trabajar a menores presiones y temperaturas. 3.5 Reactores industriales 3.5.1 Selección del tipo de reactor Las reacciones gas-sólido se pueden llevar a cabo en reactores de lecho fijo o reactores de lecho fluidizado. Los reactores de lecho fijo son los reactores más empleados en la industria, especialmente para llevar a cabo reacciones catalíticas. El flujo de este tipo de reactores se puede aproximar por un reactor de flujo en pistón, por lo que se consiguen buenas eficacias de contacto. Además, presenta mayor conversión por peso de catalizador frente a otro tipo de reactores catalíticos. Como desventajas presenta la formación de puntos calientes en el reactor debido a que la transmisión de calor es menor que en los reactores de lecho fluidizado. En su contraparte, en el caso de los reactores de lecho fluidizado, el lecho de partículas catalíticas se encuentra suspendido a lo largo del reactor por el propio gas, lo cual requiere velocidades elevadas para poder fluidizar el sólido. Sin embargo, este tipo de reactor no es conveniente, ya que el patrón de flujo difiere del reactor de flujo en pistón, lo cual conlleva a aumentar la cantidad de catalizador para aumentar el contacto entre gas y sólido. Otros inconvenientes son: un mayor volumen de recipiente frente al lecho fijo, mayores requisitos de bombeo, arrastre de partículas de catalizador como consecuencia de las altas velocidades, la erosión de los componentes internos del reactor y la dificultad del modelo de flujo. Dado que el catalizador que se emplea para la síntesis de amoníaco posee una larga vida de operación, de en torno a 10-15 años, y el reactor de lecho fijo es más fácil de modelizar, más económico tanto en la construcción como en la operación y requiere menor cantidad de catalizador, este ha sido el reactor escogido. Además, la síntesis de amoníaco en reactores de lecho fijo es uno de los procesos más común e importante en la industria química [22]. 3.5.2 Disposición del flujo El flujo que entra al lecho de catalizador puede ser axial, radial o una combinación de ambos. En un reactor de flujo axial, la alimentación ingresa por un extremo del reactor, fluye a través del lecho de catalizador paralelamente al eje del reactor y sale por el otro extremo. De esta forma, la conversión aumenta con el avance del gas a través de la longitud del reactor. Acuña, Arapa, Chiquiar, Portal 7 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química En un reactor de flujo radial, la alimentación se distribuye a lo largo de la longitud del reactor y fluye en la dirección radial a través del lecho del catalizador contenido entre dos paredes concéntricas perforadas, comúnmente denominadas canasta del catalizador. Por encima de cierto tamaño de planta, los reactores de flujo axial individuales se vuelven demasiado grandes y se hacen necesarios múltiples reactores en paralelo. Por el contrario, un reactor de flujo radial se puede ampliar aumentando la longitud en lugar del diámetro. Además, por cómo circula el flujo en un reactor radial la conversión varía de forma radial y su caída de presión a lo largo del lecho catalítico es mucho menor que la de un lecho catalítico de flujo axial. Esto supone reducir el consumo de energía en torno a un 30%. Otro patrón de flujo empleado en la síntesis de amoníaco es el axial-radial desarrollado por Ammonia Casale. Este diseño permite que aproximadamente el 90 % del gas de alimentación pase a través del lecho del catalizador en dirección radial y el resto pase hacia abajo a través de una capa superior del catalizador en dirección axial [23]. Las diferentes disposiciones de flujo se indican en la Figura 3.5. Figura 3.5: Disposiciones de flujo. a) Flujo axial, b) Flujo radial, c) Flujo radialaxial 3.5.4 Configuración de los lechos En la producción de amoníaco mediante reactores adiabáticos, existen dos estrategias principales para controlar la temperatura del proceso: uso de intercambiadores de calor entre etapas e inyección de alimento frio. El uso de intercambiadores de calor entre etapas ofrece un control preciso de la temperatura, permitiendo ajustar de manera controlada las condiciones del gas de síntesis entre cada etapa del reactor, lo que optimiza las condiciones de reacción. Además, este enfoque asegura una mayor conversión por etapa al mantener temperaturas óptimas, logrando una conversión más eficiente del gas de síntesis a amoníaco. Sin embargo, tiene desventajas como los elevados costos de inversión y mantenimiento debido a la instalación y el mantenimiento de los intercambiadores, lo que incrementa los costos operativos y de capital. Asimismo, la integración de estos intercambiadores implica un diseño más complejo y una operación más sofisticada. Por otro lado, la inyección de alimento frío se caracteriza por una reducción de costos, ya que elimina la necesidad de intercambiadores de calor, disminuyendo los costos de inversión y mantenimiento. También destaca por la simplicidad en el diseño, lo que facilita tanto la operación como el control del sistema. No obstante, presenta desventajas como una menor eficiencia térmica, ya que la inyección de gas frío puede ocasionar fluctuaciones de temperatura que afectan la eficiencia de la reacción. Además, la conversión lograda mediante este método puede ser ligeramente inferior en comparación con la obtenida con el uso de intercambiadores de calor. Además, es importante destacar que este tipo de refrigeración sólo se puede realizar cuando la temperatura de la alimentación sea muy inferior a la temperatura de reacción y, además, cuando la temperatura no varíe mucho durante la reacción [19]. Estas condiciones Acuña, Arapa, Chiquiar, Portal 8 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química podemos resumirlas del siguiente modo: se puede efectuar la refrigeración por inyección de la alimentación fría cuando: 𝐶𝑝 𝑇𝑟𝑒𝑎𝑐𝑐𝑖ó𝑛 − 𝑇𝑎𝑙𝑖𝑚𝑒𝑛𝑡𝑎𝑐𝑖ó𝑛 > −𝛥𝐻𝑟 Finalmente, a la hora de selección el sistema de contacto, se debe tener presente que el costo en la síntesis de amoniaco depende en gran medida de la masa de catalizador empleado, que la disponibilidad de materia prima es acotada, que se desean alcanzar elevadas conversiones y trabajar dentro de la zona de progresión óptima de temperatura (zona de máxima velocidades de reacción para disminuir el uso de catalizador). Debido a que se selecciona emplear intercambiadores de calor para realizar el enfriamiento entre etapas ya que, a pesar de que esta alternativa redunda en un mayor costo de inversión y operación, es la que mejor permite controlar la temperatura y por ende, nos permitirá trabajar dentro de la zona de máxima velocidad disminuyendo así el consumo de catalizador. 3.5.5 Materiales empleados La selección de materiales para los ciclos de síntesis de amoníaco es un aspecto crucial, dado que los equipos operan en condiciones extremas de temperatura, presión y en presencia de gases corrosivos. Los fenómenos de corrosión más relevantes incluyen el ataque por hidrógeno, la nitruración y la corrosión bajo tensión entre otros. En el ANEXO 5, se realiza un estudio exhaustivo de los fenómenos de correón más comunes y condiciones contractivas para su prevención o mitigación. Finalmente, la elección de materiales depende de la ubicación y función del equipo dentro del ciclo de síntesis. Por lo tanto, los materiales seleccionados para la construcción de los reactores del ciclo de síntesis de amoniaco son los siguientes [24][25]: Aceros de baja aleación: se emplea para la construcción de la carcasa de presión del convertidor y equipos expuestos a condiciones moderadas de presión y temperatura, por ejemplo, el 2 1/2 Cr 1/2 Mo. Acero inoxidable: Se emplea para la fabricación de las partes críticas que son los componentes internos del reactor, como la "canasta", que requieren alta resistencia a la corrosión y estabilidad térmica. Generalmente se fabrican de SS304. Inconel e Incoloy: Se emplean para fabricar la entrada de la caldera de recuperación de calor residual, debido a su excelente resistencia a la corrosión y altas temperaturas. 4. Conclusión En primer lugar, se identificó al glicerol, un subproducto del biodiésel, como una materia prima alternativa prometedora. Esta elección permite valorizar un residuo industrial ampliamente disponible en Argentina, disminuyendo la dependencia de insumos convencionales como el Gas Natural y reduciendo la huella de carbono asociada al proceso. El diagrama de flujo del proceso productivo empleando esta materia prima y con todos los criterios adoptados para la síntesis de amoniaco que se detallaron previamente se encuentra disponible en el ANEXO 6. El análisis de las reacciones químicas y las condiciones operativas para la síntesis de amoníaco demostró la importancia del control térmico de la reacción mediante un sistema de enfriamiento. La selección de catalizadores de hierro, junto con el diseño robusto de reactores de lecho fijo, garantiza un desempeño técnico confiable y eficiente. En cuanto al mercado, el estudio resalta la oportunidad de exportar amoníaco verde a mercados como el chileno, donde existe una dependencia total de las importaciones. Esto representa un nicho estratégico para la producción argentina, permitiendo posicionarse como un proveedor clave en la región. Adicionalmente, el excedente de producción puede ser Acuña, Arapa, Chiquiar, Portal 9 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química utilizado para suplir la demanda interna no cubierta en los posteriores años de implementación del proyecto, incrementando la autosuficiencia nacional y fortaleciendo la balanza comercial. En conclusión, este trabajo aborda con éxito los objetivos planteados, integrando innovación técnica y análisis de mercado para desarrollar un modelo de producción sostenible y competitivo. La propuesta no solo responde a los desafíos actuales del sector químico, sino que también posiciona a Argentina como un referente en la exportación de productos descarbonizados, contribuyendo a la transición hacia una economía más limpia y resiliente. 5. Bibliografía [1] Calzada, J., Treboux, J. (2019) Importancia económica del sector agropecuario y agroindustrial en la República Argentina. Bolsa de Comercio de Rosario. [2] Calzada, J., D’Angelo, G. (2021) Fertilizantes: panorama y oportunidades para la Argentina. Bolsa de Comercio de Rosario. [3] Instituto Nacional de Estadísticas y Censo. (2023). Estadísticas de Productos Industriales. Marzo 2023. https://www.indec.gob.ar/indec/web/Nivel4-Tema-3-6-18 [4] Uçak H., Arı Y., Yelgen E. (2022). La conexión de la volatilidad entre los fertilizantes y los precios de los cultivos agrícolas: evidencia de los principales productos agrícolas seleccionados. [5] Barrera, F., Hauser, P., Carlino, H., Carlino, M., Caratori, L. (2023). Argentina como centro de producción de amoníaco verde. Una estrategia de desarrollo novedosa para abordar las crisis energética y climática globales. Agora, Industry. [6] Vásquez, R., Tello, P., Lambert, M.J., Hermosilla F., R. (2022). Industria del Amoníaco: estado actual y oportunidades para la descarbonización. Programa de Energías Renovables y Eficiencia Energética en Chile. [7] Gutiérrez, Fernández, P. (2024). Análisis del ciclo de vida prospectivo a la producción de amoniaco verde. [8] Doménech Martínez, M. (2020). Tecnologías de Producción de Hidrógeno basadas en Métodos Biológicos. Ministerio de Ciencia e Innovación. Gobierno de España. Centro de Investigaciones Energéticas, Medioambientales y Tecnológicas (Ciemat). [9] Chica, A., Fernández6, A., Grasa, G. (2022). Tecnologías del Hidrógeno. [10] Morante, J. Andreu, T. Garcia, G., Guilera, J., Terancón, A., Torrel, M. (2020). Hidrógeno. Vector energético de una económica descarbonizada. Fundación Naturgy. [11] Jimenez P., Mariza N., Huarcaya B., Alexandra M., Gómez Jiménez, Lesly R. (2022). Hidrógeno verde, una alternativa a los combustibles fósiles. Universidad Nacional de Ingenieria, Lima, Peru. [12] Aguilar B., C., De Mello Prado, R., Gonzales C., L. y Silva C., Cid N. (2016). Características de la glicerina generada en la producción de biodiesel, aplicaciones generales y su uso en el suelo. Instituto Nacional de Ciencias Agrícolas. [13] Mordor Intelligence Research & Advisory. (2023). Análisis del tamaño y la participación del mercado de amoníaco, tendencias y pronósticos de crecimiento (2023 - 2028). Disponible en: https://www.mordorintelligence.com/es/industry-reports/ammonia-market [14] Instituto Petroquímico Argentino. (2022). Información estadística de la industria petroquímica y química argentina. 43° Edición. [15] Banco Central. Indicadores de comercio exterior. Disponible en: https://www.bcentral.cl/en/buscador?categoria=Publicaciones/Estad%C3%ADsticas/Comerci o%20exterior/Indicadores%20de%20Comercio%20Exterior [16] Rozadilla, B., Ferrai, B., Terré, E. (2024). En el primer semestre de 2024, la producción de biodiesel continúa en bajos niveles respecto a sus máximos históricos. Bolsa de comercio de Rosario. https://www.bcr.com.ar/es/mercados/investigacion-ydesarrollo/informativo-semanal/noticias-informativo-semanal/en-el-primer-9 Acuña, Arapa, Chiquiar, Portal 10 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química [17] Bolsa de Comercio de Córdoba. (2024). Caracterización de la producción de biodiesel en Argentina. https://www.bccba.org.ar/informes/caracterizacion-de-la-produccionde-biodiesel-en-argentina/ [18] Farina I., Ferreti, O. Barreto. (1986). Introducción al Diseño de los Reactores Químicos. EUDEBA. Buenos Aires. [19] Levenspiel, O. (1986). Ingeniera de las Reacciones Química. 2° Edición. Editorial Reverte. Barcelona, España. [20] Mauricio Rebolledo Navarro. (2008). Estudio de prefactibilidad técnico y económica de una planta de amoníaco. Universidad Católica de Valparaíso. [21] Hattori, M., Okuyama, N., Kurosawa, H., & Hara, M. (2023). Low-temperature ammonia synthesis on iron catalyst with an electron donor. Journal of the American Chemical Society, 145(14), 7888-7897. https://doi.org/10.1021/jacs.2c13015. [22] Martínez L., Guillermo. (2022). Diseño de una planta de producción de amoniaco verde a microescala. [23] Fritz U., Wolfgang Gerhartz, Y. Stephen Yamamoto, F. Thomas Campbell, Rudolf Pfefferkorn, James F. Rounsaville. (s.f). Radial-Flow Packed-Bed Reactors. [24] Appl, M. (1999). Ammonia: Principles and Industrial Practice. Wiley-VCH. Weinheim. [25] Christiansen, L. J. (1995). Ammonia: Catalysis and Manufacture. Springer. Nueva York. [26] Buffoni, I. (2018). Estudio de sistemas catalíticos aplicados a la producción de hidrógeno a partir de glicerol. [27] C. Wang. (2013). Hydrogen production from steam reforming of glycerol by Ni-Mg-Al based catalysts in a fixed-bed reactor, Chem. Eng. J., vol. 220, pp. 133–142, 2013, doi: 10.1016/j.cej.2013.01.050. [28] Milla, M. E. (2021). Simulación de un reactor de reformado con vapor de glicerol para alimentar una pila de combustible tipo PEM. Acuña, Arapa, Chiquiar, Portal 11 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química ANEXO 1 1. Proceso convencionales para la producción de hidrogeno 1.1 Oxidación parcial La oxidación parcial es uno de los métodos convencionales para la obtención de hidrógeno. Consiste en hacer reaccionar el hidrocarburo en un horno en presencia de oxígeno y vapor de agua como catalizador de la reacción para obtener el gas de síntesis. Entre sus ventajas se encuentran que puede utilizarse cualquier tipo de hidrocarburo en este proceso, se logra una conversión total de la alimentación y no necesita aportes externos de calor al tratarse de una reacción exotérmica. Sin embargo, este proceso necesita un estricto control del oxígeno, una planta de fraccionamiento de aire en el caso de que se necesite hidrógeno puro y se debe añadir una unidad de separación de coque. Este método de obtención de hidrogeno se utiliza cuando la materia prima principal son HC más pesados porque frente a la disponibilidad de Gas Natural resulta más económico el reformado con vapor. Un diagrama de flujo esquemático del proceso se muestra en la Figura 1.1. Figura 1.1: Proceso de oxidación parcial de Gas Natural 1.1 Reformado con vapor El reformado con vapor es el proceso utilizado preferentemente cuando se dispone de HC livianos como gas natural. Este método permite convertir el metano con ayuda del vapor de agua, en gas de síntesis a un costo más económico. Necesita de un aporte externo de energía y la conversión no es completa, por ello se suele agregar un reformador secundario con catalizador de níquel en el que se agrega aire u oxígeno para convertir todo del metano residual funcionado de forma muy parecida a un reformado autotérmico. Un diagrama de flujo esquemático del proceso se muestra en la Figura 1.2. Acuña, Arapa, Chiquiar, Portal 12 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química Figura 1.1: Proceso de reformado con vapor de Gas Natural Acuña, Arapa, Chiquiar, Portal 13 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química ANEXO 2 2.1 Reformado en fase vapor de glicerol El proceso de reformado con agua en fase vapor (Steam Reforming, SR) es el proceso más reportado para convertir glicerol en hidrógeno y/o gas de síntesis. En este proceso el glicerol reacciona con vapor en presencia de un catalizador. El reformado con agua en fase vapor es un proceso endotérmico, donde la energía necesaria para este proceso es usada en la ruptura de los enlaces C-C y C-H en la molécula del glicerol. Este proceso, al igual que el reformado de Gas Natural, comprende un complejo grupo de reacciones que involucran la producción de productos intermedios que afectan la producción y pureza del H2. Antes de realizar el análisis termodinámico es importante mencionar que el glicerol crudo debe someterse a un pretratamiento antes de ser reformado, ya que este contiene impurezas propias del proceso de producción de biodiesel como lo son sales y aceites no reaccionados. Este pretratamiento consiste en el calentamiento de la corriente de glicerol crudo hasta 80°C para favorecer su separación posterior en un separador trifásico que emplea la diferencia de densidades y la fuerza centrífuga para lograr la separación. Posteriormente, luego se removidas las sales y aceites residuales, la corriente contendrá aproximadamente un 87% de glicerol, 11% de agua y 2,4% de metanol, corriente que será sometida al proceso de reformado con vapor en un reformador primario. 2.1.1 Análisis termodinámico De acuerdo con la literatura, el sistema puede describirse mediante el siguiente conjunto de reacciones: Reformado con vapor de glicerol (suma de la reacción de descomposición de glicerol y 3 veces la reacción de desplazamiento agua-gas, más conocida como reacción wáter-gas shift): 𝐶3 𝐻8 03 + 3𝐻2 𝑂 → 3𝐶𝑂2 + 7𝐻2 Descomposición del glicerol: 𝐶3 𝐻8 03 → 3𝐶𝑂 + 4𝐻2 Reacción Water-Gas Shift: 𝐶𝑂 + 𝐻2 𝑂 ↔ 𝐶𝑂2 + 𝐻2 Reacción de metanación: 𝐶𝑂 + 3𝐻2 ↔ 𝐶𝐻4 + 𝐻2 𝑂 El análisis termodinámico del proceso de reformado con vapor de glicerol ha sido estudiado con mucho detalle por diferentes grupos de investigación dentro del rango de temperatura comprendido entre los 300 y 750 °C aproximadamente, para presiones comprendidas entre 1 a 9 atmosferas y relaciones vapor/carbono variadas. La formación de los productos (H2, CH4, CO, CO2 y C) es afectada por la variación de la temperatura, de la relación molar S/C y de la presión del sistema. Formación de hidrógeno: La producción de hidrógeno aumenta con el aumento de la temperatura y de la relación S/C y con la disminución de la presión. El máximo número de moles de H2 por mol de glicerol obtenidos fue 6 para la relación S/C=3, presión atmosférica y 687ºC, siendo el valor estequiométrico 7 moles de H2 por mol de glicerol. Para temperaturas superiores la producción de H2 disminuye y para relaciones S/C menores, el máximo en la producción de H2 se desplaza a mayores temperaturas. Formación de metano: El metano es un producto indeseable porque compite con la Acuña, Arapa, Chiquiar, Portal 14 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química producción de H2. Tanto el aumento en el contenido de agua como el aumento de la temperatura son favorables termodinámicamente para inhibir la formación CH4, la cual queda inhibida para las relaciones S/C=3 y S/C=2 a temperaturas mayores de 650 ºC. El aumento de la temperatura inhibe la formación de metano debido a que la reacción de metanación es exotérmica, y en consecuencia, con el aumento de la temperatura se favorece la reacción inversa a la metanación resultando en la disminución de la producción de CH4 en el equilibrio. Por el contrario, el aumento en la presión favorece la formación de CH4. Formación de monóxido y dióxido de carbono: Con el aumento en la temperatura y en la concentración de glicerol, la producción de monóxido de carbono aumenta. Esto se debe a que el aumento de temperatura favorece la reacción inversa de water-gas-shift, la cual conduce al incremento de la concentración de CO en los productos. Además, como se dijo previamente, también se ve favorecida la reacción inversa de la metanación la cual también contribuye al incremento de la producción de CO. Durante la reacción de reformado, los moles de CO2 aumentan con el incremento de la temperatura y alcanzan su valor máximo a los 577ºC para una relación S/C=3, y luego disminuyen a temperaturas mayores. Formación de carbono: La consideración de la formación de carbono en el modelo termodinámico afecta la composición del equilibrio. La producción de hidrógeno es mayor mientras que las producciones de metano, monóxido y dióxido de carbono disminuyen. Son numerosas las reacciones de formación de carbono que pueden ocurrir en el reactor, pero por encima de los 700ºC no hay formación de carbono para todo el rango de relaciones S/C. Por lo tanto, a partir del estudio termodinámico se puede observar que las mejores condiciones para la producción de H2 son exceso de agua, relaciones S/C mayores a 3, temperatura elevada mayor a 700 °C y presión atmosférica. En estas condiciones se minimiza la producción de metano y se inhibe la formación de carbono [26][27]. En las Figuras 2.1, se observa cómo se comporta la conversión y la distribución de productos con el incremento de temperatura. Figura 2.1: Variación de la conversión de equilibrio y distribución de productos con la temperatura. Fuente: [27] Acuña, Arapa, Chiquiar, Portal 15 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química 2.1.2 Cinética de reacción El modelo Ley de Potencia fue investigado por Yei Foo y colab, empleando catalizadores monometálicos de Co/γ-Al2O3 y Ni/γ-Al2O3 y un catalizador bimetálico de CoNi/γ-Al2O3, en el rango de temperaturas entre 500 y 550ºC y presión atmosférica. De acuerdo a los datos experimentales, la velocidad de consumo de glicerol aumenta con la presión parcial del glicerol y del vapor, en consecuencia, la velocidad de consumo del glicerol puede representarse con la siguiente expresión: −𝑟𝑆𝑅𝐺 = 𝑘𝑃𝐺𝑙𝑖𝑐𝑒𝑟𝑜𝑙 𝛼 𝑃𝑣𝑎𝑝𝑜𝑟 𝛽 Donde -rSRG es la velocidad del reformado con vapor del glicerol, k es la constante de velocidad del reformado, Pglicerol y Pvapor son las presiones parciales de los reactivos y α y β son los correspondientes órdenes de reacción. Las velocidades de formación de H2, CO, CO2 y CH4 también pueden ajustarse con una expresión de ley de potencia similar. La variación de la constante de la velocidad con la temperatura se puede escribir de acuerdo a una expresión tipo Arrhenius [26][27]. −𝐸𝑎 𝑘 = 𝐴𝑒 𝑅𝑇 En la Tabla 2.1 podemos ver los órdenes de reacción para diferentes catalizadores, la energía de activación, el factor pre exponencial (en este caso ko) para diferentes estudios realizados sobre diversos catalizadores. Tabla 2.1: Recopilación de datos cinéticos Fuente: [28] 2.1.3 Catalizadores de reformado Durante la última década se han realizado diversos estudios sobre catalizadores que permitan favorecer el reformado. De los trabajos que se han llevado a cabo con diferentes metales como fase activa, se deduce que el Ni no es siempre el más activo de los metales, sin embargo, los resultados que se alcanzan son muy satisfactorios. Por otro lado, los sistemas catalíticos basados en Ni tienen la ventaja de ser más económicos que los sistemas basados en metales nobles. Las propiedades de los soportes también son importantes, no solo de cara a la resistencia mecánica, sino de cara a la efectividad del catalizador. Estas afectarán a la morfología, reactividad y estabilidad del catalizador. Un soporte muy utilizado es la alfa alúmina, por su resistencia mecánica y química bajo las condiciones de reformado. Además, por su carácter ácido promueve la disociación de las moléculas de agua, favoreciendo su reacción con el glicerol. Sin embargo, los soportes ácidos, también tienden a promover la deshidratación del glicerol, formando hidrocarburos insaturados, como el etileno, que son precursores de coque. Según la bibliografía y estudios consultados, de todos los promotores empleados para mejorar las características del soporte, el La2O3 ha proporcionado muy buenos resultados en el reformado de glicerol con vapor de agua [26]. De esta manera, el catalizador a emplear es el Ni/γ-Al2O3 con un soporte de La2O3. Acuña, Arapa, Chiquiar, Portal 16 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química ANEXO 3 3.1 Consumo nacional y tendencias del mercado La variación en el consumo aparente en el país en el periodo 2013-2022 según el IPA (Figura 3.1), indica una tendencia de alza muy leve, esto debido a las fluctuaciones que se presentan año a año principalmente por las caídas que se presentaron en 2018 debido a la crisis cambiaria, la caída del PBI y en 2021 consecuencia de la pandemia. Figura 3.1: Demanda histórica del consumo aparente periodo 2013-2022. Fuente: Elaboración propia a partir de [14] 3.2 Proyección de la demanda a nivel nacional Se realizó la proyección de la demanda futura a 10 años la cual se alinea temporalmente con el horizonte de vida útil del proyecto. Los métodos de proyección se fundamentan principalmente en la curva de demanda derivada del análisis de datos históricos. Figura 3.2: Demanda proyectada a 10 años, periodo 2013-2034. Fuente: Elaboración propia a partir de [14] Acuña, Arapa, Chiquiar, Portal 17 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química ANEXO 4 La producción nacional de glicerol crudo se obtiene si consideramos un aproximado de 10,5% en peso de la producción nacional de biodiesel. Los datos correspondientes a la producción en los últimos diez años se reflejan en la Tabla 4.1 y su representación se visualiza en la Figura 4.1 Tabla 4.1: Mercado nacional de glicerol crudo Fuente: Elaboración propia Figura 4.1: Producción nacional de biodiesel y de glicerol crudo Producción Glicerol Producción biodiesel 2024 2022 2020 2018 2016 2014 0,00 500000,00 1000000,00 1500000,00 2000000,00 2500000,00 3000000,00 3500000,00 Producción (ton/año) Fuente: Elaboración propia Acuña, Arapa, Chiquiar, Portal 18 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química ANEXO 5 5. Fenómenos de corrosión A continuación, se describen los fenómenos de corrosión más comunes y las consideraciones contractivas para su prevención o mitigación. ● Ataque por Hidrógeno: Ocurre cuando el hidrógeno atómico se difunde dentro del acero, reaccionando con el carbono para formar metano. Este metano queda atrapado en la microestructura del acero, provocando presiones internas que pueden llevar a la formación de cavidades y, eventualmente, a la ruptura del material. Se puede mitigar al emplear aleaciones con elementos formadores de carburos, como cromo (Cr) y molibdeno (Mo), que estabilizan el carbono en la estructura del acero. Las áreas de soldadura son particularmente susceptibles debido a la presencia de carburos inestables. Por lo que es fundamental realizar tratamientos térmicos posteriores a la soldadura (PWHT) para reducir riesgos. Además, las curvas de Nelson son una herramienta gráfica esencial para determinar las condiciones operativas seguras para diferentes aceros en función de la presión parcial de hidrógeno y la temperatura. ● Nitruración: Se produce cuando el amoníaco reacciona con la superficie del acero, formando una capa dura y quebradiza de nitruro. Este fenómeno afecta tanto a aceros de baja aleación como a materiales de alta resistencia. Se puede mitigar al emplear aceros de baja aleación para aplicaciones por debajo de 400 °C y para condiciones más severas se suele usar acero inoxidable, Inconel o Incoloy, que presentan resistencia a la nitruración a cualquier temperatura operativa relevante. ● Corrosión Bajo Tensión: Este tipo de corrosión ocurre debido a factores como la presencia de compuestos traza (especialmente cloro) o tratamientos térmicos deficientes en las soldaduras. Puede provocar fallas catastróficas sin signos previos de daño significativo. Se puede mitigar al garantizar la calidad de las soldaduras mediante tratamientos térmicos adecuados. ● Fragilización por Revenido: En aceros resistentes al calor, el uso prolongado a temperaturas superiores a 400 °C puede reducir la resistencia al impacto. Controlar los niveles de elementos traza como Si, Mn y Sn ayuda a mitigar este problema. ● Desintegración por Polvo Metálico: Este fenómeno afecta principalmente a aleaciones de alta temperatura en presencia de monóxido de carbono y altas temperaturas (500– 800 °C). Las soluciones incluyen el uso de recubrimientos superficiales y mayores proporciones de vapor en la mezcla de proceso. En la siguiente Tabla 5.1 se presenta un resumen. Acuña, Arapa, Chiquiar, Portal 19 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química Tabla 5.1: Fenómenos de corrosión, causas, materiales y consideraciones Fenómeno de Causa Materiales constructivos Consideraciones corrosión recomendados Ataque por Difusión de hidrógeno Aleaciones con Enfriamiento lento hidrógeno atómico en el acero formadores de carburos para evitar (Cr, Mo). (e.g., 2 1/2 Cr fragilidad 1/2 Mo) Nitruración Reacción del amoníaco Materiales avanzados Uso de aceros de con la superficie del para altas temperaturas baja aleación por acero, formando una como aceros inoxidables debajo de 400 °C. capa de nitruro (SS 304), Inconel o quebradiza Incoloy Corrosión bajo Presencia de compuestos Aceros austeníticos tensión traza como cloro Fragilización por revenido Exposición prolongada a Aceros resistentes al temperaturas >400 °C calor con bajos niveles de Si, Mn, P y Sn Desintegración Reacción del monóxido Aleaciones resistentes a por polvo de carbono a altas altas temperaturas metálico temperaturas (500–800 (Inconel 601/625) °C) Tratamientos térmicos posteriores a soldadura (PWHT). Control de elementos traza en la aleación Aplicar recubrimientos superficiales (e.g., aluminio) Acuña, Arapa, Chiquiar, Portal 20 Universidad Nacional de Salta Facultad de Ingeniería Optativa II - Petroquímica Ingeniería Química ANEXO 6 Figura 6: Diagrama de flujo de proceso. Fuente: Elaboración propia Acuña, Arapa, Chiquiar, Portal 21