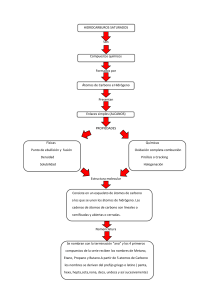
TEMA 2: LOS METALES 1. ¿Cuáles son las principales características que definen a los materiales metálicos? a. Opacidad. b. Conductividad eléctrica y térmica. c. Ductilidad. d. Alta densidad. e. Temperaturas de fusión elevadas. f. Brillo metálico. 2. ¿A qué tipo de empaquetamiento tiene tendecia el enlace metálico? a. Al empaquetamiento compacto. 3. ¿Cómo son, usualmente, los radios atómicos en un enlace metálico? ¿Y las distancias entre los vecinos más próximos? a. Usualmente son un único elemento, por lo que todos los radios son idénticos. b. Tienden a ser más pequeñas, para minimizar la energía de enlace. 4. ¿Cómo se sitúan los átomos en un material cristalino? a. En una disposición periódica, a lo largo de grandes distancias atómicas, se colocan siguiendo un patrón tridimensional repetitivo. 5. ¿Cómo se denominan los materiales que no cristalizan? a. No cristalinos o amorfos. 6. Cuando se describen estructuras cristalinas, ¿cómo se consideran los átomos? ¿Cómo se denomina este modelo atómico? a. Como esferas rígidas con diámetros bien definidos. b. Modelo atómico de esfera rígida. 7. En el contexto de estructuras cristalinas, ¿qué es una red? a. Una red es una disposición tridimensional de puntos que coinciden con las posiciones de los átomos. 8. En el contexto de estructuras cristalinas, ¿qué es una celda unitaria? a. Un grupo pequeño de átomos que forma un patrón repetitivo a lo largo de toda la red. Es la unidad estructural fundamental y define toda la red mediante su geometría. 9. ¿Cuáles son los principales tres sistemas cristalinos? a. BCC: Body Centered Cube. b. FCC: Face Centered Cube. c. HC: Hexagonal Compacta. 10. ¿Qué parámetros se utilizan para definir las estructuras? a. 3 ejes (x, y, z). Cada uno coincide con una de las 3 aristas del paralelepípedo. b. 3 longitudes de arista (a, b, c) c. 3 ángulos axiales (alpha, beta, phi) 11. ¿Cómo es la direccionalidad del enlace metálico? ¿Y qué significa? a. El enlace metálico es NO direccional. b. Hay unas restricciones mínimas en cuanto al número y posición de los átomos vecinos más cercanos, lo que conduce a un número relativamente grande de vecinos muy próximos y empaquetamientos atómicos compactos para la mayoría de estructuras metálicas. 12. ¿Cómo es la estructura cristalina cúbica centrada en el cuerpo? (BCC) a. Tiene una celda unitaria cúbica, con los átomos situados en los ocho vértices y un solo átomo en el interior del cubo. 13. ¿Qué materiales están construidos con una BCC? a. Cr (Cromo) b. Fe (Hierro) c. Mo (Molibdeno) d. V (Vanadio) e. W (Wolframio, también conocido como Tungsteno) 14. ¿Qué supone, para los materiales, que tengan una estructura BCC? a. Alta resistencia mecánica (soportan grandes cargas). b. Baja ductilidad (son más propensos a fracturarse bajo deformación). 15. ¿Cómo se relacionan, en una BCC, la longitud de la celda unitaria (a) y el radio atómico (R)? a. 𝑎 = 4𝑅 √3 16. ¿Cuántos átomos por celda unitaria tiene una BCC? ¿Por qué? 1 a. 𝑁 = 1 + 8 ∗ 8 = 2 b. Porque tiene 1 en el centro del cubo, 8 en los vértices, y los átomos de los vértices se comparten entre 8 celdas unidad (Indice de coordinación 8). 17. ¿Qué es el índice de coordinación? ¿A cuánto equivale en la BCC? a. Número de átomos, iones o moléculas que rodean a un átomo o ion central en una estructura cristalina. b. En la BCC es 8. 18. ¿Qué supone un mayor índice de coordinación? a. Una mayor estabilidad térmica. 19. ¿Cuál es la densidad atómica de la BCC? a. 𝑑 = 𝑁 2 = 3 ; siendo N el número de átomos en la celda unidad y Vc el 𝑉𝑐 𝑎 3 volumen de la celda (Para un cubo, Vc=𝑎 ) 20. ¿Y la densidad teórica en una BCC? 𝑚𝑎𝑠𝑎 a. 𝑝 = 𝑣𝑜𝑙𝑢𝑚𝑒𝑛 = 𝑁∗( 𝑃𝑀 ) 𝑁𝐴 𝑉𝑐 , donde PM es el peso molecular, NA el número de avogadro, N el número de átomos en la celda unidad y Vc el volumen de la celda unidad. 21. ¿Qué es el factor de empaquetamiento atómico? ¿Cuánto vale en una BCC? a. Es la relación que hay entre el volumen ocupado por los átomos entre el volumen total. 4𝜋𝑟3 b. 2 𝑎𝑡𝑜𝑚𝑜𝑠 𝑣𝑜𝑙 𝑜𝑐𝑢𝑝𝑎𝑑𝑜 3 𝐹. 𝐸. 𝐴 = 𝑣𝑜𝑙 𝑡𝑜𝑡𝑎𝑙 = 4𝑟 ( )3 = 0.68 = 68% √3 22. ¿Qué supone un mayor factor de empaquetamiento atómico (F.E.A)? a. Una mayor capacidad a la deformación plástica permanente. 23. ¿Cómo se definen las direcciones compactas en una BCC? ¿Y los planos compactos? a. [111] b. (110) 24. ¿Qué materiales están construidos con una FCC? a. Ag (Plata) b. Al (Aluminio) c. Au (Oro) d. Cu (Cobre) e. Ni (Niquel) f. Pb (Plomo) g. Pt (Platino) 25. ¿Qué supone, para los materiales, que tengan una estructura FCC? a. Alta ductilidad (Pueden deformarse sin romperse). b. Buena tenacidad (Son adecuados cuando se requiera resistencia a golpes y vibraciones). c. Alta conductividad (Térmica y eléctrica). d. Baja resistencia a la deformación en comparación a la BCC. 26. ¿Cómo se relacionan, en una FCC, la longitud de la celda unitaria (a) y el radio atómico (R)? a. 𝑎 = 4𝑅 √2 27. ¿Cuántos átomos por celda unitaria tiene una FCC? ¿Por qué? 1 1 a. 𝑁 = 6 ∗ 2 + 8 ∗ 8 = 4 b. Porque tiene 6 en el centro de las caras (cada uno compartido entre 2), 8 en los vértices (cada uno compartido entre 8). 28. ¿Qué es el índice de coordinación? ¿A cuánto equivale en la FCC? a. Número de átomos, iones o moléculas que rodean a un átomo o ion central en una estructura cristalina. b. En la FCC es 12. 29. ¿Cuál es la densidad atómica de la FCC? 𝑁 4 a. 𝑑 = 𝑉𝑐 = 𝑎3 ; siendo N el número de átomos en la celda unidad y Vc el volumen de la celda (Para un cubo, Vc=𝑎3 ) 30. ¿Y la densidad teórica en una FCC? 𝑚𝑎𝑠𝑎 a. 𝑝 = 𝑣𝑜𝑙𝑢𝑚𝑒𝑛 = 𝑁∗( 𝑃𝑀 ) 𝑁𝐴 𝑉𝑐 , donde PM es el peso molecular, NA el número de avogadro, N el número de átomos en la celda unidad y Vc el volumen de la celda unidad. 31. ¿Qué es el factor de empaquetamiento atómico? ¿Cuánto vale en una BCC? a. Es la relación que hay entre el volumen ocupado por los átomos entre el volumen total. 4𝜋𝑟3 b. 4 𝑎𝑡𝑜𝑚𝑜𝑠 𝑣𝑜𝑙 𝑜𝑐𝑢𝑝𝑎𝑑𝑜 3 𝐹. 𝐸. 𝐴 = 𝑣𝑜𝑙 𝑡𝑜𝑡𝑎𝑙 = 4𝑟 3 ( ) = 0.74 = 74% √2 32. ¿Cómo se definen las direcciones compactas en una FCC? ¿Y los planos compactos? a. [110] b. (111) 33. ¿Por qué los metales presentan, habitualmente, factores de empaquetamientos atómicos grandes? a. Porque así optimizan la proteccion proporcionada por la nube de electrones libres. 34. ¿Qué materiales están construidos con una HC? a. Mg (Magnesio) b. Ti (Titanio) c. Be (Berilio) d. Cd (Cadmio) e. Co (Cobalto) f. Zn (Zinc) g. Zr (Circonio) 35. ¿Qué supone, para los materiales, que tengan una estructura HC? a. Alta densidad de empaquetamiento (74%). b. Alta resistencia y baja ductilidad en comparación a FCC. c. Anisotropía (Sus propiedades mecánicas pueden variar dependiendo de la dirección en que se midan). 36. ¿Cómo se relacionan, en una HC, la longitud de la celda unitaria (a) y el radio atómico (R)? a. 𝑎 = 2𝑅 37. ¿Cuántos átomos por celda unitaria tiene una FCC? ¿Por qué? 1 1 a. 𝑁 = 3 + 2 ∗ 2 + 12 ∗ 6 = 6 b. Porque tiene 3 en el centro, 2 en las caras inferior y superior (cada uno compartido entre 2) y 12 en los vértices, cada uno compartido enre 6. 38. ¿Qué es el índice de coordinación? ¿A cuánto equivale en la HC? a. Número de átomos, iones o moléculas que rodean a un átomo o ion central en una estructura cristalina. 𝑐 𝑐 b. En la HC es 12 si 𝑎 = 1.63 o 6 si 𝑎 ≠ 1.63 39. ¿Qué es el factor de empaquetamiento atómico? ¿Cuánto vale en una HC? a. Es la relación que hay entre el volumen ocupado por los átomos entre el volumen total. b. 𝐹. 𝐸. 𝐴 = 𝑣𝑜𝑙 𝑜𝑐𝑢𝑝𝑎𝑑𝑜 = 0.74 = 74% 𝑣𝑜𝑙 𝑡𝑜𝑡𝑎𝑙 40. ¿Son ciertamente similares las estructuras FCC y HC? ¿Por qué? a. Sí. b. Porque tienen el mismo grado de compactación. 41. ¿Qué es un monocristal? a. Son materiales en los que el orden atómico se extiende ininterrumpidamente durante la totalidad de la muestra. En algunas circunstancias, pueden tener caras planas y formas geométricas. 42. ¿Qué es la anisotropía? a. Las propiedades físicas de los monocristales anisótropos de algunas sustancias dependen de la dirección cristalográfica, puesto que están orientados de manera ordenada. Es decir, sus propiedades mecáncias dependen de la dirección en que se midan. 43. ¿Qué es la isotropía? a. Las propiedades físicas de los monocristales isotrópicos no dependen de la dirección cristalográfica, puesto que están orientados de manera aleatoria. Son independientes de la dirección de medición. 44. ¿Qué es un policristal? a. La gran mayoría de sólidos cristalinos son policristalinos. Es decir, están compuestos de muchos cristales o granos pequeños que tienen diferentes orientaciones cristalográficas (Están orientados de manera aleatoria). Cada uno de estos granos es un cristal individual con su propia estructura cristalina, pero en conjunto forman el material policristalino. 45. ¿Qué son los bordes de grano? a. Son las áreas de transición entre los granos individuales en un material policristalino. 46. ¿Qué tipos de defectos existen en las estructuras cristalinas? a. Defectos puntuales. i. Vacantes. ii. Autointersticiales. iii. Impurezas. b. Defectos lineales: i. Dislocaciones. c. Defectos superficiales: i. Bordes de grano. 47. ¿Qué son los defectos puntuales vacantes? ¿Pueden crearse materiales cristalinos libres de estos defectos? a. Hacen referencia a la posición ocupada por un átomo, ausente. b. No, no es posible. La existencia de vacantes es necesaria, pues su presencia aumenta la entropía (aleatoriedad del cristal). 48. ¿Cuándo se producen los defectos puntuales vacantes? a. Pueden producirse durante la solidificación, por perturbaciones locales, durante el crecimiento de los cristales. b. También, por preordenamientos atómicos en el cristal ya formado como consecuencia de la movilidad de los átomos. 49. ¿Qué ocurre con los enlaces entorno a la posición vacante? a. Se deforman, creando una tensión interna en el material (para intentar rellenar el hueco). 50. ¿Son comunes los defectos puntuales vacantes? a. Son las imperfecciones más comunes en los cristales. 51. ¿Qué ocurre con la traslación de vacantes? ¿En qué afectan las vacantes a la difusión? a. Las vacantes pueden trasladarse, cambiando su posición con sus vecinos. Este proceso es importante en la migración o difusión de los átomos en estado sólido, sobretodo a altas temperaturas. A más temperatura, más vacantes, más desorden. b. La difusión es más fácil gracias a las vacantes, ya que hay que romper menos enlaces. 52. ¿Cuándo se forma un defecto autointersticial? a. Cuando un átomo del cristal se coloca en un lugar intersticial de la red, espacio originalmente vacío entre los átomos que forman la estructura. 53. ¿Cómo influyen los defectos autointersticiales en la difusión de átomos? a. De forma similar a las vacantes, pero en menor medida puesto que son significativamente menos frecuentes. 54. ¿Qué son los defectos puntuales “impurezas”? ¿Qué tipos hay? a. Son átomos de distinta naturaleza. Dependen del metal base y tipo de impureza. Hay dos tipos: i. Sustitucionales: El soluto o las impurezas reemplazan a átomos originales. (P.ej Cu en Ni) ii. Intersticiales: Los átomos de las impurezas llenan los vacíos o intersticios dentro del material original. (P.ej C en Fe) 55. ¿Qué es un defecto lineal? a. Es un defecto que afecta en una línea del material. 56. ¿Qué son las dislocaciones? ¿Cómo se producen? a. Son dfectos lineales entorno a algunos átomos desalineados. b. Se producen por velocidades de enfriamiento no controladas, o una deformación del material. 57. ¿Qué influencia tienen las dislocaciones en el comportamiento mecánico? a. Gran infuencia. Hacen que la carga que se tiene que aplicar para que empiece a deformarse sea menor, por lo que la resistencia mecánica disminuye. Favorecen los deslizamientos entre planos cristalinos, originando deformaciones permanentes (plásticas). 58. ¿Qué tipos de dislocaciones existen? a. Dislocación de borde: Es el extremo de un semiplano adicional de átomos. Esta se denomina linea de dislocación. b. Dislocación helicoidal: La región frontal superior del cristal se desplaza una distancia atómica a la derecha respecto a la posición inferior. c. Disloaciones mixtas: Presentan componentes de ambas. 59. ¿Qué son los defectos superficiales? ¿De qué manera se manifiestan? a. Son imperfecciones que se encuentran en la superficie de un material. b. Pueden ser: i. Rugosidad. ii. Arañazos. iii. Porosidad. iv. Fisuras. 60. ¿Qué diferencias hay entre grano fino y grano grueso? a. Grano fino: i. Tamaño: Los granos son pequeños. ii. Bordes de grano: Hay más bordes de grano, porque hay más granos en el mismo volumen. iii. Propiedades mecánicas: Suelen ser más duros y resistentes, porque los bordes de grano actúan como barreras para el movimiento de dislocaciones. iv. Ductilidad: Pueden ser menos dúctiles (menos capacidad de deformarse sin romperse) debido a la mayor cantidad de bordes de grano. b. Grano grueso: i. Tamaño: Los granos son grandes. ii. Bordes de grano: Hay menos bordes de grano, porque hay menos granos en el mismo volumen. iii. Propiedades mecánicas: Suelen ser más dúctiles y menos duros, porque hay menos barreras para el movimiento de dislocaciones. iv. Ductilidad: Pueden deformarse más fácilmente sin romperse debido a la menor cantidad de bordes de grano. 61. ¿Qué ocurre con los bordes de grano, en relación a la fundición y la corrosión? a. Los materiales empiezan a fundirse y corroerse por los bordes de grano. 62. ¿Qué es una aleación? a. Es una combinación de varios elementos de los cuales al menos uno es un metal y el/los otro/s puede/n serlo, o no. El conjunto resulta en un material con características metálicas, por lo que el enlace mayoritario entre los átomos es el metálico. 63. ¿Cómo es la solubilidad en una aleación? a. Los materiales deben ser al menos parcialmente solubles entre ellos. El elemento que se disuelve se integra en la estructura del otro. 64. ¿Qué tipos de soluciones existen en las aleaciones? a. Solución sólida sustitucional: Entre dos o más elementos con átomos que son casi del mismo tamaño, puesto que los átomos aleantes reemplazan a los átomos normales de la estructura reticular y no solamente se acomodan en los espacios que dejan los átomos normales entre sí. b. Solución sólida intersticial: Entre elementos aleantes cuyos átomos difieren mucho en tamaño. Los átomos aleantes deben ser de tamaño bastante pequeño (aproximadamente la mitad) para acomodarse dentro de la estructura reticular del metal base. 65. ¿Cómo funciona la solución sólida sustitucional? a. Uno o más átomos de la estructura se sustituye por uno del soluto. Altera la estructura e introduce tensión. Dificulta el mecanismo de deformación, aumentando la resistencia y ocasionando un endurecimiento por solución sólida tanto más sea la solubilidad. 66. ¿Cómo afectan las soluciones a las propiedades del material? a. Ambos tipos de solución afectan, ya que distorsionan la estructura cristalina y perturban la homogeneidad física y eléctrica del material disolvente. 67. ¿Qué material es el disolvente en una solución de materiales que tienen una estructura cristalina idéntica? ¿Y en una solución de materiales con estructuras distintas? a. El que aparece en mayor concentración. b. El que conserve su red. 68. ¿Qué elementos comunes son capaces de formar soluciones intersticiales? a. C (Carbono). b. N (Nitrógeno). c. O (Oxígeno). d. H (Hidrógeno). e. B (Boro). 69. ¿Cuáles son las reglas de Hume-Rothery? a. Factor Tamaño. b. Factor Electronegatividad. c. Factor Valencia. d. Factor Concentración electrónica. e. Factor Estructura cristalina. 70. En las reglas de Hume-Rothery, ¿qué significa “Factor Tamaño”? a. Un soluto puede formar parte de una solución sólida, en cantidades consideralebles, solo cuando el tamaño atómico de los metales aleantes no difiere en más del 15%. 71. En las reglas de Hume-Rothery, ¿qué significa “Factor Electronegatividad”? a. Cuanto mayor sea la diferencia de electronegatividades entre los dos átomos (soluto y disolvente), tanto mayor es la probabilidad de que se forme un compuesto intermetálico en lugar de una solución sólida sustitucional. 72. En las reglas de Hume-Rothery, ¿qué significa “Factor Valencia”? a. Un metal tiene más tendencia a disolver otro metal de valencia superior. 73. En las reglas de Hume-Rothery, ¿qué significa “Factor Concentración electrónica”? a. Nº electrónes de valencia/átomo < 1.4. Solo es aplicable cuando el disolvente actúa. 74. En las reglas de Hume-Rothery, ¿qué significa “Factor Estructura Cristalina”? a. Los metales deben cristalizar en la misma red (BCC, FCC, HC). 75. ¿Qué ocurre si se cumplen todas las reglas de Hume-Rothery? ¿Y si falta alguna? a. Que la solubilidad será total. b. La solubilidad será parcial. 76. ¿Dónde se sitúan los huecos octaédricos en la red FCC? ¿Qué se debe cumplir? a. En el centro del cubo y en el centro de cada una de sus aristas. Por lo tanto, en cada celda existen cuatro huecos (uno de llos situado en el interior de la celda y otros doce en los centros de las aristas, estando estos últimos compartidos por cuatro celdas). i. Matemáticamente: ii. 2𝑅 + 2𝑅𝑖 = 𝑎 ; 𝑎 = iii. 4𝑅 √2 𝑅𝑖 = 0.414 ; 𝑅𝑖 = 0.147𝑎 𝑅𝑠 iv. Siendo R el radio del átomo metálico, Ri el del hueco (intersticio) y Rs el del disolvente. 77. ¿Dónde se sitúan los huecos tetraédricos en la red FCC? ¿Qué se debe cumplir? a. Ocupan los ocho centros de los ocho cubos en que se puede dividir la celda unidad. Por tanto, existirán ocho huecos de este tipo en cada celda unidad; es decir, dos por cada átomo metálico. Cada hueco ocupa el centro de un tetraedro cuyos vértices coinciden con los centros de sus átomos vecinos. b. Matemáticamente: c. 𝑅 + 𝑅𝑖 = d. 4𝑅 √3𝑎 ;𝑎 = 2 4 √ 𝑅𝑖 = 0.225 ; 𝑅𝑖 = 0.079𝑎 𝑅𝑠 e. Siendo R el radio del átomo metálico, Ri el del hueco (intersticio) y Rs el del disolvente. 78. ¿Qué ocurre con los intersticios en la red BCC? a. En la red BCC existen también huecos octaédricos y tetraédricos. b. La única diferencia, en el caso de los octaédricos, radica en que, en este caso, los huecos octaédricos no son simétricos. Por tanto, en cada celda unidad existirán seis huecos (6 en los centros de las caras compartidos entre dos celdas, y 12 en los centros de las aristas compartidos por cuatro celdas); es decir, 3 huecos por cada átomo presente. c. Matemáticamente: i. 2𝑅 + 2𝑅𝑖 = 𝑎 ; 𝑎 = ii. 4𝑅 √3 𝑅𝑖 2 = 3 − 1 = 0.155 ; 𝑅𝑖 = 0.067𝑎 𝑅 √ d. Con respecto a los huecos tetraédricos, existen 4 en cada cara y, en este caso, tampoco son simétricos. Considerando uno de estos huecos, los dos átomos más cercanos a él se encuentran situados en los vértices del cubo a una distancia. Matemáticamente: i. 𝑅𝑖 = 0.291; 𝑅𝑖 = 0.067𝑎 𝑅𝑠 79. ¿Qué ocurre con los intersticios en la red FCC? 𝑅𝑖 𝑅𝑖 a. Son similares a los de la red FCC. (8) 𝑅𝑠 = 0.414 ; (4) 𝑅𝑠 = 0.225 ; 𝑅𝑖 = 0.112𝑎