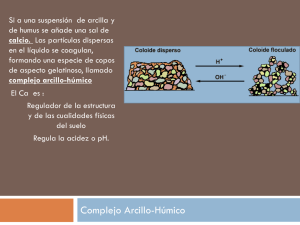
ÁCIDOS Y BASES, TEORÍAS Y MÁS QUIMPEDIA C L A S E S PA R T I C U L A R E S MOLECULAS Y FORMULA QUÍMICA • Ión: átomo o un grupo de átomos que tiene una carga eléctrica neta positiva o negativa. • Catión: ion con carga positiva. • Anión: ion con carga negativa. Ejemplos de iones monoatómicos: Na+, Cl, Ca2+, O2-, Al3+, N3iones poliatómicos: OH-, CN-, NH+, NO- TEORÍA DE ARRHENIUS la teoría de Arrhenius define ácidos y bases en términos de cómo interactúan con el agua al disolverse: 1. Ácidos: Son sustancias que, al disolverse en agua, aumentan la concentración de iones H+ (protones). Por ejemplo, el ácido clorhídrico (HCl) se disocia en: HCl → H+ + ClAquí, el ion H+ es el que da al ácido sus propiedades características, como el sabor agrio o la capacidad de reaccionar con metales. 1. Bases: Son sustancias que, al disolverse en agua, aumentan la concentración de iones OH− (hidróxido). Por ejemplo, el hidróxido de sodio (NaOH) se disocia en: NaOH → Na+ + OH− El ion OH− es el responsable de las propiedades básicas, como la sensación jabonosa o la capacidad de neutralizar ácidos. TEORÍA DE ARRHENIUS De manera simplificada: • Un acido es una sustancia que cede H+ y que los deposita en un medio o en solución. • Una base es una sustancia que aumenta los iones OH- en un medio o en solución. PROPIEDADES IMPLÍCITAS • Cuando hay iones en solución, y estas cargas son muy concentradas tanto en cargas positivas y negativas. En esos casos, la conductividad se ve implicada en la solución por la aparición de estas “cargas”. Lo que significa que, puede aumentar esa conductividad a partir de los siguientes casos: 1. Concentración de iones: Cuantos más iones haya en la solución, mayor será su capacidad para conducir electricidad. 2. Carga de los iones: Los iones con mayor carga (como Ca2+ o SO42−)contribuyen más a la conductividad que los iones de carga unitaria (Na+ o Cl−). EJERCICIO PARA RECONOCER ANIONES Y CATIONES • Disocie los siguientes compuestos químicos: 1. Al2(SO4)3 2. HPO4-2 3. Ca(OH)2 4. CH3COOH 5. KMNO4 6. Pt(OH)4 EJERCICIO PARA RECONOCER ANIONES Y CATIONES • Disocie los siguientes compuestos químicos: 1. HClO4 2. H2SO3 3. FeCl 4. LiOH 5. HSO4 6. Ni(OH)2 EJERCICIO PARA RECONOCER ANIONES Y CATIONES EN REACCIÓN • Disocie las siguientes reacciones: • H2SO4 + Sr(OH)2 • HBr + KOH • HClO4 + Ba(OH)2 • H2CO3 + CsOH • HNO3 + Mg(OH)2 • H3PO3 + KOH • NaOH + HBr EJERCICIO PARA RECONOCER ANIONES Y CATIONES EN REACCION • Disocie las siguientes reacciones: • HCl + KOH • H2CO3 + 2 KOH • H2SO4 + Fe(OH)2 • H2SO4 + Ba(OH)2 • 2 H3PO4 + 3 Ca(OH)2 • NH4OH + HNO3 • Ni(OH)2 + H2SO4