gases asfixiantes(2) - ChilePrevencion el sitio chileno del
Anuncio

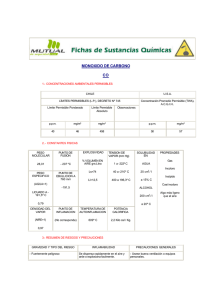
Ingeniería (E) Prevención de Riesgos HIGIENE OCUPACIONAL NIVELACION 2007 ASFIXIANTES QUIMICOS Monóxido de Carbono (CO). Se genera naturalmente a partir de la oxidación del metano (procedente de la descomposición anaerobia de la materia orgánica). También se produce CO en la combustión incompleta del carbono, como reacción a altas temperaturas entre CO2 y carbono y en la disociación de CO2 a temperaturas elevadas. Es insípido, inodoro y más pesado que el aire. Es el agente más importante de asfixia ocupacional y de intoxicaciones graves. Estos cuadros se presentan típicamente en épocas invernales, en que a causa de las bajas temperaturas , se minimizan los sistemas de ventilación general de los ambientes cerrados. Cerca del 60% emitido por el hombre procede de sus automóviles, por la combustión incompleta. Se puede acumular en calles cerradas o por inversión térmica. Los niveles en sitios no contaminados están entre 0,01 a 0,8 ppm. El CO genera una reducción irreversible de la hemoglobina, puesto que el CO es 240 veces más a fin con la hemoglobina que el oxígeno y produce una asfixia celular. Con bajos niveles se manifiesta en incapacidad para determinar intervalos de tiempo, fallas de coordinación y discriminación. Con niveles elevados puede provocar la muerte por asfixia. Usualmente una persona puede tener menos del 1% de su hemoglobina unida a CO, formando carboxihemoglobina. Existen marcadas evidencias de que el monóxido de carbono es directamente tóxico sobre las mitocondrias, organismos fundamentales para la respiración celular. Los síntomas de intoxicación son cefalea, náuseas y vértigo, dificultad respiratoria. Estos efectos se asocian a las concentraciones de Hb saturada por el CO. A partir de una saturación de un 5% se pueden presentar síntomas como cefalea, disnea, mareos, náuseas. Concentraciones superiores pueden provocar compromiso de conciencia, convulsiones, arritmias y muerte. A partir de la exposición por horas (2 a 3) a concentraciones de 50 ppm se puede alcanzar una cifra de 7% de COHb. Para concentraciones superiores, el tiempo de exposición es lógicamente menor. Se puede calcular el porcentaje de COHb en sangre mediante la siguiente fórmula: % de COHb = 0.16 * concentración CO en ppm + 0.5 El LPP es 40ppm en 745 y se bajó a 20 ppm en el 594. IBE Hasta 3,5% de carboxihemoglobina en DS 594. Es un contaminante atmosférico regulado por el DS 1215 de Calidad del Aire. La formación natural de CO es 2CO2 + Radiación UV CO + Radical de H* 2CO2 + O2 CO + Radical de OH* Cianuros Comprenden al Ácido Cianhídrico (HCN) y a sus sales, cianuros de sodio (NaCN), de potasio (KCN), y calcio (CaCN2). Estas sales por acción del agua y ácidos producen ácido cianhídrico. Este agente posee afinidad por lo iones metálicos y se une con firmeza al fierro. A nivel celular lo hace con el fierro presente en las enzimas citocromo oxidasa que constituyen el sistema de respiración celular, provocando una hipoxia celular. El HCN es usado en la producción de ácidos, en la industria de fibras, plásticos, cianuros y nitritos, en fumigación. Las sales de cianuro se usan en electroplateado, extracción de oro y plata, cuprado, zinc. Son de rápida absorción de modo que el cuadro de intoxicación se presenta con inquietud, vértigos, debilidad, vértigos, cefalea. Si el episodio es más severo aparece coma y muerte. También posee efecto irritativo sobre la piel. En los episodios de intoxicación aguda se busca la formación de metahemoglobina, para neutralizar el cianuro libre y la regeneración de la citocromo – oxidasa. Esto se lograron un agente metahemoglobizante como el nitrito de amilo. LPP HCN 8 ppm en DS 745. Ácido Sulfhídrico (H2S) Es un gas incoloro, con olor a huevos podridos a concentraciones bajo 30 ppm paraliza el olfato. Se genera por la descomposición de materia orgánica, de proteínas cuyos aminoácidos contiene grupos sulfhidrilos, con azufre: cisterna, metionina. Se usa en industria de rayón, en vulcanización, en síntesis de ácido sulfúrico, en metalurgia. Se genera en fábricas de harina de pescado, en pozos de mortalidad. Se une al fierro de la citocromo oxidas de manera de producir una asfixia intracelular. Actúa principalmente sobre el SNC y corazón. Provoca una excitación y luego una depresión. Cefalea, mareos, náuseas a 100ppm. Temblor, debilidad, convulsiones, coma, muerte sobre 500 ppm. Es irritante local de piel y mucosas además. Sus efectos a este nivel se manifiestan con concentraciones de 10 a 15 ppm en 4 a 7 horas de exposición. LPP 8 ppm (DS 745 y DS 594). 2 SOLVENTES Se consideran como tal a una serie de hidrocarburos líquidos mas o menos volátiles, entre los cuales pueden mencionarse compuestos aromáticos, alicíclico y alifáticos, alcoholes, cetonas, esteréis éteres. La exposición a estos agentes es común en la industria de hidrocarburos y química, en pintura y barnizado, en talleres de fibra de vidrio, imprentas, impregnación de redes (antifouling), industria del calzado. La vía de ingreso primordial es la respiratoria, aunque para algunos puede ser relevante el ingreso por piel. Son metabolizados en el hígado y sus metabolitos pueden ser detectados y medidos en la orina. Efectos Neurotóxicos: Los solventes provocan un deterioro en funciones cognitivas superiores. Alteran los tiempos de respuesta, la memoria a corto plazo, la calidad de operaciones aritméticas simples. Deteriora la percepción visual, las velocidades de percepción la coordinación mano ojo, la memoria y provocan daño auditivo y del equilibrio. Se registran efectos sobre el Electroencefalograma y se observa degeneración de los axones de las neuronas. Carcinogenicidad: Benceno es probadamente cancerígeno. Estireno, Tolueno, tricloroetileno, percoloroetileno poseen actividad mutagénica. En trabajadores expuestos a solventes e han encontrado incidencia aumentada de linformas, leucemias y cánceres hígado y pulmón. Toxicidad reproductiva: Se ha notado un incremento de aborto espontáneo y defectos del tubo neural en hijos de trabajadores expuestos. Otros: Glomerulonefritis (riñón), Hepatotoxicidad, disminución de la función respiratoria y daño cardíaco. 3