LABORATORIO DE BIOLOGÍA CELULAR PRÁCTICA 3. OBSERVACIÓN DE PREPARACIONES DE AGUA CONTAMINADA
Anuncio

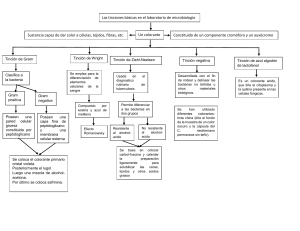
LABORATORIO DE BIOLOGÍA CELULAR PRÁCTICA 3. OBSERVACIÓN DE PREPARACIONES DE AGUA CONTAMINADA FRESCAS Y TEÑIDAS OBJETIVOS: 1. El alumno observará y aprenderá el uso adecuado del microscopio en preparaciones frescas y teñidas. 2. Aplicará algunas técnicas de tinción simple y diferencial sobre muestras biológicas de aguas contaminadas. 3. Será capaz de discernir entre las células procariotes y eucariotes en base al tamaño y tipo de tinción empleado. INTRODUCCIÓN: En su evolución, las células pasaron por diversas etapas. Las hipotéticas células primitivas cambiaron, adaptándose al medio hostil que las rodeaba implementando membranas a manera de barreras mecánicas y químicas en una evolución que duró miles de años. La compartamentalización de estructuras internas fue quizás el paso decisivo para la divergencia entre las células procariotas y las eucariotas. La célula procariota fue definida así por la ausencia de una membrana nuclear, lo que hace que la sustancia nuclear no se halle confinada y por lo tanto difícilmente sea observable. La célula eucariótica fue descrita como una entidad con un núcleo bien definido y con presencia de organelos provistos de membranas. Mayor que la célula procariota, la célula eucariota es visible en el microscopio óptico compuesto mediante tinciones simples, diferenciales y especiales en los objetivo denominados “secos”. La célula procariota puede observarse con tinciones simples, diferenciales y especiales con el objetivo de inmersión. La composición química de los organismos presenta una gran proporción de moléculas de agua en las células de los diversos tejidos. En la mayoría de ellos este fluido predomina y sólo en algunos su concentración es baja. Esta características es un factor muy importante para la observación microscópica, ya que debido a la refringencia del agua se dificulta observar los componentes estructurales de la célula. Para evitar este fenómeno se recurre a las técnicas de coloración; los colorantes tienen como función teñir los diferentes componentes celulares y tisulares para facilitar el observarlos. En biología son conocidos los primeros investigadores que usaron los colorantes. Se menciona entre ellos a Hill, quien en 1770 empleó el carmín; Ehrember utilizó en 1938 el índigo carmín, aplicándolo a organismos vivos. Sin embargo, ya en 1807 Schwarts introdujo la doble tinción utilizando el carminato de amonio y el ácido pícrico. Durante varios años las técnicas se limitaron al uso de estos colorantes, hasta que varios años después se descubrieron las anilinas, con las cuales las técnicas de coloración recibieron gran impulso. Los primeros investigadores que utilizaron las anilinas fueron: Beneke, en 1862, que usó la anilina violeta, y Waldeyer, en 1863, que empleo la fucsina. MATERIAL: - Frasco con agua contaminada. Goteros (4 de 25 mL por grupo). Portaobjetos (6 por equipo). - Cubreobjetos (6 por equipo). Equipo para tinción de Gram que incluye cristal violeta (15 mL por grupo), lugol (15 mL por grupo), alcohol etílico (96%) (25 mL por equipo) y safranina (15 mL por grupo). Colorante simple (azul de metileno, verde malaquita o fucsina ácida) (15 mL por grupo). Aceite de inmersión (5 mL por grupo). 2 pipetas de 1 mL por equipo. Microscopio óptico compuesto (1 por equipo). 1 mechero bunsen por equipo Trapo de limpieza (personal). METODOLOGÍA: 1. 2. 3. 4. 5. a) b) c) d) Limpiar y enfocar el microscopio. Agitar la muestra de agua contaminada y tomar una pequeña gota de ésta. Colocarla en un portaobjetos e inmediatamente colocar encima un cubreobjetos. Observar movimiento y forma de las células con los objetivos de 10x, 40x y 100x. No observar si el agua se secó. En otro portaobjetos, añadir una pequeña gota de la muestra de agua y dejar secar. Esta laminilla será teñida con colorante simple. Esto se realizará colocando la laminilla con la muestra fijada al aire en las barras de vidrio colocadas en las tarjas del laboratorio. Añadir el colorante simple a la superficie de la laminilla cuidando que el colorante no caiga de la laminilla y dejar reposar por 30 segundos. Lavar con agua, dejar secar y observar al microscopio. En la tercera laminilla de pondrá una muestra proveniente de un cultivo bacteriano, se fijará con calor y será teñida con la técnica de Gram, que consiste en lo siguiente: Añadir cristal violeta y dejar reposar por un minuto. Enjuagar con agua de la llave. Añadir lugol y dejar reposar por un minuto. Enjuagar con agua de la llave. Decolorar con alcohol por 30 segundos y enjuagar. Añadir safranina y dejar reposar por 30 segundos. Enjuagar, dejar secar y observar al microscopio. ACTIVIDADES. 1. 2. 3. 4. 5. 6. Haga una descripción breve de los diferentes tipos de tinción existentes. ¿En qué se basa, estructuralmente hablando, la diferencia de tinción entre bacterias Gram positivas y Gram negativas? ¿Cuál considera Usted que es la importancia de la técnica de Gram? ¿Por qué son importantes las técnicas de tinción para los estudios biológicos? ¿Por qué es necesario utilizar diferentes técnicas de tinción dependiendo de si se desea observar células procariotas o eucariotas? Haga dibujos y anotaciones de lo observado al microscopio. Anexo 1. Preparación de colorantes. 1. Cristal violeta (Para Gram). (Almacenar en gotero ámbar). A. Colorante cristal violeta 85%..........................1 g Alcohol etílico 95%.......................................20 mL Mezcle y disuelva. B. Oxalato de amonio……………………………….0.8 g Agua destilada……………………………………80 mL Añada la solución A a la solución B. Deje reposar por un día, luego filtre. Si el cristal violeta está demasiado concentrado, la solución A puede ser diluida hasta 10 veces. 2. Lugol (Para Gram). Cristales de yodo…………………………….. 1g Yoduro de potasio……………………………. 2 g Agua destilada……………………………….. 300 mL Almacene en frasco ámbar y descarte cuando el color se aclare. 3. Solución de safranina (Para Gram). (Almacenar en gotero ámbar). Safranina…………………………………….2.5 g Alcohol etílico 95%................................100 mL Para la solución de trabajo, diluya la solución stock 1/10 (10 mL de la safranina stock en 90 mL de agua destilada). Si la safranina se encuentra ya líquida, diluya hasta una concentración de 0.5%. 4. Azul de metileno. (Almacenar en un gotero ámbar) Azul de metileno……………………………0.3 g Agua destilada……………………………..100 mL