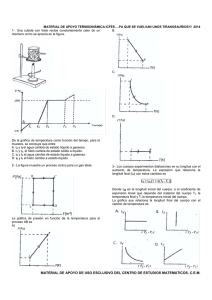
PROPOSITO: Caracterizar el principio de conservación ...
Anuncio

PROPOSITO: Caracterizar el principio de conservación de la energía como la primera ley de la termodinámica. Calcular a partir de observables como el calor y el trabajo el cambio de energía interna de un sistema PREGUNTAS: ¿Cuál es la primera ley de la termodinámica? ¿Qué es la energía interna? ¿Por qué se calientan los aparatos eléctricos al cabo de un tiempo de estar funcionando? CONTENIDO: Primera ley de la Termodinámica La primera ley no es otra cosa que el principio de conservación de la energía aplicado a un sistema de muchísimas partículas. A cada estado del sistema le corresponde una energía interna U. Cuando el sistema pasa del estado A al estado B, su energía interna cambia en U=UB-UA Supongamos que el sistema está en el estado A y realiza un trabajo W, expandiéndose. Dicho trabajo mecánico da lugar a un cambio (disminución) de la energía interna de sistema U=-W También podemos cambiar el estado del sistema poniéndolo en contacto térmico con otro sistema a diferente temperatura. Si fluye una cantidad de calor Q del segundo al primero, aumenta su energía interna en U=Q Si el sistema experimenta una transformación cíclica, el cambio en la energía interna es cero, ya que se parte del estado A y se regresa al mismo estado, U=0. Sin embargo, durante el ciclo el sistema ha efectuado un trabajo, que ha de ser proporcionado por los alrededores en forma de transferencia de calor, para preservar el principio de conservación de la energía, W=Q. Si la transformación no es cíclica U 0 Si no se realiza trabajo mecánico U=Q Si el sistema está aislado térmicamente U=-W Si el sistema realiza trabajo, U disminuye Si se realiza trabajo sobre el sistema, U aumenta Si el sistema absorbe calor al ponerlo en contacto térmico con un foco a temperatura superior, U aumenta. Si el sistema cede calor al ponerlo en contacto térmico con un foco a una temperatura inferior, U disminuye. Todos estos casos, los podemos resumir en una única ecuación que describe la conservación de la energía del sistema. U = Q - W Si el estado inicial y final están muy próximos entre sí, el primer principio se escribe dU = dQ - pdV MODELACIÓN: 1. Un motor eléctrico realiza un trabajo de 750 j por segundo y esta conectado a una batería. Al funcionar, el motor cede cada segundo 60 j en forma de calor al ambiente. ¿Cuál es el cambio de energía interna del sistema formado por la batería y el motor cada segundo. SOL: como el motor en cada segundo realiza un trabajo de 750 j, entonces, W = 750 j. De la misma manera, como el sistema cede calor, concluimos que Q = - 60 j. Por tanto, la variación de energía interna en cada segundo es: U=Q - W = - 60 j – 750 j = - 810 j 2. En determinado proceso, se suministra a un sistema 2.000 j de calor al mismo tiempo, realiza un trabajo sobre el sistema de 100 j. ¿Cuál es la variación de energía interna? SOL: como el sistema se suministra calor de 2.000 j, entonces, Q = 2.000 j. De la misma manera, como se realiza trabajo en el sistema de 100 j, por lo tanto. U=Q - W = 2.000 j – 100 j = 1.900 j SIMULACIÓN: Considera 70 litros de un gas a 300 k conectado a un cilindro al cual se suministra una cantidad de calor de 2. 000 j y se mantiene a presión constante de 1 atm. Si se produce un aumento de volumen de 15 litros. Calcula: a. El trabajo realizado por el gas sobre el pistón. b. El cambio de energía interna del gas. Un gas contenido en un cilindro provisto de un pistón, se comprime en un proceso a presión constante de 0,8 atm. Y disminuye el volumen en 0. 02 m3. Si la energía interna del gas aumenta en 400 j. Calcula: a. Cuanto trabajo se realiza sobre el sistema. b. Cuánto calor cede o absorbe el sistema. Explica. EJERCITACIÓN: 1. Un motor eléctrico tiene una potencia de 200 w y esta conectado con una batería. A funcionar el motor cede cada segundo 34 j de energía en forma de calor al ambiente. ¿Cuál es el cambio de energía interna del sistema formado por la batería y el motor en cada segundo? 2. A un sistema se le suministran 2.450 J de energía en forma de calor y al mismo tiempo se realiza un trabajo sobre él de 250 J. ¿Cuál es la variación de la energía interna del sistema? 3. Un sistema de gas con energía interna de 200 J esta a una temperatura de 150 K. si se añaden al sistema 120 cal de calor y de éstas 30 cal se convierten en trabajo hecho por el sistema, ¿Cuál es la temperatura final del gas?