Taller 7 soluciones File
Anuncio

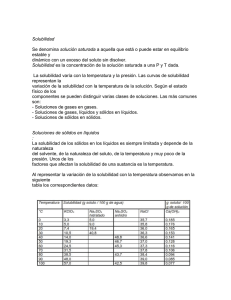
SOLUCIONES. 1. Defina los siguientes términos: solución saturada, solución insaturada, solución sobresaturada, cristalización. 2. ¿Cómo cambian las solubilidades en agua de la mayoría de los compuestos iónicos con la temperatura? 3. ¿Cuál es el efecto de la presión en la solubilidad de un líquido en un líquido y de un sólido en un líquido? 4. Una muestra de 3.20 g de una sal se disuelve en 9.10 g de agua para dar una solución saturada a 25 0C. ¿Cuál es la solubilidad (en g de sal/100 g de H20) de la sal a esa temperatura? 5. Analice los factores que influyen en la solubilidad de un gas en un líquido. Explique por qué la solubilidad de un gas en un líquido siempre disminuye al aumentar la temperatura. 6. Un estudiante está observando dos vasos con agua. Uno de los vasos se calienta a 300C y el otro a 1000C. En cada caso se forman burbujas en el agua. ¿Estas burbujas tienen el mismo origen? Explique. 7. ¿Por qué el naftaleno(C10H8 ) es más soluble que el NaCl en benceno? 8. Defina los siguientes términos y dé un ejemplo en cada caso: (a) concentración de una solución, (b) solubilidad, (c) miscibilidad, (d) soluto y solvente,. 9. El volumen de una solución acuosa cambia a medida que cambia la temperatura. Así, una concentración de una solución dada a determinad a temperatura puede no ser correcta para la misma solución a otra temperatura. ¿Qué métodos para expresar las concentraciones producirán resultados que sean independientes de la temperatura y cuáles dependientes de la temperatura? 10. El agua de mar contiene 0.412g de Ca2+ por kilogramo de agua. ¿Cuál es la concentración de Ca2+ en ppm ? 11. Calcule la cantidad de agua (en gramos) que debe agregarse a: a) 5.00 g de urea (H2NCONH2) para preparar una solución al 16.2% en masa, y b) 26.2 g de MgCl2 para preparar una disolución al 1.5% en masa. 12. Se prepara una disolución mezclando 62.6 mL de benceno (C6H6) con 80.3 mL de tolueno (C7H8). Calcule las fracciones molares de estos dos componentes. Las densidades son: benceno, 0.879 g/cm3; y tolueno, 0.867 g/cm3. 13. El sulfato de cobre(II), CuSO4, se utiliza para reducir el crecimiento de algas en lagos, pozos y depósitos de agua. Una solución acuosa de CuSO4 que es 18.0% en peso tiene una densidad de 1.208 g/mL. El sulfato de cobre(II) se obtiene comúnmente como pentahidrato, CuSO4.5H2O. ¿Qué masa de esta sustancia se debe utilizar para preparar 8.00 L de una solución que sea al 18.0% en peso? ¿Cuál es la formalidad de esta solución? 14. Se tiene 1 litro de HCI 0.18M y 1 litro de HCÍ 0.38M, Cual es el máximo volumen de HCl 0.24M que se puede preparar a partir de estas dos disoluciones, sin agregar agua? (Asumir volúmenes aditivos) 15. Se desean llevar 500 ml de HCI del 10% a una concentración del 12.5%, para lo cual se dispone de una solución al 25%. Cuantos ml de ácido al 25% son necesarios. Densidad de la sln al 10% = 1,048 g/ml. Densidad de la sln al 25% 1,123 g/ml