Actividad+enzimática
Anuncio

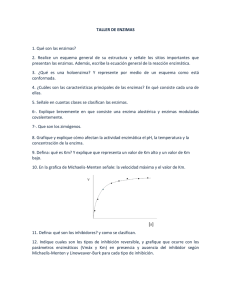
BIOQUÍMICA I CARACTERÍSTICAS DE LAS ENZIMAS 1. 2. 3. 4. 5. Son los catalizadores de las reacciones químicas de los sistemas biológicos. Tienen gran poder catalítico. Poseen un elevado grado de especificidad de sustrato. Funcionan en soluciones acuosas en condiciones suaves de pH y temperatura. La mayoría de las enzimas son proteínas: La función depende de la integridad de la conformación proteica nativa. Existen enzimas que son proteínas simples y otras que requieren componentes químicos adicionales: Cofactores: iones inorgánicos. complejos orgánicos : coenzimas, grupos prostéticos. Holoenzima/ Apoenzima + Cofactor. 6. Las enzimas se clasifican según la reacción catalizada. COFACTORES ENZIMÁTICOS En las enzimas el cofactor puede actuar como centro catalítico primario, grupo puente para reunir el sustrato y la enzima ó agente estabilizante de la actividad enzimática (conformación). IONES METÁLICOS COMO COFACTORES (Algunos de los elementos inorgánicos que actúan como cofactores para las enzimas) ION Cu2+ Fe2+ or Fe3+ K+ ENZIMA Citocromo oxidasa Citocromo oxidasa, catalasa, peroxidasa Piruvato quinasa Mg 2+ Hexoquinasa, glucosa-6-fosfatasa, piruvato quinasa Mn2+ Arginasa, ribonucleotido reductasa Mo Dinitrigenasa Ni2+ Ureasa Se Zn2+ Glutatión peroxidasa Anhidrasa carbónica, alcohol deshidrogenasa , carboxipeptidasas A y B CLASIFICACIÓN DE LAS ENZIMAS NUMERO DE CLASIFICACIÓN CLASE DE ENZIMA TIPO DE REACCIÓN CATALIZADA 1 Oxidoreductasas Transferencia de electrones, casi siempre en forma de iones hidruro o átomos de hidrógeno. 2 Transferasas 3 Hidrolasas 4 Liasas Formación de dobles enlaces por eliminación de grupos o adición de grupos o un doble enlace. 5 Isomerasas Transferencia de grupos dentro de una molécula para dar formas isoméricas. 6 Ligasas Transferencia de grupos funcionales de una molécula a otra. Ruptura de enlaces por hidrólisis. Formación de enlaces C-C, C-S, C-O y C-N por condensación acoplada con la ruptura de ATP. CLASIFICACIÓN DE LAS ENZIMAS 1. Oxidoreductasas: Catalizan reacciones de oxido reducción o redox. Precisan la colaboración de las coenzimas de oxido reducción (NAD+, NADP+, FAD) que aceptan o ceden los electrones correspondientes; tras la acción catalítica, estas coenzimas quedan modificadas en su grado de oxidación, por lo que deben ser transformadas antes de volver a efectuar la reacción catalítica. Ejemplos: deshidrogenasas, peroxidasas. 2. Transferasas: Transfieren grupos activos (obtenidos de la ruptura de ciertas moléculas) a otras sustancias receptoras. Suelen actuar en procesos de interconversión de monosacáridos, aminoácidos, etc. Ejemplos: transaminasas, quinasas. 3. Hidrolasas: Verifican reacciones de hidrólisis con la consiguiente obtención de monómeros a partir de polímeros. Actúan en la digestión de los alimentos, previamente a otras fases de su degradación. La palabra hidrólisis se deriva de hidro 'agua' y lisis 'disolución'. Ejemplos: glucosidasas, lipasas, esterasas. CLASIFICACIÓN DE LAS ENZIMAS 4. Liasas: Catalizan reacciones en las que se eliminan grupos (H2O, CO2 y NH3) para formar un doble enlace o añadirse a un doble enlace, capaces de catalizar la reducción en un sustrato. El sustrato es una molécula, la cual, se une al sitio activo de la enzima para la formación del complejo enzima-sustrato. El mismo, por acción de la enzima, es transformado en producto y es liberado del sitio activo, quedando libre para recibir otro sustrato. Ejemplos: descarboxilasas, liasas. 5. Isomerasas: Actúan sobre determinadas moléculas obteniendo de ellas sus isómeros de función o de posición, es decir, catalizan la racemización y cambios de posición de un grupo en determinada molécula obteniendo formas isoméricas. Suelen actuar en procesos de interconversión. Ejemplo: epimerasas (mutasa). 6. Ligasas: Realizan la degradación o síntesis de los enlaces denominados "fuertes" mediante el acoplamiento a sustancias de alto valor energético (como el ATP). Ejemplos: sintetasas, carboxilasas. NOMENCLATURA DE LAS ENZIMAS Las enzimas se nombran según las reacciónes que catalizan: Número clasificatorio de 4 dígitos Nombre sistemático (oficial internacional) terminado en -asa Nombre trivial Ejemplo: ATP + D – Glucosa → ADP + D – Glucosa - fosfato Número clasificatorio: E.C. 2.7.1.1 2 Clase : Transferasa. 7 Subclase : Fosfotransferasa. 1 Fosfotransferasas con OH como aceptor 1 D-glucosa como aceptor del fosfato Nombre sistemático: ATP: glucosafosfotransferasa Nombre trivial: hexoquinasa ESPECIFICIDAD MODELOS DE ACTUACIÓN DE LAS ENZIMAS MODELOS DE ACTUACIÓN DE LAS ENZIMAS Modelos de acción enzimática. Modelo llave-cerradura de Fischer Modelos de acción enzimática. Modelo de ajuste inducido de Koshland. Modelo de ajuste inducido de Koshland. Hexoquinasa ¿ cómo funcionan las enzimas ? En condiciones fisiológicas las reacciones sin catalizar tienden a ser lentas (estabilidad de biomoléculas) Muchas reacciones bioquímicas suponen situaciones poco probables Una enzima soluciona estos problemas proporcionando un ambiente tridimensional favorable a la reacción (sitio activo) LAS ENZIMAS ALTERAN LAS VELOCIDADES DE REACCIÓN PERO NO LOS EQUILIBRIOS EN EL ESTADO DE TRANSICIÓN LAS INTERACCIONES ENTRE LA ENZIMA Y EL SUSTRATO SON ÓPTIMAS EN EL ESTADO DE TRANSICIÓN LAS INTERACCIONES ENTRE LA ENZIMA Y EL SUSTRATO SON ÓPTIMAS GRUPOS CATALÍTICOS ESPECÍFICOS CONTRIBUYEN A LA CATÁLISIS CAMBIO CONFORMACIONAL DE LA HEXOQUINASA CINÉTICA ENZIMÁTICA La cinética enzimática estudia la velocidad de las reacciones químicas que son catalizadas por las enzimas. La velocidad de la reacción va aumentando a medida que aumenta la concentración de sustrato hasta que la enzima se satura. FACTORES FÍSICO-QUÍMICOS QUE PUEDEN MODIFICAR LA ACTIVIDAD ENZIMÁTICA Temperatura: las enzimas son sensibles a la temperatura pudiendo verse modificada su actividad por este factor. Los rangos de temperaturas óptimos pueden llegar a variar sustancialmente de unas enzimas a otras. Normalmente, a medida que aumente la temperatura, una enzima verá incrementada su actividad hasta el momento en que comience la desnaturalización de la misma, que dará lugar a una reducción progresiva de dicha actividad. pH: el rango de pH óptimo también es muy variable entre diferentes enzimas. Si el pH del medio se aleja del óptimo de la enzima, esta verá modificada su carga eléctrica al aceptar o donar protones, lo que modificará la estructura de los aminoácidos y por tanto la actividad enzimática. Concentración salina: al igual que en los casos anteriormente mencionados, la concentración de sales del medio es crucial para una óptima actividad enzimática. Una elevada concentración o una ausencia de sales en el medio pueden impedir la actividad enzimática, ya que las enzimas precisan de una adecuada concentración de iones para mantener su carga y su estructura. EL MODELO DE MICHAELIS-MENTEN (1913) Como las reacciones catalizadas por enzimas son saturables, la velocidad de catálisis no muestra un comportamiento lineal en una gráfica al aumentar la concentración de sustrato. Mecanismo de unión de único sustrato para una reacción enzimática. k1, k-1 y k2 son las constantes cinéticas para cada una de las etapas de la reacción. LEONOR MICHAELIS MAUD MENTEN CONCENTRACIÓN DE SUSTRATO VERSUS VELOCIDAD DE REACCIÓN Representación gráfica de la curva de saturación de una enzima donde se puede observar como evoluciona la relación entre la concentración de sustrato y la velocidad de la reacción. INHIBICIÓN ENZIMÁTICA Los inhibidores enzimáticos son moléculas que reducen o anulan la actividad enzimática. Estos inhibidores pueden unirse a las enzimas de forma reversible o irreversible. Esquema de una reacción enzimática en presencia de un inhibidor enzimático de unión reversible. INHIBIDOR IRREVERSIBLE • Modifica químicamente a la enzima. E+I E· • Inactivan una enzima de forma irreversible. • Unión irreversible por medio de enlaces covalentes. • Modificaciones químicas de los grupos catalíticos. • Modificada la enzima, y está siempre inhibida. • Estas reacciones decaen de forma exponencial y suelen ser saturables. • Mantienen una cinética de primer orden con respecto al inhibidor. INHIBIDOR REVERSIBLE • Establece un equilibrio con la enzima libre, con el complejo enzima-substrato o con ambos E+I EI ES + I ESI • La unión del inhibidor y la enzima es reversible. • Al quitar el inhibidor del medio, se recupera la actividad. • Hay 3 tipos: 1. Competitiva. 2. No Competitiva. 3. Acompetitiva (Alostérica) INHIBICIÓN COMPETITIVA INHIBICIÓN NO COMPETITIVA INHIBICIÓN ACOMPETITIVA ENZIMAS REGULADORAS 1.Enzimas alostéricas: • Son reguladas por unión no-covalente de moduladores • Constituyen excepciones a muchas reglas generales: - Efecto homotrópico [positivo (activación) o negativo (inhibición)]: varias moléculas (sustrato) idénticas se unen a la enzima. - Efecto heterotrópico (positivo o negativo): Diferentes sustancias (inhibidor y sustrato) se unen a la enzima. • Hay dos modelos que explican el comportamiento cinético de las enzimas alostéricas: - Modelo simétrico (Monod): Conformación T (tensa) y R (relajada) - Modelo secuencial (Koshland): Cambio conformacional ENZIMAS REGULADORAS 2.Modulación covalente reversible: • Fosforilación • Adenilación • Uridililación • ADP- ribosilación • Metilación