Enzimas I, IV y V
Anuncio

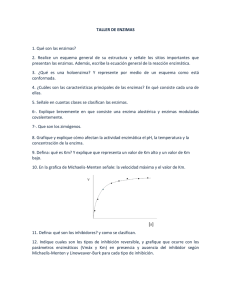
INÉS SACCHI ÁREA BIOQUÍMICA Cinco clases de Enzimas Enzimas I Introducción a las enzimas Enzimas II Cinética enzimática Enzimas III Cinética enzimática Enzimas IV Inhibición de las enzimas Enzimas V Regulación de las enzimas Enzimas I: Importancia de las enzimas Definición Localización celular Estructura molecular Características Clasificación Mecanismos de acción Importancia de las Enzimas Seres vivos Las enzimas son necesarias para la vida: - participan en casi todas las reacciones de los seres vivos. -permiten reacciones dirigidas a determinados productos, en tiempo útil y en condiciones compatibles con la vida. Importancia de las Enzimas Farmacología y terapéutica Las enzimas son blanco de la farmacología (muchos medicamentos son inhibidores o activadores de enzimas): anti-inflamatorios, antibióticos, antiparasitarios, insecticidas, etc. Importancia de las Enzimas Biotecnología e industria de los alimentos de origen animal Las enzimas son herramientas fundamentales para la biotecnología de los alimentos de origen animal: leche, quesos, yogures, etc.). terneza, procesados). manipulación genética. Definición de Enzimas Las enzimas son catalizadores de las reacciones de los sistemas biológicos. Aumentan la velocidad de las reacciones que catalizan, disminuyendo la energía de activación de las mismas. No modifican la constante de equilibrio (Keq) ni la variación de energía libre ( G) de la reacción. ¿Cómo actúan las Enzimas? Energía de activación y Velocidad de reacción Energía libre (G) Estado de Transición G = Energía de Activación Sustrato Gi G° Producto Gf Coordenada de la reacción Formas de incrementar la Velocidad de Reacción Calentar Aumento de la temperatura Aumento de la concentración Baja velocidad de reacción Aumento de la concentración X X Temp. = Cte No es posible a nivel biológico Aumento de la cantidad Vol = Cte No es posible a nivel biológico Disminución del Volumen Posible a nivel biológico ¿Cómo es posible a nivel biológico? ENZIMA Sitio Catalítico Pequeño volumen Elevada concentración Dimensiones moleculares Reactivos SC Pequeño Volumen Elevada concentración Reactivos en Estado activado Producto Energía de activación Reacción Enzimática Estado de transición G = Energía de Activación G = Energía de Activación E Reaccion enzimática Sustrato Gi G° Producto Gf Coordenada de la reacción Localización de Enzimas EXOCELULARES: actúan fuera de las células que las producen. ENDOCELULARES: actúan en las propias células que las producen. I. Exocelulares Enzimas Digestivas: Se descargan en el tubo digestivo y participan en la digestión (degradación de los alimentos). Amilasas (carbohidratos) Proteasas y peptidasas (proteínas y péptidos) Lipasas (lípidos) Enzimas de la Coagulación: Se descargan fuera de los vasos sanguíneos y provocan la coagulación de la sangre (formación del coágulo de fibrina). Factores II a XIII, se activan en cascada y convierten el FRIBRINÓGENO en FIBRINA II. Endocelulares II. Endocelulares Membrana Metabolismo intermediario Síntesis de Proteínas y otras sustancias Transmisión de mensajes, intercambio con el medio extracelular Citosol RE Núcleo Ribosomas Mitocondria Metabolismo, Procesos oxidativos y producción de energía Lisosoma Conservación y utilización de la información genética Recambio y destrucción de productos de desecho Estructura Molecular PROTEÍNAS - a excepción de las Ribozimas. Proteínas complejas de elevado Peso Molecular (PM). Tiene estructuras terciaria y generalmente cuaternaria. HEXOKINASA: Modelo espacial Glucosa Sitio Catalítico Hendidura Enzima: modelo de -Hélice (rulos) y Hoja- (cintas) Sustrato: DNA modelo espacial DNAasa: Endonucleasa, enzima de restricción Características de las Enzimas Eficientes: incrementan la velocidad de reacción (102 -1014 ) y tienen acción dirigida. No se consumen en la reacción. Actúan en pequeña concentración. Específicas. Regulables. Eficientes 1) Incrementan la velocidad de reacción Glc + ATP G6P + ADP HEXOKINASA vel. x 105 Tubo de ensayo Sin Enzima = 350 días - 16.72 kj/mol Con Enzima = 5 min Eficientes 2) Tienen acción dirigida Cuando no está la Enzima Glc + ATP + G2P + G3P + G4P + G6P + ADP + AMP + Pi + PPi + A Cuando está la Enzima Glc + ATP G6P + ADP ? G6P + ADP CH2OHPO3 HEXOKINASA H H OH HO H H H OH OH No se consumen Reacción Enzimática: S+E [E- E Complejo Enzima-Sustrato Transitorio S: Sustrato (reactivo o reactante) E: Enzima P: Producto La [E] siempre es menor a la [S]. La Enzima no se consume, puede volver a actuar. Actúan en pequeña concentración [S] = mM (10-3 M) a M (10-6 M) [E] = M (10-6 M) - nM (10-9 M) - pM (10-12 M) Rel= Concentración S que se transforma/min Concentración de E R= 1 mM/min 1 nM = 10-3 M/min = 1.000.000 10-9 M R = Número de recambio o poder catalítico Específicas Complementariedad estructural y espacial entre el sustrato y la enzima Una sustancia de estructura diferente no es reconocida por el sitio catalítico de la enzima X Especificidad las enzimas reconocen un sustrato o a un conjunto de sustratos de estructura muy similar. Especificidad Absoluta: Reconocen un solo sustrato. Ej. UREASA - solo Urea. Especificidad Restringida: Reconocen un grupo restringido de sustratos de estructura similar. Ej HEXOKINASA Glucosa, Fructosa, Manosa. Especificidad Amplia: Reconocen una amplia gama de sustratos. Ej. PROTEASAS - Proteínas y Péptidos; RIBONUCLEASAS Ácido Ribonucleicos Regulables 1) Concentración de las enzimas: depende de la expresión génica y del balance entre la síntesis y la degradación en cada célula y tejido. 2) Actividad enzimática: depende de diferentes factores cinéticos ([S], pH, temperatura, inhibidores). Solo algunas enzimas pueden tener regulación específica (alostérica, covalente o proteólisis limitada). Actividad Menor o nula Enzima Conformación nativa Mayor Actividad Regulación de enzimas: La actividad de algunas enzimas puede ser modificada. El grado de actividad de una enzima en un determinado compartimento celular, está en función de su conformación nativa. La actividad de una enzima puede ser incrementada por cambios en su conformación nativa que resultan en una forma con mayor actividad catalítica. La actividad de una enzima puede ser disminuida por cambios en su conformación nativa que resultan en una forma con menor o nula actividad catalítica. Clasificación de Enzimas 1) Oxidorreductasas: reacciones de oxido-reducción, transferencia de H+ y e-. Deshidrogenasas y Oxidasas. 2) Transferasas: transferencia de radicales (acilos, aminos, fosfatos). Aciltransferasas, Aminotransferasas, Kinasas. 3) Hidrolasas: ruptura hidrolítica de enlaces, con H2O. Esterasas, Glucosidasas, Peptidasas, Lipasas. 4) Liasas: ruptura no hidrolítica de enlaces y sin oxidorreducción. Carboxilasas y Decarboxilasas. 5) Isomerasas: implican cualquier tipo de isomerización (epimerización, Cis-Trans). Isomerasas, Mutasas, Racemasas. 6) Ligasas: formación de compuestos por condensación de dos, formación de enlaces acoplados a reacciones exergónicas. Sintetasas y Sintasas. Clasificación de Enzimas A cada enzima se le asigna un número clasificatorio de cuatro dígitos y un nombre sistemático, el cual identifica la reacción catalizada. De las clases y las sub-clases deriva el número de clasificación propio para cada enzima. - Primer dígito: indica el nombre de la clase - Segundo dígito: la sub-clase - Tercer dígito: característica diferencial de esa sub-subclase - Cuarto dígito: identifica el descubrimiento de la enzima dentro de la sub-subclase. Mecanismos de acción enzimáticos Existen 4 mecanismos diferentes por los cuales las enzimas pueden catalizar las diferentes reacciones del metabolismo. Encaje inducido (Hexoquinasa). Aproximación y deformación del sustrato (Proteasas). Catálisis covalente (Transaminaciones). Catálisis ácido-base. Estos mecanismos no se dan de forma aislada. Mecanismos de acción enzimático Encaje Inducido Mecanismo de la acción enzimática Conteste si las siguientes afirmaciones son verdadera o falsa y fundamente la respuesta: 1) La Enzima convierte una reacción desfavorable (+ Go) en favorable o espontánea (- Go). V - F 2) Todas las moléculas con actividad enzimática que se conocen son cadenas de ácidos ribonucleicos. V - F 3) La actividad catalítica de las enzimas denominadas regulables, puede ser incrementada o disminuida. V - F Resumen de las Enzimas Esenciales para la vida. Catalizadores biológicos más eficientes. Naturaleza proteica. No se consumen en la reacción que catalizan. Actúan en pequeñas concentraciones. Específicas. Regulables. Referencias Bibliográficas Guía de Bioquímica, Curso Biología Molecular y Celular. Facultad de Veterinaria, Bolsa del Libro 2011. Lehninger, Nelson , Cox. Principios de Bioquímica, Ed. Omega, 3a de 2000 - 4a de 2005 - 5ª de 2009. Voet & Voet. Biochemistry, Ed. John Willey & Sons, 1995. Bioquímica, 3° Ed. año 2006. INÉS SACCHI ÁREA BIOQUÍMICA Contenido: Definición de Inhibidores Tipos de inhibición: - reversibles - irreversibles Importancia biológica y Aplicaciones Inhibidores: Definición Sustancias capaces de disminuir o anular la actividad de una enzima. El inhibidor no es transformado por la enzima. La pérdida de la actividad enzimática en presencia de un inhibidor puede ser: parcial o total, así como transitoria o permanente. Tipos de inhibición Reversible: el inhibidor reduce la actividad enzimática en forma transitoria. Esta puede ser recuperada por diferentes procedimientos. Existen tres tipos de inhibición reversible: - Competitiva - No competitiva - para un sustrato - para mas de un sustrato (Acompetitiva) - Mixta Irreversible: el inhibidor reduce la actividad enzimática, inactivándola en forma permanente. La actividad enzimática no se recupera. Inhibición Competitiva S + E E-S + I Inhibidor se une al S.C. E-I No da productos P + E Inhibición Competitiva Vo (Abs/min) Vm =Vmi Vm/2 Vmi/2 Km Kmi Modelo Michaelis - Menten (S) mM Inhibición Competitiva 1/Vo 1/Vmi 1/Vm 1/(S) mM-1 -1/Km -1/Kmi Modelo Lineweaver - Burk Inhibición Competitiva COOC=O CH2 COOOXALOACETATO Reversible COOCH2 Aumentando la concentración de sustrato. COOMALONATO Inhibición Competitiva: características El inhibidor competitivo tiene similitud estructural con el sustrato. El inhibidor disminuye la velocidad de la reacción enzimática. Se une al sitio activo o al sitio catalítico de la enzima y compite con el sustrato. La Vm de la reacción con o sin inhibidor es la misma. El Km de la reacción con inhibidor es mayor que sin inhibidor. La inhibición puede ser revertida aumentando la concentración de sustrato. Inhibición No competitiva (para enzimas monosustrato) S + E E-S P + I Inhibidor no se une al S.C. E-I No da productos + E Inhibición No competitiva (para enzimas monosustrato) Vo (Abs/min) Vm Vmi Vm/2 Vmi/2 Km = Kmi Modelo Michaelis - Menten (S) mM Inhibición No competitiva (para enzimas monosustrato) 1/Vo 1/Vmi 1/Vm 1/(S) mM-1 -1/Km = -1/Kmi Modelo Lineweaver - Burk Inhibición No competitiva Mg+2 + Quelante + Quelante(Mg)2 Mg+2 EDTA = ácido etilendiaminotetraacético quelante; atrapa iones bivalentes (Mg2+, Ca2+) Reversible Aumentando la cantidad de Mg+2. Inhibición No competitiva (para enzimas monosustrato): características El inhibidor disminuye la velocidad de la reacción enzimática. Se une a la enzima en un sitio diferente del sitio activo o catalítico y no compite con el sustrato. La Vm de la reacción con inhibidor es menor que la presentada por la reacción enzimática sin inhibidor. El Km de la reacción con o sin inhibidor es el mismo. La inhibición no puede ser revertida aumentando la concentración de sustrato, pero puede hacerse por otros procedimientos. Inhibición No competitiva - Acompetitiva (para enzimas con más de un sustrato) S + E E-S P + E + I ES-I No da productos Inhibición No competitiva - Acompetitiva (para enzimas con mas de un sustrato) 1/Vo 1/Vmi 1/Vm -1/Kmi -1/Km Modelo Lineweaver - Burk 1/(S) mM-1 Inhibición Irreversible El inhibidor inactiva la enzima en forma permanente. La actividad enzimática no se recupera. La unión del inhibidor con la enzima es estable (uniones por metales pesados o por enlace covalente). Ejemplos: - intoxicación por Pb (iónica y estable). - covalente: unión covalente con grupos SH y OH de las enzimas. Inhibición Irreversible Ej. Yodoacetamida Cys HS + ICH2-CONH2 Cys + S-CH2 -CONH2 Ej. garrapaticidas, pulguicidas, piojicidas anti-parasitarios, insecticidas HI Referencias Bibliográficas Guía de Bioquímica, Curso Biología Molecular y Celular. Facultad de Veterinaria, Bolsa del Libro 2010. Lehninger, Nelson , Cox. Principios de Bioquímica, Ed. Omega, 3a de 2000 - 4a de 2005. Voet & Voet. Biochemistry, Ed. John Willey & Sons, 1995. INÉS SACCHI ÁREA BIOQUÍMICA Enzimas V: Tipos de regulaciones de las enzimas: - concentración enzimática - actividad enzimática Actividad Enzimática: - Regulación alostérica - Regulación covalente - Regulación por proteólisis enzimática La regulación de Enzimas se ejerce sobre: La concentración de las enzimas en una célula o tejido. La actividad de las enzimas en una célula o tejido. Concentración celular o tisular de enzimas La regulación de la concentración celular o tisular de las enzimas ocurre para todas las enzimas del organismo. La presencia o ausencia de una enzima en una célula o tejido está determinada por factores reguladores de la expresión génica. La concentración de una enzima en una célula o compartimento celular, es el resultado del grado de síntesis y de degradación de esa enzima. Regulación de la concentración de enzima: Síntesis y Degradación DNA = gen de una enzima Región codificante región Región reguladora Transcripción Traducción = síntesis Conformación nativa Ubicación celular RNA m Cadena peptídica Enzima Activa [E] en la célula Degradación Vida media - recambio Actividad Enzimática La actividad enzimática puede ser aumentada o disminuida por diferentes factores Actividad Menor o nula Enzima Conformación nativa Mayor Actividad Regulación de la Actividad Enzimática Sólo se produce en algunas enzimas llamadas reguladoras. Regulación específica puede ser: - Alostérica - Covalente - Proteólisis limitada 1. Enzimas Alostéricas Son proteínas extremadamente complejas, con estructura 3ª formada por varios dominios o 4ª formada por varios sub-unidades. Tienen sitio catalítico y además un sitio regulador llamado Sitio Alostérico. Presentan cinética sigmoide (curva de saturación en forma de ), no michaeliana (curva de saturación hipérbola) como la mayoría de las enzimas. ENZIMA ASPARTATOTRANSCARBAMILASA Cinética de las Enzimas Alostéricas Vm Vo (Abs/min) Vm/2 Vm Vm/2 Km K0.5 (S) mM Regulación Alostérica (Homotrópica) Sustrato Enzima Tetrámero forma mas activa Conformación nativa forma menos activa El Sustrato al entrar en el sitio catalítico induce la activación de otras sub-unidades de la enzima: este efecto se llama Cooperativismo positivo. Cinética de las Enzimas Alostéricas Vm Vm/2 K0.5 Regulación Alostérica (Heterotrópica) MODULACIÓN ALOSTÉRICA SA M SC Forma menos activa M + SC SA Forma más Activa M = modulador Enzimas Alostéricas La actividad enzimática se modifica por el SUSTRATO (regulación Homotrópica). La actividad enzimática es modulada por MODULADORES positivos (+) y negativos (-) (regulación Heterotrópica). Los moduladores se unen a la enzima en el sitio regulador llamado Sitio Alostérico. Cinética de una Enzima Alostérica con sus Moduladores ¿Que importancia tienen las enzimas alostéricas? - Control energético de una vía metabólica S M (-) [ATP] A B = Cte [ADP] M (+) ADP ATP P irreversibles, unidireccionales (una sola dirección). 2. Enzimas que presentan Regulación Covalente Son proteínas de estructura 3ª o 4ª extremadamente complejas y de elevado PM. La actividad enzimática puede ser modificada por la unión covalente de radicales o grupos químicos a la estructura de la enzima. Esa unión covalente de radicales o grupos químicos a la estructura de la enzima, modifica su conformación nativa, transformándola en una conformación más o menos activa. Regulación Covalente Los radicales más utilizados en animales superiores son fosfato (-OPO3 -), acetilo (CH3-CO-) y metilo (-CH3). La fosforilación (unión de grupos fosfatos), es el mecanismo más común de activación de enzimas en el metabolismo. Consiste en la unión covalente de grupos fosfato con grupos hidroxilo de los residuos aminoacídicos, (serina, treonina) constituyentes de la cadena polipeptídica de la enzima. Los mecanismos de fosforilación y desfosforilación son utilizados por las señales hormonales tanto para activar como para inhibir enzimas. Regulación Covalente HO- Inhibición Hormonal ATP Pi ADP H2O - Estímulo Hormonal Kinasa Fosfatasa Inhibición Hormonal -OH -OPO3- 3OPO- Activa Estímulo Hormonal Control Celular: Regulación de Enzimas Estímulo Hormonal Inhibición Hormonal (- ) S Regulación Covalente: Fosforilación-Desfosforilación. Señales extracelulares: responden a necesidades del organismo en su conjunto (+ ) Núcleo M(-) M(+) P Regulación Alostérica: Moduladores positivos y negativos. Señales intracelulares: responden a necesidades locales o celulares 3. Inactiva Regulación de Enzimas por Proteólisis Limitada Activa Proteólisis Limitada: Enzimas digestivas pH ácido Pepsina Enteropeptidasa Tripsina Tripsina Quimotripsina Resumen La concentración enzimática es un mecanismo de regulación de todas las enzimas del organismo. La regulación de la actividad enzimática sólo se produce en algunas enzimas llamadas reguladoras. Existen tres tipos de regulaciones específicas: - Alostérica - Covalente - Proteólisis Limitada Referencias Bibliográficas Guía de Bioquímica, Curso Biología Molecular y Celular. Facultad de Veterinaria, Bolsa del Libro 2010. Lehninger, Nelson , Cox. Principios de Bioquímica, Ed. Omega, 3a de 2000 - 4a de 2005. Voet & Voet. Biochemistry, Ed. John Willey & Sons, 1995.