CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL GRADO 7° Estándar:
Anuncio

INSTITUCIÓN EDUCATIVA FÉLIX DE BEDOUT MORENO
“Educamos en el ser y el conocer con respeto y compromiso”
TALLER ESPECÍFICO ¨Solubilidad¨
CIENCIAS NATURALES Y EDUCACIÓN AMBIENTAL
GRADO 7°
Estándar:
Establezco relaciones entre las características microscópicas y macroscópicas de sustancias y
mezclas y sus propiedades físicas y químicas que las constituyen.
Competencias:
1. Estructurar las relaciones entre los conceptos: sustancia, mezcla, solubilidad, y su
utilización en la resolución de problemas.
2. Identificar y usar adecuadamente el lenguaje de la química: fórmulas químicas relativas y
moleculares y sus respectivos nombres químicos.
3. Sustentar mis respuestas con diversos argumentos.
4. Registrar mis resultados en forma organizada y sin alteración alguna.
5. Realizar mediciones con instrumentos y equipos adecuados a las características y magnitudes
de las sustancias y sus propiedades y expresos en las unidades correspondientes.
INDICADOR DE DESEMPEÑO:
1. Diferencio sustancia y mezcla desde la interacción con la colección de los materiales y las
modificaciones que realizo.
2. Diferencio una solución de una mezcla heterogénea desde la interacción con la colección de
los materiales y las modificaciones que realizo.
3. Diferencio los componentes de una solución: soluto y solvente
en un contexto de temperatura
y presión
4. Establezco la relación entre los conceptos: sustancia, mezcla, solubilidad
5. Identificar y usar adecuadamente el lenguaje de la química: fórmulas químicas relativas y
moleculares y sus respectivos nombres químicos.
SOLUBILIDAD
Recordemos que hemos preparado diferentes mezclas, unas heterogéneas como: el cloruro de sodio (ac)
Na Cl (ac) y cloruro de sodio sólido Na Cl (s) {NaCl (ac), NaCl(s)}; sulfato de cobre pentahidratado acuoso
Cu SO4 · 5H2O (ac) y sulfato de cobre pentahidratado sólido Cu SO4 · 5H2O(s) ,
{ Cu SO4 . 5H2O (ac) , Cu SO4 · 5H2O(s)}; octazufre sólido ortorrómbico S8 (ortoh) y limadura de hierro Sólida
{ S8(s) , Fe (s)}: Otras homogéneas como: etanol acuoso C2 H5 OH (ac), cloruro de sodio acuoso
Na Cl (ac) , sulfato de cobre pentahidratado acuoso Cu SO4 ·5H2O (ac).
¿Diferencio una sustancia de una mezcla? Si___ No___
Argumento:___________________________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
¿Diferencio una mezcla homogénea de una mezcla heterogénea? Si___ No___
Argumento:___________________________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
Recordemos que una mezcla homogénea es llamada también Solución y corresponde a que toda la
cantidad de soluto está disuelta en el solvente.
¿Qué entiendo por soluto?:______________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
Y ¿qué entiendo por solvente?___________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
Enuncia dos situaciones cotidianas de cada caso:
____________________________________________________________________________________
____________________________________________________________________________________
____________________________________________________________________________________
Es importante destacar que las soluciones tanto en los procesos biológicos como en los procesos
industriales se preparan según las necesidades del trabajo a realizar. De otra parte, el aire que
respiramos es una solución gaseosa. También el aire puede ser una mezcla heterogénea según el
contexto atmosférico. El análisis de los datos de la tabla 10 nos permite percibir la composición del aire
seco al nivel del mar, la tabla 11 indica la composición del aire en Medellín se detallan las sustancias
que resultan de la combustión del diesel utilizado por el parque automotor de servicio público en la ciudad
de Medellín, los cuales constituyen los principales contaminantes del aire, representado en un 58%.
Tabla 10. Composición del aire seco al nivel del mar1
Gas { N2`, O2 , Ar, CO2 , Ne, He, Kr, Xe}
Nitrógeno N2
Oxígeno O2
Argón Ar
Dióxido de carbono CO2
Neón Ne
Helio He
Kriptón Kr
Xenón Xe
1
Chang Raymon, Química, Novena Edición.
Mc Graw Hill, 2007
Composición (% en volumen)
78,03
20,99
0,94
0,033
0.0015
0,000524
0,00014
0,000006
Tabla 11. Composición del aire en Medellín2Inscribirmei
Gas{ N2`, O2 , Ar, CO2 , Ne, He, Kr, Xe, CO, NO2, orgánicos volátíle NO2 }
Composición(% en partes por millón)
Monóxido de carbono CO
Dióxido de nitrógeno NO2
Compuestos orgánicos volátiles
Dióxido de Azufre SO2
71
11
17
1
En las mezclas homogéneas (soluciones) hemos percibido que la capacidad de disolver un soluto en un
solvente tiene un límite máximo. Este límite máximo se conoce como solubilidad y se explicita como la
máxima cantidad de soluto disuelto en 100,00 gramos de solvente a una temperatura específica. La
solubilidad se designa con la letra ese mayúscula S: g de soluto disuelto/100 g de solvente.
Nótese que la S expresa una relación de composición de una solución: máxima cantidad de soluto
disuelto en 100,00 gramos de solvente
Por ejemplo: a) la solubilidad a 25ºC del NaCl ( s ) es 35,00g/100,00g de agua significa que es la
máxima cantidad de NaCl (s) disuelto en 100,00 g de H2O. b) la solubilidad a 25ºC del CuSO4· 5H2O es
~35,00g/100,00g de agua significa que es la máxima cantidad de CuSO4· 5H2O sólido disuelto en
100,00 g de H2O.
Avancemos en los significados:
Cuando la composición de la solución corresponde a la magnitud de la relación de solubilidad o a una
cantidad proporcional a ésta, se afirma que la solución es saturada. Por el contrario cuando la cantidad
de soluto disuelto es menor al que se puede disolver en los 100 gramos de agua o en una cantidad
proporcional, nombramos a esta solución Insaturada. Pero cuando la cantidad de soluto disuelto, es un
poco mayor al que se puede disolver en los 100,00 gramos de agua, nombramos a esta solución
Sobresaturada. Se enfatiza que una solución sobresaturada requiere prepararse en unas condiciones
especiales de control de la variable de temperatura.
La tabla 12 presenta la SNaCl a 25ºC y varios casos de soluciones. Analiza los datos planteados e infiere la
clase de solución.
Tabla 12: Solubilidad de NaCl y clase de solución3
SNaCl
35,00g/100,00g
2
3
www.contaminaciónenMedellín.gov.com
Index merk.
Hambook CRC
ml H2O
100,00
100,00
100,00
50,0
50,0
30,0
30,0
30,0
200,0
200,0
250,0
250,0
g NaCl disuelto
35,00
23,40
35,80
17,50
6,30
10,50
6,76
11,06
70,00
35,70
87.50
57,80
Clase de solución
Las tablas 13 y 14 listan la solubilidad en H2 O(l) de varias sustancias a temperatura determinada.
Para estos datos responde las siguientes preguntas:
a. ¿Qué puedes concluir respecto a la variación de la solubilidad del cloruro de sodio sólido NaCl(s) con
el aumento de la temperatura?
b. ¿Qué puedes concluir respecto a la variación de la solubilidad del sulfato de cobre pentahidratado
CuSO4· 5H2O(s) con el aumento de la temperatura?
c. ¿Qué puedes concluir respecto a la variación de la solubilidad de la sacarosa C12H22O11(s) con el
aumento de la temperatura?
d. ¿Qué puedes concluir respecto a la variación de la solubilidad del Carbonato de Calcio CaCO3(s) con
respecto al aumento de la temperatura?
e. Nota que los solutos antes nombrados son sustancias en fase sólida a temperatura ambiente, ¿Qué
puedes concluir con respecto a la variación de la solubilidad de dichos sólidos al aumentar la
temperatura?
Tabla 13: Solubilidad de algunas sustancias
Sustancias
S(g de soluto/ 100,00g
De H2 O) 0ºC
S(g de soluto/ 100,00g
De H2 O) 25ºC
S(g de soluto/ 100,00g
De H2 O) 40ºC
S(g de soluto/ 100,00g
De H2 O) 50ºC
S(g de soluto/ 100,00g
De H2 O) 100ºC
Cloruro de sodio
Na Cl
35,7
35,00
Sulfato de cobre
pentahidratado
31,6
~ 35,00
203,3
soluble
soluble
soluble
soluble
soluble
soluble
38,00
39,12
Cu SO4 . 5H2O
Etanol
C2 H5OH
Sacarosa
C12H22O11
Carbonato de
Calcio CaCO3
0,0014
0,0018 (75ºC)
Dióxido de carbono
CO2
171,3 (ml)
Dioxígeno
O2 (g)
4,89 ml
Dinitrógeno
N2 (g)
2,33 ml
(90,1ml) 20º C
2,46 ml
1,42 ml
Tabla 14: Variación de la solubilidad del CO2 con respecto a la temperatura4
Sustancia
CO2(g)
CO2(s)
CO2(l)
4
Hambook CRC
0 ºC
20 ºC
171,3 ml
90,1 ml
25 ºC
0,145
0,348(g)
0,097(g)
40 ºC
60 ºC
0,058
f.
¿Qué puedes concluir respecto a la variación de la solubilidad del N2(g) con el aumento de la
temperatura?
g. ¿Qué puedes concluir respecto a la variación de la solubilidad del CO2 respecto a la variación de la
temperatura en cada una de las fases?
h. ¿Qué puedes concluir respecto a la variación de la solubilidad del O2 respecto a la variación de la
temperatura?
i.
Nota que los solutos antes nombrados son sustancias en fase gaseosa a temperatura ambiente,
¿Qué puedes concluir con respecto a la variación de la solubilidad de dichos sustancias en fase
gaseosa al aumentar la temperatura?
j.
¿Qué puedes concluir respecto a la variación de la solubilidad de las sustancias sólidas y gaseosas
anotadas con el aumento de la temperatura?
ACTIVIDADES DE CONSOLIDACIÓN 1
A. En las mezclas que preparaste define ¿cuáles son homogéneas (soluciones) y cuáles son
heterogéneas?
Justifica____________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
__________________________________________________________________________
B. En la tabla 15 se detalla el listado de las mezclas que has preparado. Indica el soluto y el solvente
de cada una
Tabla 15: Clasificación de mezclas preparadas en el aula
Mezclas
Preparadas
Soluto
Clase
Homogénea
2.0 ml de Etanol C2H5OH(l)
y 2.0 ml de agua líquida
H2O(l)
2.0 ml de Etanol C2H5OH(l), y 5.0
4,0 ml de agua líquida H2O(l)
1.0 g Cloruro de sodio
NaCl(S) y 10.0 ml agua
líquida H2 O(l)
4.0 g Cloruro de sodio
NaCl(S) y 10.0 ml agua
líquida H2O( l )
2.0 g de Sulfato de cobre
pentahidratado
CuSO4·.5H2O(s) y 10.0 ml de
agua líquida H2O(l)
4.0 g de Sulfato de cobre
pentahidratado
CuSO4·.5H2O(s) y 10.0 ml de
agua líquida H2O(l) .
1.0 g de octazufre S8(orth) y
0.1 g de limaduras de hierro
Fe(s )
Heterogénea
Solvente
Solubilidad
C. Preparar:
a. Una solución saturada a partir de 20,0 ml de agua líquida H2O(l) y cloruro de sodio sólido NaCl(s).
Según el dato de la solubilidad ¿Cuántos gramos de cloruro de sodio sólido NaCl (s) vas a
requerir?______ La mezcla es ¿Homogénea? Si__ No __ ¿Heterogénea? Si___ No___
Justifica______________________________________________________________________________
____________________________________________________________________________________
_________________________________________________________________________________
___________________________________________________________________________________
b. Una mezcla a partir de 20,0 ml de agua líquida H2O(l) y cloruro de sodio sólido NaCl(S) en 1,0 g
menos que la cantidad anterior. ¿Cuántos gramos de cloruro de sodio sólido NaCl(s)
Requieres? ________La mezcla es ¿Homogénea? Si__ No __ ¿Heterogénea? Si ___No___
Justifica______________________________________________________________________________
____________________________________________________________________________________
_________________________________________________________________________________
___________________________________________________________________________________
a. Una mezcla de 20,0 ml de agua líquida H2O (l) y una de cantidad 2,0 g mayor que el primer caso
de cloruro de sodio sólido NaCl(s). ¿Cuántos gramos de cloruro de sodio sólido NaCl(s)
requieres?_______ La mezcla es ¿Homogénea? Si_____No____ ¿Heterogénea? Si ___No___
Justifica___________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
ACTIVIDADES DE CONSOLIDACIÓN 2
En la tabla 15 se detallan distintas situaciones químicas, analiza y complétala.
Tabla 15: Mezcla [NaCl, H2O] a T,P constante
Gramos de
solvente
H2 O (l)
Gramos de
Soluto
NaCl (S)
10,0
20,0
30,0
15,0
15,0
23,0
35,0
3,5
7,0
10,5
2,0
5,0
6,0
14,0
Gramos de
Mezcla
Solución
Saturada
Solución
Insaturada
Mezcla
heterogénea
Fases
Solubilidad
S
ACTIVIDADES DE TRANSFERENCIA
1.
La tabla 16 detalla los datos experimentales de la solubilidad en H2O(l) del nitrato de potasio sólido
KNO3(s) a temperatura ambiente. Para esta información:
a.
b.
c.
d.
e.
¿La cantidad de solvente varía? ¿La del soluto varía?
Analiza como varía la solubilidad con el aumento de la temperatura.
Construye un gráfico de S vs T.
Lee en el gráfico dos datos nuevos e incorpóralos a la tabla de datos.
Escribe conclusiones.
Tabla 16: Datos experimentales de SKNO35
2.
Muestra 0.01 g de KNO3
SKNO3
TºC
2.00 g KNO3/5,00 ml H2O
24
4.00 g KNO3/5,00 ml H2O
46
6.00 g KNO3/5,00 ml H2O
62
8.00 g KNO3/5,00 ml H2O
78
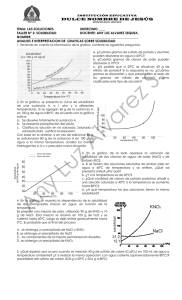
La siguiente gráfica muestra la solubilidad de distintas sustancias en función de la temperatura
Gráfica 16 Solubilidad en agua de AgNO3,NaNO3,KNO3, KCl, NaCl
a. A una temperatura de 30ªC ¿Cuál de los solutos presenta la mayor solubilidad?
b. una temperatura de 30ªC ¿Cuál de los solutos presenta la menor solubilidad?
c. En qué rango de temperatura cloruro de potasio KCly cloruro de sodio NaCl tienen solubilidad
similar?
d. A qué temperatura el nitrato de potasio KNO 3 y el nitrato de sodio NaNO3 tiene similar solubilidad?
e. En qué rango de temperatura tienen solubilidad diferente?
f. A 0ª C Cuál de los solutos presenta mayor solubilidad? ¿Cuál menor?
5
www.datos experimentales del nitrato de potasio.com
6
www.curvassolubilidad.com
g. ¿Qué puedes concluir respecto a la variación de la solubilidad con la temperatura para cada uno
de los solutos?
______________________________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
______________________________________________________________________________
AUTOEVALUACIÓN
1. ¿Qué he aprendido acerca del concepto de solubilidad?
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
¿Cómo explicarías a tus compañeros de clase?
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
_________________________________________________________________________________
2. Construye un mapa conceptual con los conceptos: soluto, mezcla homogénea, sustancia, solvente,
mezcla heterogénea, solución. Solubilidad, KNO3(ac), C2 H%OH(ac), NaCl, [KSO4(ac), K2SO4(ac)]
Evaluación: La tabla 17 detalla clases de soluciones de acuerdo a la fase:vGaseosa, líquida
y sólida. Completa con símbolos químicos la columna de la derecha.
Tabla 17: Clases de soluciones y algunos ejemplos
Clase
Gaseosa
Líquido
Estado físico de los
componentes
Soluto Solvente
Ejemplos
Gas
Gas
Aire, gas natural (metano, Etano, y otros gases)
Líquido
Sólido
Gas
Gas
No existe
Gas
Líquido
Líquido
Líquido
Bebidas gaseosas; oxígeno en agua
Sólido
Líquido
Suero salino(sal en agua), agua de mar
Gas
Sólido
Hidrógeno en platino
Líquido
Sólido
Líquido
Sólido
Amalgama dental ( mercurio en plata)
No existe
Gasolina, (varios hidrocarburos); Vinagre
(ácido acético en agua)
Sólido
Bronce (estaño en cobre), Acero ( carbono
En hierro), aleaciones.
-
Símbolos Químicos para
representar la solución