INSTITUTO POLITÉCNICO NACIONAL UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGÍA
Anuncio

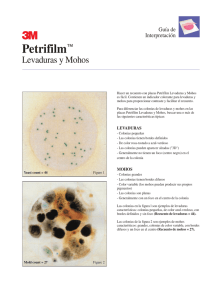
INSTITUTO POLITÉCNICO NACIONAL UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGÍA INOCUIDAD ALIMENTARIA PRÁCTICA 4 MOHOS Y LEVADURAS 1. OBJETIVOS a) El alumno conocerá la normatividad e importancia de la determinación de mohos y levaduras como indicadores microbiológicos en alimentos. b) El alumno aplicará la metodología para la determinación de mohos y levaduras en alimentos de acuerdo a la normatividad correspondiente c) El alumno determinará mohos y levaduras en muestras de alimentos. d) El alumno aplicará los criterios establecidos en la normatividad para el informe de resultados de mohos y levaduras. 2. INTRODUCCIÓN En los criterios microbiológicos pueden emplearse microorganismos indicadores. Estos criterios podrían utilizarse para evaluar la calidad de un producto ya existente o para predecir la vida útil de un alimento. Además del recuento de aerobios en placa (APC), se tienen como indicadores de calidad de productos alimenticios el recuento de hongos y levaduras, los cuales se convierten en predominantes en los alimentos cuando las condiciones para el crecimiento bacteriano son poco favorables. Por lo tanto, pueden ser un problema potencial en productos lácteos fermentados, frutas, bebidas a base de frutas y refrescos. MANUAL DE PRÁCTICAS DE INOCUIDAD ALIMENTARIA El recuento de hongos y levaduras se emplea como parte de criterios microbiológicos en varios productos lácteos tales como requesón, crema congelada y azúcar (Smoot y Pierson, 2001). El término de moho se emplea para describir ciertos hongos multicelulares que forman un entramado filamentoso conocido como micelio. Este se compone de filamentos individuales llamados hifas. Pueden crecer sumergidos en el alimento o superficialmente, en cuyo caso el crecimiento se caracteriza por aspecto algodonoso. Las hifas se clasifican en vegetativas, cuya misión es la incorporación de nutrientes y fértiles, que poseen las estructuras reproductoras en soportes aéreos. La reproducción de los mohos tiene lugar principalmente por esporas asexuales, pero también puede ocurrir por esporas sexuales. Las esporas asexuales, cuya función es propagar la especie, se producen en gran número y son pequeñas, resistentes a la desecación y fácilmente dispersables en el aire contaminando los alimentos (Hayes, 1993). Las levaduras se distinguen de los hongos típicos en que son unicelulares, no suelen formar filamentos y se reproducen por fisión binaria o por gemación. Las levaduras que se desarrollan preferentemente a una baja Aw condicionada por la presencia de azúcares se califican de osmófilas. En el caso de los hongos, se habla de xerófilos. El límite de Aw que define a un microorganismo como xerófilo es de 0.85. Las levaduras y mohos generalmente se han cultivado en medios de pH bajo (3,5-5,5) y a temperaturas de 20-30°C, condiciones bajo las cuales muchas bacterias pueden crecer. Existen medios de cultivo para los hongos según el propósito del estudio (recuento, aislamiento, identificación, producción de toxinas) y algunos específicos para ciertos géneros. Por ejemplo, el agar papa dextrosa, con amplia aplicación en la microbiología de los alimentos para hongos y levaduras. La inhibición de las bacterias se logra acidificando con ácido tartárico hasta pH 3,5. Si la acidez interfiere con el desarrollo de algunos hongos, se substituye la acidificación por la incorporación de ampicilina (Fernández, 2000). 3. INVESTIGACIÓN PRELIMINAR a) ¿Cuál es la importancia de determinar mohos y levaduras en alimentos? b) ¿Cuáles son las especificaciones establecidas para mohos y levaduras en alimentos preparados? PRACTICA 4 19 MANUAL DE PRÁCTICAS DE INOCUIDAD ALIMENTARIA c) ¿Cuáles son las principales especies de hongos y levaduras contaminantes de los alimentos? 4. MATERIALES, EQUIPO Y REACTIVOS Autoclave u Horno a 180ºC Balanza digital Cuenta colonias Potenciómetro Refrigerador Incubadora a 25 ±1ºC 4 cajas Petri 1 pipetero metálico 1 cilindro metálico para cajas Petri 4 pipetas de 2 mL 4 pipetas de 10 mL 1 probeta de 250 mL 1 vaso de precipitados de 500 mL 1 espátula 1 matraz Erlenmeyer de 250 mL 4 frascos de dilución 1 mechero 1 soporte 1 varilla Benzal Soluciones reguladoras de pH Solución estéril de ácido tartárico al 10% Agua destilada 4 frascos con 90 ml de agua peptonada al 0.1% 1 matraz con 100 ml de agar papa dextrosa Muestras de alimentos 5. DESARROLLO EXPERIMENTAL 5.1. PREPARACIÓN DE LA MUESTRA La preparación de la muestra debe ser de acuerdo a lo establecido en la NOM110-SSA1-1994, preparación y dilución de muestras de alimentos para su análisis microbiológico (ANEXO 2). PRACTICA 4 20 MANUAL DE PRÁCTICAS DE INOCUIDAD ALIMENTARIA 5.2. PROCEDIMIENTO a) Marcar las cajas en sus tapas con los datos pertinentes previamente a la inoculación. b) Colocar 1 mL de las diluciones de las muestras preparadas según la NOM-110-SSA1-1994, en una caja Petri. Realizar por duplicado. c) Agregar de 12 a 15 mL de agar papa dextrosa acidificado, fundido y mantenido a 45 1°C. d) Mezclar mediante 6 movimientos de derecha a izquierda, 6 en el sentido de las manecillas del reloj, 6 en sentido contrario y 6 de atrás a adelante, sobre una superficie lisa y horizontal hasta lograr una completa incorporación del inóculo en el medio; cuidar que el medio no moje la cubierta de las cajas. Dejar solidificar. e) Incluir una caja sin inóculo por cada lote de medio y diluyente preparado como testigo de esterilidad. f) El tiempo transcurrido desde el momento en que la muestra se incorpora al diluyente hasta que finalmente se adiciona el medio de cultivo a las cajas, no debe exceder de 20 min. g) Incubar las cajas en posición invertida a 25°C 1°C. h) Contar las colonias de cada placa después de 3, 4 y 5 días de incubación. Después de 5 días seleccionar aquellas placas que contengan entre 10 y 150 colonias. Si alguna parte de la caja muestra crecimiento extendido de mohos o si es difícil contar colonias bien aisladas, considerar los conteos de 4 días de incubación y aún de 3 días. En este caso, informar el periodo de incubación de 3 o 4 días en los resultados del análisis. 5.3. EXPRESIÓN DE DATOS a) Considerar las cuentas de placas con 10 a 150 colonias como las adecuadas para el informe. Multiplicar por el inverso de la dilución. Para la expresión de resultados, consultar el ANEXO 3 (cálculo de los valores de la cuenta en placa) y los criterios establecidos. b) Reportar PRACTICA 4 Unidades formadoras de colonias por gramo o mililitro (UFC/g o ml), de mohos en agar papa-dextrosa acidificado, incubadas a 25 1°C durante 5 días. 21 MANUAL DE PRÁCTICAS DE INOCUIDAD ALIMENTARIA Unidades formadoras de colonias por gramo o mililitro (UFC/g o ml), de levaduras en agar papa-dextrosa acidificado, incubadas a 25 1°C durante 5 días. 6. INFORME DE RESULTADOS a) En un cuadro presentar los resultados obtenidos de las muestras analizadas contemplando las especificaciones de acuerdo a la normatividad. b) Interpretar los resultados obtenidos considerando las causas posibles que pudieran dar origen a dichos valores. 7. BIBLIOGRAFÍA a) Fernández, E.E. 2000. Microbiología e inocuidad de los alimentos. Universidad Autónoma de Querétaro. México. Pág. 51-54. b) Hayes, P. R. 1993. Microbiología e higiene de los alimentos. Acribia, S.A. Zaragoza, España. Pág. 10-11. c) NOM-110-SSA1-1994 Bienes y Servicios. Preparación y dilución de muestras de alimentos para su análisis microbiológico. Secretaría de Salud. México. d) NOM-111-SSA1-1994 Bienes y Servicios. Método para la cuenta de mohos y levaduras en alimentos. Secretaría de Salud. México. e) PROY-NOM-109-SSA1-1994. Bienes y Servicios. Procedimientos para la toma, manejo y transporte de muestras de alimentos para su análisis microbiológico. Secretaría de Salud. México. f) Smoot, L. M. y Pierson, M. D. 2001. Microorganismos indicadores y criterios microbiológicos. En: Doyle, M. P; Beuchat, L. R. y Montville, T. J. Microbiología de los alimentos. Fundamentos y fronteras. Acribia. S.A. Zaragoza, España. Pág. 69-83. PRACTICA 4 22